化学人教版2019选择性必修1 2.2.3 化学平衡常数(共30张ppt)
文档属性
| 名称 | 化学人教版2019选择性必修1 2.2.3 化学平衡常数(共30张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 978.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-09 21:55:37 | ||
图片预览







文档简介
(共30张PPT)
第二章 化学反应速率与化学平衡
第二节 化学平衡
第3课时 化学平衡常数
一、化学平衡常数
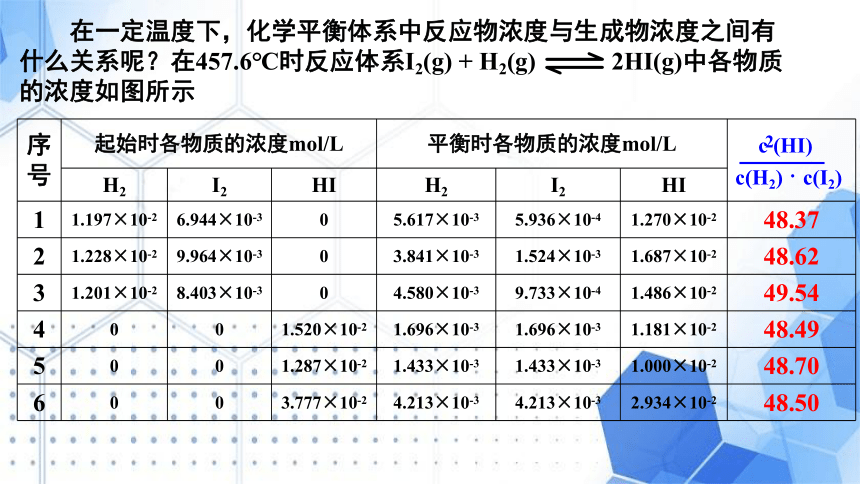
序号 起始时各物质的浓度mol/L 平衡时各物质的浓度mol/L
H2 I2 HI H2 I2 HI
1 1.197×10-2 6.944×10-3 0 5.617×10-3 5.936×10-4 1.270×10-2 48.37
2 1.228×10-2 9.964×10-3 0 3.841×10-3 1.524×10-3 1.687×10-2 48.62
3 1.201×10-2 8.403×10-3 0 4.580×10-3 9.733×10-4 1.486×10-2 49.54
4 0 0 1.520×10-2 1.696×10-3 1.696×10-3 1.181×10-2 48.49
5 0 0 1.287×10-2 1.433×10-3 1.433×10-3 1.000×10-2 48.70
6 0 0 3.777×10-2 4.213×10-3 4.213×10-3 2.934×10-2 48.50
2
c (HI)
c(H2) · c(I2)
在一定温度下,化学平衡体系中反应物浓度与生成物浓度之间有什么关系呢?在457.6℃时反应体系I2(g) + H2(g) 2HI(g)中各物质的浓度如图所示
近似相等
1.化学平衡状态时浓度数据分析
(1)无论该反应从正向进行还是从逆向进行,平衡时只要温度一定,
的值 。
(2)无论反应物或生成物的浓度如何改变,平衡时只要温度一定,
的值也 。
近似相等
(3)分析上表数据可知,该反应在457.6℃达到平衡时,
是一个 。
常数
2.化学平衡常数的概念
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,称为化学平衡常数,简称平衡常数,用符号K 表示。
3. 化学平衡常数的表达式
对于一般的可逆反应:mA(g)+nB(g) pC(g)+qD(g),当该反应在一定温度下达到平衡时,
K=
注意:固体或纯液体其浓度可看成1,一般不列入平衡常数!!!
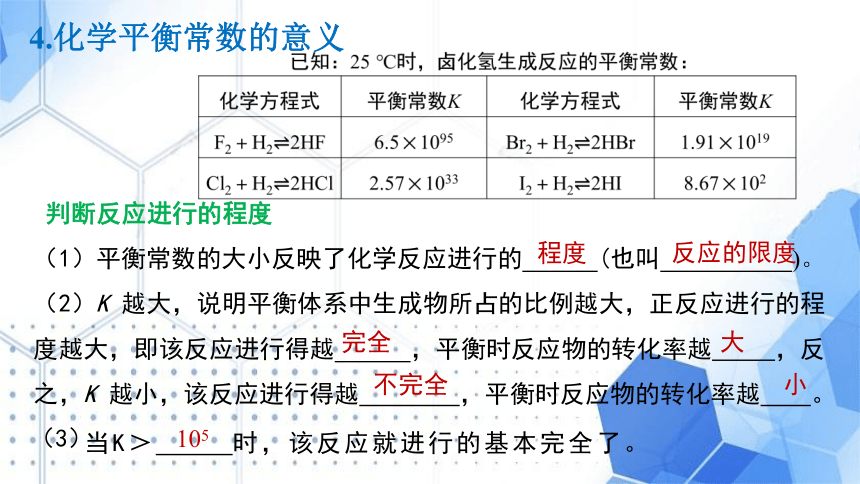
判断反应进行的程度
(1)平衡常数的大小反映了化学反应进行的 (也叫 )。
(2)K 越大,说明平衡体系中生成物所占的比例越大,正反应进行的程度越大,即该反应进行得越 ,平衡时反应物的转化率越 ,反之,K 越小,该反应进行得越 ,平衡时反应物的转化率越 。
程度
反应的限度
完全
大
不完全
小
105
当K> 时,该反应就进行的基本完全了。
(3)
4.化学平衡常数的意义
▲平衡常数数值大,不代表此温度下反应速率快,也不代表反应很容易发生。
▲平衡常数数值极小的反应,说明正反应在该温度下不能进行,如:
N2+O2 2NO K=10-30(298K)所以常温下用此反应固定氮气是不可能的。因此没有必要在该温度下进行实验,以免浪费人力物力。
【点拨】
1.写出下表中各反应的平衡常数表达式:
5.化学平衡常数的影响因素
2NO2(g) N2O4(g)
3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)
Br2+H2O H++Br-+HBrO
K= c(CO2)
CaCO3(s) CaO(s)+CO2(g)
K
1
)
H
(
c
)
N
(
c
)
NH
(
c
2
3
2
3
2
=
K
2
)
NH
(
c
)
H
(
c
)
N
(
c
3
2
2
3
2
=
K
3
)
H
(
c
)
N
(
c
)
NH
(
c
/
/
2
2
3
2
2
1
3
=
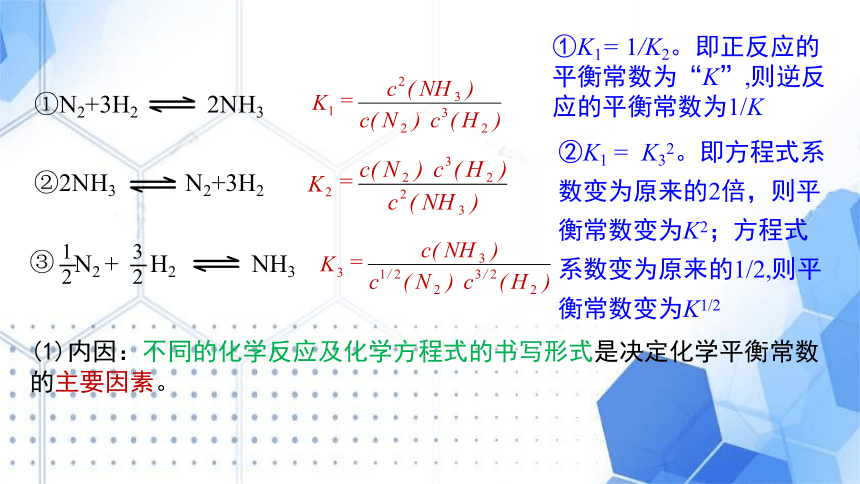
①N2+3H2 2NH3
②2NH3 N2+3H2
N2 + H2 NH3
1
2
3
2
③
(1)内因:不同的化学反应及化学方程式的书写形式是决定化学平衡常数的主要因素。
②K1 = K32。即方程式系数变为原来的2倍,则平衡常数变为K2;方程式系数变为原来的1/2,则平衡常数变为K1/2
①K1= 1/K2。即正反应的平衡常数为“K”,则逆反应的平衡常数为1/K
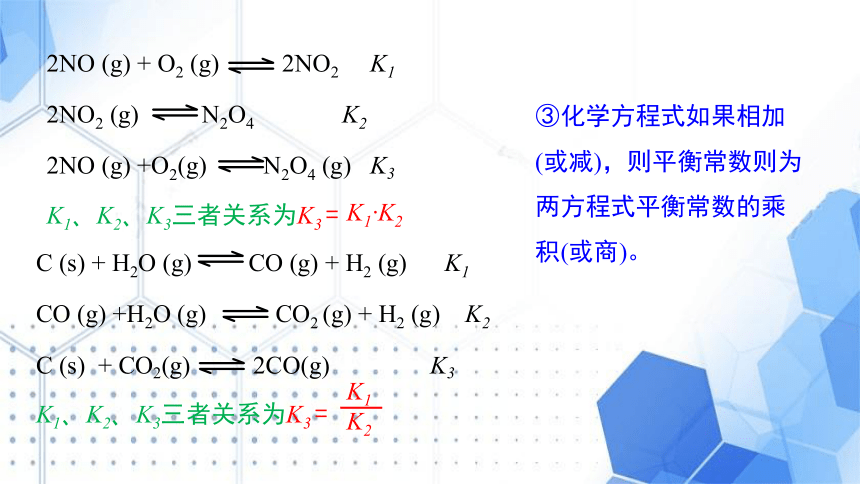
2NO (g) + O2 (g) 2NO2 K1
2NO2 (g) N2O4 K2
2NO (g) +O2(g) N2O4 (g) K3
K1、K2、K3三者关系为K3 =
K1 K2
C (s) + H2O (g) CO (g) + H2 (g) K1
CO (g) +H2O (g) CO2 (g) + H2 (g) K2
C (s) + CO2(g) 2CO(g) K3
K1、K2、K3三者关系为K3 =
K1
K2
③化学方程式如果相加(或减),则平衡常数则为两方程式平衡常数的乘积(或商)。
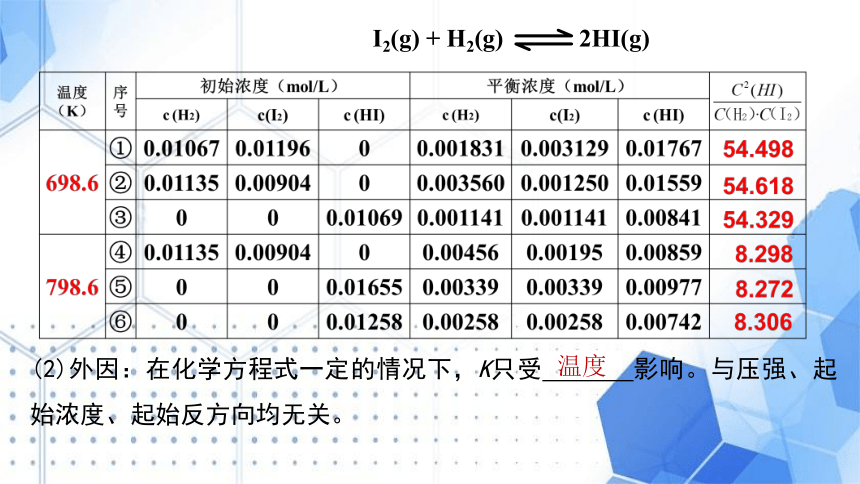
温度
(2)外因:在化学方程式一定的情况下,K只受 影响。与压强、起始浓度、起始反方向均无关。
I2(g) + H2(g) 2HI(g)
K值越大,该反应进行得越完全,反应物的转化率越大;反之,就越不完全,转化率越小
K值 正反应进行的程度 平衡时生成物浓度 平衡时反应物浓度 反应物转化率
越大 越大 越大 越小 越高
越小 越小 越小 越大 越低
6、化学平衡常数的应用
(1)判断反应进行的程度:
如:N2(g)+3H2(g) 2NH3(g)的平衡常数与温度的关系如下,由下表数据分析可知:温度升高,K值减小,则正反应为放热反应
T/K 373 473 573 673 773
K 3.35×109 1.00×107 2.45×105 1.88×104 2.99×103
(2)判断可逆反应的热效应
K值增大→正反应为吸热反应;
K值减小→正反应为放热反应
K值增大→正反应为放热反应;
K值减小→正反应为吸热反应
②降低温度:
①升高温度:
(3)判断正在进行的可逆反应是否达到平衡或反应进行的方向
对于一般的可逆反应:mA(g)+nB(g) pC(g)+qD(g),
在任意时刻的 ,称为 ,常用 表示,即
Q<K,反应向正方向进行
Q = K,反应达到平衡状态
Q >K,反应向逆方向进行
浓度熵
Q
二、化学平衡的有关计算
2.计算思路
(1)巧设未知数:具体题目要具体分析,灵活设立,一般设某物质的转化量为x。
(2)确定三个量:根据反应物、生成物及变化量的三者关系代入未知数确定平衡体系中各物质的起始量、变化量、平衡量并按1中“模式”列表。
(3)解决问题:明确“始”“变”“平”三个量的具体数值,再根据相应关系求平衡时某成分的浓度、反应物转化率等,得出题目答案。
1、已知初始浓度和平衡浓度求平衡常数和平衡转化率
例题1:在某温度下,将H2(g)和I2(g)各0.1mol混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.0080mol/L,求:
(1)反应的平衡常数
(2)在上述温度下,该容器中若通入H2(g)和I2(g)各0.2mol,试求达平衡时各物质的浓度。
(3)计算(1)、 (2)问条件下H2、I2的转化率,通过比较你有什么想法?
(1):H2的转化率为20%,I2的转化率为20%
(2):H2的转化率为20%,I2的转化率为20%
(4)在上述温度下,该容器中若通入0.1molH2、0.2mol I2,试计算H2、I2的转化率,通过分别与(1)、 (2)的转化率比较,你能得出什么结论?
增加反应物之一的浓度,可以提高其他反应物的转化率,而自身的转化率降低。
起始浓度(mol/L) 0.01 0.02 0
变化浓度(mol/L) x x 2x
平衡浓度(mol/L) 0.01 – x 0.02- x 2x
K
=
(H2)
c
(HI)
c
2
(I2)
c
=
(2 x )2
(0.01 – x)
(0.02 - x)
=
0.25
x = 0.00251188458428423 ≈0.0025
H2的转化率为25%,I2的转化率为12.5%
H2 + I2 2HI
2、知平衡常数和初始浓度求平衡浓度及转化率
例题2:在容积不变的密闭容器中,将0.2mol CO(g)与10mol H2O 加热到830℃,达到下列平衡:
此时该反应的K为1.0。求达平衡时CO转化为CO2的转化率。
三、化学平衡的有关计算——
三段式法进行化学平衡的有关计算
可逆反应:mA(g)+nB(g) pC(g)+qD(g),在体积为V的恒容密闭容器中,反应物A、B的初始加入量分别为a mol、b mol,达到化学平衡时,设A物质转化的物质的量为mx mol
对于生成物:n(平)=n(始)+n(转)
mA(g)+nB(g) pC(g)+qD(g)
起始量/mol a b 0 0
转化量/mol mx nx px qx
平衡量/mol a-mx b-nx px qx
对于反应物:n(平)=n(始)-n(转)
ρ
2、表达式:对于可逆反应:
压强平衡常数
拓展
1、Kp含义:在化学平衡体系中,用各气体物质的分压替代浓度计算的平衡常数叫压强平衡常数
3、计算技巧
(1)直接根据分压强计算压强平衡常数
例1、用测压法在刚性密闭容器中研究T ℃时4NO(g) N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
反应时间/min 0 10 20 30 40
压强/MPa 15.00 14.02 13.20 12.50 12.50
(1)20 min时,NO的转化率α==________%
(2)T ℃时,4NO(g) N2(g)+2NO2(g)反应的平衡常数Kp==________(Kp为以分压表示的平衡常数)
=
第一步,根据“三段式”法计算平衡体系中各物质的物质的量或物质的量浓度
第二步,计算各气体组分的物质的量分数或体积分数;
第三步,根据分压计算公式求出各气体物质的分压:某气体的分压==气体总压强×该气体的体积分数(或物质的量分数)
第四步,根据压强平衡常数计算公式代入计算
(2)根据“某气体的分压==气体总压强×该气体的体积分数(或物质的量分数)”计算压强平衡常数
例2、在温度T下,容积固定的密闭容器中充入3 mol NO和2 mol H2发生2H2(g)+2NO(g)N2(g)+2H2O(g),起始压强为p0,一段时间后,反应达到平衡,此时压强p==0.9p0,则NO的平衡转化率α(NO)==________(结果保留三位有效数字),该反应的平衡常数Kp==________(用含p的代数式表示,Kp为以分压表示的平衡常数,且某气体的分压=总压×该气体的物质的量分数)
第二章 化学反应速率与化学平衡
第二节 化学平衡
第3课时 化学平衡常数
一、化学平衡常数
序号 起始时各物质的浓度mol/L 平衡时各物质的浓度mol/L
H2 I2 HI H2 I2 HI
1 1.197×10-2 6.944×10-3 0 5.617×10-3 5.936×10-4 1.270×10-2 48.37
2 1.228×10-2 9.964×10-3 0 3.841×10-3 1.524×10-3 1.687×10-2 48.62
3 1.201×10-2 8.403×10-3 0 4.580×10-3 9.733×10-4 1.486×10-2 49.54
4 0 0 1.520×10-2 1.696×10-3 1.696×10-3 1.181×10-2 48.49
5 0 0 1.287×10-2 1.433×10-3 1.433×10-3 1.000×10-2 48.70
6 0 0 3.777×10-2 4.213×10-3 4.213×10-3 2.934×10-2 48.50
2
c (HI)
c(H2) · c(I2)
在一定温度下,化学平衡体系中反应物浓度与生成物浓度之间有什么关系呢?在457.6℃时反应体系I2(g) + H2(g) 2HI(g)中各物质的浓度如图所示
近似相等
1.化学平衡状态时浓度数据分析
(1)无论该反应从正向进行还是从逆向进行,平衡时只要温度一定,
的值 。
(2)无论反应物或生成物的浓度如何改变,平衡时只要温度一定,
的值也 。
近似相等
(3)分析上表数据可知,该反应在457.6℃达到平衡时,
是一个 。
常数
2.化学平衡常数的概念
在一定温度下,当一个可逆反应达到化学平衡时,生成物浓度幂之积与反应物浓度幂之积的比值是一个常数,称为化学平衡常数,简称平衡常数,用符号K 表示。
3. 化学平衡常数的表达式
对于一般的可逆反应:mA(g)+nB(g) pC(g)+qD(g),当该反应在一定温度下达到平衡时,
K=
注意:固体或纯液体其浓度可看成1,一般不列入平衡常数!!!
判断反应进行的程度
(1)平衡常数的大小反映了化学反应进行的 (也叫 )。
(2)K 越大,说明平衡体系中生成物所占的比例越大,正反应进行的程度越大,即该反应进行得越 ,平衡时反应物的转化率越 ,反之,K 越小,该反应进行得越 ,平衡时反应物的转化率越 。
程度
反应的限度
完全
大
不完全
小
105
当K> 时,该反应就进行的基本完全了。
(3)
4.化学平衡常数的意义
▲平衡常数数值大,不代表此温度下反应速率快,也不代表反应很容易发生。
▲平衡常数数值极小的反应,说明正反应在该温度下不能进行,如:
N2+O2 2NO K=10-30(298K)所以常温下用此反应固定氮气是不可能的。因此没有必要在该温度下进行实验,以免浪费人力物力。
【点拨】
1.写出下表中各反应的平衡常数表达式:
5.化学平衡常数的影响因素
2NO2(g) N2O4(g)
3Fe(s)+4H2O(g) Fe3O4(s)+4H2(g)
Br2+H2O H++Br-+HBrO
K= c(CO2)
CaCO3(s) CaO(s)+CO2(g)
K
1
)
H
(
c
)
N
(
c
)
NH
(
c
2
3
2
3
2
=
K
2
)
NH
(
c
)
H
(
c
)
N
(
c
3
2
2
3
2
=
K
3
)
H
(
c
)
N
(
c
)
NH
(
c
/
/
2
2
3
2
2
1
3
=
①N2+3H2 2NH3
②2NH3 N2+3H2
N2 + H2 NH3
1
2
3
2
③
(1)内因:不同的化学反应及化学方程式的书写形式是决定化学平衡常数的主要因素。
②K1 = K32。即方程式系数变为原来的2倍,则平衡常数变为K2;方程式系数变为原来的1/2,则平衡常数变为K1/2
①K1= 1/K2。即正反应的平衡常数为“K”,则逆反应的平衡常数为1/K
2NO (g) + O2 (g) 2NO2 K1
2NO2 (g) N2O4 K2
2NO (g) +O2(g) N2O4 (g) K3
K1、K2、K3三者关系为K3 =
K1 K2
C (s) + H2O (g) CO (g) + H2 (g) K1
CO (g) +H2O (g) CO2 (g) + H2 (g) K2
C (s) + CO2(g) 2CO(g) K3
K1、K2、K3三者关系为K3 =
K1
K2
③化学方程式如果相加(或减),则平衡常数则为两方程式平衡常数的乘积(或商)。
温度
(2)外因:在化学方程式一定的情况下,K只受 影响。与压强、起始浓度、起始反方向均无关。
I2(g) + H2(g) 2HI(g)
K值越大,该反应进行得越完全,反应物的转化率越大;反之,就越不完全,转化率越小
K值 正反应进行的程度 平衡时生成物浓度 平衡时反应物浓度 反应物转化率
越大 越大 越大 越小 越高
越小 越小 越小 越大 越低
6、化学平衡常数的应用
(1)判断反应进行的程度:
如:N2(g)+3H2(g) 2NH3(g)的平衡常数与温度的关系如下,由下表数据分析可知:温度升高,K值减小,则正反应为放热反应
T/K 373 473 573 673 773
K 3.35×109 1.00×107 2.45×105 1.88×104 2.99×103
(2)判断可逆反应的热效应
K值增大→正反应为吸热反应;
K值减小→正反应为放热反应
K值增大→正反应为放热反应;
K值减小→正反应为吸热反应
②降低温度:
①升高温度:
(3)判断正在进行的可逆反应是否达到平衡或反应进行的方向
对于一般的可逆反应:mA(g)+nB(g) pC(g)+qD(g),
在任意时刻的 ,称为 ,常用 表示,即
Q<K,反应向正方向进行
Q = K,反应达到平衡状态
Q >K,反应向逆方向进行
浓度熵
Q
二、化学平衡的有关计算
2.计算思路
(1)巧设未知数:具体题目要具体分析,灵活设立,一般设某物质的转化量为x。
(2)确定三个量:根据反应物、生成物及变化量的三者关系代入未知数确定平衡体系中各物质的起始量、变化量、平衡量并按1中“模式”列表。
(3)解决问题:明确“始”“变”“平”三个量的具体数值,再根据相应关系求平衡时某成分的浓度、反应物转化率等,得出题目答案。
1、已知初始浓度和平衡浓度求平衡常数和平衡转化率
例题1:在某温度下,将H2(g)和I2(g)各0.1mol混合物充入10L的密闭容器中,充分反应,达到平衡后,测得c(H2)=0.0080mol/L,求:
(1)反应的平衡常数
(2)在上述温度下,该容器中若通入H2(g)和I2(g)各0.2mol,试求达平衡时各物质的浓度。
(3)计算(1)、 (2)问条件下H2、I2的转化率,通过比较你有什么想法?
(1):H2的转化率为20%,I2的转化率为20%
(2):H2的转化率为20%,I2的转化率为20%
(4)在上述温度下,该容器中若通入0.1molH2、0.2mol I2,试计算H2、I2的转化率,通过分别与(1)、 (2)的转化率比较,你能得出什么结论?
增加反应物之一的浓度,可以提高其他反应物的转化率,而自身的转化率降低。
起始浓度(mol/L) 0.01 0.02 0
变化浓度(mol/L) x x 2x
平衡浓度(mol/L) 0.01 – x 0.02- x 2x
K
=
(H2)
c
(HI)
c
2
(I2)
c
=
(2 x )2
(0.01 – x)
(0.02 - x)
=
0.25
x = 0.00251188458428423 ≈0.0025
H2的转化率为25%,I2的转化率为12.5%
H2 + I2 2HI
2、知平衡常数和初始浓度求平衡浓度及转化率
例题2:在容积不变的密闭容器中,将0.2mol CO(g)与10mol H2O 加热到830℃,达到下列平衡:
此时该反应的K为1.0。求达平衡时CO转化为CO2的转化率。
三、化学平衡的有关计算——
三段式法进行化学平衡的有关计算
可逆反应:mA(g)+nB(g) pC(g)+qD(g),在体积为V的恒容密闭容器中,反应物A、B的初始加入量分别为a mol、b mol,达到化学平衡时,设A物质转化的物质的量为mx mol
对于生成物:n(平)=n(始)+n(转)
mA(g)+nB(g) pC(g)+qD(g)
起始量/mol a b 0 0
转化量/mol mx nx px qx
平衡量/mol a-mx b-nx px qx
对于反应物:n(平)=n(始)-n(转)
ρ
2、表达式:对于可逆反应:
压强平衡常数
拓展
1、Kp含义:在化学平衡体系中,用各气体物质的分压替代浓度计算的平衡常数叫压强平衡常数
3、计算技巧
(1)直接根据分压强计算压强平衡常数
例1、用测压法在刚性密闭容器中研究T ℃时4NO(g) N2(g)+2NO2(g)的分解反应,现将一定量的NO充入该密闭容器中,测得体系的总压强随时间的变化如下表所示:
反应时间/min 0 10 20 30 40
压强/MPa 15.00 14.02 13.20 12.50 12.50
(1)20 min时,NO的转化率α==________%
(2)T ℃时,4NO(g) N2(g)+2NO2(g)反应的平衡常数Kp==________(Kp为以分压表示的平衡常数)
=
第一步,根据“三段式”法计算平衡体系中各物质的物质的量或物质的量浓度
第二步,计算各气体组分的物质的量分数或体积分数;
第三步,根据分压计算公式求出各气体物质的分压:某气体的分压==气体总压强×该气体的体积分数(或物质的量分数)
第四步,根据压强平衡常数计算公式代入计算
(2)根据“某气体的分压==气体总压强×该气体的体积分数(或物质的量分数)”计算压强平衡常数
例2、在温度T下,容积固定的密闭容器中充入3 mol NO和2 mol H2发生2H2(g)+2NO(g)N2(g)+2H2O(g),起始压强为p0,一段时间后,反应达到平衡,此时压强p==0.9p0,则NO的平衡转化率α(NO)==________(结果保留三位有效数字),该反应的平衡常数Kp==________(用含p的代数式表示,Kp为以分压表示的平衡常数,且某气体的分压=总压×该气体的物质的量分数)
