第一章 物质及其变化 第一节 物质的分类及转化第1课时 物质的分类2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册)
文档属性
| 名称 | 第一章 物质及其变化 第一节 物质的分类及转化第1课时 物质的分类2022-2023学年高一化学上学期课后培优分级练(人教版2019必修第一册) |

|
|
| 格式 | zip | ||
| 文件大小 | 179.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-09 00:00:00 | ||
图片预览



文档简介
第一章 物质及其变化
第一节 物质的分类及转化
第1课时 物质的分类
培优第一阶——基础过关练
1. 下列物质中属于碱性氧化物的是
A. SO2 B. KOH C. FeO D. NaCl
2. 下列物质不属于分散系的是
A. 水 B. 碘酒 C. 空气 D. 有色玻璃
3. 分类法是研究物质性质的基本方法之一,下列关于的分类不正确的是
A. 碳酸盐 B. 钠盐 C. 酸 D. 易溶盐
4. 当光束通过下列物质时,会出现丁达尔效应的是
①Fe(OH)3胶体 ②蔗糖溶液 ③有尘埃的空气 ④溶液
A. ①② B. ①③ C. ②③ D. ②④
5. 朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾形成的种种美景本质原因是
A. 雾是一种胶体 B. 空气中的小水滴颗粒的布朗运动
C. 发生丁达尔现象 D. 空气中的小水滴颗粒直径大小约为1~100 nm
6. 下列各组物质,按化合物、单质、混合物顺序排列的是
A. 烧碱、液态氧、碘酒
B. 生石灰、白磷、熟石灰
C. 干冰、铁、氯化氢
D. 空气、氮气、胆矾
7. 下列关于胶体的叙述不正确的是
A. Fe(OH)3胶体在一定条件下能稳定存在
B. 胶体分散质的直径介于溶液和浊液分散质直径之间
C. 用激光笔照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
D. 胶体区别于其他分散系的本质特征是分散质粒子的直径在1nm~100nm之间
8. 下列事实中,可以用胶体性质解释的是
A. 利用醋酸除水垢
B. 可以用过滤的方法除去粗盐水中的难溶杂质
C. 向溶液中滴加NaOH溶液产生蓝色沉淀
D. 黑暗的电影院中,放映口发出的光会在影院中形成光柱
9. 下列关于物质分类的说法不正确的是
A. HNO3属于酸 B. SO2属于氧化物 C. Na2CO3属于碱 D. 液态Cl2属于纯净物
10. 分类法在化学学习中应用广泛。
(1)为了保护环境,应减少SO2在大气中的排放。SO2属于酸性氧化物,可与NaOH、___(填与NaOH不同类别的一种具体物质)等反应。写出SO2与NaOH反应的化学方程式___。
(2)氯化铁(FeCl3)可用于金属蚀刻、污水处理等,是重要的化工原料。写出两个生成FeCl3的化学方程式(以含铁元素的不同类别物质为原料)。
①___。
②___。
培优第二阶——拓展培优练
11. 纯碳新材料“碳纳米泡沫”中每个泡沫约含有4000个碳原子,直径约为6-9nm,在低于-183℃时,该泡沫具有水久磁性。下列叙述正确的是
A. “碳纳米泡沫”是一种新型的含碳化合物
B. “碳纳米泡沫”不能透过滤纸
C. “碳纳米泡沫”和金刚石的性质完全相同
D. “碳纳米泡沫”与石墨互为同素异形体
12. 下列关于物质分类的正确组合是
分类 组合 碱 酸 盐 碱性氧化物 酸性氧化物
A CuO
B NaOH HCl
C
D KOH NaCl CaO CO
A. A B. B C. C D. D
13. 分类是化学学习和研究的常用手段。下列分类依据和结论都正确的是
A. 含有氧元素的化合物,一定是氧化物
B. 烧碱、纯碱、火碱都属于碱
C. 酸性氧化物一定是非金属氧化物
D. CuSO4·5H2O、冰水、液氨都属于纯净物
14. 近期意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,下列说法正确的是
A. N4属于一种新型的化合物 B. N4的相对分子质量为56g
C. N4转化为N2属于物理变化 D. N4与N2都是由氮元素形成的不同单质
15. 如图为五个椭圆交叉构成的图案,其中五个椭圆内分别写了C2H5OH、CO2、CO、FeCl3、KOH五种物质,图中相连的物质均可归为一类,相交部分A、B、C、D为相应的分类标准代号:
(1)相连的两种物质都是氧化物的是___________(填分类标准代号,下同)。
(2)图中相连的两种物质能够相互反应的是___________,所属基本反应类型的是___________反应。
(3)用洁净的烧杯取25mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热至液体呈红褐色,得到的分散系称为___________,写出制备此分散系的化学反应方程式___________。
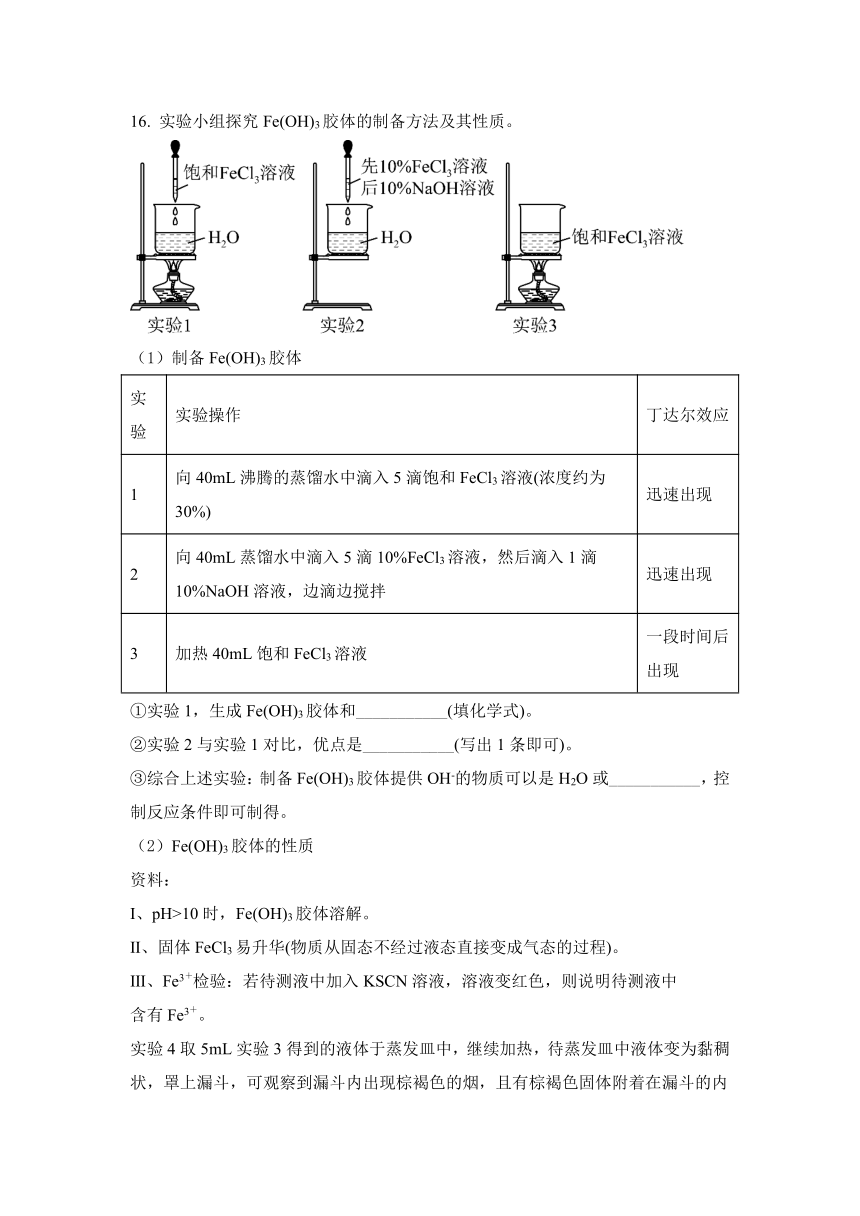
16. 实验小组探究Fe(OH)3胶体的制备方法及其性质。
(1)制备Fe(OH)3胶体
实验 实验操作 丁达尔效应
1 向40mL沸腾的蒸馏水中滴入5滴饱和FeCl3溶液(浓度约为30%) 迅速出现
2 向40mL蒸馏水中滴入5滴10%FeCl3溶液,然后滴入1滴10%NaOH溶液,边滴边搅拌 迅速出现
3 加热40mL饱和FeCl3溶液 一段时间后出现
①实验1,生成Fe(OH)3胶体和___________(填化学式)。
②实验2与实验1对比,优点是___________(写出1条即可)。
③综合上述实验:制备Fe(OH)3胶体提供OH-的物质可以是H2O或___________,控制反应条件即可制得。
(2)Fe(OH)3胶体的性质
资料:
Ⅰ、pH>10时,Fe(OH)3胶体溶解。
Ⅱ、固体FeCl3易升华(物质从固态不经过液态直接变成气态的过程)。
Ⅲ、Fe3+检验:若待测液中加入KSCN溶液,溶液变红色,则说明待测液中
含有Fe3+。
实验4取5mL实验3得到的液体于蒸发皿中,继续加热,待蒸发皿中液体变为黏稠状,罩上漏斗,可观察到漏斗内出现棕褐色的烟,且有棕褐色固体附着在漏斗的内壁上。继续加热,蒸发皿中最终得到红棕色固体Fe2O3。
①根据资料,推测漏斗内棕褐色的烟中主要含有___________(填化学式)。
②检验蒸发皿中红棕色固体中阳离子的方案:取少量红棕色固体溶于稀盐酸中,___________。
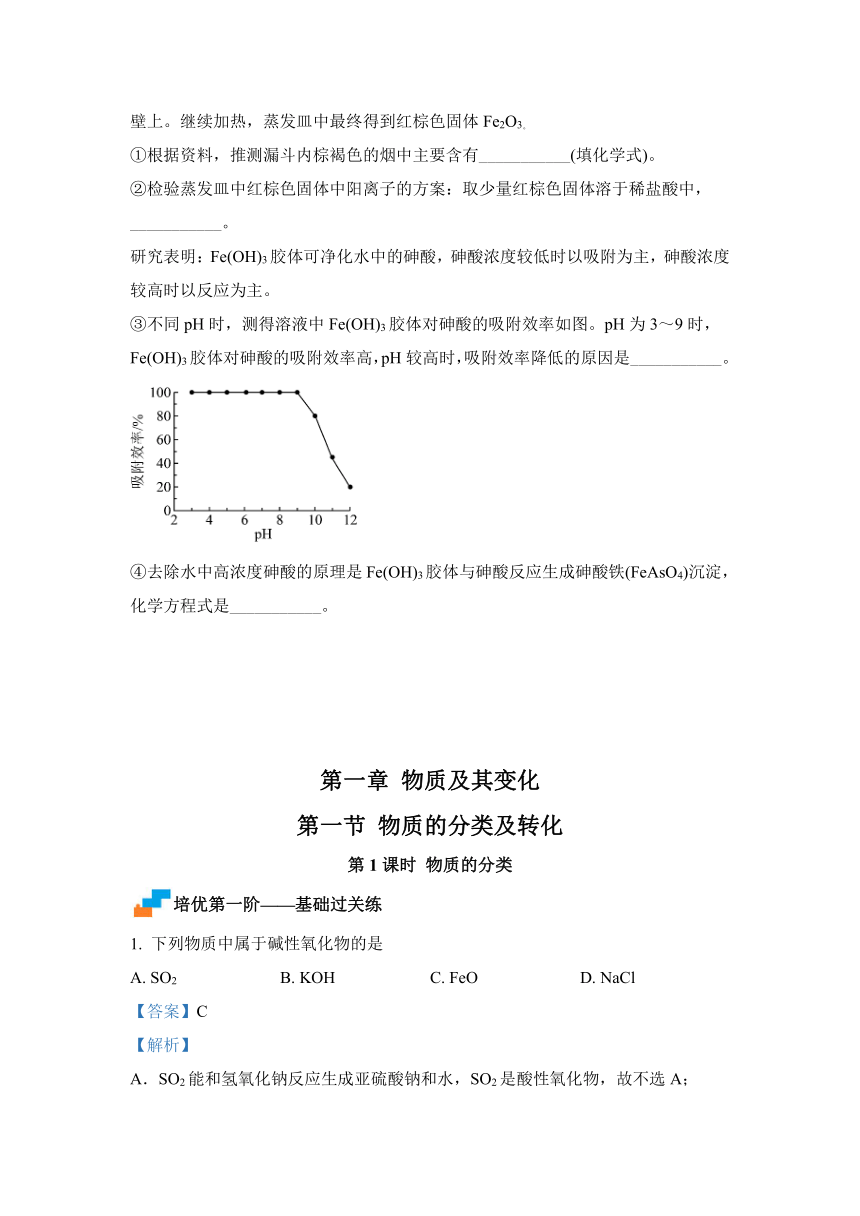
研究表明:Fe(OH)3胶体可净化水中的砷酸,砷酸浓度较低时以吸附为主,砷酸浓度较高时以反应为主。
③不同pH时,测得溶液中Fe(OH)3胶体对砷酸的吸附效率如图。pH为3~9时,Fe(OH)3胶体对砷酸的吸附效率高,pH较高时,吸附效率降低的原因是___________。
④去除水中高浓度砷酸的原理是Fe(OH)3胶体与砷酸反应生成砷酸铁(FeAsO4)沉淀,化学方程式是___________。
第一章 物质及其变化
第一节 物质的分类及转化
第1课时 物质的分类
培优第一阶——基础过关练
1. 下列物质中属于碱性氧化物的是
A. SO2 B. KOH C. FeO D. NaCl
【答案】C
【解析】
A.SO2能和氢氧化钠反应生成亚硫酸钠和水,SO2是酸性氧化物,故不选A;
B.KOH在水溶液中电离出的阴离子全是OH-,KOH属于碱,故不选B;
C.FeO能和盐酸反应生成氯化亚铁和水,FeO属于碱性氧化物,故选C;
D.NaCl能电离出金属阳离子和酸根离子,NaCl属于盐,故不选D;
选C。
2. 下列物质不属于分散系的是
A. 水 B. 碘酒 C. 空气 D. 有色玻璃
【答案】A
【解析】
A.水是纯净物,不属于分散系,故A符合题意;
B.碘酒是碘的乙醇溶液,属于分散系,故B不符合题意;
C.空气是混合物,属于分散系,故C不符合题意;
D.有色玻璃是混合物,属于分散系,故D不符合题意;
故选A。
3. 分类法是研究物质性质的基本方法之一,下列关于的分类不正确的是
A. 碳酸盐 B. 钠盐 C. 酸 D. 易溶盐
【答案】C
【解析】
A.由钠离子和碳酸根离子构成,按照阴离子分类,属于碳酸盐,故A正确;
B.由钠离子和碳酸根离子构成,按照阳离子分类,属于钠盐,故B正确;
C.属于盐,不属于酸,故C错误;
D.易溶于水,按照溶解性分类,属于易溶盐,故D正确;
故选C。
4. 当光束通过下列物质时,会出现丁达尔效应的是
①Fe(OH)3胶体 ②蔗糖溶液 ③有尘埃的空气 ④溶液
A. ①② B. ①③ C. ②③ D. ②④
【答案】B
【解析】
①Fe(OH)3胶体是胶体,能发生丁达尔效应,②蔗糖溶液是溶液不是胶体,不能发生丁达尔效应,③有尘埃的空气具有胶体的成分,能够发生丁达尔效应,④溶液是溶液不是胶体,不能发生丁达尔效应,综上所述可知,①③会出现丁达尔效应,故答案为:B。
5. 朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾形成的种种美景本质原因是
A. 雾是一种胶体 B. 空气中的小水滴颗粒的布朗运动
C. 发生丁达尔现象 D. 空气中的小水滴颗粒直径大小约为1~100 nm
【答案】D
【解析】
雾是一种胶体,所以月光穿过薄雾形成的种种美景的本质原因是空气中的小水滴颗粒直径大小约为1~100nm,故选D。
6. 下列各组物质,按化合物、单质、混合物顺序排列的是
A. 烧碱、液态氧、碘酒
B. 生石灰、白磷、熟石灰
C. 干冰、铁、氯化氢
D. 空气、氮气、胆矾
【答案】A
【解析】
A.烧碱是NaOH的俗称,是化合物,液态氧是单质,碘酒是溶液,属于混合物,故选A;
B.生石灰是CaO的俗称,是化合物,白磷是单质,熟石灰是Ca(OH)2的俗称,是化合物,故不选B;
C.干冰是指固态的二氧化碳,是化合物,铁是单质,氯化氢是化合物,故不选C;
D.空气中含有氮气、氧气等多种成分是混合物,氮气是单质,胆矾是五水合硫酸铜,是化合物,故不选D;
选A。
7. 下列关于胶体的叙述不正确的是
A. Fe(OH)3胶体在一定条件下能稳定存在
B. 胶体分散质的直径介于溶液和浊液分散质直径之间
C. 用激光笔照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
D. 胶体区别于其他分散系的本质特征是分散质粒子的直径在1nm~100nm之间
【答案】C
【解析】
A.胶体具有介稳性,则Fe(OH)3胶体在一定条件下能稳定存在,A正确;
B.胶体分散质的直径为1~100nm,溶液为小于1nm,浊液为大于100nm,故胶体分散质的直径介于溶液和浊液分散质直径之间,B正确;
C.用激光笔照射NaCl溶液无光亮的通路,而照射Fe(OH)3胶体时形成光亮的通路,则产生的现象不相同,C错误;
D.胶体区别于其他分散系的本质特征是分散质粒子的直径在1nm~100nm之间,D正确;
故答案为:C。
8. 下列事实中,可以用胶体性质解释的是
A. 利用醋酸除水垢
B. 可以用过滤的方法除去粗盐水中的难溶杂质
C. 向溶液中滴加NaOH溶液产生蓝色沉淀
D. 黑暗的电影院中,放映口发出的光会在影院中形成光柱
【答案】D
【解析】
A.利用醋酸除水垢是用醋酸溶液与水垢中的碳酸钙反应生成可溶性醋酸钙,与胶体性质无关,不能用胶体性质解释,故A错误;
B.用过滤的方法除去粗盐水中的难溶杂质是利用物质的溶解性不同分离固液混合物,与胶体性质无关,不能用胶体性质解释,故B错误;
C.硫酸铜溶液中滴加氢氧化钠溶液产生蓝色沉淀是盐溶液与碱溶液生成新盐和新碱的复分解反应,与胶体性质无关,不能用胶体性质解释,故C错误;
D.黑暗的电影院中,放映口发出的光会在影院中形成光柱是气溶胶产生了丁达尔效应,与胶体性质有关,能用胶体性质解释,故D正确;
故选D。
9. 下列关于物质分类的说法不正确的是
A. HNO3属于酸 B. SO2属于氧化物 C. Na2CO3属于碱 D. 液态Cl2属于纯净物
【答案】C
【解析】
A.电离出的阳离子只有H+属于酸,所以HNO3属于酸,故A不符合题意;
B.SO2由硫和氧两种元素组成,其中一种元素为氧元素的化合物,故属于氧化物,故B不符合题意;
C.由酸根离子和金属阳离子组成的是盐类物质,所以Na2CO3属于盐,故C 符合题意;
D.只由一种物质组成是纯净物,所以液态Cl2属于纯净物,故D不符合题意;
答案为C。
10. 分类法在化学学习中应用广泛。
(1)为了保护环境,应减少SO2在大气中的排放。SO2属于酸性氧化物,可与NaOH、___(填与NaOH不同类别的一种具体物质)等反应。写出SO2与NaOH反应的化学方程式___。
(2)氯化铁(FeCl3)可用于金属蚀刻、污水处理等,是重要的化工原料。写出两个生成FeCl3的化学方程式(以含铁元素的不同类别物质为原料)。
①___。
②___。
【答案】(1) ①. H2O或Na2O ②. SO2+2NaOH=Na2SO3+H2O
(2) ①. 2Fe+3Cl22FeCl3(或Fe(OH)3+3HCl=FeCl3+3H2O) ②. Fe2O3+6HCl=2FeCl3+3H2O(或3BaCl2+Fe2(SO4)3=2FeCl3+3BaSO4↓)
【解析】
【小问1详解】
SO2属于酸性氧化物,具有酸性氧化物的性质,可与NaOH、H2O、Na2O等反应。SO2与NaOH反应生成亚硫酸钠和水,其反应的化学方程式SO2+2NaOH=Na2SO3+H2O;故答案为:H2O或Na2O;SO2+2NaOH=Na2SO3+H2O。
【小问2详解】
①根据题意,以铁单质和铁的化合物中盐、碱、氧化物分别书写,2Fe+3Cl22FeCl3(或Fe(OH)3+3HCl=FeCl3+3H2O);故答案为:2Fe+3Cl22FeCl3(或Fe(OH)3+3HCl=FeCl3+3H2O)。
②根据前面分析得到Fe2O3+6HCl=2FeCl3+3H2O(或3BaCl2+Fe2(SO4)3=2FeCl3+3BaSO4↓);故答案为:Fe2O3+6HCl=2FeCl3+3H2O(或3BaCl2+Fe2(SO4)3=2FeCl3+3BaSO4↓)。
培优第二阶——拓展培优练
11. 纯碳新材料“碳纳米泡沫”中每个泡沫约含有4000个碳原子,直径约为6-9nm,在低于-183℃时,该泡沫具有水久磁性。下列叙述正确的是
A. “碳纳米泡沫”是一种新型的含碳化合物
B. “碳纳米泡沫”不能透过滤纸
C. “碳纳米泡沫”和金刚石的性质完全相同
D. “碳纳米泡沫”与石墨互为同素异形体
【答案】D
【解析】
A. “碳纳米泡沫”只含有一种元素,属于碳单质,故A错误;
B. “碳纳米泡沫”每个泡沫含有约4000个碳原子,直径约6-9nm,分散到适当的溶剂中形成胶体,能透过滤纸,故B错误;
C. “碳纳米泡沫”在低于-183℃时,泡沫具有永久磁性,金刚石没有磁性,二者性质不同,故C错误;
D. “碳纳米泡沫”只含有一种元素,属于碳单质,与石墨互为同素异形体,故D正确;
故选D。
12. 下列关于物质分类的正确组合是
分类 组合 碱 酸 盐 碱性氧化物 酸性氧化物
A CuO
B NaOH HCl
C
D KOH NaCl CaO CO
A. A B. B C. C D. D
【答案】B
【解析】
A. 属于盐,不是碱,故A错误;
B. NaOH为碱,HCl为酸,为盐,为碱性氧化物,为酸性氧化物,故B正确;
C. 为两性氧化物,故C错误;
D. CO不是酸性氧化物,故D错误;
答案选B。
13. 分类是化学学习和研究的常用手段。下列分类依据和结论都正确的是
A. 含有氧元素的化合物,一定是氧化物
B. 烧碱、纯碱、火碱都属于碱
C. 酸性氧化物一定是非金属氧化物
D. CuSO4·5H2O、冰水、液氨都属于纯净物
【答案】D
【解析】
A.含有氧元素的化合物不一定都是氧化物,如Na2CO3是盐,A项错误;
B.纯碱是碳酸钠,属于盐,B项错误;
C.酸性氧化物不一定是非金属氧化物,如Mn2O7是金属氧化物,但也是酸性氧化物,C项错误;
D.CuSO4·5H2O、冰水、液氨都属于纯净物,D项正确;
答案选D。
14. 近期意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,下列说法正确的是
A. N4属于一种新型的化合物 B. N4的相对分子质量为56g
C. N4转化为N2属于物理变化 D. N4与N2都是由氮元素形成的不同单质
【答案】D
【解析】
A.N4中只有氮元素,因此N4属于单质,A错误;
B. N4的相对分子质量为56,没有单位g,B错误;
C.N4与N2是两种不同的分子,因此N4转化为N2时有新物质产生,发生的变化属于化学变化,C错误;
D.N4与N2是N元素形成的不同性质的单质,二者互为同素异形体,D正确;
答案选D。
15. 如图为五个椭圆交叉构成的图案,其中五个椭圆内分别写了C2H5OH、CO2、CO、FeCl3、KOH五种物质,图中相连的物质均可归为一类,相交部分A、B、C、D为相应的分类标准代号:
(1)相连的两种物质都是氧化物的是___________(填分类标准代号,下同)。
(2)图中相连的两种物质能够相互反应的是___________,所属基本反应类型的是___________反应。
(3)用洁净的烧杯取25mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热至液体呈红褐色,得到的分散系称为___________,写出制备此分散系的化学反应方程式___________。
【答案】(1)B (2) ①. D ②. 复分解
(3) ①. 胶体 ②. FeCl3+3H2OFe(OH)3(胶体)+3HCl
【解析】
【小问1详解】
由两种元素组成、且其中一种元素是氧元素的化合物为氧化物,C2H5OH不是氧化物,CO2是氧化物,CO是氧化物,FeCl3是盐,KOH是碱,因此相连的两种物质都是氧化物的是B。
【小问2详解】
C2H5OH与CO2不发生反应,CO2与CO不发生反应,CO与FeCl3不发生反应,FeCl3与KOH能发生反应,反应的化学方程式为:FeCl3+3KOH=Fe(OH)3↓+3KCl,属于复分解反应。
【小问3详解】
用洁净的烧杯取25mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热至液体呈红褐色,该物质为氯化铁,该红褐色物质为Fe(OH)3胶体,原理为氯化铁水解生成氢氧化铁胶体和HCl,反应的化学方程式为:FeCl3+3H2OFe(OH)3(胶体)+3HCl。
16. 实验小组探究Fe(OH)3胶体的制备方法及其性质。
(1)制备Fe(OH)3胶体
实验 实验操作 丁达尔效应
1 向40mL沸腾的蒸馏水中滴入5滴饱和FeCl3溶液(浓度约为30%) 迅速出现
2 向40mL蒸馏水中滴入5滴10%FeCl3溶液,然后滴入1滴10%NaOH溶液,边滴边搅拌 迅速出现
3 加热40mL饱和FeCl3溶液 一段时间后出现
①实验1,生成Fe(OH)3胶体和___________(填化学式)。
②实验2与实验1对比,优点是___________(写出1条即可)。
③综合上述实验:制备Fe(OH)3胶体提供OH-的物质可以是H2O或___________,控制反应条件即可制得。
(2)Fe(OH)3胶体的性质
资料:
Ⅰ、pH>10时,Fe(OH)3胶体溶解。
Ⅱ、固体FeCl3易升华(物质从固态不经过液态直接变成气态的过程)。
Ⅲ、Fe3+检验:若待测液中加入KSCN溶液,溶液变红色,则说明待测液中含有Fe3+。
实验4取5mL实验3得到的液体于蒸发皿中,继续加热,待蒸发皿中液体变为黏稠状,罩上漏斗,可观察到漏斗内出现棕褐色的烟,且有棕褐色固体附着在漏斗的内壁上。继续加热,蒸发皿中最终得到红棕色固体Fe2O3。
①根据资料,推测漏斗内棕褐色的烟中主要含有___________(填化学式)。
②检验蒸发皿中红棕色固体中阳离子的方案:取少量红棕色固体溶于稀盐酸中,___________。
研究表明:Fe(OH)3胶体可净化水中的砷酸,砷酸浓度较低时以吸附为主,砷酸浓度较高时以反应为主。
③不同pH时,测得溶液中Fe(OH)3胶体对砷酸的吸附效率如图。pH为3~9时,Fe(OH)3胶体对砷酸的吸附效率高,pH较高时,吸附效率降低的原因是___________。
④去除水中高浓度砷酸的原理是Fe(OH)3胶体与砷酸反应生成砷酸铁(FeAsO4)沉淀,化学方程式是___________。
【答案】(1) ①. HCl ②. 不需加热,FeCl3溶液浓度小 ③. NaOH
(2) ①. FeCl3 ②. 滴加KSCN溶液,溶液变红,则固体中含有Fe3+ ③. pH>10时,Fe(OH)3胶体溶解 ④. Fe(OH)3(胶体)+H3AsO4=FeAsO4↓+3H2O
【解析】
本实验通过三种不同的方式制备氢氧化铁胶体,从而比较三种不同方式的优劣,之后验证氢氧化铁胶体的性质。
【小问1详解】
①向40mL沸腾的蒸馏水中滴入5滴饱和FeCl3溶液,FeCl3与H2O反应生成氢氧化铁胶体和HCl。
②根据实验1和实验2的对比可知,实验2的优点是不需加热,可以节约能源,FeCl3溶液浓度小。
③通过实验1和实验2可知,制备Fe(OH)3胶体提供OH-的物质可以是H2O或NaOH,即提供氢氧根离子的物质可以是水或碱。
【小问2详解】
①由资料可知,FeCl3固体易升华,则推测漏斗内棕褐色的烟中主要含有FeCl3。
②红棕色固体中阳离子是Fe3+,所以验证方法为:取少量红棕色固体溶于稀盐酸中,滴加KSCN溶液,溶液变红,则固体中含有Fe3+。
③根据图像以及资料可知,pH较高时,氢氧根离子浓度较大,破坏胶体稳定性,逐渐变为氢氧化铁沉淀,失去吸附性,吸附效率降低。
④Fe(OH)3胶体与砷酸反应生成砷酸铁(FeAsO4)沉淀和水,反应的化学方程式为:Fe(OH)3(胶体)+H3AsO4=FeAsO4↓+3H2O。
第一节 物质的分类及转化
第1课时 物质的分类
培优第一阶——基础过关练
1. 下列物质中属于碱性氧化物的是
A. SO2 B. KOH C. FeO D. NaCl
2. 下列物质不属于分散系的是
A. 水 B. 碘酒 C. 空气 D. 有色玻璃
3. 分类法是研究物质性质的基本方法之一,下列关于的分类不正确的是
A. 碳酸盐 B. 钠盐 C. 酸 D. 易溶盐
4. 当光束通过下列物质时,会出现丁达尔效应的是
①Fe(OH)3胶体 ②蔗糖溶液 ③有尘埃的空气 ④溶液
A. ①② B. ①③ C. ②③ D. ②④
5. 朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾形成的种种美景本质原因是
A. 雾是一种胶体 B. 空气中的小水滴颗粒的布朗运动
C. 发生丁达尔现象 D. 空气中的小水滴颗粒直径大小约为1~100 nm
6. 下列各组物质,按化合物、单质、混合物顺序排列的是
A. 烧碱、液态氧、碘酒
B. 生石灰、白磷、熟石灰
C. 干冰、铁、氯化氢
D. 空气、氮气、胆矾
7. 下列关于胶体的叙述不正确的是
A. Fe(OH)3胶体在一定条件下能稳定存在
B. 胶体分散质的直径介于溶液和浊液分散质直径之间
C. 用激光笔照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
D. 胶体区别于其他分散系的本质特征是分散质粒子的直径在1nm~100nm之间
8. 下列事实中,可以用胶体性质解释的是
A. 利用醋酸除水垢
B. 可以用过滤的方法除去粗盐水中的难溶杂质
C. 向溶液中滴加NaOH溶液产生蓝色沉淀
D. 黑暗的电影院中,放映口发出的光会在影院中形成光柱
9. 下列关于物质分类的说法不正确的是
A. HNO3属于酸 B. SO2属于氧化物 C. Na2CO3属于碱 D. 液态Cl2属于纯净物
10. 分类法在化学学习中应用广泛。
(1)为了保护环境,应减少SO2在大气中的排放。SO2属于酸性氧化物,可与NaOH、___(填与NaOH不同类别的一种具体物质)等反应。写出SO2与NaOH反应的化学方程式___。
(2)氯化铁(FeCl3)可用于金属蚀刻、污水处理等,是重要的化工原料。写出两个生成FeCl3的化学方程式(以含铁元素的不同类别物质为原料)。
①___。
②___。
培优第二阶——拓展培优练
11. 纯碳新材料“碳纳米泡沫”中每个泡沫约含有4000个碳原子,直径约为6-9nm,在低于-183℃时,该泡沫具有水久磁性。下列叙述正确的是
A. “碳纳米泡沫”是一种新型的含碳化合物
B. “碳纳米泡沫”不能透过滤纸
C. “碳纳米泡沫”和金刚石的性质完全相同
D. “碳纳米泡沫”与石墨互为同素异形体
12. 下列关于物质分类的正确组合是
分类 组合 碱 酸 盐 碱性氧化物 酸性氧化物
A CuO
B NaOH HCl
C
D KOH NaCl CaO CO
A. A B. B C. C D. D
13. 分类是化学学习和研究的常用手段。下列分类依据和结论都正确的是
A. 含有氧元素的化合物,一定是氧化物
B. 烧碱、纯碱、火碱都属于碱
C. 酸性氧化物一定是非金属氧化物
D. CuSO4·5H2O、冰水、液氨都属于纯净物
14. 近期意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,下列说法正确的是
A. N4属于一种新型的化合物 B. N4的相对分子质量为56g
C. N4转化为N2属于物理变化 D. N4与N2都是由氮元素形成的不同单质
15. 如图为五个椭圆交叉构成的图案,其中五个椭圆内分别写了C2H5OH、CO2、CO、FeCl3、KOH五种物质,图中相连的物质均可归为一类,相交部分A、B、C、D为相应的分类标准代号:
(1)相连的两种物质都是氧化物的是___________(填分类标准代号,下同)。
(2)图中相连的两种物质能够相互反应的是___________,所属基本反应类型的是___________反应。
(3)用洁净的烧杯取25mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热至液体呈红褐色,得到的分散系称为___________,写出制备此分散系的化学反应方程式___________。
16. 实验小组探究Fe(OH)3胶体的制备方法及其性质。
(1)制备Fe(OH)3胶体
实验 实验操作 丁达尔效应
1 向40mL沸腾的蒸馏水中滴入5滴饱和FeCl3溶液(浓度约为30%) 迅速出现
2 向40mL蒸馏水中滴入5滴10%FeCl3溶液,然后滴入1滴10%NaOH溶液,边滴边搅拌 迅速出现
3 加热40mL饱和FeCl3溶液 一段时间后出现
①实验1,生成Fe(OH)3胶体和___________(填化学式)。
②实验2与实验1对比,优点是___________(写出1条即可)。
③综合上述实验:制备Fe(OH)3胶体提供OH-的物质可以是H2O或___________,控制反应条件即可制得。
(2)Fe(OH)3胶体的性质
资料:
Ⅰ、pH>10时,Fe(OH)3胶体溶解。
Ⅱ、固体FeCl3易升华(物质从固态不经过液态直接变成气态的过程)。
Ⅲ、Fe3+检验:若待测液中加入KSCN溶液,溶液变红色,则说明待测液中
含有Fe3+。
实验4取5mL实验3得到的液体于蒸发皿中,继续加热,待蒸发皿中液体变为黏稠状,罩上漏斗,可观察到漏斗内出现棕褐色的烟,且有棕褐色固体附着在漏斗的内壁上。继续加热,蒸发皿中最终得到红棕色固体Fe2O3。
①根据资料,推测漏斗内棕褐色的烟中主要含有___________(填化学式)。
②检验蒸发皿中红棕色固体中阳离子的方案:取少量红棕色固体溶于稀盐酸中,___________。
研究表明:Fe(OH)3胶体可净化水中的砷酸,砷酸浓度较低时以吸附为主,砷酸浓度较高时以反应为主。
③不同pH时,测得溶液中Fe(OH)3胶体对砷酸的吸附效率如图。pH为3~9时,Fe(OH)3胶体对砷酸的吸附效率高,pH较高时,吸附效率降低的原因是___________。
④去除水中高浓度砷酸的原理是Fe(OH)3胶体与砷酸反应生成砷酸铁(FeAsO4)沉淀,化学方程式是___________。
第一章 物质及其变化
第一节 物质的分类及转化
第1课时 物质的分类
培优第一阶——基础过关练
1. 下列物质中属于碱性氧化物的是
A. SO2 B. KOH C. FeO D. NaCl
【答案】C
【解析】
A.SO2能和氢氧化钠反应生成亚硫酸钠和水,SO2是酸性氧化物,故不选A;
B.KOH在水溶液中电离出的阴离子全是OH-,KOH属于碱,故不选B;
C.FeO能和盐酸反应生成氯化亚铁和水,FeO属于碱性氧化物,故选C;
D.NaCl能电离出金属阳离子和酸根离子,NaCl属于盐,故不选D;
选C。
2. 下列物质不属于分散系的是
A. 水 B. 碘酒 C. 空气 D. 有色玻璃
【答案】A
【解析】
A.水是纯净物,不属于分散系,故A符合题意;
B.碘酒是碘的乙醇溶液,属于分散系,故B不符合题意;
C.空气是混合物,属于分散系,故C不符合题意;
D.有色玻璃是混合物,属于分散系,故D不符合题意;
故选A。
3. 分类法是研究物质性质的基本方法之一,下列关于的分类不正确的是
A. 碳酸盐 B. 钠盐 C. 酸 D. 易溶盐
【答案】C
【解析】
A.由钠离子和碳酸根离子构成,按照阴离子分类,属于碳酸盐,故A正确;
B.由钠离子和碳酸根离子构成,按照阳离子分类,属于钠盐,故B正确;
C.属于盐,不属于酸,故C错误;
D.易溶于水,按照溶解性分类,属于易溶盐,故D正确;
故选C。
4. 当光束通过下列物质时,会出现丁达尔效应的是
①Fe(OH)3胶体 ②蔗糖溶液 ③有尘埃的空气 ④溶液
A. ①② B. ①③ C. ②③ D. ②④
【答案】B
【解析】
①Fe(OH)3胶体是胶体,能发生丁达尔效应,②蔗糖溶液是溶液不是胶体,不能发生丁达尔效应,③有尘埃的空气具有胶体的成分,能够发生丁达尔效应,④溶液是溶液不是胶体,不能发生丁达尔效应,综上所述可知,①③会出现丁达尔效应,故答案为:B。
5. 朱自清在《荷塘月色》中写道:“薄薄的青雾浮起在荷塘里……月光是隔了树照过来的,高处丛生的灌木,落下参差的斑驳的黑影……”月光穿过薄雾形成的种种美景本质原因是
A. 雾是一种胶体 B. 空气中的小水滴颗粒的布朗运动
C. 发生丁达尔现象 D. 空气中的小水滴颗粒直径大小约为1~100 nm
【答案】D
【解析】
雾是一种胶体,所以月光穿过薄雾形成的种种美景的本质原因是空气中的小水滴颗粒直径大小约为1~100nm,故选D。
6. 下列各组物质,按化合物、单质、混合物顺序排列的是
A. 烧碱、液态氧、碘酒
B. 生石灰、白磷、熟石灰
C. 干冰、铁、氯化氢
D. 空气、氮气、胆矾
【答案】A
【解析】
A.烧碱是NaOH的俗称,是化合物,液态氧是单质,碘酒是溶液,属于混合物,故选A;
B.生石灰是CaO的俗称,是化合物,白磷是单质,熟石灰是Ca(OH)2的俗称,是化合物,故不选B;
C.干冰是指固态的二氧化碳,是化合物,铁是单质,氯化氢是化合物,故不选C;
D.空气中含有氮气、氧气等多种成分是混合物,氮气是单质,胆矾是五水合硫酸铜,是化合物,故不选D;
选A。
7. 下列关于胶体的叙述不正确的是
A. Fe(OH)3胶体在一定条件下能稳定存在
B. 胶体分散质的直径介于溶液和浊液分散质直径之间
C. 用激光笔照射NaCl溶液和Fe(OH)3胶体时,产生的现象相同
D. 胶体区别于其他分散系的本质特征是分散质粒子的直径在1nm~100nm之间
【答案】C
【解析】
A.胶体具有介稳性,则Fe(OH)3胶体在一定条件下能稳定存在,A正确;
B.胶体分散质的直径为1~100nm,溶液为小于1nm,浊液为大于100nm,故胶体分散质的直径介于溶液和浊液分散质直径之间,B正确;
C.用激光笔照射NaCl溶液无光亮的通路,而照射Fe(OH)3胶体时形成光亮的通路,则产生的现象不相同,C错误;
D.胶体区别于其他分散系的本质特征是分散质粒子的直径在1nm~100nm之间,D正确;
故答案为:C。
8. 下列事实中,可以用胶体性质解释的是
A. 利用醋酸除水垢
B. 可以用过滤的方法除去粗盐水中的难溶杂质
C. 向溶液中滴加NaOH溶液产生蓝色沉淀
D. 黑暗的电影院中,放映口发出的光会在影院中形成光柱
【答案】D
【解析】
A.利用醋酸除水垢是用醋酸溶液与水垢中的碳酸钙反应生成可溶性醋酸钙,与胶体性质无关,不能用胶体性质解释,故A错误;
B.用过滤的方法除去粗盐水中的难溶杂质是利用物质的溶解性不同分离固液混合物,与胶体性质无关,不能用胶体性质解释,故B错误;
C.硫酸铜溶液中滴加氢氧化钠溶液产生蓝色沉淀是盐溶液与碱溶液生成新盐和新碱的复分解反应,与胶体性质无关,不能用胶体性质解释,故C错误;
D.黑暗的电影院中,放映口发出的光会在影院中形成光柱是气溶胶产生了丁达尔效应,与胶体性质有关,能用胶体性质解释,故D正确;
故选D。
9. 下列关于物质分类的说法不正确的是
A. HNO3属于酸 B. SO2属于氧化物 C. Na2CO3属于碱 D. 液态Cl2属于纯净物
【答案】C
【解析】
A.电离出的阳离子只有H+属于酸,所以HNO3属于酸,故A不符合题意;
B.SO2由硫和氧两种元素组成,其中一种元素为氧元素的化合物,故属于氧化物,故B不符合题意;
C.由酸根离子和金属阳离子组成的是盐类物质,所以Na2CO3属于盐,故C 符合题意;
D.只由一种物质组成是纯净物,所以液态Cl2属于纯净物,故D不符合题意;
答案为C。
10. 分类法在化学学习中应用广泛。
(1)为了保护环境,应减少SO2在大气中的排放。SO2属于酸性氧化物,可与NaOH、___(填与NaOH不同类别的一种具体物质)等反应。写出SO2与NaOH反应的化学方程式___。
(2)氯化铁(FeCl3)可用于金属蚀刻、污水处理等,是重要的化工原料。写出两个生成FeCl3的化学方程式(以含铁元素的不同类别物质为原料)。
①___。
②___。
【答案】(1) ①. H2O或Na2O ②. SO2+2NaOH=Na2SO3+H2O
(2) ①. 2Fe+3Cl22FeCl3(或Fe(OH)3+3HCl=FeCl3+3H2O) ②. Fe2O3+6HCl=2FeCl3+3H2O(或3BaCl2+Fe2(SO4)3=2FeCl3+3BaSO4↓)
【解析】
【小问1详解】
SO2属于酸性氧化物,具有酸性氧化物的性质,可与NaOH、H2O、Na2O等反应。SO2与NaOH反应生成亚硫酸钠和水,其反应的化学方程式SO2+2NaOH=Na2SO3+H2O;故答案为:H2O或Na2O;SO2+2NaOH=Na2SO3+H2O。
【小问2详解】
①根据题意,以铁单质和铁的化合物中盐、碱、氧化物分别书写,2Fe+3Cl22FeCl3(或Fe(OH)3+3HCl=FeCl3+3H2O);故答案为:2Fe+3Cl22FeCl3(或Fe(OH)3+3HCl=FeCl3+3H2O)。
②根据前面分析得到Fe2O3+6HCl=2FeCl3+3H2O(或3BaCl2+Fe2(SO4)3=2FeCl3+3BaSO4↓);故答案为:Fe2O3+6HCl=2FeCl3+3H2O(或3BaCl2+Fe2(SO4)3=2FeCl3+3BaSO4↓)。
培优第二阶——拓展培优练
11. 纯碳新材料“碳纳米泡沫”中每个泡沫约含有4000个碳原子,直径约为6-9nm,在低于-183℃时,该泡沫具有水久磁性。下列叙述正确的是
A. “碳纳米泡沫”是一种新型的含碳化合物
B. “碳纳米泡沫”不能透过滤纸
C. “碳纳米泡沫”和金刚石的性质完全相同
D. “碳纳米泡沫”与石墨互为同素异形体
【答案】D
【解析】
A. “碳纳米泡沫”只含有一种元素,属于碳单质,故A错误;
B. “碳纳米泡沫”每个泡沫含有约4000个碳原子,直径约6-9nm,分散到适当的溶剂中形成胶体,能透过滤纸,故B错误;
C. “碳纳米泡沫”在低于-183℃时,泡沫具有永久磁性,金刚石没有磁性,二者性质不同,故C错误;
D. “碳纳米泡沫”只含有一种元素,属于碳单质,与石墨互为同素异形体,故D正确;
故选D。
12. 下列关于物质分类的正确组合是
分类 组合 碱 酸 盐 碱性氧化物 酸性氧化物
A CuO
B NaOH HCl
C
D KOH NaCl CaO CO
A. A B. B C. C D. D
【答案】B
【解析】
A. 属于盐,不是碱,故A错误;
B. NaOH为碱,HCl为酸,为盐,为碱性氧化物,为酸性氧化物,故B正确;
C. 为两性氧化物,故C错误;
D. CO不是酸性氧化物,故D错误;
答案选B。
13. 分类是化学学习和研究的常用手段。下列分类依据和结论都正确的是
A. 含有氧元素的化合物,一定是氧化物
B. 烧碱、纯碱、火碱都属于碱
C. 酸性氧化物一定是非金属氧化物
D. CuSO4·5H2O、冰水、液氨都属于纯净物
【答案】D
【解析】
A.含有氧元素的化合物不一定都是氧化物,如Na2CO3是盐,A项错误;
B.纯碱是碳酸钠,属于盐,B项错误;
C.酸性氧化物不一定是非金属氧化物,如Mn2O7是金属氧化物,但也是酸性氧化物,C项错误;
D.CuSO4·5H2O、冰水、液氨都属于纯净物,D项正确;
答案选D。
14. 近期意大利罗马大学的FulvioCacace等人获得了极具理论研究意义的N4分子。N4分子结构如图所示,下列说法正确的是
A. N4属于一种新型的化合物 B. N4的相对分子质量为56g
C. N4转化为N2属于物理变化 D. N4与N2都是由氮元素形成的不同单质
【答案】D
【解析】
A.N4中只有氮元素,因此N4属于单质,A错误;
B. N4的相对分子质量为56,没有单位g,B错误;
C.N4与N2是两种不同的分子,因此N4转化为N2时有新物质产生,发生的变化属于化学变化,C错误;
D.N4与N2是N元素形成的不同性质的单质,二者互为同素异形体,D正确;
答案选D。
15. 如图为五个椭圆交叉构成的图案,其中五个椭圆内分别写了C2H5OH、CO2、CO、FeCl3、KOH五种物质,图中相连的物质均可归为一类,相交部分A、B、C、D为相应的分类标准代号:
(1)相连的两种物质都是氧化物的是___________(填分类标准代号,下同)。
(2)图中相连的两种物质能够相互反应的是___________,所属基本反应类型的是___________反应。
(3)用洁净的烧杯取25mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热至液体呈红褐色,得到的分散系称为___________,写出制备此分散系的化学反应方程式___________。
【答案】(1)B (2) ①. D ②. 复分解
(3) ①. 胶体 ②. FeCl3+3H2OFe(OH)3(胶体)+3HCl
【解析】
【小问1详解】
由两种元素组成、且其中一种元素是氧元素的化合物为氧化物,C2H5OH不是氧化物,CO2是氧化物,CO是氧化物,FeCl3是盐,KOH是碱,因此相连的两种物质都是氧化物的是B。
【小问2详解】
C2H5OH与CO2不发生反应,CO2与CO不发生反应,CO与FeCl3不发生反应,FeCl3与KOH能发生反应,反应的化学方程式为:FeCl3+3KOH=Fe(OH)3↓+3KCl,属于复分解反应。
【小问3详解】
用洁净的烧杯取25mL蒸馏水,加热至沸腾,向烧杯中逐滴加入上述五种物质中的某一物质的饱和溶液,加热至液体呈红褐色,该物质为氯化铁,该红褐色物质为Fe(OH)3胶体,原理为氯化铁水解生成氢氧化铁胶体和HCl,反应的化学方程式为:FeCl3+3H2OFe(OH)3(胶体)+3HCl。
16. 实验小组探究Fe(OH)3胶体的制备方法及其性质。
(1)制备Fe(OH)3胶体
实验 实验操作 丁达尔效应
1 向40mL沸腾的蒸馏水中滴入5滴饱和FeCl3溶液(浓度约为30%) 迅速出现
2 向40mL蒸馏水中滴入5滴10%FeCl3溶液,然后滴入1滴10%NaOH溶液,边滴边搅拌 迅速出现
3 加热40mL饱和FeCl3溶液 一段时间后出现
①实验1,生成Fe(OH)3胶体和___________(填化学式)。
②实验2与实验1对比,优点是___________(写出1条即可)。
③综合上述实验:制备Fe(OH)3胶体提供OH-的物质可以是H2O或___________,控制反应条件即可制得。
(2)Fe(OH)3胶体的性质
资料:
Ⅰ、pH>10时,Fe(OH)3胶体溶解。
Ⅱ、固体FeCl3易升华(物质从固态不经过液态直接变成气态的过程)。
Ⅲ、Fe3+检验:若待测液中加入KSCN溶液,溶液变红色,则说明待测液中含有Fe3+。
实验4取5mL实验3得到的液体于蒸发皿中,继续加热,待蒸发皿中液体变为黏稠状,罩上漏斗,可观察到漏斗内出现棕褐色的烟,且有棕褐色固体附着在漏斗的内壁上。继续加热,蒸发皿中最终得到红棕色固体Fe2O3。
①根据资料,推测漏斗内棕褐色的烟中主要含有___________(填化学式)。
②检验蒸发皿中红棕色固体中阳离子的方案:取少量红棕色固体溶于稀盐酸中,___________。
研究表明:Fe(OH)3胶体可净化水中的砷酸,砷酸浓度较低时以吸附为主,砷酸浓度较高时以反应为主。
③不同pH时,测得溶液中Fe(OH)3胶体对砷酸的吸附效率如图。pH为3~9时,Fe(OH)3胶体对砷酸的吸附效率高,pH较高时,吸附效率降低的原因是___________。
④去除水中高浓度砷酸的原理是Fe(OH)3胶体与砷酸反应生成砷酸铁(FeAsO4)沉淀,化学方程式是___________。
【答案】(1) ①. HCl ②. 不需加热,FeCl3溶液浓度小 ③. NaOH
(2) ①. FeCl3 ②. 滴加KSCN溶液,溶液变红,则固体中含有Fe3+ ③. pH>10时,Fe(OH)3胶体溶解 ④. Fe(OH)3(胶体)+H3AsO4=FeAsO4↓+3H2O
【解析】
本实验通过三种不同的方式制备氢氧化铁胶体,从而比较三种不同方式的优劣,之后验证氢氧化铁胶体的性质。
【小问1详解】
①向40mL沸腾的蒸馏水中滴入5滴饱和FeCl3溶液,FeCl3与H2O反应生成氢氧化铁胶体和HCl。
②根据实验1和实验2的对比可知,实验2的优点是不需加热,可以节约能源,FeCl3溶液浓度小。
③通过实验1和实验2可知,制备Fe(OH)3胶体提供OH-的物质可以是H2O或NaOH,即提供氢氧根离子的物质可以是水或碱。
【小问2详解】
①由资料可知,FeCl3固体易升华,则推测漏斗内棕褐色的烟中主要含有FeCl3。
②红棕色固体中阳离子是Fe3+,所以验证方法为:取少量红棕色固体溶于稀盐酸中,滴加KSCN溶液,溶液变红,则固体中含有Fe3+。
③根据图像以及资料可知,pH较高时,氢氧根离子浓度较大,破坏胶体稳定性,逐渐变为氢氧化铁沉淀,失去吸附性,吸附效率降低。
④Fe(OH)3胶体与砷酸反应生成砷酸铁(FeAsO4)沉淀和水,反应的化学方程式为:Fe(OH)3(胶体)+H3AsO4=FeAsO4↓+3H2O。
