江苏省扬州市宝应县2021-2022学年高二下学期期中检测化学试卷(Word版含答案)
文档属性
| 名称 | 江苏省扬州市宝应县2021-2022学年高二下学期期中检测化学试卷(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-11 18:25:33 | ||
图片预览



文档简介
宝应县2021-2022学年高二下学期期中检测
化学
(本试卷满分100分,考试时间75分钟)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Al 27 S 32 Fe 56 Cu 64
一、单项选择题:共14题,每题3分,共42分。每题只有一个选项最符合题意。
1.科技创新让2022年北京冬奥会举世瞩目。对下列科技创新所涉及化学知识判断正确的是
A.“战袍”利用微信小程序,调控石墨烯片加热保暖,石墨烯和碳纳米管互为同分异构体
B.冰墩墩的外壳材质主要是有机硅橡胶,有机硅橡胶是纯净物
C.主火炬96块小雪花和6个橄榄枝组成,没有两片雪花是相同的,因此雪花为非晶体
D.速滑竞赛服使用聚氨酯材料可减少空气阻力,聚氨酯是高分子材料
2.下列表示相关微粒的化学用语正确的是
A.的电子式: B.硝基苯的结构简式:
C.乙醇的结构式: D.的球棍模型:
3.下列生活中遇到的问题,不涉及到化学变化的是
A.用食醋来除水壶里的水垢 B.烹鱼时加入少量食醋和黄酒来调味
C.用CCl4可擦去圆珠笔油渍 D.蜂蚁蛰咬处涂抹稀氨水可减痛
4.下列实验操作中正确的是
A.除去苯中的苯酚:加适量溴水,过滤
B.实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸
C.检验卤代烃中的卤原子:加入NaOH溶液共热,再加AgNO3溶液,观察沉淀的颜色
D. 鉴别己烯和苯:向己烯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色
5.奥昔布宁具有解痉和抗胆碱作用,其结构简式如图所示。下列关于奥昔布宁的说法正确的是
A.分子中的含氧官能团为羟基和羧基
B.奥昔布宁能使溴的CCl4溶液褪色
C.分子中碳原子轨道杂化类型有2种
D.奥昔布宁不能发生消去反应
6.下列实验方案设计正确且能达到相应实验目的的是
A.用装置甲实验室制乙烯并检验产物
B.用装置乙实验室制溴苯并检验产物中的HBr
C.用装置丙蒸干溶液获得CuSO4·5H2O
D.用装置丁实验室制乙酸乙酯并收集
7.HOCH2CH=CHCH2OH 广泛用于生产工程塑料及纤维,下列有关说法正确的是
A.与乙酸乙酯互为同分异构体
B. 与乙酸互为同系物
C.所有原子均处于同一平面
D.可被酸性KMnO4 氧化为HOOCCH=CHCOOH
8.向盛有硫酸铜蓝色溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色溶液,再加无水乙醇得到深蓝色晶体。下列说法正确的是
A.深蓝色溶液中含有的主要有色离子为
B.加乙醇的目的是降低生成的配合物的溶解度
C. NH3与Cu2+间的配位键比H2O与Cu2+间的配位键弱
D.1 mol 中含有键的数目为8 mol
9.水杨酸X与化合物Y在一定条件下可合成阿司匹林Z。下列说法正确的是
A.1 mol X中含有2 mol碳氧π键
B.1 mol X与足量的溴水反应,消耗3 mol Br2
C.1 mol Z在一定条件下反应消耗4 mol H2
D.1 mol X和1 mol Z分别与足量NaOH溶液反应,消耗NaOH的物质的量之比为2:3
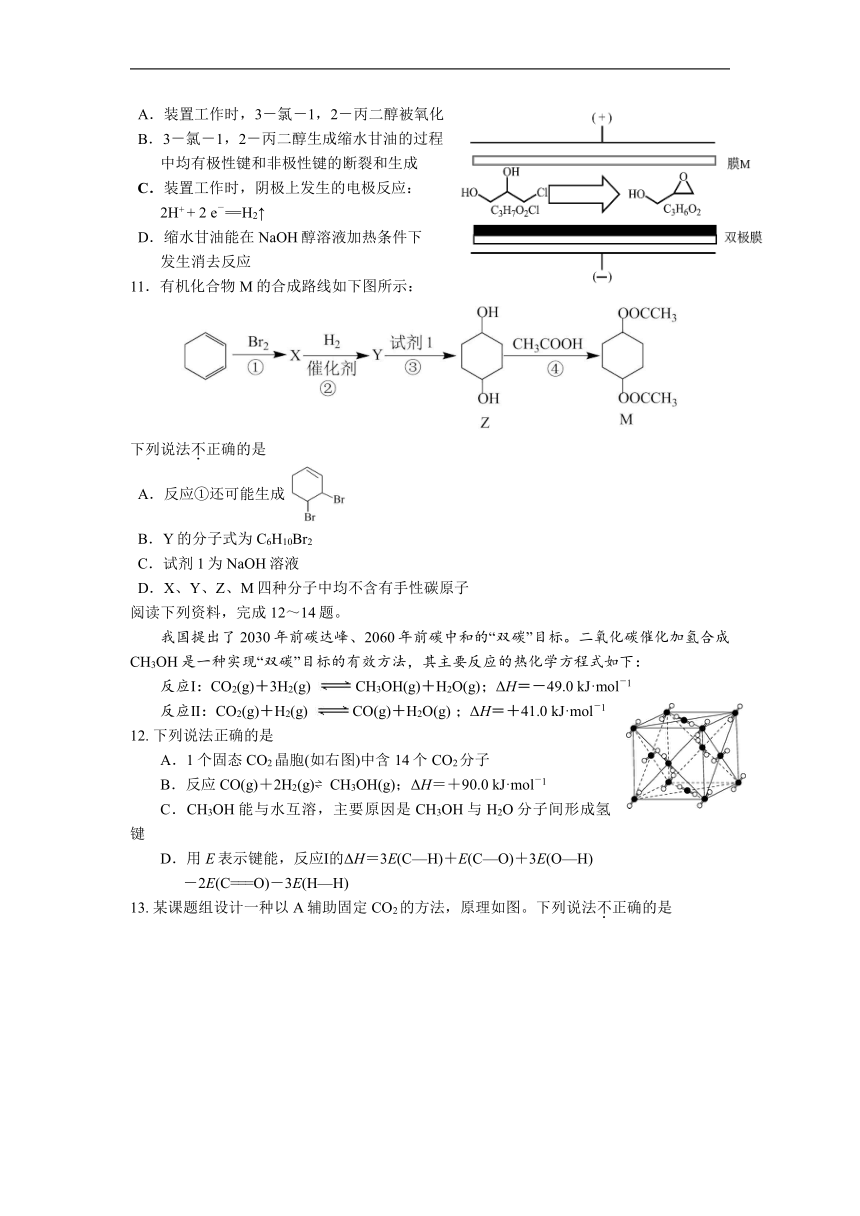
10.双极膜电渗析法制备缩水甘油()的原理:将3-氯-1,2-丙二醇的水溶液通过膜M与双极膜之间的电渗析室,最终得到的缩水甘油纯度很高(几乎不含无机盐)。在直流电场的作用下,双极膜复合层间的H2O解离成OH-和H+并分别通过阴膜和阳膜。下列说法正确的是
A.装置工作时,3-氯-1,2-丙二醇被氧化
B.3-氯-1,2-丙二醇生成缩水甘油的过程
中均有极性键和非极性键的断裂和生成
C.装置工作时,阴极上发生的电极反应:
2H+ + 2 e-=H2↑
D.缩水甘油能在NaOH醇溶液加热条件下
发生消去反应
11.有机化合物M的合成路线如下图所示:
下列说法不正确的是
A.反应①还可能生成
B.Y的分子式为C6H10Br2
C.试剂1为NaOH溶液
D.X、Y、Z、M四种分子中均不含有手性碳原子
阅读下列资料,完成12~14题。
我国提出了2030年前碳达峰、2060年前碳中和的“双碳”目标。二氧化碳催化加氢合成CH3OH是一种实现“双碳”目标的有效方法,其主要反应的热化学方程式如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH=-49.0 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) ;ΔH=+41.0 kJ·mol-1
12. 下列说法正确的是
A.1个固态CO2晶胞(如右图)中含14个CO2分子
B.反应CO(g)+2H2(g) CH3OH(g);ΔH=+90.0 kJ·mol-1
C.CH3OH能与水互溶,主要原因是CH3OH与H2O分子间形成氢键
D.用E表示键能,反应Ⅰ的ΔH=3E(C—H)+E(C—O)+3E(O—H)
-2E(C===O)-3E(H—H)
13. 某课题组设计一种以A辅助固定CO2的方法,原理如图。下列说法不正确的是
A.总反应符合“绿色化学”理念,原子利用率100%。
B.化合物A为CH3OH
C.HOCH2CH2OH若用辅助固定,则产物可能为
D.反应②的类型为加成反应
14.在二氧化碳加氢制甲烷的反应体系中,主要发生反应的热化学方程式为
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
向恒压、密闭容器中通入1 mol CO2和4 mol H2,平衡时CH4、CO、CO2的物质的量随温度的变化如图所示.下列说法正确的是
A.反应Ⅰ的平衡常数可表示为
B.图中曲线C表示的物质的量随温度的变化
C.提高CO2转化为CH4的转化率,需要研发在高温区高效的催化剂
D.的
二、 非选择题:共4题,共58分。
15.(16分)已知元素X、Y均为短周期元素,X元素的一种核素常用于测文物的年代,Y元素原子半径是所有原子中最小的,元素X、Y可形成两种化合物M和N,已知M可以使酸性高锰酸钾溶液褪色,M分子中所含X元素的质量是Y元素质量的6倍,且M的相对分子质量为56。N是一种常用溶剂,分子式中两种元素原子个数比为1:1。回答下列问题:
(1) ①M的分子式为: ▲ 。
②写出一种含有顺反异构的M的结构简式 ▲ 。
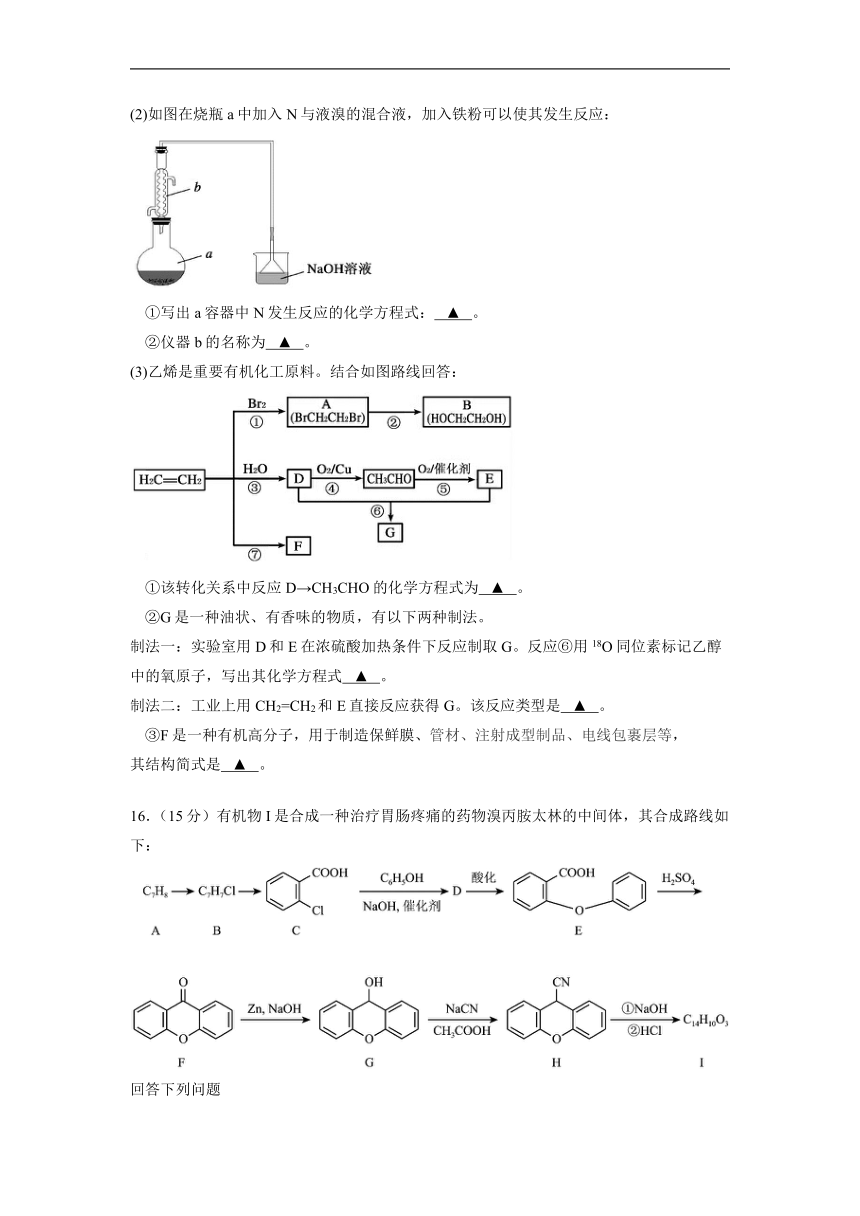
(2)如图在烧瓶a中加入N与液溴的混合液,加入铁粉可以使其发生反应:
①写出a容器中N发生反应的化学方程式: ▲ 。
②仪器b的名称为 ▲ 。
(3)乙烯是重要有机化工原料。结合如图路线回答:
①该转化关系中反应D→CH3CHO的化学方程式为 ▲ 。
②G是一种油状、有香味的物质,有以下两种制法。
制法一:实验室用D和E在浓硫酸加热条件下反应制取G。反应⑥用18O同位素标记乙醇中的氧原子,写出其化学方程式 ▲ 。
制法二:工业上用CH2=CH2和E直接反应获得G。该反应类型是 ▲ 。
③F是一种有机高分子,用于制造保鲜膜、管材、注射成型制品、电线包裹层等,
其结构简式是 ▲ 。
16.(15分)有机物I是合成一种治疗胃肠疼痛的药物溴丙胺太林的中间体,其合成路线如下:
回答下列问题
(1)A的化学名称为 ▲ ,化合物I中含氧官能团的名称 ▲ 。
(2)B→C的反应类型 ▲ 。
(3)写出在一定温度、压强、催化剂的作用下化合物C和过量氢氧化钠溶液反应的化学方程式 ▲ 。
(4)符合下列条件的G的同分异构体的结构简式 ▲ 。
①分子中含有两个苯环结构,且苯环间以单键相连
②能发生银镜反应,能与FeCl3溶液发生显色反应。
③核磁共振氢谱为六组峰,峰面积之比为1∶2∶2∶2∶2∶1。
(5)结合上述流程相关信息,设计以二苯甲酮()和乙醇、乙酸为原料合成化合物的合理流程图(反应条件及无机物任选) ▲ 。
17.(12分)苯胺又名氨基苯是最重要的胺类物质之一,可作为炸药中的稳定剂、汽油中的防爆剂,也可作为医药磺胺药的原料等。苯胺为无色油状液体,有特殊气味,可用水蒸气蒸馏提纯。用纳米铁粉还原硝基苯制备苯胺的原理及装置图(略去夹持装置和加热装置)如下:
4+9Fe+4H2O4+3Fe3O4
已知部分有机物的一些数据如下表:
名称 相对分子质量 密度(g/mL) 熔点(℃) 沸点(℃) 溶解性
硝基苯 123 1.20 5.7 210.8 难溶于水,易溶于乙醇、乙醚
苯胺 93 1.02 -6.3 184.4 难溶于水,易溶于乙醇、乙醚
乙醚 74 0.71 -116.3 34.6 微溶于水,易溶于乙醇
I.合成:在装置1中的仪器X中,加入9g纳米铁粉、20mL水、1mL冰醋酸,加热至煮沸,煮沸后冷却至室温,再将8.0mL硝基苯逐滴加入(该反应强烈放热),搅拌、加热、回流半小时,至反应完全。
II.分离提纯:将装置1改为装置2进行水蒸气蒸馏,取装置2中的馏出物约5-6mL,转移至分液漏斗中,分离出有机层后,水层加入1.3gNaCl固体,用乙醚萃取3次(每次用7.0mL乙醚),合并有机层和乙醚萃取液,加入粒状NaOH干燥,过滤后转移至干燥的圆底烧瓶中,水浴蒸去乙醚,残留物再利用装置3蒸馏并收集温度T℃时的馏分。
请回答下列问题:
(1)加入硝基苯时,“逐滴加入”的目的是 ▲ 。
(2)分离提纯过程中加入NaCl固体的作用是 ▲ 。
(3)装置2中长导管B的作用是 ▲ 。
(4)“水蒸气蒸馏”结束后,应先打开止水夹T,再停止对“水蒸气发生装置”加热,目的是
▲ 。
(5)利用装置3蒸馏时,温度的范围为 ▲ ,实验结束得到产物6.5mL,则苯胺的产率为
▲ (保留三位有效数字)。
18.(15分)化合物F是合成某种祛痰止咳药的重要中间体,其合成路线如下:
(1)1 mol 有机物C中含键的数目为 ▲ 。
(2)D→E的过程中,涉及的反应类型有:加成反应、 ▲ 。
(3)若E中有D残留,则产物F中可能含有杂质C7H7NOBr2,其结构简式为 ▲ 。
(4)的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
▲ 。
①分子中有一个含氮五元环;
②核磁共振氢谱显示分子中有5种不同化学环境的氢原子;
③红外光谱显示分子中无甲基。
(5)已知:,易被氧化(R为H或烃基)。
设计以和为原料制备 的合成路线 ▲ 。
(无机试剂和有机溶剂任用,合成路线示例见本题题干)。
宝应县2021-2022学年高二下学期期中检测化学参考答案
一、单项选择题:本题包括14小题,每小题3分,共计42分.
1. D 2. A 3. C 4.D 5. B 6. B 7. A 8. B 9. D 10. C 11. D 12. C 13.A 14.B
二、非选择题:共4题,共58分。
15. (每空2分,共16分)
(1)①C4H8 ②CH3CH=CHCH3
(2)① ②球形冷凝管(冷凝管)
(3)①2CH3CH2OH + O2 2CH3CHO + 2H2O
②CH3COOH + CH3CH218OH CH3CO18O CH2CH3+ H2O
加成反应 ③
16.(共15分)
(1) 甲苯(甲基苯) (2分) 羧基和醚键 (2分,各1分)
(2) 氧化反应 (2分)
(3) +3NaOH+NaCl+2H2O (2分)
(4) (-CHO与-OH可以互换) (2分)
(5) (5分)
17. (每空2分,共12分)
(1)控制反应速率,防止爆炸;提高硝基苯的转化率 (达到一点即给2分)
(2)减小苯胺在水中的溶解度,提高苯胺的产率
(3) 平衡装置内外气压,防止发生爆炸
(4)防止倒吸
(5)184.4-210.8℃ 91.3%
18.(共15分)
(1)18 mol(2分)
(2)消去反应(2分)
(3) (3分) (4) (3分)
(5) (5分)
化学
(本试卷满分100分,考试时间75分钟)
可能用到的相对原子质量:H 1 C 12 N 14 O 16 Al 27 S 32 Fe 56 Cu 64
一、单项选择题:共14题,每题3分,共42分。每题只有一个选项最符合题意。
1.科技创新让2022年北京冬奥会举世瞩目。对下列科技创新所涉及化学知识判断正确的是
A.“战袍”利用微信小程序,调控石墨烯片加热保暖,石墨烯和碳纳米管互为同分异构体
B.冰墩墩的外壳材质主要是有机硅橡胶,有机硅橡胶是纯净物
C.主火炬96块小雪花和6个橄榄枝组成,没有两片雪花是相同的,因此雪花为非晶体
D.速滑竞赛服使用聚氨酯材料可减少空气阻力,聚氨酯是高分子材料
2.下列表示相关微粒的化学用语正确的是
A.的电子式: B.硝基苯的结构简式:
C.乙醇的结构式: D.的球棍模型:
3.下列生活中遇到的问题,不涉及到化学变化的是
A.用食醋来除水壶里的水垢 B.烹鱼时加入少量食醋和黄酒来调味
C.用CCl4可擦去圆珠笔油渍 D.蜂蚁蛰咬处涂抹稀氨水可减痛
4.下列实验操作中正确的是
A.除去苯中的苯酚:加适量溴水,过滤
B.实验室制取硝基苯:先加入浓硫酸,再加苯,最后滴入浓硝酸
C.检验卤代烃中的卤原子:加入NaOH溶液共热,再加AgNO3溶液,观察沉淀的颜色
D. 鉴别己烯和苯:向己烯和苯中分别滴入酸性KMnO4溶液,振荡,观察是否褪色
5.奥昔布宁具有解痉和抗胆碱作用,其结构简式如图所示。下列关于奥昔布宁的说法正确的是
A.分子中的含氧官能团为羟基和羧基
B.奥昔布宁能使溴的CCl4溶液褪色
C.分子中碳原子轨道杂化类型有2种
D.奥昔布宁不能发生消去反应
6.下列实验方案设计正确且能达到相应实验目的的是
A.用装置甲实验室制乙烯并检验产物
B.用装置乙实验室制溴苯并检验产物中的HBr
C.用装置丙蒸干溶液获得CuSO4·5H2O
D.用装置丁实验室制乙酸乙酯并收集
7.HOCH2CH=CHCH2OH 广泛用于生产工程塑料及纤维,下列有关说法正确的是
A.与乙酸乙酯互为同分异构体
B. 与乙酸互为同系物
C.所有原子均处于同一平面
D.可被酸性KMnO4 氧化为HOOCCH=CHCOOH
8.向盛有硫酸铜蓝色溶液的试管里加入氨水,首先形成难溶物,继续添加氨水,难溶物溶解得到深蓝色溶液,再加无水乙醇得到深蓝色晶体。下列说法正确的是
A.深蓝色溶液中含有的主要有色离子为
B.加乙醇的目的是降低生成的配合物的溶解度
C. NH3与Cu2+间的配位键比H2O与Cu2+间的配位键弱
D.1 mol 中含有键的数目为8 mol
9.水杨酸X与化合物Y在一定条件下可合成阿司匹林Z。下列说法正确的是
A.1 mol X中含有2 mol碳氧π键
B.1 mol X与足量的溴水反应,消耗3 mol Br2
C.1 mol Z在一定条件下反应消耗4 mol H2
D.1 mol X和1 mol Z分别与足量NaOH溶液反应,消耗NaOH的物质的量之比为2:3
10.双极膜电渗析法制备缩水甘油()的原理:将3-氯-1,2-丙二醇的水溶液通过膜M与双极膜之间的电渗析室,最终得到的缩水甘油纯度很高(几乎不含无机盐)。在直流电场的作用下,双极膜复合层间的H2O解离成OH-和H+并分别通过阴膜和阳膜。下列说法正确的是
A.装置工作时,3-氯-1,2-丙二醇被氧化
B.3-氯-1,2-丙二醇生成缩水甘油的过程
中均有极性键和非极性键的断裂和生成
C.装置工作时,阴极上发生的电极反应:
2H+ + 2 e-=H2↑
D.缩水甘油能在NaOH醇溶液加热条件下
发生消去反应
11.有机化合物M的合成路线如下图所示:
下列说法不正确的是
A.反应①还可能生成
B.Y的分子式为C6H10Br2
C.试剂1为NaOH溶液
D.X、Y、Z、M四种分子中均不含有手性碳原子
阅读下列资料,完成12~14题。
我国提出了2030年前碳达峰、2060年前碳中和的“双碳”目标。二氧化碳催化加氢合成CH3OH是一种实现“双碳”目标的有效方法,其主要反应的热化学方程式如下:
反应Ⅰ:CO2(g)+3H2(g) CH3OH(g)+H2O(g);ΔH=-49.0 kJ·mol-1
反应Ⅱ:CO2(g)+H2(g) CO(g)+H2O(g) ;ΔH=+41.0 kJ·mol-1
12. 下列说法正确的是
A.1个固态CO2晶胞(如右图)中含14个CO2分子
B.反应CO(g)+2H2(g) CH3OH(g);ΔH=+90.0 kJ·mol-1
C.CH3OH能与水互溶,主要原因是CH3OH与H2O分子间形成氢键
D.用E表示键能,反应Ⅰ的ΔH=3E(C—H)+E(C—O)+3E(O—H)
-2E(C===O)-3E(H—H)
13. 某课题组设计一种以A辅助固定CO2的方法,原理如图。下列说法不正确的是
A.总反应符合“绿色化学”理念,原子利用率100%。
B.化合物A为CH3OH
C.HOCH2CH2OH若用辅助固定,则产物可能为
D.反应②的类型为加成反应
14.在二氧化碳加氢制甲烷的反应体系中,主要发生反应的热化学方程式为
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
向恒压、密闭容器中通入1 mol CO2和4 mol H2,平衡时CH4、CO、CO2的物质的量随温度的变化如图所示.下列说法正确的是
A.反应Ⅰ的平衡常数可表示为
B.图中曲线C表示的物质的量随温度的变化
C.提高CO2转化为CH4的转化率,需要研发在高温区高效的催化剂
D.的
二、 非选择题:共4题,共58分。
15.(16分)已知元素X、Y均为短周期元素,X元素的一种核素常用于测文物的年代,Y元素原子半径是所有原子中最小的,元素X、Y可形成两种化合物M和N,已知M可以使酸性高锰酸钾溶液褪色,M分子中所含X元素的质量是Y元素质量的6倍,且M的相对分子质量为56。N是一种常用溶剂,分子式中两种元素原子个数比为1:1。回答下列问题:
(1) ①M的分子式为: ▲ 。
②写出一种含有顺反异构的M的结构简式 ▲ 。
(2)如图在烧瓶a中加入N与液溴的混合液,加入铁粉可以使其发生反应:
①写出a容器中N发生反应的化学方程式: ▲ 。
②仪器b的名称为 ▲ 。
(3)乙烯是重要有机化工原料。结合如图路线回答:
①该转化关系中反应D→CH3CHO的化学方程式为 ▲ 。
②G是一种油状、有香味的物质,有以下两种制法。
制法一:实验室用D和E在浓硫酸加热条件下反应制取G。反应⑥用18O同位素标记乙醇中的氧原子,写出其化学方程式 ▲ 。
制法二:工业上用CH2=CH2和E直接反应获得G。该反应类型是 ▲ 。
③F是一种有机高分子,用于制造保鲜膜、管材、注射成型制品、电线包裹层等,
其结构简式是 ▲ 。
16.(15分)有机物I是合成一种治疗胃肠疼痛的药物溴丙胺太林的中间体,其合成路线如下:
回答下列问题
(1)A的化学名称为 ▲ ,化合物I中含氧官能团的名称 ▲ 。
(2)B→C的反应类型 ▲ 。
(3)写出在一定温度、压强、催化剂的作用下化合物C和过量氢氧化钠溶液反应的化学方程式 ▲ 。
(4)符合下列条件的G的同分异构体的结构简式 ▲ 。
①分子中含有两个苯环结构,且苯环间以单键相连
②能发生银镜反应,能与FeCl3溶液发生显色反应。
③核磁共振氢谱为六组峰,峰面积之比为1∶2∶2∶2∶2∶1。
(5)结合上述流程相关信息,设计以二苯甲酮()和乙醇、乙酸为原料合成化合物的合理流程图(反应条件及无机物任选) ▲ 。
17.(12分)苯胺又名氨基苯是最重要的胺类物质之一,可作为炸药中的稳定剂、汽油中的防爆剂,也可作为医药磺胺药的原料等。苯胺为无色油状液体,有特殊气味,可用水蒸气蒸馏提纯。用纳米铁粉还原硝基苯制备苯胺的原理及装置图(略去夹持装置和加热装置)如下:
4+9Fe+4H2O4+3Fe3O4
已知部分有机物的一些数据如下表:
名称 相对分子质量 密度(g/mL) 熔点(℃) 沸点(℃) 溶解性
硝基苯 123 1.20 5.7 210.8 难溶于水,易溶于乙醇、乙醚
苯胺 93 1.02 -6.3 184.4 难溶于水,易溶于乙醇、乙醚
乙醚 74 0.71 -116.3 34.6 微溶于水,易溶于乙醇
I.合成:在装置1中的仪器X中,加入9g纳米铁粉、20mL水、1mL冰醋酸,加热至煮沸,煮沸后冷却至室温,再将8.0mL硝基苯逐滴加入(该反应强烈放热),搅拌、加热、回流半小时,至反应完全。
II.分离提纯:将装置1改为装置2进行水蒸气蒸馏,取装置2中的馏出物约5-6mL,转移至分液漏斗中,分离出有机层后,水层加入1.3gNaCl固体,用乙醚萃取3次(每次用7.0mL乙醚),合并有机层和乙醚萃取液,加入粒状NaOH干燥,过滤后转移至干燥的圆底烧瓶中,水浴蒸去乙醚,残留物再利用装置3蒸馏并收集温度T℃时的馏分。
请回答下列问题:
(1)加入硝基苯时,“逐滴加入”的目的是 ▲ 。
(2)分离提纯过程中加入NaCl固体的作用是 ▲ 。
(3)装置2中长导管B的作用是 ▲ 。
(4)“水蒸气蒸馏”结束后,应先打开止水夹T,再停止对“水蒸气发生装置”加热,目的是
▲ 。
(5)利用装置3蒸馏时,温度的范围为 ▲ ,实验结束得到产物6.5mL,则苯胺的产率为
▲ (保留三位有效数字)。
18.(15分)化合物F是合成某种祛痰止咳药的重要中间体,其合成路线如下:
(1)1 mol 有机物C中含键的数目为 ▲ 。
(2)D→E的过程中,涉及的反应类型有:加成反应、 ▲ 。
(3)若E中有D残留,则产物F中可能含有杂质C7H7NOBr2,其结构简式为 ▲ 。
(4)的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:
▲ 。
①分子中有一个含氮五元环;
②核磁共振氢谱显示分子中有5种不同化学环境的氢原子;
③红外光谱显示分子中无甲基。
(5)已知:,易被氧化(R为H或烃基)。
设计以和为原料制备 的合成路线 ▲ 。
(无机试剂和有机溶剂任用,合成路线示例见本题题干)。
宝应县2021-2022学年高二下学期期中检测化学参考答案
一、单项选择题:本题包括14小题,每小题3分,共计42分.
1. D 2. A 3. C 4.D 5. B 6. B 7. A 8. B 9. D 10. C 11. D 12. C 13.A 14.B
二、非选择题:共4题,共58分。
15. (每空2分,共16分)
(1)①C4H8 ②CH3CH=CHCH3
(2)① ②球形冷凝管(冷凝管)
(3)①2CH3CH2OH + O2 2CH3CHO + 2H2O
②CH3COOH + CH3CH218OH CH3CO18O CH2CH3+ H2O
加成反应 ③
16.(共15分)
(1) 甲苯(甲基苯) (2分) 羧基和醚键 (2分,各1分)
(2) 氧化反应 (2分)
(3) +3NaOH+NaCl+2H2O (2分)
(4) (-CHO与-OH可以互换) (2分)
(5) (5分)
17. (每空2分,共12分)
(1)控制反应速率,防止爆炸;提高硝基苯的转化率 (达到一点即给2分)
(2)减小苯胺在水中的溶解度,提高苯胺的产率
(3) 平衡装置内外气压,防止发生爆炸
(4)防止倒吸
(5)184.4-210.8℃ 91.3%
18.(共15分)
(1)18 mol(2分)
(2)消去反应(2分)
(3) (3分) (4) (3分)
(5) (5分)
同课章节目录
