1.2.2气体摩尔体积 课件(31张) 2022-2023 苏教版 高中化学 必修第一册(31张ppt)
文档属性
| 名称 | 1.2.2气体摩尔体积 课件(31张) 2022-2023 苏教版 高中化学 必修第一册(31张ppt) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-12 17:30:02 | ||
图片预览







文档简介
(共31张PPT)
第二单元 物质的化学计量
第2课时 气体摩尔体积
2022年北京冬奥会主场馆国家速滑馆“冰丝带”等冰上会场,采用二氧化碳制冰技术,不仅使场馆碳排放趋近于零,还可以将场地冰面温差控制在0.5摄氏度以内。
思考:标准状况下,1000L CO2的物质的量是多少呢?
1.了解气体摩尔体积、阿伏加德罗定律的含义。
2.掌握物质的量、气体摩尔体积、气体体积之间的计算。(重点)
1.能从宏观和微观的角度认识物质的多样性及其构成,了解物质的量、气体摩尔体积、阿伏加德罗常数的含义与应用。(宏观辨识与微观探析)
2.利用初中物理知识,联系物质的量的基本概念,建立研究物质的摩尔体积的基本模型,使学生了解科学的推理过程,理解微观粒子模型在化学研究中的重要作用。(科学探究与创新意识)
3.能基于物质的量认识物质组成及变化,建立运用气体摩尔体积、阿伏加德罗常数、摩尔质量之间计算的思维模型。(证据推理与模型认知)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
观看“电解水”的视频,思考与回答下面的问题。
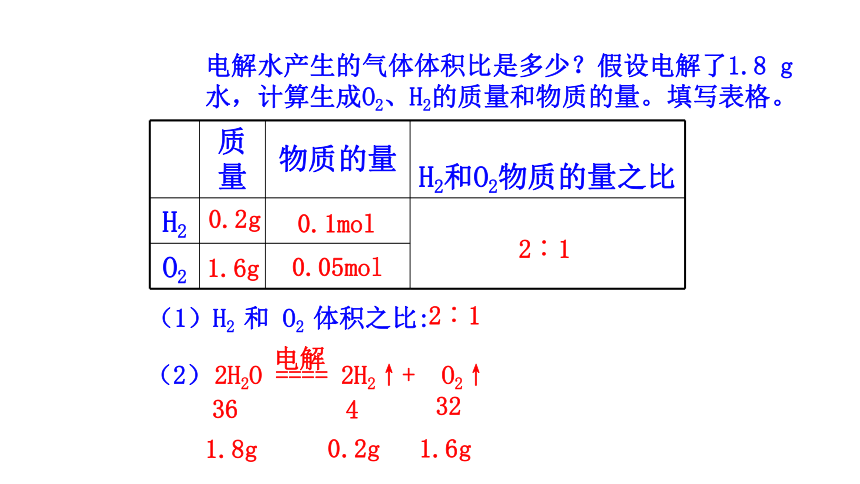
质量 物质的量 H2和O2物质的量之比
H2
O2
0.2g
1.6g
0.1mol
0.05mol
2︰1
36
1.8g
4
0.2g
32
1.6g
(1)H2 和 O2 体积之比:
2H2O ==== 2H2↑+ O2↑
电解
(2)
2︰1
电解水产生的气体体积比是多少?假设电解了1.8 g水,计算生成O2、H2的质量和物质的量。填写表格。
相同温度和压强下,1 mol H2和1mol O2的体积是
。
H2 和 O2物质的量之比:2︰1
H2 和 O2 体积之比:2︰1
n(O2)
n(H2)
=
V(H2)
V(O2)
=
2
1
相等的
由表格内容,你能否得出气体物质的量相等时体积也相等的结论?
【想一想】
计算出在标准状况时 1 mol H2 和 1mol O2 的体积(保留小数点后2位)。你能得出什么结论?
物质 1 mol 物质的质量(g) 密度 (g·L-1) 体积 (L)
H2 2.016g 0.0899
O2 32g 1.429
22.4
22.39
由计算得出的数据可知,它们的体积几乎相等哦!
【算一算】
物质 状态 1 mol 物质所含微粒数 1 mol 物质质量(g) 密度
(g·cm-3) 体积
(cm3)
Fe
Al
H2O
H2SO4
在相同的条件下 1 mol 固体或液体的体积是否也相等?
固体
固体
液体
液体
56
27
18
98
7.86
2.70
1.83
7.12
10.00
18.04
53.55
6.02×1023
0.998
下表是 1 mol 不同状态的物质在标准状况下的体积,分析这些数据,你能得到什么启示?
物质 状态 密度 体积
Fe 固体 7.86 g·cm-3 7.12cm3
Al 固体 2.70 g·cm-3 10.00cm3
H2O 液体 0.998 g·cm-3 18.04cm3
H2SO4 液体 1.83 g·cm-3 53.55cm3
H2 气体 0.0893 g·L-1 22.4L
O2 气体 1.429 g·L-1 22.39L
CO2 气体 1.965 g·L-1 22.39L
【思考交流】
由上表的体积数据结合物质状态,可以得出如下结
论:
1.在同温同压下,1 mol 固体和液体的体积各不相同。
2.在同温同压下,1 mol 任何气体的体积基本相同。
3.标准状况(0℃、1.01×105 Pa)下,1 mol 任何气体的体积约为 22.4 L。
物质的体积由哪些因素决定
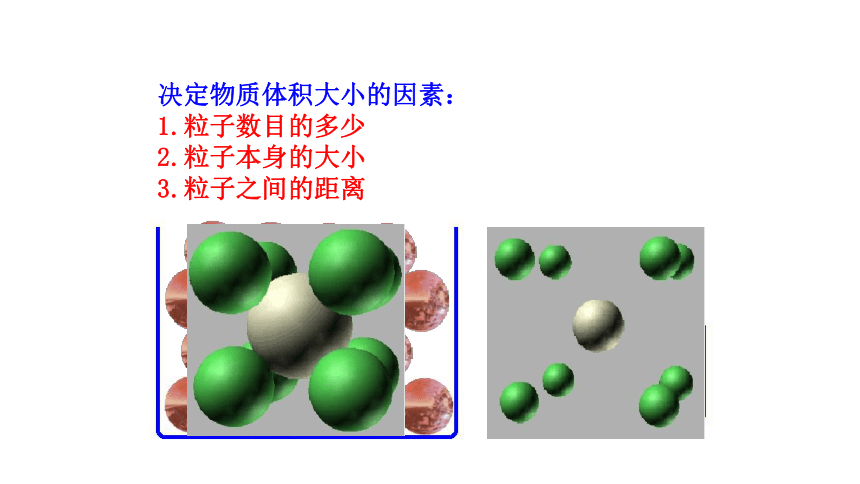
【想一想】
决定物质体积大小的因素:
1.粒子数目的多少
2.粒子本身的大小
3.粒子之间的距离
当粒子之间距离很小时,物质的体积主要取决于粒子的大小
当粒子间的距离比较大时,物质的体积主要取决于粒子间的距离
粒子大小
粒子间距
当物质的粒子数目均为1mol时,决定固、液、气态物质的体积大小的主要因素有哪些
【思考交流】
0℃ 1 mol H2O(18 mL)
100℃ 1 mol H2O (g) (3.06×104 mL)
(体积扩大1700倍)
压强不变
【想一想】
液态水变成水蒸气,体积增大的原因是什么?
因素
状态 粒子个数 粒子大小 粒子间距离
固体和 液体
气体
1 mol
主要因素
次要因素
1 mol
忽略
决定因素
决定具有相同数目粒子的物质体积大小的因素
【归纳总结】
下列有关气体体积的叙述中,正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.1 mol 水在液态和气态时体积相同
D.决定气体体积大小的主要因素是粒子数目和粒子的大小
【及时巩固】
B
气体分子间距离很大
分子间平均距离是分子直径的10倍
所以相同数目的气体分子所占体积主要受粒子间距影响,基本不受粒子大小影响;条件相同时,分子间平均距离几乎是相等的。
在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子,这就是阿伏加德罗定律。
阿伏加德罗定律
注意事项:
(1)一定要明确适用范围为气体。
(2)在定律中有四同:“同温”、“同压”、“同
体积”、“同分子数目”,“三同”定“一同”。
(3)在同温同压下,气体的体积之比与气体的分子
数(或物质的量)之比成正比。可表示为
【及时巩固】
同温同压下,向两个密闭容器中分别充满等质量的O2、O3气体,下列说法正确的是( )
A.两气体的物质的量之比为3∶2 B.两种容器的体积比为2∶3
C.两种气体的分子数目相等 D.两种气体的密度之比是3∶2
A
【提示】因O2和O3质量相等,故其物质的量与摩尔质量成反比,即48∶32=3∶2,A项正确;同温同压下,气体的体积之比等于其物质的量之比,即3∶2,B项错误;分子数目之比等于其物质的量之比,即3∶2,C项错误;同温同压下,气体的密度之比等于其摩尔质量之比,即32∶48=2∶3,D项错误。
气体分子距离相同
V相同(V=22.4 L)
T、p相同
在标准状况下1 mol 任何气体所占的体积都约为 22.4 L,为什么?
【想一想】
气体摩尔体积
1.概念:单位物质的量的气体所占的体积。
2.符号: Vm
标准状况下的气体摩尔体积约为22.4L·mol-1,这是特定条件下的气体摩尔体积。
4.单位:L·mol-1和m3·mol-1。
3.公式:
下列说法是否正确?为什么?
(1)标准状况下任何气体的体积都约是 22.4 L
(2)1 mol CO2占有的体积约为 22.4 L
(3)1 mol H2O在标准状况下的体积约为 22.4 L
【提示】错误。因未指明气体的物质的量。
【提示】错误。因未指明气体所处的状况。
【提示】错误。因水在标准状况下不是气体。
【思考交流】
条件:标准状况
对象:任何气体
物质的量:1mol
结论
体积约占22.4L
标准状况下的气体摩尔体积的要点:
1mol任何气体,可以是单一纯净的气体,也可以是混合气体,气体体积与分子种类无关。
特别提示
【归纳总结】
下列说法正确的是( )
A.气体摩尔体积就是22.4 L·mol-1
B.标准状况下,22.4 L的氦气含有2 mol氦原子
C.标准状况下,22.4 L任何气体都约含有6.02×1023
个原子
D.25℃、101kPa时,18g水的分子数约是6.02×1023
【及时巩固】
D
特例
取决于
体积
粒子大小
粒子数目
粒子距离
固体、液体体积
气体体积
气体摩尔体积
阿伏加德罗定律
单位物质的量的气体所占体积
22.4L·mol-1(标况)
三同定一同
物质的量
微粒数
NA
÷NA
M
÷M
质量
气体体积(标准状况)
Vm(22.4L·mol-1)
÷Vm
ρ
÷ρ
M 摩尔质量
NA 阿伏加德罗常数
Vm 气体摩尔体积
ρ 气体密度
1.下列有关气体体积的叙述,正确的是( )
A.气体的体积的大小由其分子的大小和分子的数量决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.不同的气体,若体积不同,则它们所含分子数也不同
D.气体摩尔体积指1 mol任何气体所占的体积约为22.4 L
B
2.(双选)下列说法正确的是( )
A.某气体的体积为22.4L,则该气体的物质的量约为1 mol
B.1 mol某气体体积为22.4 L,则该气体所处状态为标准状况
C.1 mol H2和O2的混合气体,在标准状况下体积约为22.4 L
D.固态CO2又叫干冰,含1 mol CO2的干冰在标准状况下体积必定小于22.4 L
C
3.m g氢气和n g氦气的下列说法中,正确的是( )
A.同温同压下,H2与He的体积比为m∶2n
B.同温同压下,若m=n,则H2与He的分子数之比为2∶1
C.同温同压下,同体积时,H2与He的质量比m/n>1
D.同温同压下,H2与He的密度比为2∶1
【提示】H2、He的摩尔质量分别为2 g·mol-1、4 g·mol-1。同温同压下,物质的量之比等于气体体积之比,V(H2)∶V(He)=m/2∶n/4=2m ∶n,A项错;分子数之比等于物质的量之比,B项正确;同温同压下,同体积时气体物质的量相等,则m/2=n/4,m/n=1/2,C项错;同温同压下,气体密度之比等于相对分子质量之比,ρ(H2)∶ρ(He)=2∶4=1∶2,D项错。
B
4.448 mL某气体在标准状况下的质量为1.28 g,则该气体的相对分子质量是_________。
【提示】解法一:0.448 L气体的物质的量:n=V/Vm=0.448 L/
22.4 L·mol-1=0.02 mol,气体的摩尔质量M=m/n=1.28 g/
0.02 mol=64 g·mol-1,即该气体的相对分子质量为64。
解法二:标准状况下该气体的密度ρ为1.28 g/0.448 L≈
2.86 g·L-1,根据M=Vmρ=2.86 g·L-1×22.4 L·mol-1≈
64 g·mol-1,即该气体的相对分子质量为64。
解法三:0.448 L气体质量为1.28 g,设标准状况下22.4 L气体(1 mol)的质量为x,根据n=V/Vm=m/M,0.448 L/22.4 L·mol-1=1.28 g/x,解得x=64 g·mol-1。即该气体的摩尔质量为64 g·mol-1,相对分子质量为64。
64
如果你对一个人说不出什么美好的话,那就什么也别说。
幸福的大秘诀是:与其让外界的事物适应自己,不如让自己去适应外界的事物。
第二单元 物质的化学计量
第2课时 气体摩尔体积
2022年北京冬奥会主场馆国家速滑馆“冰丝带”等冰上会场,采用二氧化碳制冰技术,不仅使场馆碳排放趋近于零,还可以将场地冰面温差控制在0.5摄氏度以内。
思考:标准状况下,1000L CO2的物质的量是多少呢?
1.了解气体摩尔体积、阿伏加德罗定律的含义。
2.掌握物质的量、气体摩尔体积、气体体积之间的计算。(重点)
1.能从宏观和微观的角度认识物质的多样性及其构成,了解物质的量、气体摩尔体积、阿伏加德罗常数的含义与应用。(宏观辨识与微观探析)
2.利用初中物理知识,联系物质的量的基本概念,建立研究物质的摩尔体积的基本模型,使学生了解科学的推理过程,理解微观粒子模型在化学研究中的重要作用。(科学探究与创新意识)
3.能基于物质的量认识物质组成及变化,建立运用气体摩尔体积、阿伏加德罗常数、摩尔质量之间计算的思维模型。(证据推理与模型认知)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
观看“电解水”的视频,思考与回答下面的问题。
质量 物质的量 H2和O2物质的量之比
H2
O2
0.2g
1.6g
0.1mol
0.05mol
2︰1
36
1.8g
4
0.2g
32
1.6g
(1)H2 和 O2 体积之比:
2H2O ==== 2H2↑+ O2↑
电解
(2)
2︰1
电解水产生的气体体积比是多少?假设电解了1.8 g水,计算生成O2、H2的质量和物质的量。填写表格。
相同温度和压强下,1 mol H2和1mol O2的体积是
。
H2 和 O2物质的量之比:2︰1
H2 和 O2 体积之比:2︰1
n(O2)
n(H2)
=
V(H2)
V(O2)
=
2
1
相等的
由表格内容,你能否得出气体物质的量相等时体积也相等的结论?
【想一想】
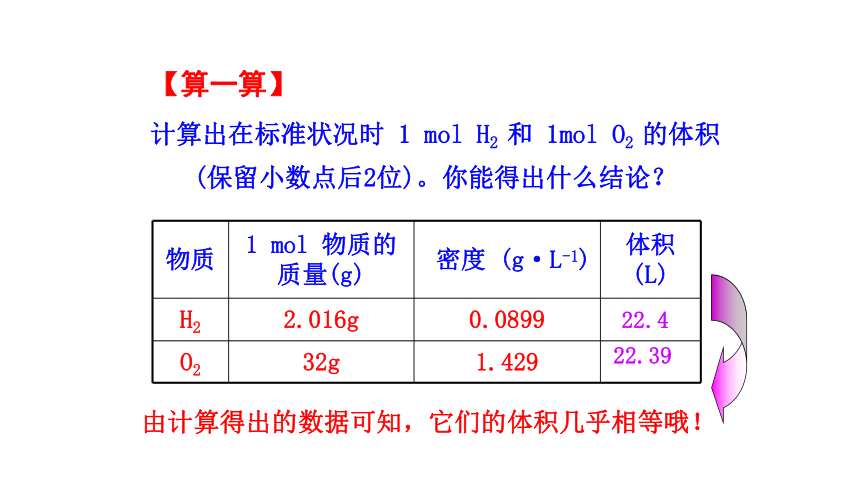
计算出在标准状况时 1 mol H2 和 1mol O2 的体积(保留小数点后2位)。你能得出什么结论?
物质 1 mol 物质的质量(g) 密度 (g·L-1) 体积 (L)
H2 2.016g 0.0899
O2 32g 1.429
22.4
22.39
由计算得出的数据可知,它们的体积几乎相等哦!
【算一算】
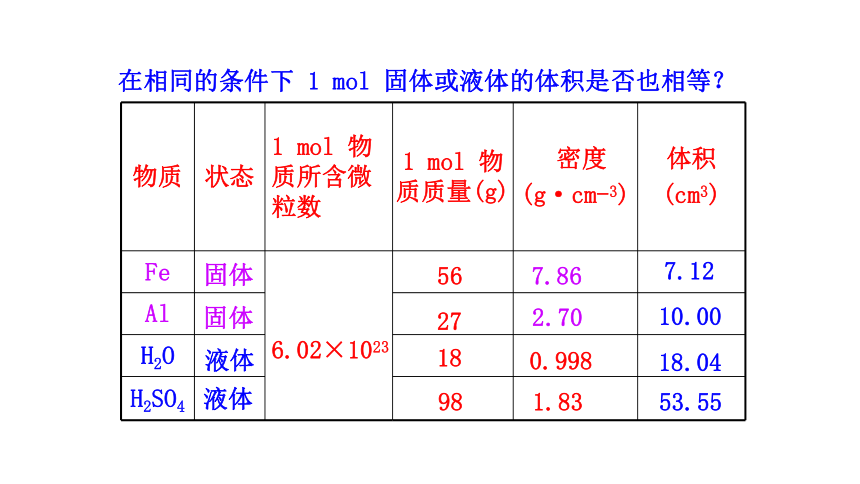
物质 状态 1 mol 物质所含微粒数 1 mol 物质质量(g) 密度
(g·cm-3) 体积
(cm3)
Fe
Al
H2O
H2SO4
在相同的条件下 1 mol 固体或液体的体积是否也相等?
固体
固体
液体
液体
56
27
18
98
7.86
2.70
1.83
7.12
10.00
18.04
53.55
6.02×1023
0.998
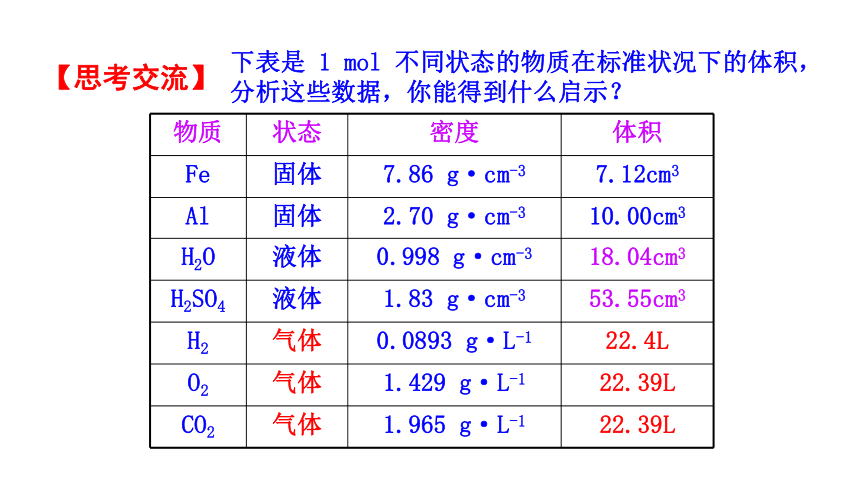
下表是 1 mol 不同状态的物质在标准状况下的体积,分析这些数据,你能得到什么启示?
物质 状态 密度 体积
Fe 固体 7.86 g·cm-3 7.12cm3
Al 固体 2.70 g·cm-3 10.00cm3
H2O 液体 0.998 g·cm-3 18.04cm3
H2SO4 液体 1.83 g·cm-3 53.55cm3
H2 气体 0.0893 g·L-1 22.4L
O2 气体 1.429 g·L-1 22.39L
CO2 气体 1.965 g·L-1 22.39L
【思考交流】
由上表的体积数据结合物质状态,可以得出如下结
论:
1.在同温同压下,1 mol 固体和液体的体积各不相同。
2.在同温同压下,1 mol 任何气体的体积基本相同。
3.标准状况(0℃、1.01×105 Pa)下,1 mol 任何气体的体积约为 22.4 L。
物质的体积由哪些因素决定
【想一想】
决定物质体积大小的因素:
1.粒子数目的多少
2.粒子本身的大小
3.粒子之间的距离
当粒子之间距离很小时,物质的体积主要取决于粒子的大小
当粒子间的距离比较大时,物质的体积主要取决于粒子间的距离
粒子大小
粒子间距
当物质的粒子数目均为1mol时,决定固、液、气态物质的体积大小的主要因素有哪些
【思考交流】
0℃ 1 mol H2O(18 mL)
100℃ 1 mol H2O (g) (3.06×104 mL)
(体积扩大1700倍)
压强不变
【想一想】
液态水变成水蒸气,体积增大的原因是什么?
因素
状态 粒子个数 粒子大小 粒子间距离
固体和 液体
气体
1 mol
主要因素
次要因素
1 mol
忽略
决定因素
决定具有相同数目粒子的物质体积大小的因素
【归纳总结】
下列有关气体体积的叙述中,正确的是( )
A.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子大小决定
B.一定温度和压强下,各种气态物质体积的大小,由构成气体的分子数决定
C.1 mol 水在液态和气态时体积相同
D.决定气体体积大小的主要因素是粒子数目和粒子的大小
【及时巩固】
B
气体分子间距离很大
分子间平均距离是分子直径的10倍
所以相同数目的气体分子所占体积主要受粒子间距影响,基本不受粒子大小影响;条件相同时,分子间平均距离几乎是相等的。
在相同的温度和压强下,相同体积的任何气体都含有相同数目的分子,这就是阿伏加德罗定律。
阿伏加德罗定律
注意事项:
(1)一定要明确适用范围为气体。
(2)在定律中有四同:“同温”、“同压”、“同
体积”、“同分子数目”,“三同”定“一同”。
(3)在同温同压下,气体的体积之比与气体的分子
数(或物质的量)之比成正比。可表示为
【及时巩固】
同温同压下,向两个密闭容器中分别充满等质量的O2、O3气体,下列说法正确的是( )
A.两气体的物质的量之比为3∶2 B.两种容器的体积比为2∶3
C.两种气体的分子数目相等 D.两种气体的密度之比是3∶2
A
【提示】因O2和O3质量相等,故其物质的量与摩尔质量成反比,即48∶32=3∶2,A项正确;同温同压下,气体的体积之比等于其物质的量之比,即3∶2,B项错误;分子数目之比等于其物质的量之比,即3∶2,C项错误;同温同压下,气体的密度之比等于其摩尔质量之比,即32∶48=2∶3,D项错误。
气体分子距离相同
V相同(V=22.4 L)
T、p相同
在标准状况下1 mol 任何气体所占的体积都约为 22.4 L,为什么?
【想一想】
气体摩尔体积
1.概念:单位物质的量的气体所占的体积。
2.符号: Vm
标准状况下的气体摩尔体积约为22.4L·mol-1,这是特定条件下的气体摩尔体积。
4.单位:L·mol-1和m3·mol-1。
3.公式:
下列说法是否正确?为什么?
(1)标准状况下任何气体的体积都约是 22.4 L
(2)1 mol CO2占有的体积约为 22.4 L
(3)1 mol H2O在标准状况下的体积约为 22.4 L
【提示】错误。因未指明气体的物质的量。
【提示】错误。因未指明气体所处的状况。
【提示】错误。因水在标准状况下不是气体。
【思考交流】
条件:标准状况
对象:任何气体
物质的量:1mol
结论
体积约占22.4L
标准状况下的气体摩尔体积的要点:
1mol任何气体,可以是单一纯净的气体,也可以是混合气体,气体体积与分子种类无关。
特别提示
【归纳总结】
下列说法正确的是( )
A.气体摩尔体积就是22.4 L·mol-1
B.标准状况下,22.4 L的氦气含有2 mol氦原子
C.标准状况下,22.4 L任何气体都约含有6.02×1023
个原子
D.25℃、101kPa时,18g水的分子数约是6.02×1023
【及时巩固】
D
特例
取决于
体积
粒子大小
粒子数目
粒子距离
固体、液体体积
气体体积
气体摩尔体积
阿伏加德罗定律
单位物质的量的气体所占体积
22.4L·mol-1(标况)
三同定一同
物质的量
微粒数
NA
÷NA
M
÷M
质量
气体体积(标准状况)
Vm(22.4L·mol-1)
÷Vm
ρ
÷ρ
M 摩尔质量
NA 阿伏加德罗常数
Vm 气体摩尔体积
ρ 气体密度
1.下列有关气体体积的叙述,正确的是( )
A.气体的体积的大小由其分子的大小和分子的数量决定
B.一定温度、压强下,气体体积由其物质的量的多少决定
C.不同的气体,若体积不同,则它们所含分子数也不同
D.气体摩尔体积指1 mol任何气体所占的体积约为22.4 L
B
2.(双选)下列说法正确的是( )
A.某气体的体积为22.4L,则该气体的物质的量约为1 mol
B.1 mol某气体体积为22.4 L,则该气体所处状态为标准状况
C.1 mol H2和O2的混合气体,在标准状况下体积约为22.4 L
D.固态CO2又叫干冰,含1 mol CO2的干冰在标准状况下体积必定小于22.4 L
C
3.m g氢气和n g氦气的下列说法中,正确的是( )
A.同温同压下,H2与He的体积比为m∶2n
B.同温同压下,若m=n,则H2与He的分子数之比为2∶1
C.同温同压下,同体积时,H2与He的质量比m/n>1
D.同温同压下,H2与He的密度比为2∶1
【提示】H2、He的摩尔质量分别为2 g·mol-1、4 g·mol-1。同温同压下,物质的量之比等于气体体积之比,V(H2)∶V(He)=m/2∶n/4=2m ∶n,A项错;分子数之比等于物质的量之比,B项正确;同温同压下,同体积时气体物质的量相等,则m/2=n/4,m/n=1/2,C项错;同温同压下,气体密度之比等于相对分子质量之比,ρ(H2)∶ρ(He)=2∶4=1∶2,D项错。
B
4.448 mL某气体在标准状况下的质量为1.28 g,则该气体的相对分子质量是_________。
【提示】解法一:0.448 L气体的物质的量:n=V/Vm=0.448 L/
22.4 L·mol-1=0.02 mol,气体的摩尔质量M=m/n=1.28 g/
0.02 mol=64 g·mol-1,即该气体的相对分子质量为64。
解法二:标准状况下该气体的密度ρ为1.28 g/0.448 L≈
2.86 g·L-1,根据M=Vmρ=2.86 g·L-1×22.4 L·mol-1≈
64 g·mol-1,即该气体的相对分子质量为64。
解法三:0.448 L气体质量为1.28 g,设标准状况下22.4 L气体(1 mol)的质量为x,根据n=V/Vm=m/M,0.448 L/22.4 L·mol-1=1.28 g/x,解得x=64 g·mol-1。即该气体的摩尔质量为64 g·mol-1,相对分子质量为64。
64
如果你对一个人说不出什么美好的话,那就什么也别说。
幸福的大秘诀是:与其让外界的事物适应自己,不如让自己去适应外界的事物。
