2.3.1 人类对原子的认识 课件(37张) 2022-2023 苏教版 高中化学 必修第一册
文档属性
| 名称 | 2.3.1 人类对原子的认识 课件(37张) 2022-2023 苏教版 高中化学 必修第一册 |  | |
| 格式 | ppt | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-12 17:51:42 | ||
图片预览








文档简介
(共37张PPT)
第三单元 人类对原子结构的认识
第1课时 人类认识原子结构的历程
原子核的构成
两千多万种化学物质大多数由原子构成,而人类对原子的认识和探索已经历了2500多年。直到20世纪80年代,科学家才用扫描隧道显微镜观察到物体表面的原子。可你有没有思考过下列问题?
⑴原子到底是什么“东西”?
⑵科学家眼里的原子是怎样的?
⑶科学家是怎样探索原子结构的?有哪些科学家为探索原子结构作出了重大的贡献?
1.了解原子结构模型演变的历史。
2.能用原子结构示意图来表示典型元素原子的核外电子排布。
3.了解活泼金属和非金属原子在化学反应过程中通过电子得失使最外层达到稳定结构的事实。
4.举例说明原子核的组成,知道核素和同位素。
1.通过了解原子结构模型演变的历史,体验科学家探索原子结构的艰难过程,认识实验、假说、模型等科学方法对化学研究的作用。(科学态度与社会责任)
2.以原子结构模型为例,能从宏观和微观结合的视角理解原子结构模型提出的证据,初步形成模型建构的认知方式。(证据推理与模型认识)
3.能基于原子结构特点,预测元素性质,形成结构决定性质的学科观念。(变化观念与平衡思想)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
1803年,英国科学家道尔顿提出近代原子学说,
他认为原子是化学变化中不可再分的实心球体。
原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子
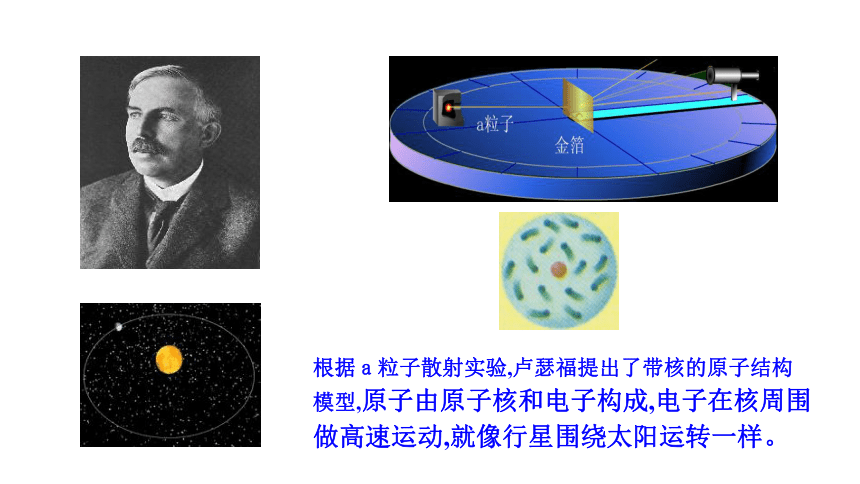
根据a粒子散射实验,卢瑟福提出了带核的原子结构模型,原子由原子核和电子构成,电子在核周围做高速运动,就像行星围绕太阳运转一样。
1913年,丹麦物理学家玻尔提出的原子结构模型,他认为核外电子是分层排布的。
丹麦物理学家玻尔
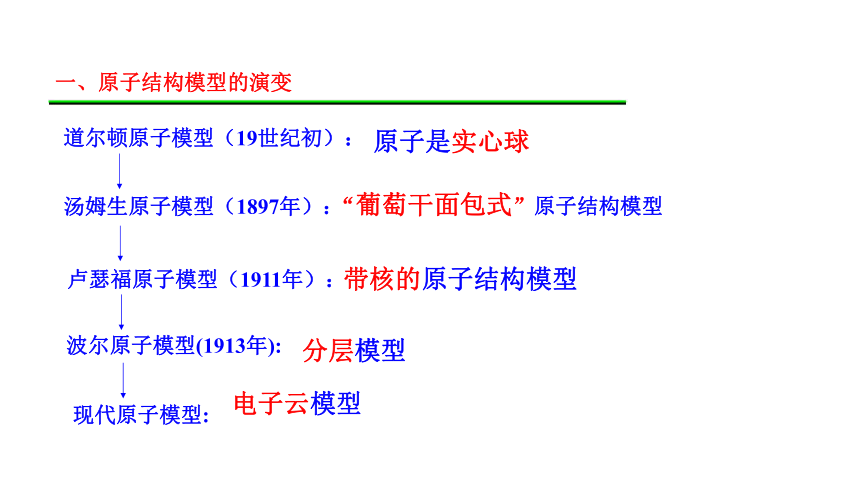
一、原子结构模型的演变
汤姆生原子模型(1897年):
卢瑟福原子模型(1911年):
波尔原子模型(1913年):
现代原子模型:
道尔顿原子模型(19世纪初):
原子是实心球
“葡萄干面包式”原子结构模型
带核的原子结构模型
分层模型
电子云模型
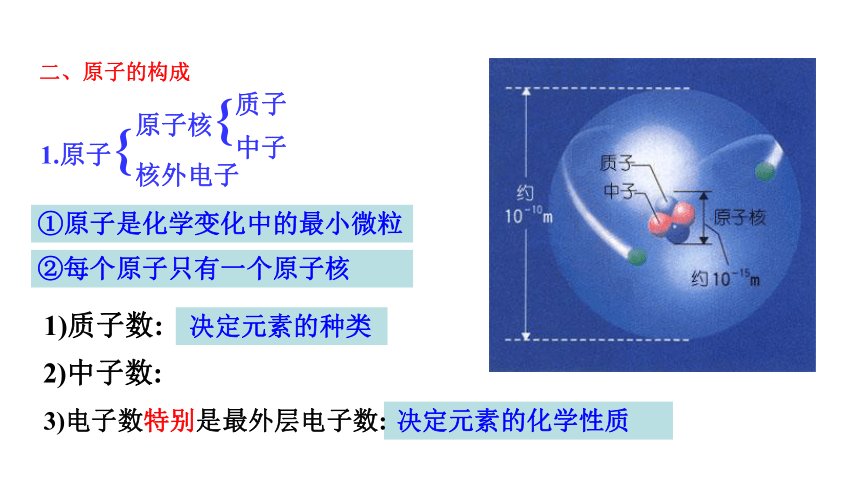
1.原子
原子核
核外电子
质子
{
{
二、原子的构成
决定元素的种类
1)质子数:
2)中子数:
决定元素的化学性质
3)电子数特别是最外层电子数:
①原子是化学变化中的最小微粒
②每个原子只有一个原子核
中子
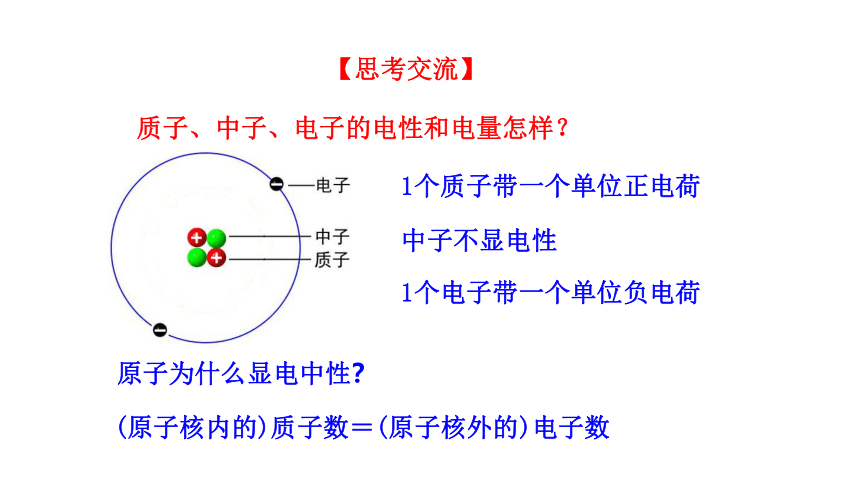
1个质子带一个单位正电荷
1个电子带一个单位负电荷
中子不显电性
原子为什么显电中性?
(原子核内的)质子数=(原子核外的)电子数
质子、中子、电子的电性和电量怎样?
【思考交流】
1)电性关系式:
质子数=电子数
2.构成原子的微粒之间的数量关系
核电荷数=
元素的原子序数=
比较Al、Al3+的质子数和电子数:
微粒符号 质子数 电子数
Al
Al3+
13
13
13
10
原子核半径小于原子半径的万分之一,体积占原子体积的几千万亿分之一。(如同大型体育场与蚂蚁)
视野拓展:
——了解原子核的大小
构成原子
的微粒 电子 原子核
质子 中子
电性和电量 1个电子带一个单位负电荷 1个质子带一个单位正电荷 中子不显
电性
质量/kg 9.109×10—31 1.673×10—27 1.675×10—27
相对质量
1.007≈1
1.008≈1
原子的质量主要集中在原子核上
小结:
1/1836
0.00054
已知一个质子的实际质量为1.673×10—27 kg,一个中子的实际质量为1.675×10—27 kg,一个电子的实际质量为9.109×10—31 kg,一个12C原子的实际质量的1/12为1.661×10—27 kg,求质子、中子、电子的相对质量。
原子 质子数(Z) 中子数(N) 质子数+中子数 相对原子质量
F 10 18.998
Na 12 22.990
Al 14 26.982
【学以致用】
9
11
19
23
13
27
如果忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,我们称之为质量数( A )
≈
≈
≈
原子的相对原子质量
m(原子)
m(C-12)
12
1
=
m(质子)+ m(中子)+ m(电子)
m(C-12)
12
1
=
≈
m(质子)+ m(中子)
m(C-12)
12
1
=
Z·m(一个质子)+ N·m(一个中子)
12
1
m(C-12)
≈
Z+N
=A
质量关系式:
2.构成原子的微粒之间的数量关系
质量数(A)=质子数(Z)+中子数(N)
≈原子的相对原子质量
+10
Ne原子的核外电子分层排布示意图
原子核
核电荷数
该电子层上的电子
电子层
三、原子的表示
+2
+10
Ne
+18
Ar
+1
H
+8
O
+12
Mg
几种原子的核外电子分层排布示意图
He
10
第1层
第2层
原子核
原子核带正电
核电荷数
2
8
电子离核越远,能量也就越高
1.原子结构示意图
+
为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
Ca
K
核电荷数为1~20的元素原子核外电子层排布
2.原子符号:
X
A
Z
——元素符号
碳-12
12C
12C
6
或
(6个质子6个中子的碳原子)
碳-13
13C
13C
6
或
(6个质子7个中子的碳原子)
碳-14
14C
14C
6
或
(6个质子8个中子的碳原子)
如:
X
a、b、c、d、e各代表什么?
a——代表质量数;
b——代表核电荷数(质子数)
c——代表离子所带的电荷数
d——代表化合价
e——代表原子个数
b
a
c+
-
-
±d
e
【思考交流】
阳离子:质子数=电子数+电荷数
阴离子:质子数=电子数-电荷数
如:Mg2+ 的质子数 电子数
如:F-的质子数 电子数
1)电性关系式:
12
10
9
10
质量数(A)=质子数(Z)+中子数(N)
2)质量关系式:
四、构成离子的微粒之间的数量关系
1、ARn+离子核内有x个中子,则Rn+离子核外的电子数为__________
2、ARn+离子核内有x个中子,则m g Rn+离子核外的电子数为_______
A-x-n
② 决定元素种类的因素:核电荷数(质子数)
① 同类包括质子数相同的各种不同原子、以及各种状况下的原子或者离子(包括游离态和化合态)
如 H H+ H- 都表示氢元素
五、元素、核素与同位素
具有相同核电荷数(质子数)的同类原子的总称
② 决定因素:质子数和中子数
① 不同的核素可能质子数相同、或中子数相同、或质量数相同,或者三者都不同
具有一定质子数和一定中子数的一种原子称为一种核素
氕 氢 (H) 中子数为 0
氘 重氢(D) 中子数为 1
氚 超重氢(T) 中子数为 2
如质子数相同,质量数不同(中子数不同)的核素,则互为同位素。
C
6
14
C
6
12
元素:具有相同质子数的一类原子的总称。
核素:具有一定质子数和一定中子数的一种原子。
同位素:同种元素的不同种核素间的互称。
1、元素、核素和同位素的关系
1、质子数相同 核外电子数相同
化学性质几乎完全相同
2、中子数不同 物理性质不同 用途不同
特点
互为同位素
核素1
核素2
某种元素
……
在天然元素中,多数元素含有多种核素,少数元素只含有一种核素(例如Na、K等)。某种元素跟核素和同位素的关系:
一、原子结构模型的演变
道尔顿→汤姆生→卢瑟福 →玻尔→量子力学
二、原子核外电子的分层排布
1.原子结构示意图
2.原子核外电子排布一般规律
3.原子结构与元素性质的关系(结构决定性质)
4.原子核外电子数与元素化合价的关系
2.在离子RO3n-中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数为( )
某阴离子Rn-核外共有x个电子, 其质量数为A,该元素的原子核内中子数为( )
A. A-x-n B. A+x+n
C. A+x-n D. A-x+n
D
A.A-x+n+48 B.A-x+n+24
C.A-x+n-24 D.A+x-n-24
B
3.据报道,上海某医院正在研究用放射性的一种碘 治疗肿瘤。该碘原子的核内的中子数与核外电子数之差是( )
I
125
53
A、72 B、19 C、53 D、125
B
4.某二价阴离子,核外有18个电子,质量数为32,则其中子数为( )
A、12 B、14 C、16 D、18
C
5.原子、元素、核素、同位素等都属于重要的化学基本概念,原子的构成属于重要的化学基本理论,下列八种化学符号:
(1)涉及到的核素共有( )种
(2)互为同位素的是( )和( )
(3)质量数相等,但不能互称为同位素的是( )和( )
(4)中子数相等,但质子数不相等的是( )和( )
8
认真可以把事情做对,而用心却可以做到完美。
第三单元 人类对原子结构的认识
第1课时 人类认识原子结构的历程
原子核的构成
两千多万种化学物质大多数由原子构成,而人类对原子的认识和探索已经历了2500多年。直到20世纪80年代,科学家才用扫描隧道显微镜观察到物体表面的原子。可你有没有思考过下列问题?
⑴原子到底是什么“东西”?
⑵科学家眼里的原子是怎样的?
⑶科学家是怎样探索原子结构的?有哪些科学家为探索原子结构作出了重大的贡献?
1.了解原子结构模型演变的历史。
2.能用原子结构示意图来表示典型元素原子的核外电子排布。
3.了解活泼金属和非金属原子在化学反应过程中通过电子得失使最外层达到稳定结构的事实。
4.举例说明原子核的组成,知道核素和同位素。
1.通过了解原子结构模型演变的历史,体验科学家探索原子结构的艰难过程,认识实验、假说、模型等科学方法对化学研究的作用。(科学态度与社会责任)
2.以原子结构模型为例,能从宏观和微观结合的视角理解原子结构模型提出的证据,初步形成模型建构的认知方式。(证据推理与模型认识)
3.能基于原子结构特点,预测元素性质,形成结构决定性质的学科观念。(变化观念与平衡思想)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
1803年,英国科学家道尔顿提出近代原子学说,
他认为原子是化学变化中不可再分的实心球体。
原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子
根据a粒子散射实验,卢瑟福提出了带核的原子结构模型,原子由原子核和电子构成,电子在核周围做高速运动,就像行星围绕太阳运转一样。
1913年,丹麦物理学家玻尔提出的原子结构模型,他认为核外电子是分层排布的。
丹麦物理学家玻尔
一、原子结构模型的演变
汤姆生原子模型(1897年):
卢瑟福原子模型(1911年):
波尔原子模型(1913年):
现代原子模型:
道尔顿原子模型(19世纪初):
原子是实心球
“葡萄干面包式”原子结构模型
带核的原子结构模型
分层模型
电子云模型
1.原子
原子核
核外电子
质子
{
{
二、原子的构成
决定元素的种类
1)质子数:
2)中子数:
决定元素的化学性质
3)电子数特别是最外层电子数:
①原子是化学变化中的最小微粒
②每个原子只有一个原子核
中子
1个质子带一个单位正电荷
1个电子带一个单位负电荷
中子不显电性
原子为什么显电中性?
(原子核内的)质子数=(原子核外的)电子数
质子、中子、电子的电性和电量怎样?
【思考交流】
1)电性关系式:
质子数=电子数
2.构成原子的微粒之间的数量关系
核电荷数=
元素的原子序数=
比较Al、Al3+的质子数和电子数:
微粒符号 质子数 电子数
Al
Al3+
13
13
13
10
原子核半径小于原子半径的万分之一,体积占原子体积的几千万亿分之一。(如同大型体育场与蚂蚁)
视野拓展:
——了解原子核的大小
构成原子
的微粒 电子 原子核
质子 中子
电性和电量 1个电子带一个单位负电荷 1个质子带一个单位正电荷 中子不显
电性
质量/kg 9.109×10—31 1.673×10—27 1.675×10—27
相对质量
1.007≈1
1.008≈1
原子的质量主要集中在原子核上
小结:
1/1836
0.00054
已知一个质子的实际质量为1.673×10—27 kg,一个中子的实际质量为1.675×10—27 kg,一个电子的实际质量为9.109×10—31 kg,一个12C原子的实际质量的1/12为1.661×10—27 kg,求质子、中子、电子的相对质量。
原子 质子数(Z) 中子数(N) 质子数+中子数 相对原子质量
F 10 18.998
Na 12 22.990
Al 14 26.982
【学以致用】
9
11
19
23
13
27
如果忽略电子的质量,将原子核内所有的质子和中子的相对质量取近似整数值加起来,所得的数值,我们称之为质量数( A )
≈
≈
≈
原子的相对原子质量
m(原子)
m(C-12)
12
1
=
m(质子)+ m(中子)+ m(电子)
m(C-12)
12
1
=
≈
m(质子)+ m(中子)
m(C-12)
12
1
=
Z·m(一个质子)+ N·m(一个中子)
12
1
m(C-12)
≈
Z+N
=A
质量关系式:
2.构成原子的微粒之间的数量关系
质量数(A)=质子数(Z)+中子数(N)
≈原子的相对原子质量
+10
Ne原子的核外电子分层排布示意图
原子核
核电荷数
该电子层上的电子
电子层
三、原子的表示
+2
+10
Ne
+18
Ar
+1
H
+8
O
+12
Mg
几种原子的核外电子分层排布示意图
He
10
第1层
第2层
原子核
原子核带正电
核电荷数
2
8
电子离核越远,能量也就越高
1.原子结构示意图
+
为了形象地表示原子的结构,人们就创造了“原子结构示意图”这种特殊的图形。
Ca
K
核电荷数为1~20的元素原子核外电子层排布
2.原子符号:
X
A
Z
——元素符号
碳-12
12C
12C
6
或
(6个质子6个中子的碳原子)
碳-13
13C
13C
6
或
(6个质子7个中子的碳原子)
碳-14
14C
14C
6
或
(6个质子8个中子的碳原子)
如:
X
a、b、c、d、e各代表什么?
a——代表质量数;
b——代表核电荷数(质子数)
c——代表离子所带的电荷数
d——代表化合价
e——代表原子个数
b
a
c+
-
-
±d
e
【思考交流】
阳离子:质子数=电子数+电荷数
阴离子:质子数=电子数-电荷数
如:Mg2+ 的质子数 电子数
如:F-的质子数 电子数
1)电性关系式:
12
10
9
10
质量数(A)=质子数(Z)+中子数(N)
2)质量关系式:
四、构成离子的微粒之间的数量关系
1、ARn+离子核内有x个中子,则Rn+离子核外的电子数为__________
2、ARn+离子核内有x个中子,则m g Rn+离子核外的电子数为_______
A-x-n
② 决定元素种类的因素:核电荷数(质子数)
① 同类包括质子数相同的各种不同原子、以及各种状况下的原子或者离子(包括游离态和化合态)
如 H H+ H- 都表示氢元素
五、元素、核素与同位素
具有相同核电荷数(质子数)的同类原子的总称
② 决定因素:质子数和中子数
① 不同的核素可能质子数相同、或中子数相同、或质量数相同,或者三者都不同
具有一定质子数和一定中子数的一种原子称为一种核素
氕 氢 (H) 中子数为 0
氘 重氢(D) 中子数为 1
氚 超重氢(T) 中子数为 2
如质子数相同,质量数不同(中子数不同)的核素,则互为同位素。
C
6
14
C
6
12
元素:具有相同质子数的一类原子的总称。
核素:具有一定质子数和一定中子数的一种原子。
同位素:同种元素的不同种核素间的互称。
1、元素、核素和同位素的关系
1、质子数相同 核外电子数相同
化学性质几乎完全相同
2、中子数不同 物理性质不同 用途不同
特点
互为同位素
核素1
核素2
某种元素
……
在天然元素中,多数元素含有多种核素,少数元素只含有一种核素(例如Na、K等)。某种元素跟核素和同位素的关系:
一、原子结构模型的演变
道尔顿→汤姆生→卢瑟福 →玻尔→量子力学
二、原子核外电子的分层排布
1.原子结构示意图
2.原子核外电子排布一般规律
3.原子结构与元素性质的关系(结构决定性质)
4.原子核外电子数与元素化合价的关系
2.在离子RO3n-中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数为( )
某阴离子Rn-核外共有x个电子, 其质量数为A,该元素的原子核内中子数为( )
A. A-x-n B. A+x+n
C. A+x-n D. A-x+n
D
A.A-x+n+48 B.A-x+n+24
C.A-x+n-24 D.A+x-n-24
B
3.据报道,上海某医院正在研究用放射性的一种碘 治疗肿瘤。该碘原子的核内的中子数与核外电子数之差是( )
I
125
53
A、72 B、19 C、53 D、125
B
4.某二价阴离子,核外有18个电子,质量数为32,则其中子数为( )
A、12 B、14 C、16 D、18
C
5.原子、元素、核素、同位素等都属于重要的化学基本概念,原子的构成属于重要的化学基本理论,下列八种化学符号:
(1)涉及到的核素共有( )种
(2)互为同位素的是( )和( )
(3)质量数相等,但不能互称为同位素的是( )和( )
(4)中子数相等,但质子数不相等的是( )和( )
8
认真可以把事情做对,而用心却可以做到完美。
