3.1.2氧化还原反应 课件(25张) 2022-2023 苏教版 高中化学 必修第一册
文档属性
| 名称 | 3.1.2氧化还原反应 课件(25张) 2022-2023 苏教版 高中化学 必修第一册 |  | |
| 格式 | ppt | ||
| 文件大小 | 1.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-12 20:53:50 | ||
图片预览






文档简介
(共25张PPT)
第一单元 氯气及氯的化合物
第2课时 氧化还原反应
2022年2月4日,举世瞩目的北京冬奥会在国家体育场“鸟巢”盛大开幕,氢气在开幕式作为燃料点燃了冬奥赛场主火炬,实现奥林匹克精神与绿色、环保进一步结合。氢气点燃发生反应:2H2+O2====2H2O。该反应中氢元素和氧元素的化合价分别是怎样变化的呢?
点燃
1.以常见氧化还原反应为例,建立概念,并能从物质角度(得氧失氧)、元素角度(化合价变化)、微粒角度(电子得失)认识氧化还原反应的特征和本质,体会认识发展的规律。(变化观念与平衡思想)
1.知道氧化还原反应、氧化反应和还原反应的概念。
2.能根据反应中的元素化合价是否升降来判断氧化还原反应和非氧化还原反应。
3.能用电子转移的观点判断、分析氧化还原反应,并能举例说明化学反应中元素化合价升降与电子转移的关系。
2.通过元素化合价变化的分析,判断氧化还原反应,辨识与四大基本反应类型的关系,建立分析氧化还原反应的思维模型。(证据推理与模型认知)
3.感受氧化还原反应在生产、生活中的应用,认识化学在社会发展和科技进步中的作用。(科学态度与社会责任)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
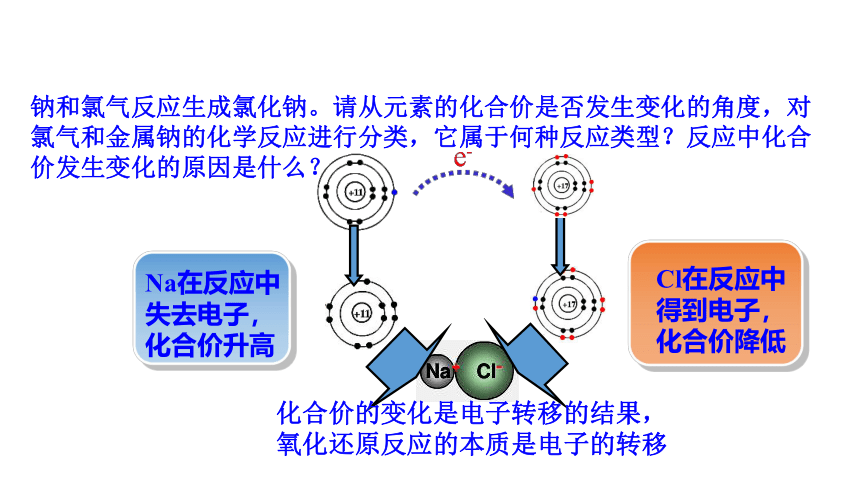
钠和氯气反应生成氯化钠。请从元素的化合价是否发生变化的角度,对氯气和金属钠的化学反应进行分类,它属于何种反应类型?反应中化合价发生变化的原因是什么?
Cl在反应中得到电子,化合价降低
Na在反应中失去电子,化合价升高
化合价的变化是电子转移的结果,
氧化还原反应的本质是电子的转移
一、氧化还原反应的概念
1、定义:有电子转移的反应即氧化还原反应
没有电子转移的反应即非氧化还原反应
2、特点:元素化合价发生升降变化
3、实质:电子转移
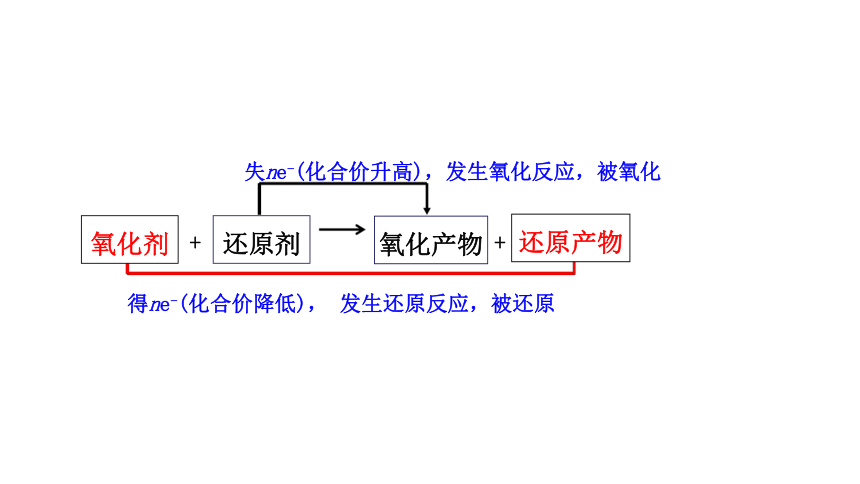
4、氧化剂:得到电子的物质。
化合价降低,被还原,得到还原产物。
还原剂:失去电子的物质。
化合价升高,被氧化,得到氧化产物。
得ne-(化合价降低), 发生还原反应,被还原
失ne-(化合价升高),发生氧化反应,被氧化
氧化剂
还原剂
还原产物
氧化产物
+
+
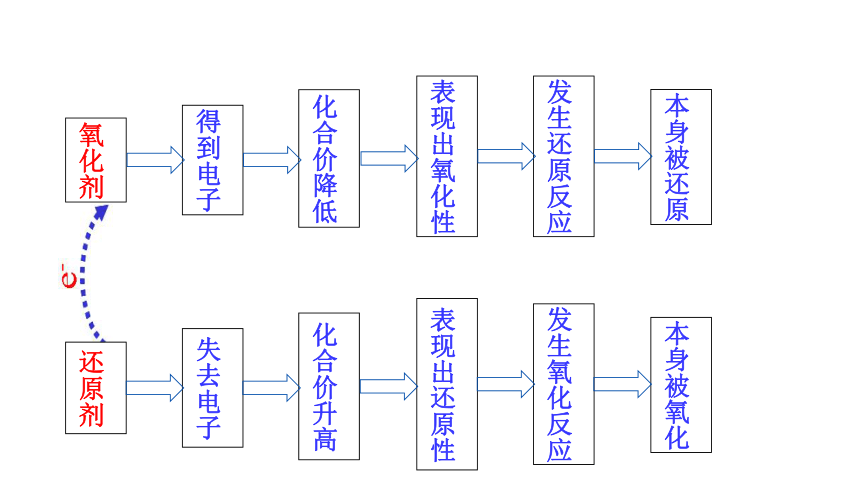
还原剂
失去电子
化合价升高
表现出还原性
发生氧化反应
本身被氧化
氧化剂
得到电子
化合价降低
表现出氧化性
发生还原反应
本身被还原
1.下列反应属于氧化还原反应的是( )
A.CuO+2HCl====CuCl2 +H2O
B.CaCO3+2HCl====2NaCl+CO2↑+H2O
C.2KMnO4====K2MnO4+MnO2+O2 ↑
D.Ca(OH)2+CO2====CaCO3↓ + H2O
C
2(双选)下列叙述正确的是( )
A、在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、凡是有元素化合价升降的化学反应都是氧化还原反应
C、在氧化还原反应中一定所有的元素化合价都发生变化
D、氧化还原反应的本质是电子的转移(得失或偏移)
B D
课堂练习
△
思考:钠原子与氯原子之间发生了电子转移,导致钠元素与氯元素的化合价发生了改变。那么怎样表示该化学反应中电子转移情况呢?
1、双线桥法:表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
二、氧化还原反应中电子转移的表示方法
2Na+Cl2 == 2NaCl
失去2×e-,被氧化,作还原剂
得到2×e-,被还原,作氧化剂
(1)标价态:正确标出反应前后各元素的化合价,明确变价元素的化合价升降关系。
(2)双箭头:一条线始于被还原的物质中的降价元素,止于还原产物中的相应元素;一条线始于被氧化的物质中的升价元素,终止于氧化产物中的相应元素。
(3)注得失:标出“失去”或“得到”电子的总数。
1、箭头、箭尾必须对应化合价变化的同种元素的原子;
2、必须注明“得到”或“失去”;
3、被还原的物质和被氧化的物质得、失电子数守恒。
书写步骤:
注意事项:
高锰酸钾与浓盐酸在一定条件下可以反应生成氯气。2KMnO4+16HCl(浓)==2KC1+2MnCl2+5Cl2↑+8H2O 该反应是氧化还原反应吗?如果是,指出反应中化合价发生变化的元素,分析电子转移的方向和数目,并指出氧化剂和还原剂。如果不是,请给出理由。
【学以致用】
△
2、单线桥法:表示反应过程中不同元素原子间的电子转移情况。
2Na + Cl2 == 2NaCl
2e-
还原剂
氧化剂
既是氧化产物,又是还原产物
点燃
(1)标价态:正确标出反应前后各元素的化合价;明确变价元素的化合价升降关系。
(2)单线桥:始于被氧化物质中化合价升高的元素,止于被还原物质中化合价降低的元素。
(3)标数目:标出转移电子的总数。
1、不需要标明“得到”或“失去”,只标明电子转移数目;
2、要用箭头标明电子转移的方向;
3、箭头由反应物中失电子元素原子指向得电子元素原子。
书写步骤:
注意事项:
2KMn04+16HCl(浓)==2KC1+2MnCl2+5Cl2↑+8H2O
2KMn04+16HCl(浓)==2KC1+2MnCl2+5Cl2↑+8H2O
失去10e-,被氧化,作还原剂
得到10e-,被还原,作氧化剂
练习
10e-
△
△
【思考交流】化学反应中遵循哪些守恒?
1、质量守恒:参加化学反应的各物质的总质量等于反应后生成的各物质的总质量。
2、化合价升降守恒:反应前后元素化合价升、降的总数相等。
3、电子守恒:反应中氧化剂得电子的数目等于还原剂失电子的数目。
概念
氧化还原反应
电子转移表示方式
三个守恒
双线桥法
单线桥法
氧化还原反应与非氧化还原反应
氧化还原反应的基本形式
相关概念
质量守恒
化合价升降守恒
电子转移守恒
1.下列有关氧化还原反应的叙述中正确的是 ( )
A.有单质参加或有单质生成的反应一定是氧化还原反应
B.氧化还原反应的本质是元素化合价的升降
C.金属单质在化学反应中一定作还原剂
D.失电子的反应物在反应中作还原剂,反应中被还原
解析:有单质参加或有单质生成的反应不一定是氧化还原反应,如:石墨转化为金刚石就不是氧化还原反应,A错误;氧化还原反应的本质是有电子的转移,B错误;在化学反应中,金属最外层电子很容易失去,所以金属单质常常作还原剂, C正确;失电子的反应物在反应中作还原剂,反应中被氧化,D错误。
C
2.某国外化学教材中有一张关于氧化还原反应的插图:
由图可知,
A. 氧化剂 B. 还原剂 C. 氧化产物 D. 还原产物
在该反应中是( )
B
3.根据世界环保联盟的要求,广谱消毒剂ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,则反应后Na2SO3转化为( )
A. Na2SO4 B. SO2 C. S D. Na2S
解析:反应物为NaClO3和Na2SO3,NaClO3生成ClO2,氯元素的化合价降低,则NaClO3为氧化剂,Na2SO3为还原剂,Na2SO3中硫元素化合价升高,只能为Na2SO4,故A正确。
A
4.火药是中国的“四大发明”之一,黑火药在发生爆炸时,发生如下的反应:
2KNO3+C+S=K2S+2NO2↑+CO2↑
(1)用双线桥法表示电子转移。
(2)反应中被还原的元素是 ,被氧化的元素是 ,
氧化剂是 ,还原剂是 ,
氧化产物是 ,还原产物是 。
N、S
C
KNO3、S
C
CO2
K2S、NO2
失4e-
得 2e-
得 2e-
5.储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米
管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提
纯。其反应式为3C+2K2Cr2O7 +8H2SO4===3CO2↑+2K2SO4+2Cr2(SO4)3
+8H2O。
(1)请用双线桥法标出电子转移方向和数目__________________________
(2)上述反应中发生还原反应的物质是______(填化学式),被氧化的元素
是________(填元素符号)。
(3)H2SO4 在上述反应中表现出来的性质是________(填序号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为
_________L。
K2Cr2O7
C
C
4.48
征服世界,并不伟大,一个人能征服自己,才是世界上最伟大的人。
第一单元 氯气及氯的化合物
第2课时 氧化还原反应
2022年2月4日,举世瞩目的北京冬奥会在国家体育场“鸟巢”盛大开幕,氢气在开幕式作为燃料点燃了冬奥赛场主火炬,实现奥林匹克精神与绿色、环保进一步结合。氢气点燃发生反应:2H2+O2====2H2O。该反应中氢元素和氧元素的化合价分别是怎样变化的呢?
点燃
1.以常见氧化还原反应为例,建立概念,并能从物质角度(得氧失氧)、元素角度(化合价变化)、微粒角度(电子得失)认识氧化还原反应的特征和本质,体会认识发展的规律。(变化观念与平衡思想)
1.知道氧化还原反应、氧化反应和还原反应的概念。
2.能根据反应中的元素化合价是否升降来判断氧化还原反应和非氧化还原反应。
3.能用电子转移的观点判断、分析氧化还原反应,并能举例说明化学反应中元素化合价升降与电子转移的关系。
2.通过元素化合价变化的分析,判断氧化还原反应,辨识与四大基本反应类型的关系,建立分析氧化还原反应的思维模型。(证据推理与模型认知)
3.感受氧化还原反应在生产、生活中的应用,认识化学在社会发展和科技进步中的作用。(科学态度与社会责任)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
钠和氯气反应生成氯化钠。请从元素的化合价是否发生变化的角度,对氯气和金属钠的化学反应进行分类,它属于何种反应类型?反应中化合价发生变化的原因是什么?
Cl在反应中得到电子,化合价降低
Na在反应中失去电子,化合价升高
化合价的变化是电子转移的结果,
氧化还原反应的本质是电子的转移
一、氧化还原反应的概念
1、定义:有电子转移的反应即氧化还原反应
没有电子转移的反应即非氧化还原反应
2、特点:元素化合价发生升降变化
3、实质:电子转移
4、氧化剂:得到电子的物质。
化合价降低,被还原,得到还原产物。
还原剂:失去电子的物质。
化合价升高,被氧化,得到氧化产物。
得ne-(化合价降低), 发生还原反应,被还原
失ne-(化合价升高),发生氧化反应,被氧化
氧化剂
还原剂
还原产物
氧化产物
+
+
还原剂
失去电子
化合价升高
表现出还原性
发生氧化反应
本身被氧化
氧化剂
得到电子
化合价降低
表现出氧化性
发生还原反应
本身被还原
1.下列反应属于氧化还原反应的是( )
A.CuO+2HCl====CuCl2 +H2O
B.CaCO3+2HCl====2NaCl+CO2↑+H2O
C.2KMnO4====K2MnO4+MnO2+O2 ↑
D.Ca(OH)2+CO2====CaCO3↓ + H2O
C
2(双选)下列叙述正确的是( )
A、在氧化还原反应中,失去电子的物质,所含元素化合价降低
B、凡是有元素化合价升降的化学反应都是氧化还原反应
C、在氧化还原反应中一定所有的元素化合价都发生变化
D、氧化还原反应的本质是电子的转移(得失或偏移)
B D
课堂练习
△
思考:钠原子与氯原子之间发生了电子转移,导致钠元素与氯元素的化合价发生了改变。那么怎样表示该化学反应中电子转移情况呢?
1、双线桥法:表示反应前后同一元素由反应物转化为生成物时电子转移的情况。
二、氧化还原反应中电子转移的表示方法
2Na+Cl2 == 2NaCl
失去2×e-,被氧化,作还原剂
得到2×e-,被还原,作氧化剂
(1)标价态:正确标出反应前后各元素的化合价,明确变价元素的化合价升降关系。
(2)双箭头:一条线始于被还原的物质中的降价元素,止于还原产物中的相应元素;一条线始于被氧化的物质中的升价元素,终止于氧化产物中的相应元素。
(3)注得失:标出“失去”或“得到”电子的总数。
1、箭头、箭尾必须对应化合价变化的同种元素的原子;
2、必须注明“得到”或“失去”;
3、被还原的物质和被氧化的物质得、失电子数守恒。
书写步骤:
注意事项:
高锰酸钾与浓盐酸在一定条件下可以反应生成氯气。2KMnO4+16HCl(浓)==2KC1+2MnCl2+5Cl2↑+8H2O 该反应是氧化还原反应吗?如果是,指出反应中化合价发生变化的元素,分析电子转移的方向和数目,并指出氧化剂和还原剂。如果不是,请给出理由。
【学以致用】
△
2、单线桥法:表示反应过程中不同元素原子间的电子转移情况。
2Na + Cl2 == 2NaCl
2e-
还原剂
氧化剂
既是氧化产物,又是还原产物
点燃
(1)标价态:正确标出反应前后各元素的化合价;明确变价元素的化合价升降关系。
(2)单线桥:始于被氧化物质中化合价升高的元素,止于被还原物质中化合价降低的元素。
(3)标数目:标出转移电子的总数。
1、不需要标明“得到”或“失去”,只标明电子转移数目;
2、要用箭头标明电子转移的方向;
3、箭头由反应物中失电子元素原子指向得电子元素原子。
书写步骤:
注意事项:
2KMn04+16HCl(浓)==2KC1+2MnCl2+5Cl2↑+8H2O
2KMn04+16HCl(浓)==2KC1+2MnCl2+5Cl2↑+8H2O
失去10e-,被氧化,作还原剂
得到10e-,被还原,作氧化剂
练习
10e-
△
△
【思考交流】化学反应中遵循哪些守恒?
1、质量守恒:参加化学反应的各物质的总质量等于反应后生成的各物质的总质量。
2、化合价升降守恒:反应前后元素化合价升、降的总数相等。
3、电子守恒:反应中氧化剂得电子的数目等于还原剂失电子的数目。
概念
氧化还原反应
电子转移表示方式
三个守恒
双线桥法
单线桥法
氧化还原反应与非氧化还原反应
氧化还原反应的基本形式
相关概念
质量守恒
化合价升降守恒
电子转移守恒
1.下列有关氧化还原反应的叙述中正确的是 ( )
A.有单质参加或有单质生成的反应一定是氧化还原反应
B.氧化还原反应的本质是元素化合价的升降
C.金属单质在化学反应中一定作还原剂
D.失电子的反应物在反应中作还原剂,反应中被还原
解析:有单质参加或有单质生成的反应不一定是氧化还原反应,如:石墨转化为金刚石就不是氧化还原反应,A错误;氧化还原反应的本质是有电子的转移,B错误;在化学反应中,金属最外层电子很容易失去,所以金属单质常常作还原剂, C正确;失电子的反应物在反应中作还原剂,反应中被氧化,D错误。
C
2.某国外化学教材中有一张关于氧化还原反应的插图:
由图可知,
A. 氧化剂 B. 还原剂 C. 氧化产物 D. 还原产物
在该反应中是( )
B
3.根据世界环保联盟的要求,广谱消毒剂ClO2将逐渐取代Cl2成为生产自来水的消毒剂。工业上ClO2常用NaClO3和Na2SO3溶液混合并加H2SO4酸化后反应制得,则反应后Na2SO3转化为( )
A. Na2SO4 B. SO2 C. S D. Na2S
解析:反应物为NaClO3和Na2SO3,NaClO3生成ClO2,氯元素的化合价降低,则NaClO3为氧化剂,Na2SO3为还原剂,Na2SO3中硫元素化合价升高,只能为Na2SO4,故A正确。
A
4.火药是中国的“四大发明”之一,黑火药在发生爆炸时,发生如下的反应:
2KNO3+C+S=K2S+2NO2↑+CO2↑
(1)用双线桥法表示电子转移。
(2)反应中被还原的元素是 ,被氧化的元素是 ,
氧化剂是 ,还原剂是 ,
氧化产物是 ,还原产物是 。
N、S
C
KNO3、S
C
CO2
K2S、NO2
失4e-
得 2e-
得 2e-
5.储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米
管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提
纯。其反应式为3C+2K2Cr2O7 +8H2SO4===3CO2↑+2K2SO4+2Cr2(SO4)3
+8H2O。
(1)请用双线桥法标出电子转移方向和数目__________________________
(2)上述反应中发生还原反应的物质是______(填化学式),被氧化的元素
是________(填元素符号)。
(3)H2SO4 在上述反应中表现出来的性质是________(填序号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8 mol,则产生的气体在标准状况下的体积为
_________L。
K2Cr2O7
C
C
4.48
征服世界,并不伟大,一个人能征服自己,才是世界上最伟大的人。
