必做实验:粗盐中杂质离子的去除 课件(16张) 2022-2023 苏教版 高中化学 必修第一册
文档属性
| 名称 | 必做实验:粗盐中杂质离子的去除 课件(16张) 2022-2023 苏教版 高中化学 必修第一册 |  | |
| 格式 | ppt | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-12 21:01:22 | ||
图片预览





文档简介
(共16张PPT)
第三单元 海洋化学资源的综合利用
必做实验 粗盐中杂质离子的去除
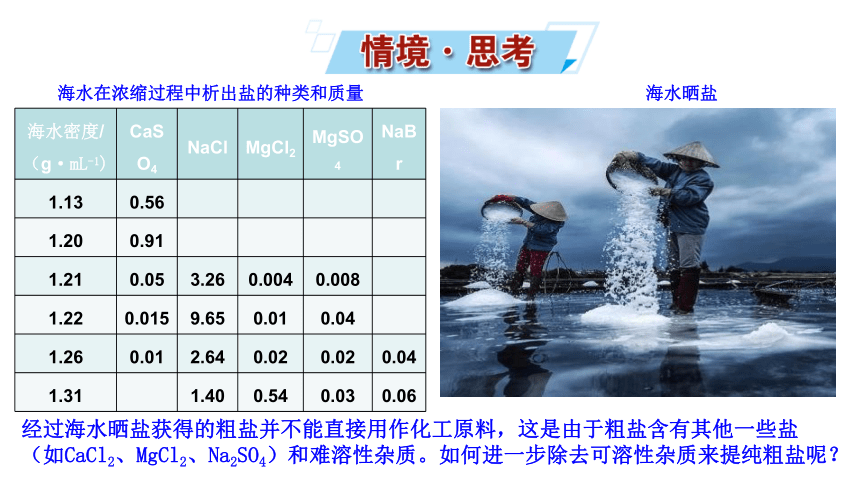
海水在浓缩过程中析出盐的种类和质量
海水密度/(g·mL-1) CaSO4 NaCl MgCl2 MgSO4 NaBr
1.13 0.56
1.20 0.91
1.21 0.05 3.26 0.004 0.008
1.22 0.015 9.65 0.01 0.04
1.26 0.01 2.64 0.02 0.02 0.04
1.31 1.40 0.54 0.03 0.06
海水晒盐
经过海水晒盐获得的粗盐并不能直接用作化工原料,这是由于粗盐含有其他一些盐(如CaCl2、MgCl2、Na2SO4)和难溶性杂质。如何进一步除去可溶性杂质来提纯粗盐呢?
1.理解粗盐提纯的方法和过程。
1.通过粗盐提纯实验,能依据物质性质和实验方法设计资源综合用的方案。(科学探究与创新意识)
3.熟练掌握溶解、过滤、蒸发等操作,认识化学方法在物质分离和提纯中的重要作用。
2.用化学沉淀法去除粗盐中的Ca2+、Mg2+和SO42-。
2.通过设计实验方案,解决多种离子的除杂问题,提高学生酸碱盐知识综合灵活应用能力,形成解决除杂问题的思维模型。(证据推理与模型认知)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
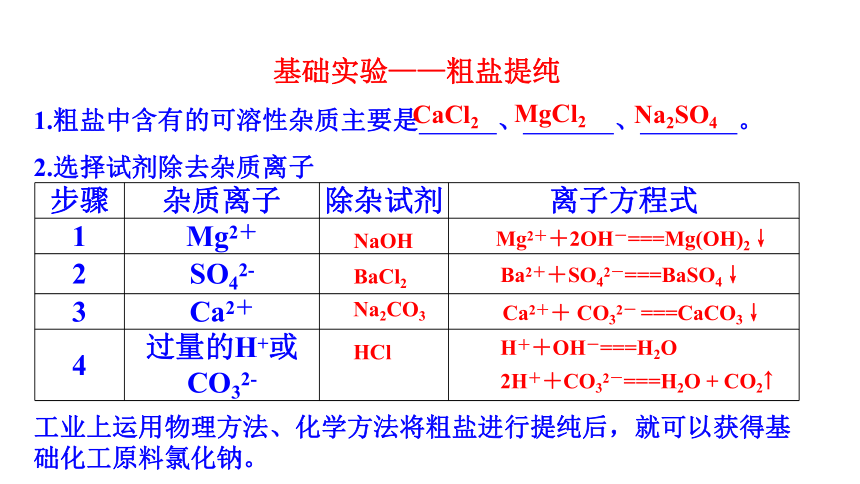
基础实验——粗盐提纯
步骤 杂质离子 除杂试剂 离子方程式
1 Mg2+
2 SO42-
3 Ca2+
4 过量的H+或CO32-
1.粗盐中含有的可溶性杂质主要是 、 、 。
CaCl2
MgCl2
Na2SO4
Na2CO3
HCl
H++OH-===H2O
2H++CO32-===H2O + CO2↑
工业上运用物理方法、化学方法将粗盐进行提纯后,就可以获得基础化工原料氯化钠。
Mg2++2OH-===Mg(OH)2↓
Ba2++SO42-===BaSO4↓
Ca2++ CO32- ===CaCO3↓
2.选择试剂除去杂质离子
NaOH
BaCl2
思考:按一定顺序加入试剂除去杂质后,是否会引入新的杂质?如果有,应如何除去?
3.物质除杂和分离的基本原则
(1)不增(不引入新的杂质)。
(2)不减(不减少被提纯的物质)。
(3)易分离(被提纯的物质与杂质易分离)。
(4)易复原(被提纯的物质易复原)。
4.物质除杂和分离注意的问题
(1)除杂试剂要过量。
(2)后续试剂应能除去过量的前一试剂。
(3)尽可能将杂质转化为所需物质。
(4)除去多种杂质时考虑加入试剂的合理顺序。
基础实验——粗盐提纯
5.过程:(除杂试剂加入的顺序)
过程1:
BaCl2 → Na2CO3 → NaOH →过滤 → 加盐酸 → 蒸发结晶
过程2:
NaOH → BaCl2 →Na2CO3 →过滤 → 加盐酸 → 蒸发结晶
过程3:
BaCl2 → NaOH → Na2CO3→过滤 → 加盐酸 → 蒸发结晶
思考:加入的除杂试剂的顺序有什么特点?为什么?
(1)Na2CO3在BaCl2之后加入。
(2)盐酸在最后加入。
(3)加入盐酸之前过滤一次。
1.除去粗盐中可溶性杂质的原理
粗盐中含有Ca2+、Mg2+、SO42-等杂质。
2.粗盐提纯时加试剂的先后顺序
为使杂质离子完全除去,要加入过量的试剂。后续试剂要能够将前面所加过量的试剂除去,由此可知Na2CO3溶液要在BaCl2溶液之后加入,通常加入试剂的几种顺序
(1)BaCl2溶液→NaOH溶液→Na2CO3溶液→盐酸;
(2)NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸;
(3)BaCl2溶液→Na2CO3溶液→NaOH溶液→盐酸。
1.为了除去粗盐中的Ca2+、Mg2+、SO42—及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( )
①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A、①④②③⑤ B、④①②⑤③ C、②⑤④①③ D、⑤②④①③
解析:首先明确所加试剂分别除哪种离子,根据粗盐中所含杂质离子的性质,NaOH除去Mg2+;Na2CO3除去Ca2+、Mg2+,主要为Ca2+;BaCl2除去SO42-。但是选择这三种溶液又会引入新的杂质离子CO32-、OH-、Ba2+,除去CO32-和OH-通过加适量盐酸将它们转化为H2O或CO2,但过量Ba2+必须由Na2CO3除去。因此Na2CO3溶液的加入必须在BaCl2溶液之后,而NaOH溶液和BaCl2溶液加入的顺序可以相互调换。
CD
2.下图是某研究性学习小组设计的除去粗食盐中可溶性杂质的流程,思考解答下列问题:
(1)写出上述各步反应的离子方程式:
① ;
② ;
③ , 。
Mg2++2OH-===Mg(OH)2↓
Ba2++SO42-===BaSO4↓
Ca2++CO32-===CaCO3↓
Ba2++CO32-===BaCO3↓
(2)Na2CO3溶液和BaCl2溶液的顺序是否可以颠倒?为什么?
不可以。Na2CO3溶液的作用不但是除去溶液中的Ca2+,另一个作用是除去溶液中过量的Ba2+,因此Na2CO3溶液必须在加入BaCl2溶液之后加入。
(3)如何检验食盐水中杂质离子已除干净?
①取少许滤液于试管中,加入稀盐酸,再加BaCl2溶液,如无白色沉淀生成,证明SO42-除净。
②取少许滤液于试管中,加入NaOH溶液,如无白色沉淀生成,证明Mg2+除净。
③取少许滤液于试管中,加入Na2CO3溶液,如无白色沉淀生成,证明Ca2+已除净。
(1)第①步操作的名称是_____,第②步加入的试剂化学式为____。
(2)第④步加入试剂的化学式为______,作用是 。
(3)第⑤步操作所需玻璃仪器的名称是______。
(4)步骤②、③、④用到的试剂还可以有其他的添加顺序是___(填写化学式)。
(5)若将步骤⑤与步骤⑥对调,即先用盐酸调pH再过滤,将对实验结果产生的影响是 。
3.为除去粗盐中的CaCl2、MgCl2、FeCl3、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
解析:(1)粗盐中的CaCl2、MgCl2、FeCl3、Na2SO4以及泥沙等杂质的除杂方法:先将混合物溶解,后过滤除泥沙,再加入试剂分别将钙离子、镁离子、铁离子以及SO42-除去,但是碳酸钠一定放在氯化钡的后面,氢氧化钠和氯化钡的顺序无要求。(2)最后加入试剂是碳酸钠,将溶液中的杂质离子钙离子以及多余的钡离子除去。(3)第⑤步操作是将沉淀和溶液分离的方法,所需玻璃仪器是漏斗、玻璃棒、烧杯。(4)碳酸钠一定放在氯化钡的后面加,否则溶液中过量的钡离子无法除去,除杂试剂BaCl2、NaOH、Na2CO3加入的顺序还可以是NaOH、BaCl2、Na2CO3、(或BaCl2、Na2CO3、NaOH。(5)由于盐酸能够与碳酸钡、碳酸钙、氢氧化镁发生反应,先用盐酸调pH再过滤,导致少量CaCO3、BaCO3、Mg(OH)2沉淀溶解,使NaCl混有杂质。
答案:(1)溶解;BaCl2 (2)Na2CO3 ;除去Ca2+、Ba2+(3)漏斗、玻璃棒、烧杯(4)BaCl2、Na2CO3、NaOH或NaOH、BaCl2、Na2CO3 (5)先加HCl会有少量CaCO3、BaCO3、Mg(OH)2沉淀溶解,使NaCl混有杂质,从而影响制得NaCl的纯度
觉是一个瞬间,悟是一个过程。
交到一个好朋友就是开创了一段美好生活。我们的朋友正像一面镜子,从他们身上能看到自己的差距。
第三单元 海洋化学资源的综合利用
必做实验 粗盐中杂质离子的去除
海水在浓缩过程中析出盐的种类和质量
海水密度/(g·mL-1) CaSO4 NaCl MgCl2 MgSO4 NaBr
1.13 0.56
1.20 0.91
1.21 0.05 3.26 0.004 0.008
1.22 0.015 9.65 0.01 0.04
1.26 0.01 2.64 0.02 0.02 0.04
1.31 1.40 0.54 0.03 0.06
海水晒盐
经过海水晒盐获得的粗盐并不能直接用作化工原料,这是由于粗盐含有其他一些盐(如CaCl2、MgCl2、Na2SO4)和难溶性杂质。如何进一步除去可溶性杂质来提纯粗盐呢?
1.理解粗盐提纯的方法和过程。
1.通过粗盐提纯实验,能依据物质性质和实验方法设计资源综合用的方案。(科学探究与创新意识)
3.熟练掌握溶解、过滤、蒸发等操作,认识化学方法在物质分离和提纯中的重要作用。
2.用化学沉淀法去除粗盐中的Ca2+、Mg2+和SO42-。
2.通过设计实验方案,解决多种离子的除杂问题,提高学生酸碱盐知识综合灵活应用能力,形成解决除杂问题的思维模型。(证据推理与模型认知)
体会课堂探究的乐趣,
汲取新知识的营养,
让我们一起 吧!
进
走
课
堂
基础实验——粗盐提纯
步骤 杂质离子 除杂试剂 离子方程式
1 Mg2+
2 SO42-
3 Ca2+
4 过量的H+或CO32-
1.粗盐中含有的可溶性杂质主要是 、 、 。
CaCl2
MgCl2
Na2SO4
Na2CO3
HCl
H++OH-===H2O
2H++CO32-===H2O + CO2↑
工业上运用物理方法、化学方法将粗盐进行提纯后,就可以获得基础化工原料氯化钠。
Mg2++2OH-===Mg(OH)2↓
Ba2++SO42-===BaSO4↓
Ca2++ CO32- ===CaCO3↓
2.选择试剂除去杂质离子
NaOH
BaCl2
思考:按一定顺序加入试剂除去杂质后,是否会引入新的杂质?如果有,应如何除去?
3.物质除杂和分离的基本原则
(1)不增(不引入新的杂质)。
(2)不减(不减少被提纯的物质)。
(3)易分离(被提纯的物质与杂质易分离)。
(4)易复原(被提纯的物质易复原)。
4.物质除杂和分离注意的问题
(1)除杂试剂要过量。
(2)后续试剂应能除去过量的前一试剂。
(3)尽可能将杂质转化为所需物质。
(4)除去多种杂质时考虑加入试剂的合理顺序。
基础实验——粗盐提纯
5.过程:(除杂试剂加入的顺序)
过程1:
BaCl2 → Na2CO3 → NaOH →过滤 → 加盐酸 → 蒸发结晶
过程2:
NaOH → BaCl2 →Na2CO3 →过滤 → 加盐酸 → 蒸发结晶
过程3:
BaCl2 → NaOH → Na2CO3→过滤 → 加盐酸 → 蒸发结晶
思考:加入的除杂试剂的顺序有什么特点?为什么?
(1)Na2CO3在BaCl2之后加入。
(2)盐酸在最后加入。
(3)加入盐酸之前过滤一次。
1.除去粗盐中可溶性杂质的原理
粗盐中含有Ca2+、Mg2+、SO42-等杂质。
2.粗盐提纯时加试剂的先后顺序
为使杂质离子完全除去,要加入过量的试剂。后续试剂要能够将前面所加过量的试剂除去,由此可知Na2CO3溶液要在BaCl2溶液之后加入,通常加入试剂的几种顺序
(1)BaCl2溶液→NaOH溶液→Na2CO3溶液→盐酸;
(2)NaOH溶液→BaCl2溶液→Na2CO3溶液→盐酸;
(3)BaCl2溶液→Na2CO3溶液→NaOH溶液→盐酸。
1.为了除去粗盐中的Ca2+、Mg2+、SO42—及泥沙,可将粗盐溶于水,然后进行下列五项操作。其中正确的操作顺序是( )
①过滤 ②加过量的NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液
A、①④②③⑤ B、④①②⑤③ C、②⑤④①③ D、⑤②④①③
解析:首先明确所加试剂分别除哪种离子,根据粗盐中所含杂质离子的性质,NaOH除去Mg2+;Na2CO3除去Ca2+、Mg2+,主要为Ca2+;BaCl2除去SO42-。但是选择这三种溶液又会引入新的杂质离子CO32-、OH-、Ba2+,除去CO32-和OH-通过加适量盐酸将它们转化为H2O或CO2,但过量Ba2+必须由Na2CO3除去。因此Na2CO3溶液的加入必须在BaCl2溶液之后,而NaOH溶液和BaCl2溶液加入的顺序可以相互调换。
CD
2.下图是某研究性学习小组设计的除去粗食盐中可溶性杂质的流程,思考解答下列问题:
(1)写出上述各步反应的离子方程式:
① ;
② ;
③ , 。
Mg2++2OH-===Mg(OH)2↓
Ba2++SO42-===BaSO4↓
Ca2++CO32-===CaCO3↓
Ba2++CO32-===BaCO3↓
(2)Na2CO3溶液和BaCl2溶液的顺序是否可以颠倒?为什么?
不可以。Na2CO3溶液的作用不但是除去溶液中的Ca2+,另一个作用是除去溶液中过量的Ba2+,因此Na2CO3溶液必须在加入BaCl2溶液之后加入。
(3)如何检验食盐水中杂质离子已除干净?
①取少许滤液于试管中,加入稀盐酸,再加BaCl2溶液,如无白色沉淀生成,证明SO42-除净。
②取少许滤液于试管中,加入NaOH溶液,如无白色沉淀生成,证明Mg2+除净。
③取少许滤液于试管中,加入Na2CO3溶液,如无白色沉淀生成,证明Ca2+已除净。
(1)第①步操作的名称是_____,第②步加入的试剂化学式为____。
(2)第④步加入试剂的化学式为______,作用是 。
(3)第⑤步操作所需玻璃仪器的名称是______。
(4)步骤②、③、④用到的试剂还可以有其他的添加顺序是___(填写化学式)。
(5)若将步骤⑤与步骤⑥对调,即先用盐酸调pH再过滤,将对实验结果产生的影响是 。
3.为除去粗盐中的CaCl2、MgCl2、FeCl3、Na2SO4以及泥沙等杂质,某同学设计了一种制备精盐的实验方案,步骤如下(用于沉淀的试剂稍过量):
解析:(1)粗盐中的CaCl2、MgCl2、FeCl3、Na2SO4以及泥沙等杂质的除杂方法:先将混合物溶解,后过滤除泥沙,再加入试剂分别将钙离子、镁离子、铁离子以及SO42-除去,但是碳酸钠一定放在氯化钡的后面,氢氧化钠和氯化钡的顺序无要求。(2)最后加入试剂是碳酸钠,将溶液中的杂质离子钙离子以及多余的钡离子除去。(3)第⑤步操作是将沉淀和溶液分离的方法,所需玻璃仪器是漏斗、玻璃棒、烧杯。(4)碳酸钠一定放在氯化钡的后面加,否则溶液中过量的钡离子无法除去,除杂试剂BaCl2、NaOH、Na2CO3加入的顺序还可以是NaOH、BaCl2、Na2CO3、(或BaCl2、Na2CO3、NaOH。(5)由于盐酸能够与碳酸钡、碳酸钙、氢氧化镁发生反应,先用盐酸调pH再过滤,导致少量CaCO3、BaCO3、Mg(OH)2沉淀溶解,使NaCl混有杂质。
答案:(1)溶解;BaCl2 (2)Na2CO3 ;除去Ca2+、Ba2+(3)漏斗、玻璃棒、烧杯(4)BaCl2、Na2CO3、NaOH或NaOH、BaCl2、Na2CO3 (5)先加HCl会有少量CaCO3、BaCO3、Mg(OH)2沉淀溶解,使NaCl混有杂质,从而影响制得NaCl的纯度
觉是一个瞬间,悟是一个过程。
交到一个好朋友就是开创了一段美好生活。我们的朋友正像一面镜子,从他们身上能看到自己的差距。
