化学人教版2019选择性必修1 3.1.1 强弱电解质(共28张ppt)
文档属性
| 名称 | 化学人教版2019选择性必修1 3.1.1 强弱电解质(共28张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 7.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-12 21:27:40 | ||
图片预览








文档简介
(共28张PPT)
走进奇妙的化学世界
选择性必修1
第三章 水溶液中的离子
反应与平衡
第一节 电离平衡
第1课时 强弱电解质
化学与生活
你知道吗?
主要成分是盐酸(HCl),为什么不用醋酸(CH3COOH)?
为什么除水垢用醋酸(CH3COOH)、而不用盐酸(HCl)。
学习
目标
第1课时
强弱电解质
PART
01
PART
02
了解强、弱电解质的概念
掌握强电解质与弱电解质的判断
掌握弱电解质的电离方程式的书写
PART
03
温故而知新
电解质
在水溶液中或熔融状态下能够导电的化合物
如:酸、碱、盐、活泼金属氧化物、H2O
非电解质
在水溶液和熔融状态下都不能导电的化合物
如:多数有机化合物、非金属氧化物和氨等
疑点突破:
电解质、非电解质的前提必须为化合物,故单质、混合物既不是电解质也不是非电解质
电解质必须是化合物本身能电离出离子,否则不属于电解质。例:NH3、SO2、CO2 。
电解质的导电:导电的条件是溶于水或熔融状态
导电的本质是自由离子的定向移动
导电能力与离子浓度和离子所带电荷有关
【做一做】
1.根据电解质的概念,分析以下几种说法是否正确,并说明原因。
(1)石墨能导电,所以是电解质。
(2)SO2、NH3、Na2O溶于水可导电,所以均为电解质。
(3)盐酸能导电,所以盐酸是电解质。
提示:(1)石墨是单质,不是电解质。
(2)SO2、NH3溶于水可导电,是因为SO2、NH3与水反应生成的亚硫酸、一水合氨是电解质,SO2、NH3是非电解质。
(3)盐酸是混合物,盐酸不是电解质。
疑点突破:① 电解质、非电解质的前提必须为化合物
②电解质不一定导电,导电的不一定是电解质。例如:氯化钠固体、氯化钠水溶液.
非电解质不导电,不导电的不一定是非电解质。例如:氢气
③电解质必须是化合物本身能电离出离子,否则不属于电解质。例如NH3、SO2、CO2
④ 电解质的导电: 导电的条件是溶于水或熔融状态
导电的本质是自由离子的定向移动
导电能力与离子浓度和离子所带电荷有关
2、 现有下列物质:
①石墨 ②BaSO4 ③稀盐酸 ④CO2 ⑤CaO ⑥NaCl ⑦硫酸 ⑧熔融KCl
⑨酒精 ⑩ 醋酸 ⑾ NaCl溶液
以上指定物质中,属于电解质的是_____________
属于非电解质的是------------------
能导电的是____________
②⑤⑥⑦⑧⑩
④⑨
①③⑧⑾
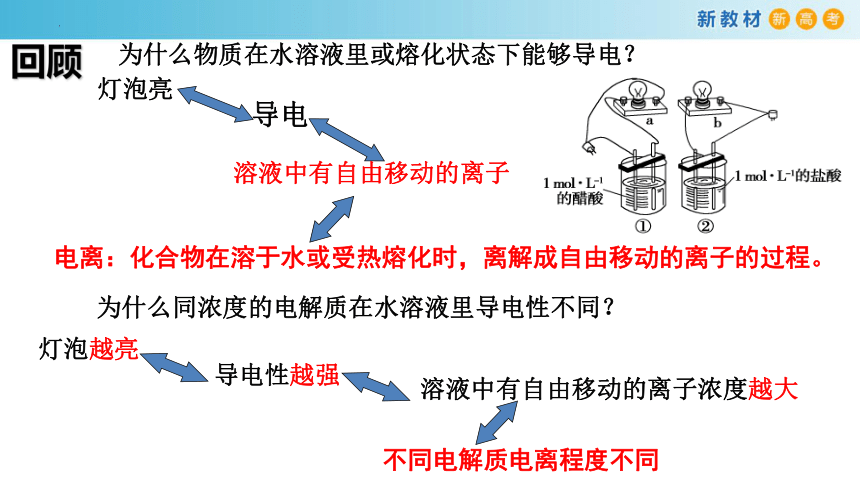
回顾
为什么物质在水溶液里或熔化状态下能够导电?
灯泡亮
导电
溶液中有自由移动的离子
电离:化合物在溶于水或受热熔化时,离解成自由移动的离子的过程。
为什么同浓度的电解质在水溶液里导电性不同?
灯泡越亮
导电性越强
溶液中有自由移动的离子浓度越大
不同电解质电离程度不同
探究实验:课本P56
实验3-1:体积相同,0.1mol/L的盐酸和醋酸,比较它们PH的大小,测试其导电能力,并分别与等量镁条反应,观察现象。
【实验1】分别向等体积0.1 mol/L 盐酸、0.1 mol/L 醋酸中加入等量镁条。
【实验2】用水质检测笔检测0.1 mol/L 盐酸、0.1 mol/L 醋酸、蒸馏水的导电性。
(已知:相同温度下,水质检测笔读数越大,溶液的导电性越强)
数据分析:
读数:7180
读数:187
读数:2
导电性:
0.1 mol/L 盐酸 > 0.1 mol/L 醋酸
离子浓度:
0.1 mol/L 盐酸 > 0.1 mol/L 醋酸
溶质电离行为的差异,造成实验结果不同
【实验3】常温时,测定0.1 mol/L 盐酸、0.1 mol/L 醋酸的pH。
资料卡片:PH= - lgC(H+)
PH=1 C(H+) =0.1mol/L
PH=2.8 C(H+) =0.00168mol/L
0.1 mol/L 盐酸 pH=1
c(H+)=0.1 mol/L
0.1 mol/L 醋酸 pH=3
c(H+)=0.001 mol/L
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
pH
导电能力
与镁条反应
1 接近3
强 弱
迅速产生大量气泡
产生气泡相对缓慢
结论:
HCl在水中的电离程度大于CH3COOH
数据分析
提示:c(H+)=10-pH
0.1mol/L HCl(aq)
c(H+)=
10-1
=0.1 mol/L
0.1mol/L CH3COOH(aq)
c(H+)≈
0.001 mol/L
结论:
HCl分子在水中完全电离
醋酸分子在水中部分电离,且非常微弱
Cl- H3O+
图示模拟电离
强电解质
弱电解质
HCl在水中电离示意图 CH3COOH在水中电离示意图
H3O+ CH3COO- CH3COOH
HCl
CH3COOH
不彻底、可逆过程
完全电离
部分电离
溶质在溶液中只以离子形式存在,没有分子
在水溶液中能够全部电离的电解质称为强电解质
在水溶液中只能部分电离的电解质称为弱电解质
溶质在溶液中大部分以分子形式存在,仅一少部分发生电离。
强电解质
弱电解质
Cl- H3O+
H3O+ CH3COO- CH3COOH
强弱电解质
在水溶液中能够全部电离的电解质。
强电解质
在水溶液中能够部分电离的电解质。
弱电解质
特点:完全电离,只有离子,无分子,不可逆,电离方程式用“=”连接
类别:强酸:HCl、H2SO4、HNO3、HBr、HI、HClO4
强碱:NaOH、KOH、Ca(OH)2、Ba(OH)2
大部分盐(包括难溶盐)NaCl、NH4Cl、Fe(NO3)3、BaSO4等
活泼金属氧化物Na2O等
特点:不完全电离,既有分子又有离子,可逆,存在电离平衡,电离方程式用“ ”连接
类别:弱酸HF、HClO、H2S、H2SO3、H3PO4、H2CO3、 CH3COOH等
弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等
少数盐:醋酸铅、HgCl2等 H2O是极弱电解质。
3、电离方程式的书写
(1)强电解质用等号,弱电解质用可逆号。
H2SO4 = 2H+ + SO42-
CH3COOH CH3COO - + H+
(3)多元弱碱的电离认为一步完成。
(2)二元及多元弱酸的电离分步完成, 并以第一步电离为主。
H2CO3 H+ + HCO3-
HCO3- H+ + CO32-
原则:遵循质量守恒、电荷守恒、客观事实
Cu(OH)2 Cu2+ + 2OH —
强电解质在溶液中完全电离,用“=”
弱电解质在溶液中部分电离,用“ ”
多元弱酸分步电离,分步书写电离方程式,多元弱碱也是分步电离,但可按一步电离写出。
弱电解质的电离过程是可逆的
两性氢氧化物:
Al3++3OH-
Al(OH)3
H++AlO2-+H2O
碱式
酸式
【例】请写出H2SO4、NH3·H2O 、H2CO3、Al(OH)3、NaHCO3 、
NaHSO4 、Ba(OH)2在水溶液中的电离方程式。
H2SO4=2H++SO42-
NH3·H2O NH4++OH-
H2CO3 H++HCO3-
HCO3- H++CO32-
Al(OH)3 Al3++3OH- (碱式电离)
Al(OH)3 AlO2-+H++H2O(酸式电离)
NaHCO3=Na++HCO3-
HCO3- H++CO32-
NaHSO4=Na++H++SO42-
Ba(OH)2=Ba2++2OH-
①先判断强、弱电解质,决定符号。
③弱酸的酸式酸根阴离子只微弱电离,要保留;强酸的酸式酸根在水中完全电离,要拆开。
②多元弱酸分步电离,分步写;多元弱碱分步电离,写一步。
电离方程式的书写要点
④Al(OH)3有酸式和碱式电离。
解题通法
强等号、弱可逆、多元弱酸分步写,多元弱碱写一步
难溶:BaSO4 Fe(OH)3
电解质的强弱与其溶解性有何关系?
易溶:HCl CH3COOH
思考与交流
能否根据溶液导电能力判断电解质的相对强弱?
难溶:BaSO4 Fe(OH)3
电解质的强弱与其溶解性有何关系?
易溶:HCl CH3COOH
强电解质
思考与交流
能否根据溶液导电能力判断电解质的相对强弱?
难溶:BaSO4 Fe(OH)3
电解质的强弱与其溶解性有何关系?
易溶:HCl CH3COOH
强电解质
弱电解质
思考与交流
能否根据溶液导电能力判断电解质的相对强弱?
无关
4、电解质的强弱与溶液的导电性:
溶液的导电性的影响因素:
①水溶液中自由移动的离子总浓度
②离子总浓度相同时,看离子所带的电荷数
③与温度也有关
高中阶段,极性共价键有水才电离,没水不电离!
在水溶液中:NaHSO4=Na++H++SO42-
熔融状态下:NaHSO4=Na++HSO4-
【思考】熔融状态下NaHSO4的电离方程式?
你知道吗
课堂小结
1.融化状态下能导电的物质一定是电解质
2.融化状态下不能导电的物质一定不是电解质
3.溶于水能导电的物质一定是电解质
4.某些化合物溶于水能导电一定是电解质
5.盐酸能导电,所以盐酸是电解质
6.SO2、NH3、Na2O溶于水可导电,所以均为电解质
练习
2.写出下列物质在水中的电离方程式:
⑴ NH3·H2O ⑵ HClO ⑶ H2SO3
⑷ Fe(OH)3 (5)Al(OH)3 (6)NaHCO3
(7)NaHSO4 (8)Ba(OH)2 (9)HClO4
(10)Na2SO4 (11)Mg(NO3)2 (12)CaCO3
3.现有以下物质:①硫酸铜晶体 ②AlCl3 ③冰醋酸 ④硫化氢 ⑤三氧化硫 ⑥金属镁 ⑦石墨 ⑧亚硫酸钠 ⑨氨水 ⑩熟石灰固体。
(1)属于强电解质的是 (填序号,下同)。
(2)属于弱电解质的是 。
(3)属于非电解质的是 。
(4)既不是电解质,又不是非电解质的是 。
(5)能导电的是 。
①②⑧⑩
③④
⑤
⑥⑦⑨
⑥⑦⑨
走进奇妙的化学世界
选择性必修1
第三章 水溶液中的离子
反应与平衡
第一节 电离平衡
第1课时 强弱电解质
化学与生活
你知道吗?
主要成分是盐酸(HCl),为什么不用醋酸(CH3COOH)?
为什么除水垢用醋酸(CH3COOH)、而不用盐酸(HCl)。
学习
目标
第1课时
强弱电解质
PART
01
PART
02
了解强、弱电解质的概念
掌握强电解质与弱电解质的判断
掌握弱电解质的电离方程式的书写
PART
03
温故而知新
电解质
在水溶液中或熔融状态下能够导电的化合物
如:酸、碱、盐、活泼金属氧化物、H2O
非电解质
在水溶液和熔融状态下都不能导电的化合物
如:多数有机化合物、非金属氧化物和氨等
疑点突破:
电解质、非电解质的前提必须为化合物,故单质、混合物既不是电解质也不是非电解质
电解质必须是化合物本身能电离出离子,否则不属于电解质。例:NH3、SO2、CO2 。
电解质的导电:导电的条件是溶于水或熔融状态
导电的本质是自由离子的定向移动
导电能力与离子浓度和离子所带电荷有关
【做一做】
1.根据电解质的概念,分析以下几种说法是否正确,并说明原因。
(1)石墨能导电,所以是电解质。
(2)SO2、NH3、Na2O溶于水可导电,所以均为电解质。
(3)盐酸能导电,所以盐酸是电解质。
提示:(1)石墨是单质,不是电解质。
(2)SO2、NH3溶于水可导电,是因为SO2、NH3与水反应生成的亚硫酸、一水合氨是电解质,SO2、NH3是非电解质。
(3)盐酸是混合物,盐酸不是电解质。
疑点突破:① 电解质、非电解质的前提必须为化合物
②电解质不一定导电,导电的不一定是电解质。例如:氯化钠固体、氯化钠水溶液.
非电解质不导电,不导电的不一定是非电解质。例如:氢气
③电解质必须是化合物本身能电离出离子,否则不属于电解质。例如NH3、SO2、CO2
④ 电解质的导电: 导电的条件是溶于水或熔融状态
导电的本质是自由离子的定向移动
导电能力与离子浓度和离子所带电荷有关
2、 现有下列物质:
①石墨 ②BaSO4 ③稀盐酸 ④CO2 ⑤CaO ⑥NaCl ⑦硫酸 ⑧熔融KCl
⑨酒精 ⑩ 醋酸 ⑾ NaCl溶液
以上指定物质中,属于电解质的是_____________
属于非电解质的是------------------
能导电的是____________
②⑤⑥⑦⑧⑩
④⑨
①③⑧⑾
回顾
为什么物质在水溶液里或熔化状态下能够导电?
灯泡亮
导电
溶液中有自由移动的离子
电离:化合物在溶于水或受热熔化时,离解成自由移动的离子的过程。
为什么同浓度的电解质在水溶液里导电性不同?
灯泡越亮
导电性越强
溶液中有自由移动的离子浓度越大
不同电解质电离程度不同
探究实验:课本P56
实验3-1:体积相同,0.1mol/L的盐酸和醋酸,比较它们PH的大小,测试其导电能力,并分别与等量镁条反应,观察现象。
【实验1】分别向等体积0.1 mol/L 盐酸、0.1 mol/L 醋酸中加入等量镁条。
【实验2】用水质检测笔检测0.1 mol/L 盐酸、0.1 mol/L 醋酸、蒸馏水的导电性。
(已知:相同温度下,水质检测笔读数越大,溶液的导电性越强)
数据分析:
读数:7180
读数:187
读数:2
导电性:
0.1 mol/L 盐酸 > 0.1 mol/L 醋酸
离子浓度:
0.1 mol/L 盐酸 > 0.1 mol/L 醋酸
溶质电离行为的差异,造成实验结果不同
【实验3】常温时,测定0.1 mol/L 盐酸、0.1 mol/L 醋酸的pH。
资料卡片:PH= - lgC(H+)
PH=1 C(H+) =0.1mol/L
PH=2.8 C(H+) =0.00168mol/L
0.1 mol/L 盐酸 pH=1
c(H+)=0.1 mol/L
0.1 mol/L 醋酸 pH=3
c(H+)=0.001 mol/L
酸 0.1 mol/L 盐酸 0.1 mol/L 醋酸
pH
导电能力
与镁条反应
1 接近3
强 弱
迅速产生大量气泡
产生气泡相对缓慢
结论:
HCl在水中的电离程度大于CH3COOH
数据分析
提示:c(H+)=10-pH
0.1mol/L HCl(aq)
c(H+)=
10-1
=0.1 mol/L
0.1mol/L CH3COOH(aq)
c(H+)≈
0.001 mol/L
结论:
HCl分子在水中完全电离
醋酸分子在水中部分电离,且非常微弱
Cl- H3O+
图示模拟电离
强电解质
弱电解质
HCl在水中电离示意图 CH3COOH在水中电离示意图
H3O+ CH3COO- CH3COOH
HCl
CH3COOH
不彻底、可逆过程
完全电离
部分电离
溶质在溶液中只以离子形式存在,没有分子
在水溶液中能够全部电离的电解质称为强电解质
在水溶液中只能部分电离的电解质称为弱电解质
溶质在溶液中大部分以分子形式存在,仅一少部分发生电离。
强电解质
弱电解质
Cl- H3O+
H3O+ CH3COO- CH3COOH
强弱电解质
在水溶液中能够全部电离的电解质。
强电解质
在水溶液中能够部分电离的电解质。
弱电解质
特点:完全电离,只有离子,无分子,不可逆,电离方程式用“=”连接
类别:强酸:HCl、H2SO4、HNO3、HBr、HI、HClO4
强碱:NaOH、KOH、Ca(OH)2、Ba(OH)2
大部分盐(包括难溶盐)NaCl、NH4Cl、Fe(NO3)3、BaSO4等
活泼金属氧化物Na2O等
特点:不完全电离,既有分子又有离子,可逆,存在电离平衡,电离方程式用“ ”连接
类别:弱酸HF、HClO、H2S、H2SO3、H3PO4、H2CO3、 CH3COOH等
弱碱:NH3·H2O、Fe(OH)3、Al(OH)3、Cu(OH)2等
少数盐:醋酸铅、HgCl2等 H2O是极弱电解质。
3、电离方程式的书写
(1)强电解质用等号,弱电解质用可逆号。
H2SO4 = 2H+ + SO42-
CH3COOH CH3COO - + H+
(3)多元弱碱的电离认为一步完成。
(2)二元及多元弱酸的电离分步完成, 并以第一步电离为主。
H2CO3 H+ + HCO3-
HCO3- H+ + CO32-
原则:遵循质量守恒、电荷守恒、客观事实
Cu(OH)2 Cu2+ + 2OH —
强电解质在溶液中完全电离,用“=”
弱电解质在溶液中部分电离,用“ ”
多元弱酸分步电离,分步书写电离方程式,多元弱碱也是分步电离,但可按一步电离写出。
弱电解质的电离过程是可逆的
两性氢氧化物:
Al3++3OH-
Al(OH)3
H++AlO2-+H2O
碱式
酸式
【例】请写出H2SO4、NH3·H2O 、H2CO3、Al(OH)3、NaHCO3 、
NaHSO4 、Ba(OH)2在水溶液中的电离方程式。
H2SO4=2H++SO42-
NH3·H2O NH4++OH-
H2CO3 H++HCO3-
HCO3- H++CO32-
Al(OH)3 Al3++3OH- (碱式电离)
Al(OH)3 AlO2-+H++H2O(酸式电离)
NaHCO3=Na++HCO3-
HCO3- H++CO32-
NaHSO4=Na++H++SO42-
Ba(OH)2=Ba2++2OH-
①先判断强、弱电解质,决定符号。
③弱酸的酸式酸根阴离子只微弱电离,要保留;强酸的酸式酸根在水中完全电离,要拆开。
②多元弱酸分步电离,分步写;多元弱碱分步电离,写一步。
电离方程式的书写要点
④Al(OH)3有酸式和碱式电离。
解题通法
强等号、弱可逆、多元弱酸分步写,多元弱碱写一步
难溶:BaSO4 Fe(OH)3
电解质的强弱与其溶解性有何关系?
易溶:HCl CH3COOH
思考与交流
能否根据溶液导电能力判断电解质的相对强弱?
难溶:BaSO4 Fe(OH)3
电解质的强弱与其溶解性有何关系?
易溶:HCl CH3COOH
强电解质
思考与交流
能否根据溶液导电能力判断电解质的相对强弱?
难溶:BaSO4 Fe(OH)3
电解质的强弱与其溶解性有何关系?
易溶:HCl CH3COOH
强电解质
弱电解质
思考与交流
能否根据溶液导电能力判断电解质的相对强弱?
无关
4、电解质的强弱与溶液的导电性:
溶液的导电性的影响因素:
①水溶液中自由移动的离子总浓度
②离子总浓度相同时,看离子所带的电荷数
③与温度也有关
高中阶段,极性共价键有水才电离,没水不电离!
在水溶液中:NaHSO4=Na++H++SO42-
熔融状态下:NaHSO4=Na++HSO4-
【思考】熔融状态下NaHSO4的电离方程式?
你知道吗
课堂小结
1.融化状态下能导电的物质一定是电解质
2.融化状态下不能导电的物质一定不是电解质
3.溶于水能导电的物质一定是电解质
4.某些化合物溶于水能导电一定是电解质
5.盐酸能导电,所以盐酸是电解质
6.SO2、NH3、Na2O溶于水可导电,所以均为电解质
练习
2.写出下列物质在水中的电离方程式:
⑴ NH3·H2O ⑵ HClO ⑶ H2SO3
⑷ Fe(OH)3 (5)Al(OH)3 (6)NaHCO3
(7)NaHSO4 (8)Ba(OH)2 (9)HClO4
(10)Na2SO4 (11)Mg(NO3)2 (12)CaCO3
3.现有以下物质:①硫酸铜晶体 ②AlCl3 ③冰醋酸 ④硫化氢 ⑤三氧化硫 ⑥金属镁 ⑦石墨 ⑧亚硫酸钠 ⑨氨水 ⑩熟石灰固体。
(1)属于强电解质的是 (填序号,下同)。
(2)属于弱电解质的是 。
(3)属于非电解质的是 。
(4)既不是电解质,又不是非电解质的是 。
(5)能导电的是 。
①②⑧⑩
③④
⑤
⑥⑦⑨
⑥⑦⑨
