化学反应速率
图片预览






文档简介
课件15张PPT。 第二章 化学反应速率和平衡
第一节 化学反应速率
三维目标 思维激活
在我们熟悉的化学反应中,有的反应可以瞬间完成,如沉淀反应、中和反应等,但有的反应很慢,如煤的形成、石油的形成等。如何来表示这些反应的快慢呢?
自学导引
一、化学反应速率
1.化学反应速率的概念
在容积不变的反应器中,通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示化学反应速率。
2.化学反应速率的数学表达式v=
(1)化学反应速率的符号是v,Δc=|c始-c末|表示反应过程中,其反应物减少的浓度或生成物增加的浓度的绝对值.(2)单位:mol/L.h 、mol/L.min 、mol/L.s 思考题 同一反应,用不同物质的物质的量浓度变化所表示的反应速率的数值可能不同。为什么?
答案 在一个化学反应里,各物质的化学计量数不一定相同,则单位时间内不同物质的物质的量浓度变化量就可能不同,所以用不同物质所表示的化学反应速率的数值就不一定相同。
二、化学反应速率的测定
化学反应的速率是通过实验来测定的。包括能够直接观察的某些性质,如释放出气体的体积和体系的压强;也包括必须依靠仪器来测量的性质,如颜色的深浅、光的吸收、光的发射、导电能力等。在溶液中常常利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应的速率。 名师解惑
一、化学反应速率的计算规律
在1 L固定容积的容器中发生反应:N2+3H2??2NH3,在1 min内2 mol N2与6 mol H2反应生成了4 mol NH3。在该反应中,各物质的化学计量数之比、发生化学变化的物质的量之比、发生化学变化的物质的量浓度之比、各物质表示的化学反应速率之比如下: 可以看出,各物质所占有的体积及反应所用的时间均相同,所以各物质的化学计量数之比=发生变化的物质的量之比=发生变化的物质的量浓度之比=化学反应速率之比。
二、理解化学反应速率时要注意的几个问题
1.无论是反应物还是生成物,其化学反应速率的值都取正值。
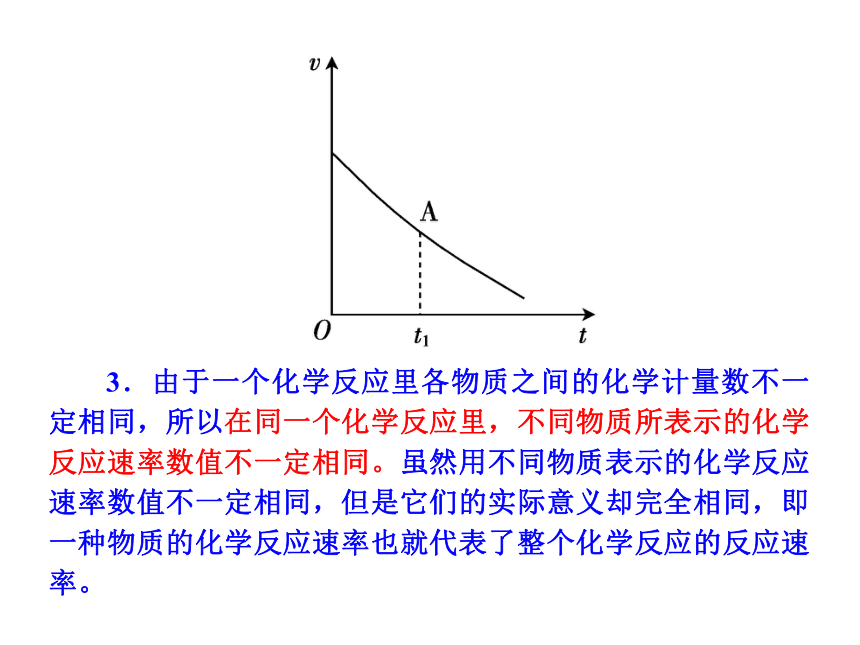
2.对于给定的一个化学反应,有关的物质的量是不断变化的,因此化学反应速率有平均速率和即时(瞬时)速率之分。在中学化学里,我们能够计算的是单位时间内的反应速率,即平均速率,而在速率图像上的每一个点则表示的是瞬时速率。如右图表示的是一定量的碳酸氢钠在盐酸中反应的速率—时间曲线,曲线中的每一个点表示该时刻的瞬时速率,如A点表示t1时刻的反应速率。
3.由于一个化学反应里各物质之间的化学计量数不一定相同,所以在同一个化学反应里,不同物质所表示的化学反应速率数值不一定相同。虽然用不同物质表示的化学反应速率数值不一定相同,但是它们的实际意义却完全相同,即一种物质的化学反应速率也就代表了整个化学反应的反应速率。 4.在一定温度下,纯固态和纯液态物质,单位体积里的物质的量保持不变,因此液态或固态纯物质物质的量浓度可以看成常数,所以不能用纯固体或纯液体来表示化学反应的反应速率。
[特别提醒]
在比较化学反应速率的大小时,不能简单直接地进行数据比较,要做到反应速率的单位一致,对应物质的化学计量数相同,或换算成同一物质的反应速率后再进行比较。
知识点1:化学反应速率的计算
例1 在一密闭的容器里装有氮气和氢气。反应开始时,氮气的浓度为2 mol·L-1,氢气的浓度为5 mol·L-1,反应开始2 min后,测得容器中氮气的浓度为1.8 mol·L-1。这2min内氮气的平均反应速率是多少?氢气和氨气的平均反应速率各是多少?
解析 N2+3H2? ?2NH3
起始浓度(mol·L-1) 2 5
2 min后浓度(mol·L-1) 1.8
变化浓度(mol·L-1) 0.2
用氮气的浓度变化表示的反应速率是:
v(N2)= =0.1 mol·L-1·min-1
根据各物质的化学反应速率之比等于化学计量数之比,用氢气和氨气的浓度变化表示的反应速率分别是:
v(H2)=v(N2)× =0.1 mol·L-1·min-1× =0.3 mol·L-1·min-1
v(NH3)=v(N2)× =0.1 mol·L-1·min-1× =0.2 mol·L-1·min-1。
跟踪练习1 将化合物A的蒸气1 mol通入0.5 L 的容器中加热,发生反应:2A(g)??B(g)+nC(g)。反应到3 min时,容器内A的浓度为0.8 mol·L-1,通过测定得这段时间内的平均速率v(C)=0.6 mol·L-1·min-1,则化学方程式中的n值为________________,用物质B表示这段时间的平均速率v(B)=________________。
答案 3;0.2 mol·L-1·min-1 知识点2:判断化学反应速率的快慢
例2 反应:A+3B=2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15 mol·L-1·min-1,②v(B)=0.01 mol·L-1·s-1,③v(C)=0.40 mol·L-1·min-1,④v(D)=0.45 mol·L-1·min-1,该反应进行的快慢顺序为________________(填序号)。
解析 比较四种不同情况下反应速率的快慢,需要用同一物质的变化来表示。
v(A)∶v(B)∶v(C)∶v(D)=1∶3∶2∶2,转化为用A的浓度变化来表示的反应速率为:①v(A)=0.15 mol·L-1·min-1;②v(B)=0.01
mol·L-1·s-1=0.6 mol·L-1·min-1,则v(A)= v(B)=0.20 mol·L-1·min-1;
③v(C)=0.40 mol·L-1·min-1,则v(A)= v(C)=0.20 mol·L-1·min-1;④
v(D)=0.45 mol·L-1·min-1,则v(A)= v(D)=0.225 mol·L-1·min-1。故
反应进行的快慢顺序为:④>②=③>①。
答案 ④>②=③>① 跟踪练习2 甲、乙两个容器内都在进行A→B的反应,甲中每分钟减少4 mol A,乙中每分钟减少2 mol A,则两容器中的反应速率( )
A.甲快 B.乙快 C.相等 D.无法确定
答案 D
知识点3:化学方程式的推断
例3 某温度时,在2 L的容器中,
X、Y、Z三种物质的物质的量随时间
变化的曲线如下图所示。则由图中数
据分析可知:该反应的化学方程式为
____________________;反应开始至
2 min时,用Z表示的平均反应速率为
________________________。 解析 由图可知,X、Y的物质的量随反应的进行而减小,Z的物质的量随反应的进行而增大,则X和Y为反应物,Z为生成物。且2 min后,X、Y、Z三种物质的物质的量不再发生改变,则可确定该反应为可逆反应。
Δn(X)=1.0 mol-0.7 mol=0.3 mol
Δn(Y)=1.0 mol-0.9 mol=0.1 mol
Δn(Z)=0.2 mol-0=0.2 mol
Δn(X)∶Δn(Y)∶Δn(Z)
=0.3 mol∶0.1 mol∶0.2 mol
=3∶1∶2
故反应的化学方程式为:
3X+Y??2Z
v(Z)= =0.05 mol·L-1·min-1
答案 3X+Y 2Z;0.05 mol·L-1·min-1
跟踪练习3 在一定条件下,反应:mA+nB=pC中各物质的化学反应速率分别为:
v(A)=a mol·L-1·s-1,
v(B)= mol·L-1·s-1,
v(C)=a mol·L-1·s-1,
则该反应的化学方程式是________________________。
答案 2A+B=2C归纳总结
第一节 化学反应速率
三维目标 思维激活
在我们熟悉的化学反应中,有的反应可以瞬间完成,如沉淀反应、中和反应等,但有的反应很慢,如煤的形成、石油的形成等。如何来表示这些反应的快慢呢?
自学导引
一、化学反应速率
1.化学反应速率的概念
在容积不变的反应器中,通常用单位时间内反应物浓度的减少或生成物浓度的增加来表示化学反应速率。
2.化学反应速率的数学表达式v=
(1)化学反应速率的符号是v,Δc=|c始-c末|表示反应过程中,其反应物减少的浓度或生成物增加的浓度的绝对值.(2)单位:mol/L.h 、mol/L.min 、mol/L.s 思考题 同一反应,用不同物质的物质的量浓度变化所表示的反应速率的数值可能不同。为什么?
答案 在一个化学反应里,各物质的化学计量数不一定相同,则单位时间内不同物质的物质的量浓度变化量就可能不同,所以用不同物质所表示的化学反应速率的数值就不一定相同。
二、化学反应速率的测定
化学反应的速率是通过实验来测定的。包括能够直接观察的某些性质,如释放出气体的体积和体系的压强;也包括必须依靠仪器来测量的性质,如颜色的深浅、光的吸收、光的发射、导电能力等。在溶液中常常利用颜色深浅和显色物质浓度间的正比关系来跟踪反应的过程和测量反应的速率。 名师解惑
一、化学反应速率的计算规律
在1 L固定容积的容器中发生反应:N2+3H2??2NH3,在1 min内2 mol N2与6 mol H2反应生成了4 mol NH3。在该反应中,各物质的化学计量数之比、发生化学变化的物质的量之比、发生化学变化的物质的量浓度之比、各物质表示的化学反应速率之比如下: 可以看出,各物质所占有的体积及反应所用的时间均相同,所以各物质的化学计量数之比=发生变化的物质的量之比=发生变化的物质的量浓度之比=化学反应速率之比。
二、理解化学反应速率时要注意的几个问题
1.无论是反应物还是生成物,其化学反应速率的值都取正值。
2.对于给定的一个化学反应,有关的物质的量是不断变化的,因此化学反应速率有平均速率和即时(瞬时)速率之分。在中学化学里,我们能够计算的是单位时间内的反应速率,即平均速率,而在速率图像上的每一个点则表示的是瞬时速率。如右图表示的是一定量的碳酸氢钠在盐酸中反应的速率—时间曲线,曲线中的每一个点表示该时刻的瞬时速率,如A点表示t1时刻的反应速率。
3.由于一个化学反应里各物质之间的化学计量数不一定相同,所以在同一个化学反应里,不同物质所表示的化学反应速率数值不一定相同。虽然用不同物质表示的化学反应速率数值不一定相同,但是它们的实际意义却完全相同,即一种物质的化学反应速率也就代表了整个化学反应的反应速率。 4.在一定温度下,纯固态和纯液态物质,单位体积里的物质的量保持不变,因此液态或固态纯物质物质的量浓度可以看成常数,所以不能用纯固体或纯液体来表示化学反应的反应速率。
[特别提醒]
在比较化学反应速率的大小时,不能简单直接地进行数据比较,要做到反应速率的单位一致,对应物质的化学计量数相同,或换算成同一物质的反应速率后再进行比较。
知识点1:化学反应速率的计算
例1 在一密闭的容器里装有氮气和氢气。反应开始时,氮气的浓度为2 mol·L-1,氢气的浓度为5 mol·L-1,反应开始2 min后,测得容器中氮气的浓度为1.8 mol·L-1。这2min内氮气的平均反应速率是多少?氢气和氨气的平均反应速率各是多少?
解析 N2+3H2? ?2NH3
起始浓度(mol·L-1) 2 5
2 min后浓度(mol·L-1) 1.8
变化浓度(mol·L-1) 0.2
用氮气的浓度变化表示的反应速率是:
v(N2)= =0.1 mol·L-1·min-1
根据各物质的化学反应速率之比等于化学计量数之比,用氢气和氨气的浓度变化表示的反应速率分别是:
v(H2)=v(N2)× =0.1 mol·L-1·min-1× =0.3 mol·L-1·min-1
v(NH3)=v(N2)× =0.1 mol·L-1·min-1× =0.2 mol·L-1·min-1。
跟踪练习1 将化合物A的蒸气1 mol通入0.5 L 的容器中加热,发生反应:2A(g)??B(g)+nC(g)。反应到3 min时,容器内A的浓度为0.8 mol·L-1,通过测定得这段时间内的平均速率v(C)=0.6 mol·L-1·min-1,则化学方程式中的n值为________________,用物质B表示这段时间的平均速率v(B)=________________。
答案 3;0.2 mol·L-1·min-1 知识点2:判断化学反应速率的快慢
例2 反应:A+3B=2C+2D在四种不同情况下的反应速率分别为:
①v(A)=0.15 mol·L-1·min-1,②v(B)=0.01 mol·L-1·s-1,③v(C)=0.40 mol·L-1·min-1,④v(D)=0.45 mol·L-1·min-1,该反应进行的快慢顺序为________________(填序号)。
解析 比较四种不同情况下反应速率的快慢,需要用同一物质的变化来表示。
v(A)∶v(B)∶v(C)∶v(D)=1∶3∶2∶2,转化为用A的浓度变化来表示的反应速率为:①v(A)=0.15 mol·L-1·min-1;②v(B)=0.01
mol·L-1·s-1=0.6 mol·L-1·min-1,则v(A)= v(B)=0.20 mol·L-1·min-1;
③v(C)=0.40 mol·L-1·min-1,则v(A)= v(C)=0.20 mol·L-1·min-1;④
v(D)=0.45 mol·L-1·min-1,则v(A)= v(D)=0.225 mol·L-1·min-1。故
反应进行的快慢顺序为:④>②=③>①。
答案 ④>②=③>① 跟踪练习2 甲、乙两个容器内都在进行A→B的反应,甲中每分钟减少4 mol A,乙中每分钟减少2 mol A,则两容器中的反应速率( )
A.甲快 B.乙快 C.相等 D.无法确定
答案 D
知识点3:化学方程式的推断
例3 某温度时,在2 L的容器中,
X、Y、Z三种物质的物质的量随时间
变化的曲线如下图所示。则由图中数
据分析可知:该反应的化学方程式为
____________________;反应开始至
2 min时,用Z表示的平均反应速率为
________________________。 解析 由图可知,X、Y的物质的量随反应的进行而减小,Z的物质的量随反应的进行而增大,则X和Y为反应物,Z为生成物。且2 min后,X、Y、Z三种物质的物质的量不再发生改变,则可确定该反应为可逆反应。
Δn(X)=1.0 mol-0.7 mol=0.3 mol
Δn(Y)=1.0 mol-0.9 mol=0.1 mol
Δn(Z)=0.2 mol-0=0.2 mol
Δn(X)∶Δn(Y)∶Δn(Z)
=0.3 mol∶0.1 mol∶0.2 mol
=3∶1∶2
故反应的化学方程式为:
3X+Y??2Z
v(Z)= =0.05 mol·L-1·min-1
答案 3X+Y 2Z;0.05 mol·L-1·min-1
跟踪练习3 在一定条件下,反应:mA+nB=pC中各物质的化学反应速率分别为:
v(A)=a mol·L-1·s-1,
v(B)= mol·L-1·s-1,
v(C)=a mol·L-1·s-1,
则该反应的化学方程式是________________________。
答案 2A+B=2C归纳总结
