第3章物质构成的奥秘单元测试题--2022-2023学年九年级化学沪教版(全国)上册(word版有答案)
文档属性
| 名称 | 第3章物质构成的奥秘单元测试题--2022-2023学年九年级化学沪教版(全国)上册(word版有答案) |  | |
| 格式 | zip | ||
| 文件大小 | 111.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-13 18:29:35 | ||
图片预览


文档简介
第3章物质构成的奥秘单元测试题--2022-2023学年九年级化学沪教版(全国)上册
1.防疫期间常用酒精消毒,在消毒过程中我们能闻到酒精散发出的特殊气味,主要是因为
A.分子的体积很小 B.分子间有间隔
C.分子在不断运动 D.分子可以再分
2.《Science》杂志报道,科学家合成了一种环状碳分子C18,这种分子具有广泛的应用前景。1个环状碳分子C18中共含有18个( )
A.原子 B.质子 C.中子 D.电子
3.下列物质中,由原子构成的是
A.酒精 B.铜 C.食盐 D.水
4.亚硝酸钠(NaNO2)外观与食盐相似,误食会引起食物中毒,不能作为食品添加剂,亚硝酸钠中氮元素化合价为( )
A.+5 B.+3 C.-3 D.+4
5.下列物质的名称与化学式对应不正确 的是
A.氯化铁 FeCl2 B.碳酸钙 CaCO3 C.氧化铝 Al2O3 D.氯化钠 NaCl
6.下列物质的分类不正确的是
A.空气污染物:SO2、CO2、NO B.混合物:食盐水、空气、自来水
C.单质:氢气、氮气、金刚石 D.氧化物:水、氧化铜、四氧化三铁
7.通过学习化学我们学会了从化学的视角认识水,下列对水的认识错误的是
A.水由氢气和氧气组成
B.冰中的水分子也在不断运动
C.硬水中含有较多可溶性钙,镁化合物
D.沉淀过滤蒸馏等净水操作中,蒸馏的净水程度最高
8.下列符号和数字与描述相符是( )
A.一个镁离子:Mg+2 B.两个铁离子:2Fe2+
C.三个氨分子:3NH3 D.结构示意图为,其质子数为10
9.一氯胺(NH2Cl)是国家新版(生活饮用水卫生标准》中新增的一种消毒剂,下列关于一氯胺的说法中,正确的是
A.一氯胺是氧化物 B.一氯胺的相对分子质量为51.5g
C.一氯胺由三种元素组成 D.一氯胺中氮元素的质量分数最高
10.科学家因锂离子电池发展的研究获诺贝尔化学奖。结合图示,有关锂的说法正确的是
A.属于非金属元素
B.相对原子质量是6.941g
C. 表示核内有3个电子
D.离子符号是Li+.
11.婴儿“尿不湿”最关键的材料是聚丙烯酸钠,它是由丙烯酸(C3H4O2)与氢氧化钠经过一系列的复杂反应而制得。下列有关丙烯酸(C3H4O2)的说法正确的是
A.丙烯酸中氢元素的质量分数最大
B.丙烯酸是由碳、氢、氧三种元素组成
C.丙烯酸中碳、氢、氧元素的质量比是3:4:2
D.丙烯酸是由3个碳原子4个氢原子和2个氧原子构成
12.某过氧化氢溶液中氢元素和氧元素的质量比,经分析是1:9,现向50g该溶液中加入2g二氧化锰充分反应后,生成的氧气质量为
A.2g B.3.2g C.23.5g D.5g
13.有关如图实验的说法正确的是
A.点燃氢气前不用检验纯度
B.干冷烧杯内壁无明显变化
C.b管气体能使带火星木条复燃
D.两个实验均可证明水的组成
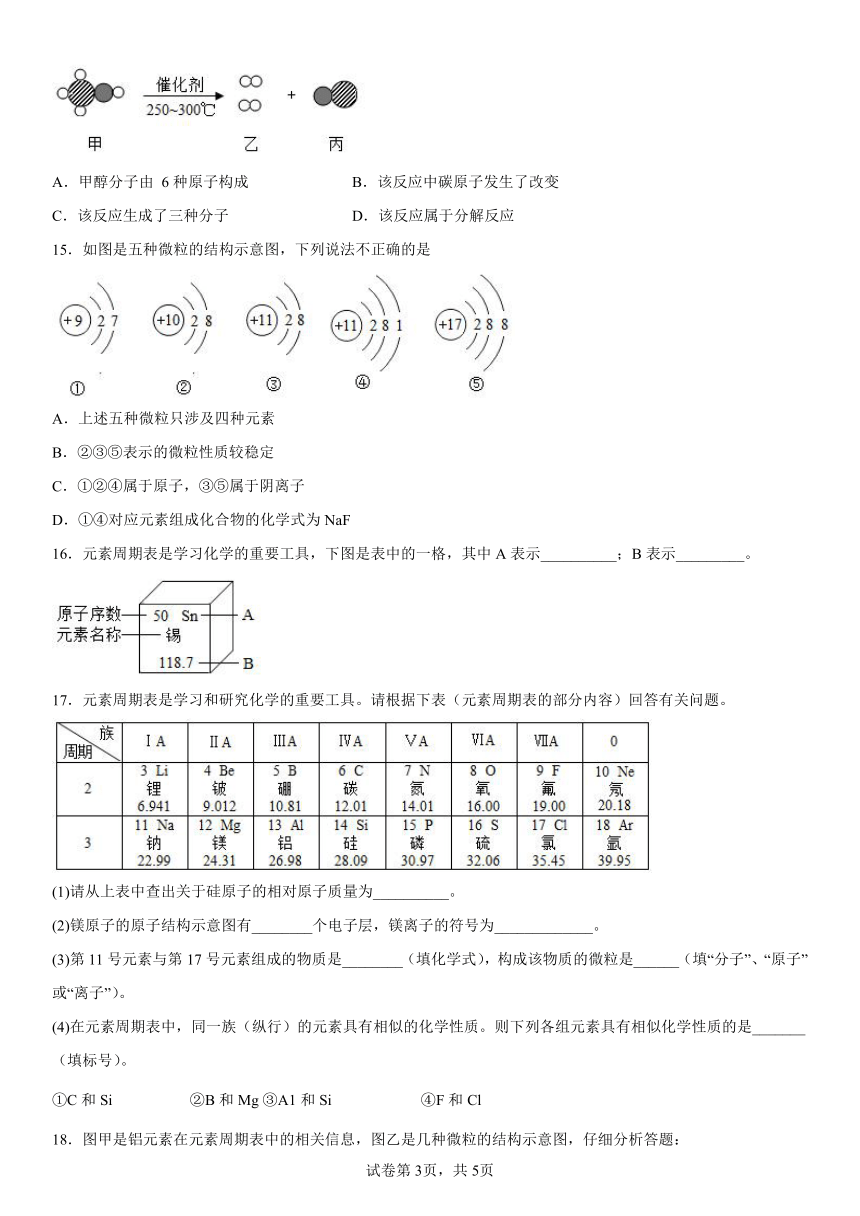
14.甲醇(CH3OH)制氢具有工艺简单 节能环保等优点 其中一种转化反应的微观示意图如图 下列有关该反应的说法正确的是
A.甲醇分子由 6种原子构成 B.该反应中碳原子发生了改变
C.该反应生成了三种分子 D.该反应属于分解反应
15.如图是五种微粒的结构示意图,下列说法不正确的是
A.上述五种微粒只涉及四种元素
B.②③⑤表示的微粒性质较稳定
C.①②④属于原子,③⑤属于阴离子
D.①④对应元素组成化合物的化学式为NaF
16.元素周期表是学习化学的重要工具,下图是表中的一格,其中A表示__________;B表示_________。
17.元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题。
(1)请从上表中查出关于硅原子的相对原子质量为__________。
(2)镁原子的原子结构示意图有________个电子层,镁离子的符号为_____________。
(3)第11号元素与第17号元素组成的物质是________(填化学式),构成该物质的微粒是______(填“分子”、“原子”或“离子”)。
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是_______(填标号)。
①C和Si ②B和Mg ③A1和Si ④F和Cl
18.图甲是铝元素在元素周期表中的相关信息,图乙是几种微粒的结构示意图,仔细分析答题:
(1)图甲中,铝元素的信息有处错误,请加以改正_________;
(2)铝原子的相对原子质量_________ ;
(3)图乙中,属于稳定结构的原子是____ (填序号, 下同);
(4)图乙中,与铝不属于同一周期元素的是_________。
19.地壳中各元素含量按从高到低的顺序,铝元素含量仅次于________;空气中能供给呼吸的物质是__________。
20.下图是部分元素周期表和锂原子结构示意图。
(1)同一周期元素的原子具有相同的_____;表中与氧元素化学性质最相似的元素是_____。
(2)写出一种与氖原子的电子层结构相同的阳离子_____(填离子符号)。
(3)锂原子第一层上的电子数为_____。
(4)锂元素与地壳中含量最多的元素形成的化合物化学式为_____。
(5)氟是最活泼的非金属元素。把氟气通入水中,与水发生反应的微观示意图如下:
①两种生成物的分子个数比为_____。
②“”所表示的物质中氢元素的质量分数为_____。
③该反应属于_____反应(填基本反应类型)。
21.用如图装置进行实验。
(1)静置,烧杯中的水逐渐变成红色,从微粒的角度解释其原因是______。
(2)继续向烧杯中加水,溶液颜色变浅。该过程中发生变化的是______(填序号)。
A 分子的种类
B 分子的大小
C 分子的间隔
22.味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl,其它成分不考虑。请回答下列问题:
(1)味精中至少含有__________(填数字)种元素。
(2)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是_________(填字母)。
A.5mL B.10 mL C.50 mL D.100 mL
(3)下图是配制过程,正确的操作顺序为_______(填字母) 。
A.①②③④ B.②①④③ C.②④①③
(4)为测定NaCl在味精中的质量分数,进行如下实验:
①向所配制的50g溶液中加入AgNO3溶液充分反应,检验沉淀是否完全的方法是:静置后,在上层清液中加入______(填化学式)溶液,观察是否有沉淀生成。
②在其它操作均正确的情况下,若在配制溶液过程中,仰视刻度量取蒸馏水,则所配制溶液中,谷氨酸钠的质量分数____(填“偏大”、“偏小”或“无影响”),所测定的味精中NaCI的质量分数___(填“偏大”、“偏小”或“无影响”)。
③精确测定AgCl沉淀质量为2.87 g,则该味精中NaCl的质量分数为___。(计算结果精确到0.1%。有关物质的相对分子质量:NaCl-58. 5 , AgCl-143. 5 )
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.A
3.B
4.B
5.A
6.A
7.A
8.C
9.C
10.D
11.B
12.D
13.D
14.D
15.C
16. (1) 元素符号 (2) 相对原子质量
17.(1)28.09
(2) 3 Mg2+
(3) NaCl 离子
(4)①④
18. (1) Al 26.98 (2) AD A
19.(1) Si (2)O2
20.(1) 电子层数 硫元素 (2)Na+、Mg2+、Al3+ 2 Li2O (3) 4:1或1:4 5% 置换
21. (1) 品红分子在不断运动 (2) C
22. (1) 6 C B (2) AgNO3 偏小 (3) 无影响 23.4%
答案第1页,共2页
答案第1页,共2页
1.防疫期间常用酒精消毒,在消毒过程中我们能闻到酒精散发出的特殊气味,主要是因为
A.分子的体积很小 B.分子间有间隔
C.分子在不断运动 D.分子可以再分
2.《Science》杂志报道,科学家合成了一种环状碳分子C18,这种分子具有广泛的应用前景。1个环状碳分子C18中共含有18个( )
A.原子 B.质子 C.中子 D.电子
3.下列物质中,由原子构成的是
A.酒精 B.铜 C.食盐 D.水
4.亚硝酸钠(NaNO2)外观与食盐相似,误食会引起食物中毒,不能作为食品添加剂,亚硝酸钠中氮元素化合价为( )
A.+5 B.+3 C.-3 D.+4
5.下列物质的名称与化学式对应不正确 的是
A.氯化铁 FeCl2 B.碳酸钙 CaCO3 C.氧化铝 Al2O3 D.氯化钠 NaCl
6.下列物质的分类不正确的是
A.空气污染物:SO2、CO2、NO B.混合物:食盐水、空气、自来水
C.单质:氢气、氮气、金刚石 D.氧化物:水、氧化铜、四氧化三铁
7.通过学习化学我们学会了从化学的视角认识水,下列对水的认识错误的是
A.水由氢气和氧气组成
B.冰中的水分子也在不断运动
C.硬水中含有较多可溶性钙,镁化合物
D.沉淀过滤蒸馏等净水操作中,蒸馏的净水程度最高
8.下列符号和数字与描述相符是( )
A.一个镁离子:Mg+2 B.两个铁离子:2Fe2+
C.三个氨分子:3NH3 D.结构示意图为,其质子数为10
9.一氯胺(NH2Cl)是国家新版(生活饮用水卫生标准》中新增的一种消毒剂,下列关于一氯胺的说法中,正确的是
A.一氯胺是氧化物 B.一氯胺的相对分子质量为51.5g
C.一氯胺由三种元素组成 D.一氯胺中氮元素的质量分数最高
10.科学家因锂离子电池发展的研究获诺贝尔化学奖。结合图示,有关锂的说法正确的是
A.属于非金属元素
B.相对原子质量是6.941g
C. 表示核内有3个电子
D.离子符号是Li+.
11.婴儿“尿不湿”最关键的材料是聚丙烯酸钠,它是由丙烯酸(C3H4O2)与氢氧化钠经过一系列的复杂反应而制得。下列有关丙烯酸(C3H4O2)的说法正确的是
A.丙烯酸中氢元素的质量分数最大
B.丙烯酸是由碳、氢、氧三种元素组成
C.丙烯酸中碳、氢、氧元素的质量比是3:4:2
D.丙烯酸是由3个碳原子4个氢原子和2个氧原子构成
12.某过氧化氢溶液中氢元素和氧元素的质量比,经分析是1:9,现向50g该溶液中加入2g二氧化锰充分反应后,生成的氧气质量为
A.2g B.3.2g C.23.5g D.5g
13.有关如图实验的说法正确的是
A.点燃氢气前不用检验纯度
B.干冷烧杯内壁无明显变化
C.b管气体能使带火星木条复燃
D.两个实验均可证明水的组成
14.甲醇(CH3OH)制氢具有工艺简单 节能环保等优点 其中一种转化反应的微观示意图如图 下列有关该反应的说法正确的是
A.甲醇分子由 6种原子构成 B.该反应中碳原子发生了改变
C.该反应生成了三种分子 D.该反应属于分解反应
15.如图是五种微粒的结构示意图,下列说法不正确的是
A.上述五种微粒只涉及四种元素
B.②③⑤表示的微粒性质较稳定
C.①②④属于原子,③⑤属于阴离子
D.①④对应元素组成化合物的化学式为NaF
16.元素周期表是学习化学的重要工具,下图是表中的一格,其中A表示__________;B表示_________。
17.元素周期表是学习和研究化学的重要工具。请根据下表(元素周期表的部分内容)回答有关问题。
(1)请从上表中查出关于硅原子的相对原子质量为__________。
(2)镁原子的原子结构示意图有________个电子层,镁离子的符号为_____________。
(3)第11号元素与第17号元素组成的物质是________(填化学式),构成该物质的微粒是______(填“分子”、“原子”或“离子”)。
(4)在元素周期表中,同一族(纵行)的元素具有相似的化学性质。则下列各组元素具有相似化学性质的是_______(填标号)。
①C和Si ②B和Mg ③A1和Si ④F和Cl
18.图甲是铝元素在元素周期表中的相关信息,图乙是几种微粒的结构示意图,仔细分析答题:
(1)图甲中,铝元素的信息有处错误,请加以改正_________;
(2)铝原子的相对原子质量_________ ;
(3)图乙中,属于稳定结构的原子是____ (填序号, 下同);
(4)图乙中,与铝不属于同一周期元素的是_________。
19.地壳中各元素含量按从高到低的顺序,铝元素含量仅次于________;空气中能供给呼吸的物质是__________。
20.下图是部分元素周期表和锂原子结构示意图。
(1)同一周期元素的原子具有相同的_____;表中与氧元素化学性质最相似的元素是_____。
(2)写出一种与氖原子的电子层结构相同的阳离子_____(填离子符号)。
(3)锂原子第一层上的电子数为_____。
(4)锂元素与地壳中含量最多的元素形成的化合物化学式为_____。
(5)氟是最活泼的非金属元素。把氟气通入水中,与水发生反应的微观示意图如下:
①两种生成物的分子个数比为_____。
②“”所表示的物质中氢元素的质量分数为_____。
③该反应属于_____反应(填基本反应类型)。
21.用如图装置进行实验。
(1)静置,烧杯中的水逐渐变成红色,从微粒的角度解释其原因是______。
(2)继续向烧杯中加水,溶液颜色变浅。该过程中发生变化的是______(填序号)。
A 分子的种类
B 分子的大小
C 分子的间隔
22.味精是常用的调味品,它的鲜味来自于其中的主要成分“谷氨酸钠”(化学式是C5H8NO4Na,易溶于水,与AgNO3不反应),另外还含有NaCl,其它成分不考虑。请回答下列问题:
(1)味精中至少含有__________(填数字)种元素。
(2)称取5.0g味精配制成50g溶液,量取蒸馏水的量筒规格是_________(填字母)。
A.5mL B.10 mL C.50 mL D.100 mL
(3)下图是配制过程,正确的操作顺序为_______(填字母) 。
A.①②③④ B.②①④③ C.②④①③
(4)为测定NaCl在味精中的质量分数,进行如下实验:
①向所配制的50g溶液中加入AgNO3溶液充分反应,检验沉淀是否完全的方法是:静置后,在上层清液中加入______(填化学式)溶液,观察是否有沉淀生成。
②在其它操作均正确的情况下,若在配制溶液过程中,仰视刻度量取蒸馏水,则所配制溶液中,谷氨酸钠的质量分数____(填“偏大”、“偏小”或“无影响”),所测定的味精中NaCI的质量分数___(填“偏大”、“偏小”或“无影响”)。
③精确测定AgCl沉淀质量为2.87 g,则该味精中NaCl的质量分数为___。(计算结果精确到0.1%。有关物质的相对分子质量:NaCl-58. 5 , AgCl-143. 5 )
试卷第1页,共3页
试卷第1页,共3页
参考答案:
1.C
2.A
3.B
4.B
5.A
6.A
7.A
8.C
9.C
10.D
11.B
12.D
13.D
14.D
15.C
16. (1) 元素符号 (2) 相对原子质量
17.(1)28.09
(2) 3 Mg2+
(3) NaCl 离子
(4)①④
18. (1) Al 26.98 (2) AD A
19.(1) Si (2)O2
20.(1) 电子层数 硫元素 (2)Na+、Mg2+、Al3+ 2 Li2O (3) 4:1或1:4 5% 置换
21. (1) 品红分子在不断运动 (2) C
22. (1) 6 C B (2) AgNO3 偏小 (3) 无影响 23.4%
答案第1页,共2页
答案第1页,共2页
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
