课题2 酸和碱的中和反应第一课时课件—2021-2022学年九年级化学人教版下册(共25张PPT)
文档属性
| 名称 | 课题2 酸和碱的中和反应第一课时课件—2021-2022学年九年级化学人教版下册(共25张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-13 00:00:00 | ||
图片预览





文档简介
(共25张PPT)
10.2.1酸和碱的中和反应
人教版初中化学—九年级上册—第十单元:酸和碱
酸与碱能否发生反应?
酸的化学通性
①酸能使指示剂变色。
②酸能和活泼金属反应放出氢气。
③酸能和某些金属氧化物反应。
......
碱的化学通性
①碱能使指示剂变色。
②碱能和某些金属氧化物反应。
......
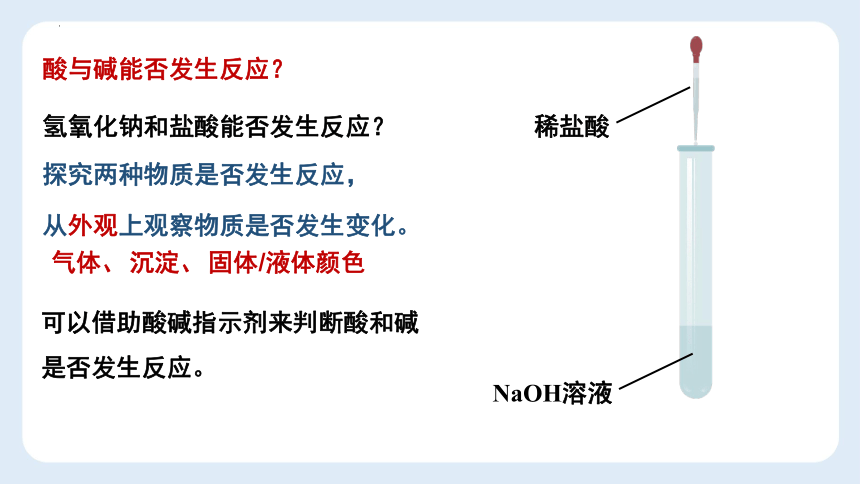
酸与碱能否发生反应?
氢氧化钠和盐酸能否发生反应?
探究两种物质是否发生反应,
可以借助酸碱指示剂来判断酸和碱
是否发生反应。
NaOH溶液
稀盐酸
从外观上观察物质是否发生变化。
气体、
沉淀、
固体/液体颜色
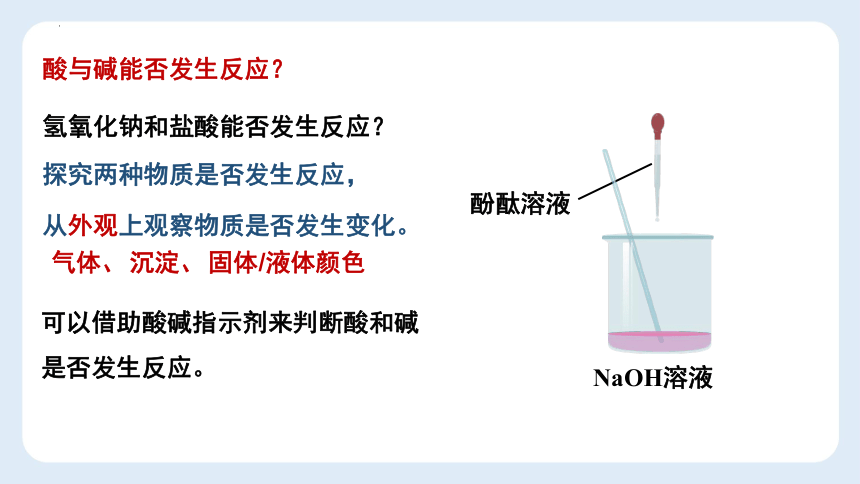
酚酞溶液
酸与碱能否发生反应?
氢氧化钠和盐酸能否发生反应?
探究两种物质是否发生反应,
可以借助酸碱指示剂来判断酸和碱
是否发生反应。
从外观上观察物质是否发生变化。
气体、
沉淀、
固体/液体颜色
NaOH溶液
稀盐酸
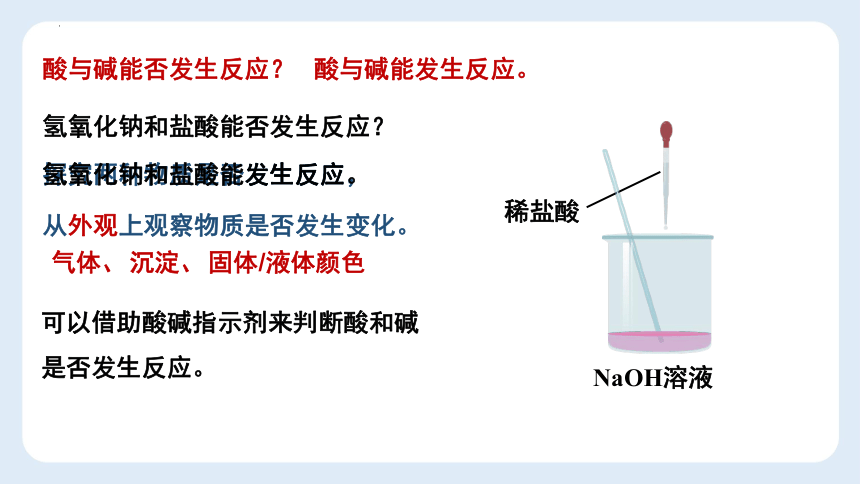
酸与碱能否发生反应?
氢氧化钠和盐酸能否发生反应?
探究两种物质是否发生反应,
可以借助酸碱指示剂来判断酸和碱
是否发生反应。
从外观上观察物质是否发生变化。
气体、
沉淀、
固体/液体颜色
NaOH溶液
氢氧化钠和盐酸能发生反应。
酸与碱能发生反应。
稀盐酸
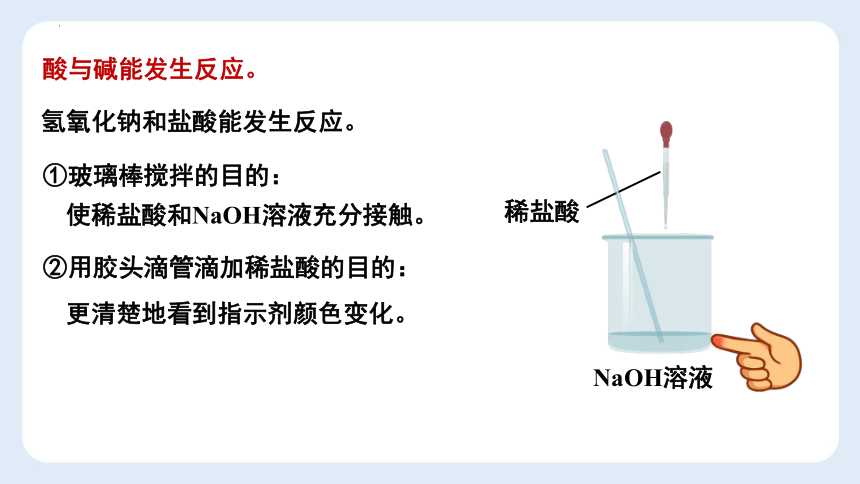
酸与碱能发生反应。
NaOH溶液
氢氧化钠和盐酸能发生反应。
①玻璃棒搅拌的目的:
使稀盐酸和NaOH溶液充分接触。
②用胶头滴管滴加稀盐酸的目的:
更清楚地看到指示剂颜色变化。
+
酸碱反应的实质:
+ 化合物[由酸根离子和金属阳离子(或NH4+)构成]
酸
H+ + 酸根离子
碱
OH- + 金属离子
(或NH4+)
酸 + 碱
+
H2O
HCI
NaOH
H+ + CI-
OH- + Na+
+
H2O
+
NaCI
HCI + NaOH =
NaCI
CI- + Na+
酸和碱反应的化学方程式的书写
Ca(OH)2 + HCI = H2O + CaCI2
酸碱反应的实质:
+ 化合物[由酸根离子和金属阳离子(或NH4+)构成]
酸 + 碱
H2O
写出Ca(OH)2和盐酸反应的化学方程式
盐
+ 化合物[由酸根离子和金属阳离子(或NH4+)构成]
酸 + 碱
H2O
NaCI
CI- + Na+
盐
金属离子
(或NH4+)
+ 酸根离子
H+和酸根离子
阳离子全都是H+
HCl、H2SO4
OH-
和金属阳离子
(或NH4+)
阴离子都是OH-
NaOH、
Ca(OH)2、
NH3·H2O
金属阳离子(或NH4+)
和酸根离子
除了金属阳离子(或NH4+)
和酸根离子还可能含有其他离子
NaCl、
NH4Cl、
NaHSO4
NH3·H2O NH4+ + OH-
NaHSO4 Na+ + SO42-+ H+
中和反应:
注意:
③中和反应放出热量。
不是中和反应
酸和碱作用生成盐和水的反应。
酸 + 碱
盐 + H2O
①酸碱反应一定生成盐和水,但有盐和水生成的反应不一定是中和反应。
CO2+Ca(OH)2 = CaCO3↓+H2O
②并不是所有的中和反应都是无明显现象的。
H2SO4+Ba(OH)2 = BaSO4↓+2H2O
难溶于水、难溶于酸
Ba(OH)2溶液
稀盐酸
稀盐酸
例:实验室有瓶标签模糊的烧碱溶液,小军测量其溶质质量分数的操作如下:
①取一洁净的锥形瓶称量,其质量为25.5g,往其中注入一定量上述烧碱溶液,
并滴入1滴酚酞溶液后,又称量锥形瓶,质量为37.5g;
②取质量分数为24.5%的稀硫酸逐滴滴入上述锥形瓶中,边滴边振荡,当观察
到溶液由红色变为无色时,停止滴液。再次称量锥形瓶,质量为51.0g。
请解答下列问题:
(1)所取烧碱溶液的质量= g。(注:滴入酚酞的质量忽略不计)
(2)反应所消耗的稀硫酸质量= g。
(3)通过计算确定该瓶烧碱溶液的溶质质量分数。(列出计算过程)
12
13.5
该瓶烧碱溶液的溶质质量分数为22.5%
中和反应:
注意:
③中和反应放出热量。
不是中和反应
酸和碱作用生成盐和水的反应。
酸 + 碱
盐 + H2O
①酸碱反应一定生成盐和水,但有盐和水生成的反应不一定是中和反应。
CO2+Ca(OH)2 = CaCO3↓+H2O
②并不是所有的中和反应都是无明显现象的。
H2SO4+Ba(OH)2 = BaSO4↓+2H2O
难溶于水、难溶于酸
H+和酸根离子
阳离子全都是H+
HCl、H2SO4
OH-
和金属阳离子
(或NH4+)
阴离子都是OH-
NaOH、
Ca(OH)2、
NH3·H2O
金属阳离子(或NH4+)
和酸根离子
除了金属阳离子(或NH4+)
和酸根离子还可能含有其他离子
NaCl、
NH4Cl、
NaHSO4
酸的化学通性
①酸能使指示剂变色。
②酸能和活泼金属反应放出氢气。
③酸能和某些金属氧化物反应。
......
碱的化学通性
①碱能使指示剂变色。
②碱能和某些金属氧化物反应。
......
④酸能和碱发生中和反应。
③碱能和酸发生中和反应。
1、调节土壤的酸碱性
农作物一般适宜在中性或者接近中性的土壤中生长。
人们可加入适量的熟石灰以中和土壤的酸性。
人们可加入适量的碳酸水以中和土壤的碱性。
①若土壤呈酸性,不利于农作物生长,
②若土壤呈碱性,不利于农作物生长,
工业生产伴随废气、废液、废渣。
2、处理工厂的废水
①硫酸厂的污水中含有H2SO4等物质,可选择用熟石灰来处理这种废液。
H2SO4+Ca(OH)2 = CaSO4+2H2O
②印染厂的废液中大多含有NaOH等物质,可选择用废硫酸等进行中和。
H2SO4+2NaOH = Na2SO4+2H2O
3、用于医药
①含有Al(OH)3或Mg(OH)2的药物可以治疗胃酸过多。
Al(OH)3+3HCl=AlCl3+3H2O
Mg(OH)2+2HCl= MgCl2+2H2O
②蚊虫在人体的皮肤内可以分泌出蚁酸,
注意:
Al(OH)3是过去常用的治疗胃酸过多的药物,
但是反应得到的Al3+对人体有不良作用,
所以已经逐渐被其他药物取代。
涂一些含有碱性物质的药水、牙膏、肥皂水可减轻被蚊虫叮咬的痛痒。
使叮咬处很快肿成大包而痛痒。
4.生活中的应用
洗发时大多先用弱碱性的洗发剂,
后用弱酸性的护发素。
例:下列实际应用中,利用中和反应原理的是( )
①用氢氧化钠溶液处理泄漏的浓硫酸
②用碳酸氢钠治疗胃酸过多
③用熟石灰改良酸性土壤
④用稀氨水涂抹在蚊子叮咬处止痒
A.①② B.①②③④ C.②③ D.①③④
D
注意:在实际生活生产中,并不仅仅考虑化学原理就可以随意选用酸或者碱。
②含有Al(OH)3或Mg(OH)2的药物可以治疗胃酸过多,一定不能使用NaOH或者Ca(OH)2。
①酸性土壤可使用熟石灰来调节土壤的酸碱性,但一定不能
使用具有腐蚀性的NaOH。
1、调节土壤的酸碱性
①若土壤呈酸性,不利于农作物生长,人们可加入适量的熟石灰以中和土壤的酸性。
②若土壤呈碱性,不利于农作物生长,人们可加入适量的碳酸水以中和土壤的碱性。
2、处理工厂的废水
①硫酸厂的污水中含有H2SO4等物质,可选择用熟石灰来处理这种废液。
②印染厂的废液中大多含有NaOH等物质,可选择用废硫酸等进行中和。
3、用于医药
①含有Al(OH)3或Mg(OH)2的药物可以治疗胃酸过多。
②涂一些含有碱性物质的药水、牙膏、肥皂水可减轻被蚊虫叮咬的痛痒
4.生活中的应用
洗发时大多先用弱碱性的洗发剂,后用显弱酸性的护发素。
Thanks
10.2.1酸和碱的中和反应
人教版初中化学—九年级上册—第十单元:酸和碱
酸与碱能否发生反应?
酸的化学通性
①酸能使指示剂变色。
②酸能和活泼金属反应放出氢气。
③酸能和某些金属氧化物反应。
......
碱的化学通性
①碱能使指示剂变色。
②碱能和某些金属氧化物反应。
......
酸与碱能否发生反应?
氢氧化钠和盐酸能否发生反应?
探究两种物质是否发生反应,
可以借助酸碱指示剂来判断酸和碱
是否发生反应。
NaOH溶液
稀盐酸
从外观上观察物质是否发生变化。
气体、
沉淀、
固体/液体颜色
酚酞溶液
酸与碱能否发生反应?
氢氧化钠和盐酸能否发生反应?
探究两种物质是否发生反应,
可以借助酸碱指示剂来判断酸和碱
是否发生反应。
从外观上观察物质是否发生变化。
气体、
沉淀、
固体/液体颜色
NaOH溶液
稀盐酸
酸与碱能否发生反应?
氢氧化钠和盐酸能否发生反应?
探究两种物质是否发生反应,
可以借助酸碱指示剂来判断酸和碱
是否发生反应。
从外观上观察物质是否发生变化。
气体、
沉淀、
固体/液体颜色
NaOH溶液
氢氧化钠和盐酸能发生反应。
酸与碱能发生反应。
稀盐酸
酸与碱能发生反应。
NaOH溶液
氢氧化钠和盐酸能发生反应。
①玻璃棒搅拌的目的:
使稀盐酸和NaOH溶液充分接触。
②用胶头滴管滴加稀盐酸的目的:
更清楚地看到指示剂颜色变化。
+
酸碱反应的实质:
+ 化合物[由酸根离子和金属阳离子(或NH4+)构成]
酸
H+ + 酸根离子
碱
OH- + 金属离子
(或NH4+)
酸 + 碱
+
H2O
HCI
NaOH
H+ + CI-
OH- + Na+
+
H2O
+
NaCI
HCI + NaOH =
NaCI
CI- + Na+
酸和碱反应的化学方程式的书写
Ca(OH)2 + HCI = H2O + CaCI2
酸碱反应的实质:
+ 化合物[由酸根离子和金属阳离子(或NH4+)构成]
酸 + 碱
H2O
写出Ca(OH)2和盐酸反应的化学方程式
盐
+ 化合物[由酸根离子和金属阳离子(或NH4+)构成]
酸 + 碱
H2O
NaCI
CI- + Na+
盐
金属离子
(或NH4+)
+ 酸根离子
H+和酸根离子
阳离子全都是H+
HCl、H2SO4
OH-
和金属阳离子
(或NH4+)
阴离子都是OH-
NaOH、
Ca(OH)2、
NH3·H2O
金属阳离子(或NH4+)
和酸根离子
除了金属阳离子(或NH4+)
和酸根离子还可能含有其他离子
NaCl、
NH4Cl、
NaHSO4
NH3·H2O NH4+ + OH-
NaHSO4 Na+ + SO42-+ H+
中和反应:
注意:
③中和反应放出热量。
不是中和反应
酸和碱作用生成盐和水的反应。
酸 + 碱
盐 + H2O
①酸碱反应一定生成盐和水,但有盐和水生成的反应不一定是中和反应。
CO2+Ca(OH)2 = CaCO3↓+H2O
②并不是所有的中和反应都是无明显现象的。
H2SO4+Ba(OH)2 = BaSO4↓+2H2O
难溶于水、难溶于酸
Ba(OH)2溶液
稀盐酸
稀盐酸
例:实验室有瓶标签模糊的烧碱溶液,小军测量其溶质质量分数的操作如下:
①取一洁净的锥形瓶称量,其质量为25.5g,往其中注入一定量上述烧碱溶液,
并滴入1滴酚酞溶液后,又称量锥形瓶,质量为37.5g;
②取质量分数为24.5%的稀硫酸逐滴滴入上述锥形瓶中,边滴边振荡,当观察
到溶液由红色变为无色时,停止滴液。再次称量锥形瓶,质量为51.0g。
请解答下列问题:
(1)所取烧碱溶液的质量= g。(注:滴入酚酞的质量忽略不计)
(2)反应所消耗的稀硫酸质量= g。
(3)通过计算确定该瓶烧碱溶液的溶质质量分数。(列出计算过程)
12
13.5
该瓶烧碱溶液的溶质质量分数为22.5%
中和反应:
注意:
③中和反应放出热量。
不是中和反应
酸和碱作用生成盐和水的反应。
酸 + 碱
盐 + H2O
①酸碱反应一定生成盐和水,但有盐和水生成的反应不一定是中和反应。
CO2+Ca(OH)2 = CaCO3↓+H2O
②并不是所有的中和反应都是无明显现象的。
H2SO4+Ba(OH)2 = BaSO4↓+2H2O
难溶于水、难溶于酸
H+和酸根离子
阳离子全都是H+
HCl、H2SO4
OH-
和金属阳离子
(或NH4+)
阴离子都是OH-
NaOH、
Ca(OH)2、
NH3·H2O
金属阳离子(或NH4+)
和酸根离子
除了金属阳离子(或NH4+)
和酸根离子还可能含有其他离子
NaCl、
NH4Cl、
NaHSO4
酸的化学通性
①酸能使指示剂变色。
②酸能和活泼金属反应放出氢气。
③酸能和某些金属氧化物反应。
......
碱的化学通性
①碱能使指示剂变色。
②碱能和某些金属氧化物反应。
......
④酸能和碱发生中和反应。
③碱能和酸发生中和反应。
1、调节土壤的酸碱性
农作物一般适宜在中性或者接近中性的土壤中生长。
人们可加入适量的熟石灰以中和土壤的酸性。
人们可加入适量的碳酸水以中和土壤的碱性。
①若土壤呈酸性,不利于农作物生长,
②若土壤呈碱性,不利于农作物生长,
工业生产伴随废气、废液、废渣。
2、处理工厂的废水
①硫酸厂的污水中含有H2SO4等物质,可选择用熟石灰来处理这种废液。
H2SO4+Ca(OH)2 = CaSO4+2H2O
②印染厂的废液中大多含有NaOH等物质,可选择用废硫酸等进行中和。
H2SO4+2NaOH = Na2SO4+2H2O
3、用于医药
①含有Al(OH)3或Mg(OH)2的药物可以治疗胃酸过多。
Al(OH)3+3HCl=AlCl3+3H2O
Mg(OH)2+2HCl= MgCl2+2H2O
②蚊虫在人体的皮肤内可以分泌出蚁酸,
注意:
Al(OH)3是过去常用的治疗胃酸过多的药物,
但是反应得到的Al3+对人体有不良作用,
所以已经逐渐被其他药物取代。
涂一些含有碱性物质的药水、牙膏、肥皂水可减轻被蚊虫叮咬的痛痒。
使叮咬处很快肿成大包而痛痒。
4.生活中的应用
洗发时大多先用弱碱性的洗发剂,
后用弱酸性的护发素。
例:下列实际应用中,利用中和反应原理的是( )
①用氢氧化钠溶液处理泄漏的浓硫酸
②用碳酸氢钠治疗胃酸过多
③用熟石灰改良酸性土壤
④用稀氨水涂抹在蚊子叮咬处止痒
A.①② B.①②③④ C.②③ D.①③④
D
注意:在实际生活生产中,并不仅仅考虑化学原理就可以随意选用酸或者碱。
②含有Al(OH)3或Mg(OH)2的药物可以治疗胃酸过多,一定不能使用NaOH或者Ca(OH)2。
①酸性土壤可使用熟石灰来调节土壤的酸碱性,但一定不能
使用具有腐蚀性的NaOH。
1、调节土壤的酸碱性
①若土壤呈酸性,不利于农作物生长,人们可加入适量的熟石灰以中和土壤的酸性。
②若土壤呈碱性,不利于农作物生长,人们可加入适量的碳酸水以中和土壤的碱性。
2、处理工厂的废水
①硫酸厂的污水中含有H2SO4等物质,可选择用熟石灰来处理这种废液。
②印染厂的废液中大多含有NaOH等物质,可选择用废硫酸等进行中和。
3、用于医药
①含有Al(OH)3或Mg(OH)2的药物可以治疗胃酸过多。
②涂一些含有碱性物质的药水、牙膏、肥皂水可减轻被蚊虫叮咬的痛痒
4.生活中的应用
洗发时大多先用弱碱性的洗发剂,后用显弱酸性的护发素。
Thanks
同课章节目录
