课题2 酸和碱的中和反应第二课时酸碱度—pH课件—2021-2022学年九年级化学人教版下册(共24张PPT)
文档属性
| 名称 | 课题2 酸和碱的中和反应第二课时酸碱度—pH课件—2021-2022学年九年级化学人教版下册(共24张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 605.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-13 00:00:00 | ||
图片预览







文档简介
(共24张PPT)
10.2.2酸碱度—pH
人教版初中化学—九年级上册—第十单元:酸和碱
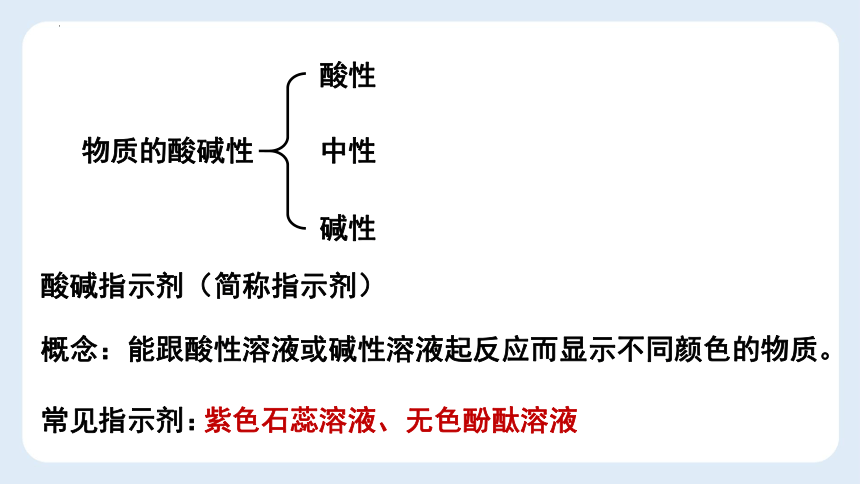
物质的酸碱性
酸性
中性
碱性
酸碱指示剂(简称指示剂)
常见指示剂:
概念:能跟酸性溶液或碱性溶液起反应而显示不同颜色的物质。
紫色石蕊溶液、无色酚酞溶液
溶液的酸碱度:
pH和溶液酸碱性的关系
如何测定溶液的pH?
酸性增强
碱性增强
中性
酸性
碱性
定量表示溶液酸碱性的强弱程度,常用pH来表示。
溶液pH的测定
pH试纸的使用方法:
最为简便的方法是使用pH试纸。
将一小片pH试纸放在白瓷板或者玻璃片上,
然后用玻璃棒蘸取溶液
滴在pH试纸上,
溶液pH的测定
pH试纸的使用方法:
把试纸显示的颜色与标准比色卡进行比较,读出该溶液的pH。
最为简便的方法是使用pH试纸。
将一小片pH试纸放在白瓷板或者玻璃片上,
然后用玻璃棒蘸取溶液
滴在pH试纸上,
取滴色比
广泛pH试纸测得某溶液的pH为4.3。
pH试纸的使用方法:
取滴色比
1、测溶液pH时,不可以直接将pH试纸浸入到待测液中。
2、pH试纸、玻璃棒不需要用蒸馏水润湿。
若待测液是酸性溶液,
润湿后测得pH偏大;
若待测液是碱性溶液,
润湿后测得pH偏小;
若待测液是中性溶液,润湿后对pH测定无影响。
3、可以用湿润的pH试纸测定气体的酸碱性。
4、广泛pH试纸测pH比较粗略,读数为0~14之间的整数。
溶液pH的测定
方法:
(又称酸度计,精确测定溶液pH的仪器)
pH试纸、
pH计
例1:下列有关pH试纸的使用说法正确的是( )
A.用pH试纸测定石灰水的pH为12.4
B.用润湿的玻璃棒蘸取待测液
C.把显色的pH试纸与标准比色卡对照读数
D.用干燥的pH试纸测定二氧化碳气体的pH
C
了解酸碱度的重要意义
4、测定人体内或者排放出的液体的pH,帮助人们了解自己的身体健康状况。
pH<4或pH>8
1、在化工生产中,许多反应都必须在一定pH的溶液中才能进行的。
2、在农业生产中,农作物一般适宜在pH等于7或者接近7的土壤中生长。
测定土壤的pH,改良酸性土壤/碱性土壤或选择更加适宜种植的植物。
酸雨:pH小于5.6的雨水。
3、测定雨水pH能了解空气污染程度。
人体正常状态下,血液pH应维持在7.3~7.4之间。
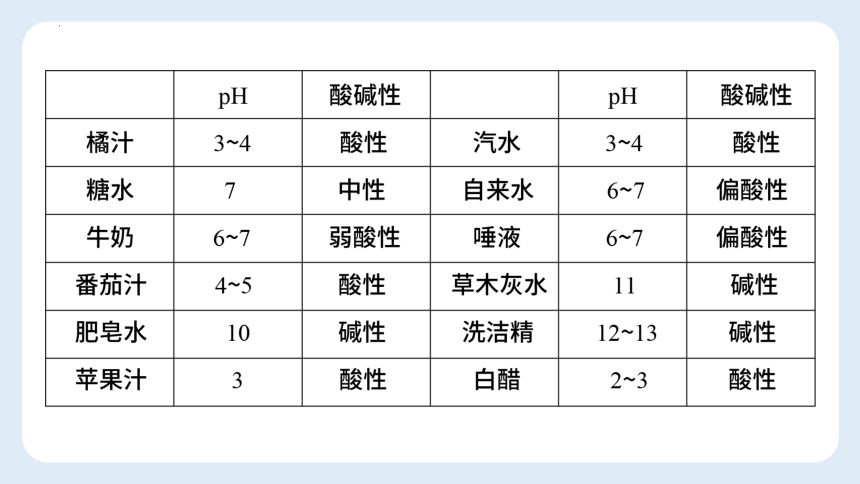
例2:几种作物适宜生长的pH范围如下表。取某地土壤浸出液,加入紫色石蕊溶液,溶液略显红色,则该土壤最不适宜种植的作物是( )
A.水稻 B.棉花 C.茶树 D.甘草
D
溶液的酸碱度:
pH和溶液酸碱性的关系
酸性增强
碱性增强
中性
酸性
碱性
定量表示溶液酸碱性的强弱程度,常用pH来表示。
溶液pH的测定
方法:
(又称酸度计,精确测定溶液pH的仪器)
pH试纸、
pH计
pH试纸的使用方法:
取滴色比
1、测溶液pH时,不可以直接将pH试纸浸入到待测液中。
2、pH试纸、玻璃棒不需要用蒸馏水润湿。
若待测液是酸性溶液,
润湿后测得pH偏大;
若待测液是碱性溶液,
润湿后测得pH偏小;
若待测液是中性溶液,润湿后对pH测定无影响。
3、可以用湿润的pH试纸测定气体的酸碱性。
4、广泛pH试纸测pH比较粗略,读数为0~14之间的整数。
了解酸碱度的重要意义
4、测定人体内或者排放出的液体的pH,帮助人们了解自己的身体健康状况。
1、在化工生产中,许多反应都必须在一定pH的溶液中才能进行的。
2、在农业生产中,农作物一般适宜在pH等于7或者接近7的土壤中生长。
测定土壤的pH,改良酸性土壤/碱性土壤或选择更加适宜种植的植物。
酸雨:pH小于5.6的雨水。
3、测定雨水pH能了解空气污染程度。
溶液的酸碱度:
定量表示溶液酸碱性的强弱程度,常用pH来表示。
pH和溶液酸碱性的关系
酸性增强
碱性增强
中性
酸性
碱性
1、溶液稀释
①酸性溶液
以稀释稀盐酸为例
pH会无限接近于7,但绝对不等于7。
酸性溶液加水稀释,浓度降低,酸性减弱,pH增大;
1、溶液稀释
①酸性溶液
②碱性溶液
③中性溶液
2、中和反应
①向酸溶液中加入碱溶液
以向稀盐酸中滴加NaOH溶液为例
NaOH不足时,
HCI+NaOH=NaCl+H2O
起始溶液成分:HCl
NaOH过量时,溶液成分:NaCl、NaOH
溶液成分:HCl、NaCl
酸碱恰好中和,溶液成分:NaCl
2、中和反应
②向碱溶液中加入酸溶液
以向NaOH溶液中滴加稀盐酸为例
稀盐酸不足时,
起始溶液成分:NaOH
稀盐酸过量时,溶液成分:HCl、NaCI
溶液成分:NaCl、NaOH
酸碱恰好中和,溶液成分:NaCl
NaOH+HCl=NaCl+H2O
2、中和反应
①向酸溶液中加入碱溶液
以向稀盐酸中滴加NaOH溶液为例
HCI+NaOH=NaCl+H2O
2、中和反应
②向碱溶液中加入酸溶液
以向NaOH溶液中滴加稀盐酸为例
NaOH+HCl=NaCl+H2O
例:如图表示稀氢氧化钠溶液与稀盐酸反应过程中温度和pH变化的曲线。下列说法正确的是( )
A.该实验是将稀盐酸滴入到稀氢氧化钠溶液中
B.稀氢氧化钠溶液与稀盐酸反应为吸热反应
C.60s时,溶液中溶质为NaOH和NaCl
D.在20s到40s之间某一时刻,两溶液恰好完全反应
C
1、溶液稀释
①酸性溶液
②碱性溶液
③中性溶液
2、中和反应
①向酸溶液中加入碱溶液
2、中和反应
②向碱溶液中加入酸溶液
Thanks
10.2.2酸碱度—pH
人教版初中化学—九年级上册—第十单元:酸和碱
物质的酸碱性
酸性
中性
碱性
酸碱指示剂(简称指示剂)
常见指示剂:
概念:能跟酸性溶液或碱性溶液起反应而显示不同颜色的物质。
紫色石蕊溶液、无色酚酞溶液
溶液的酸碱度:
pH和溶液酸碱性的关系
如何测定溶液的pH?
酸性增强
碱性增强
中性
酸性
碱性
定量表示溶液酸碱性的强弱程度,常用pH来表示。
溶液pH的测定
pH试纸的使用方法:
最为简便的方法是使用pH试纸。
将一小片pH试纸放在白瓷板或者玻璃片上,
然后用玻璃棒蘸取溶液
滴在pH试纸上,
溶液pH的测定
pH试纸的使用方法:
把试纸显示的颜色与标准比色卡进行比较,读出该溶液的pH。
最为简便的方法是使用pH试纸。
将一小片pH试纸放在白瓷板或者玻璃片上,
然后用玻璃棒蘸取溶液
滴在pH试纸上,
取滴色比
广泛pH试纸测得某溶液的pH为4.3。
pH试纸的使用方法:
取滴色比
1、测溶液pH时,不可以直接将pH试纸浸入到待测液中。
2、pH试纸、玻璃棒不需要用蒸馏水润湿。
若待测液是酸性溶液,
润湿后测得pH偏大;
若待测液是碱性溶液,
润湿后测得pH偏小;
若待测液是中性溶液,润湿后对pH测定无影响。
3、可以用湿润的pH试纸测定气体的酸碱性。
4、广泛pH试纸测pH比较粗略,读数为0~14之间的整数。
溶液pH的测定
方法:
(又称酸度计,精确测定溶液pH的仪器)
pH试纸、
pH计
例1:下列有关pH试纸的使用说法正确的是( )
A.用pH试纸测定石灰水的pH为12.4
B.用润湿的玻璃棒蘸取待测液
C.把显色的pH试纸与标准比色卡对照读数
D.用干燥的pH试纸测定二氧化碳气体的pH
C
了解酸碱度的重要意义
4、测定人体内或者排放出的液体的pH,帮助人们了解自己的身体健康状况。
pH<4或pH>8
1、在化工生产中,许多反应都必须在一定pH的溶液中才能进行的。
2、在农业生产中,农作物一般适宜在pH等于7或者接近7的土壤中生长。
测定土壤的pH,改良酸性土壤/碱性土壤或选择更加适宜种植的植物。
酸雨:pH小于5.6的雨水。
3、测定雨水pH能了解空气污染程度。
人体正常状态下,血液pH应维持在7.3~7.4之间。
例2:几种作物适宜生长的pH范围如下表。取某地土壤浸出液,加入紫色石蕊溶液,溶液略显红色,则该土壤最不适宜种植的作物是( )
A.水稻 B.棉花 C.茶树 D.甘草
D
溶液的酸碱度:
pH和溶液酸碱性的关系
酸性增强
碱性增强
中性
酸性
碱性
定量表示溶液酸碱性的强弱程度,常用pH来表示。
溶液pH的测定
方法:
(又称酸度计,精确测定溶液pH的仪器)
pH试纸、
pH计
pH试纸的使用方法:
取滴色比
1、测溶液pH时,不可以直接将pH试纸浸入到待测液中。
2、pH试纸、玻璃棒不需要用蒸馏水润湿。
若待测液是酸性溶液,
润湿后测得pH偏大;
若待测液是碱性溶液,
润湿后测得pH偏小;
若待测液是中性溶液,润湿后对pH测定无影响。
3、可以用湿润的pH试纸测定气体的酸碱性。
4、广泛pH试纸测pH比较粗略,读数为0~14之间的整数。
了解酸碱度的重要意义
4、测定人体内或者排放出的液体的pH,帮助人们了解自己的身体健康状况。
1、在化工生产中,许多反应都必须在一定pH的溶液中才能进行的。
2、在农业生产中,农作物一般适宜在pH等于7或者接近7的土壤中生长。
测定土壤的pH,改良酸性土壤/碱性土壤或选择更加适宜种植的植物。
酸雨:pH小于5.6的雨水。
3、测定雨水pH能了解空气污染程度。
溶液的酸碱度:
定量表示溶液酸碱性的强弱程度,常用pH来表示。
pH和溶液酸碱性的关系
酸性增强
碱性增强
中性
酸性
碱性
1、溶液稀释
①酸性溶液
以稀释稀盐酸为例
pH会无限接近于7,但绝对不等于7。
酸性溶液加水稀释,浓度降低,酸性减弱,pH增大;
1、溶液稀释
①酸性溶液
②碱性溶液
③中性溶液
2、中和反应
①向酸溶液中加入碱溶液
以向稀盐酸中滴加NaOH溶液为例
NaOH不足时,
HCI+NaOH=NaCl+H2O
起始溶液成分:HCl
NaOH过量时,溶液成分:NaCl、NaOH
溶液成分:HCl、NaCl
酸碱恰好中和,溶液成分:NaCl
2、中和反应
②向碱溶液中加入酸溶液
以向NaOH溶液中滴加稀盐酸为例
稀盐酸不足时,
起始溶液成分:NaOH
稀盐酸过量时,溶液成分:HCl、NaCI
溶液成分:NaCl、NaOH
酸碱恰好中和,溶液成分:NaCl
NaOH+HCl=NaCl+H2O
2、中和反应
①向酸溶液中加入碱溶液
以向稀盐酸中滴加NaOH溶液为例
HCI+NaOH=NaCl+H2O
2、中和反应
②向碱溶液中加入酸溶液
以向NaOH溶液中滴加稀盐酸为例
NaOH+HCl=NaCl+H2O
例:如图表示稀氢氧化钠溶液与稀盐酸反应过程中温度和pH变化的曲线。下列说法正确的是( )
A.该实验是将稀盐酸滴入到稀氢氧化钠溶液中
B.稀氢氧化钠溶液与稀盐酸反应为吸热反应
C.60s时,溶液中溶质为NaOH和NaCl
D.在20s到40s之间某一时刻,两溶液恰好完全反应
C
1、溶液稀释
①酸性溶液
②碱性溶液
③中性溶液
2、中和反应
①向酸溶液中加入碱溶液
2、中和反应
②向碱溶液中加入酸溶液
Thanks
同课章节目录
