第5节 物质的转化(第4课时)(课件 23张PPT)
文档属性
| 名称 | 第5节 物质的转化(第4课时)(课件 23张PPT) |  | |
| 格式 | zip | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-09-07 08:46:01 | ||
图片预览






文档简介
(共23张PPT)
浙教版 九年级上
第5节 物质的转化
(第4课时)
教材解析
【核心概念】
1.物质的结构与性质 结构与功能
【学习内容与要求】
1.4 常见的化合物
认识酸、碱、盐的主要性质
物质是不断变化的,性质决定用途。
运用酸和碱的通性及盐的性质进行物质的鉴别。
探究实践
物质的鉴别
目标
1.进一步了解酸、碱、盐和氧化物的化学性质及相互间的关系。
2.能根据物质的特征反应进行物质的鉴别。
3.进一步体验科学家通过实验研究物质性质的方法。
氯化钡溶液,硝酸银溶液,稀硝酸,碳酸钠溶液,紫色石蕊试液,酚酞试液,蒸馏水,试管 6 支。
器材
探究实践
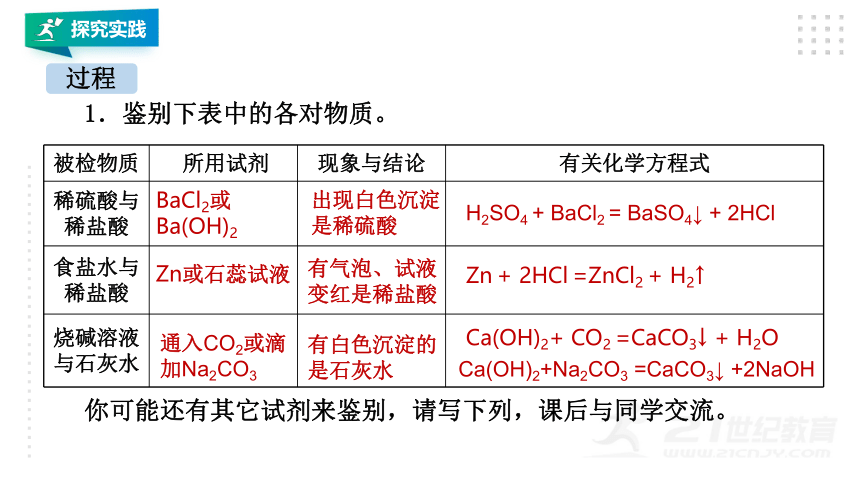
1.鉴别下表中的各对物质。
被检物质 所用试剂 现象与结论 有关化学方程式
稀硫酸与稀盐酸
食盐水与稀盐酸
烧碱溶液与石灰水
BaCl2或
Ba(OH)2
出现白色沉淀是稀硫酸
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
Zn或石蕊试液
有气泡、试液变红是稀盐酸
Zn + 2HCl =ZnCl2 + H2↑
通入CO2或滴加Na2CO3
有白色沉淀的是石灰水
Ca(OH)2+ CO2 =CaCO3↓ + H2O
Ca(OH)2+Na2CO3 =CaCO3↓ +2NaOH
过程
你可能还有其它试剂来鉴别,请写下列,课后与同学交流。
探究实践
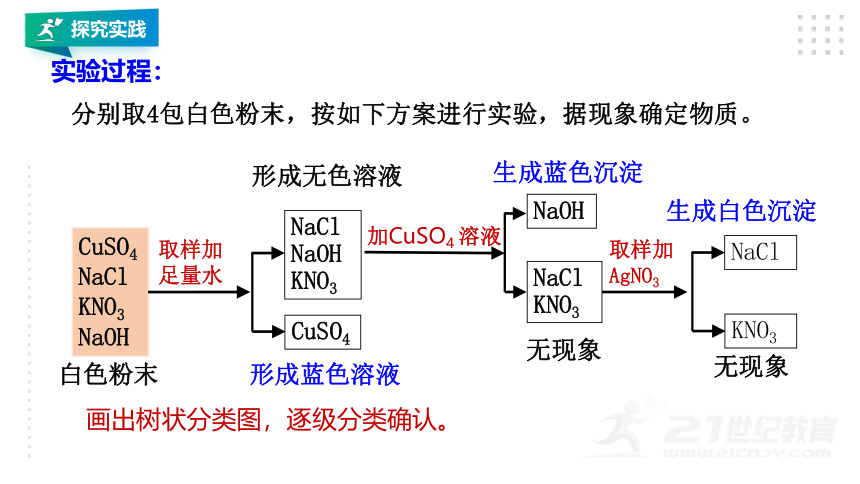
2.现有4包白色粉末,编号为A、B、C、D,它们是硫酸铜、氯化钠、硝酸钾、氢氧化钠,请通过实验,一一加以区别。
(1)设计实验方案:依据物质的性质特征,设计相应的实验方案,区别物质。
(2)按实验方案进行实验,并记录实验现象。
(3)根据实验现象,得出结论。
(4)写出实验过程中所发生反应的化学方程式。
A是_________,B是_________,
C是_________,D是_________。
探究实践
CuSO4
NaCl KNO3 NaOH
白色粉末
取样加足量水
NaCl NaOH KNO3
CuSO4
形成蓝色溶液
形成无色溶液
加CuSO4 溶液
NaOH
生成蓝色沉淀
无现象
NaCl KNO3
取样加AgNO3
生成白色沉淀
NaCl
无现象
KNO3
实验过程:
分别取4包白色粉末,按如下方案进行实验,据现象确定物质。
画出树状分类图,逐级分类确认。
探究实践
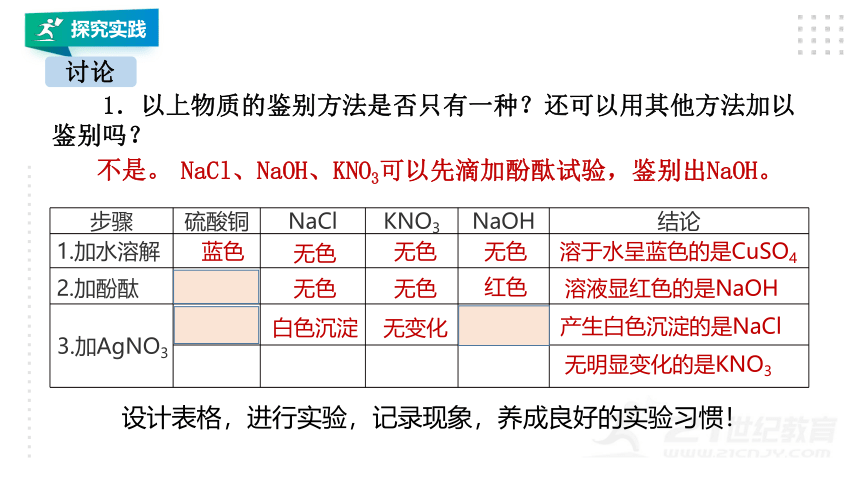
1.以上物质的鉴别方法是否只有一种?还可以用其他方法加以鉴别吗?
不是。
NaCl、NaOH、KNO3可以先滴加酚酞试验,鉴别出NaOH。
讨论
步骤 硫酸铜 NaCl KNO3 NaOH 结论
1.加水溶解
蓝色
无色
无色
无色
溶于水呈蓝色的是CuSO4
2.加酚酞
无色
无色
红色
溶液显红色的是NaOH
3.加AgNO3
白色沉淀
无变化
产生白色沉淀的是NaCl
无明显变化的是KNO3
设计表格,进行实验,记录现象,养成良好的实验习惯!
根据物质性质制作二歧分类检索表设计、进行实验,得出结论。
1a加水溶解溶液蓝色
1b加水溶解溶液无色
…………………………CuSO4
…………………………2
2a溶液中加酚酞显红色
2b溶液中加酚酞显无色
…………………………NaOH
…………………………3
3a溶液中加AgNO3溶液,产生白色沉淀
3b溶液中加AgNO3溶液,没有明显变化
…………NaCl
…………KNO3
如果还有其它方法,请写下来,课后与同学交流!
探究实践
探究实践
2.你的实验结果是否与其他组的同学不同?请找出原因。
3.只用一种试剂鉴别氯化钠、盐酸、氯化钡 三种无色溶液?
BaCl2
HCl
NaCl
加K2CO3
或Na2CO3
产生白色沉淀的是氯化钡
产生无色气体盐酸
无现象的是氯化钠
探究实践
物质的鉴别的方法
依据物质的物理性质(颜色、气味、状态、溶解性、溶于水是否放热等)的差异性分析。
1.物理方法
(1)观察颜色
① 沉淀
Cu(OH)2
Fe(OH)3
----蓝色沉淀
-----红褐色沉淀
BaSO4、AgCl、BaCO3、CaCO3、Mg(OH)2等
-----白色沉淀
② 固体
CuO、MnO2、C、Fe3O4等
-----黑色
Fe2O3、红磷等
③ 溶液
含铜离子(Cu2+)的溶液
----蓝色
含铁离子(Fe3+)的溶液
----棕黄色
含亚铁离子(Fe2+)的溶液
----浅绿色
(2)气味
SO2、HCl、NH3
S
-----黄色
KMnO4
-----紫黑色
硫酸铜晶体
-----蓝色
不同的刺激性气味
-----红色
探究实践
探究实践
(3)溶解性
探究实践
钾盐、钠盐、铵盐、硝酸盐都溶于水;
盐酸盐:除AgCl难溶外,其余可溶于水;
碳酸盐:大多难溶(除钾盐、钠盐、铵盐可溶外)。
② 盐的溶解性
①碱的溶解性
可溶性碱有NaOH、KOH、Ca(OH)2、Ba(OH)2。
硫酸盐:除BaSO4难溶,CaSO4、Ag2SO4 微溶外,其余可溶于水;
探究实践
2.化学方法
根据化学反应时产生的不同现象或产物进行分析,将已知的多种物质逐一区分开来。
(1)利用酸碱性
指示剂或PH试纸变色,区别酸性、碱性物质。
(2)生成气体
碳酸根离子(CO32 _)的检验:
加入稀盐酸溶液,生成能使澄清石灰水变浑浊的气体。
(3)生成沉淀
①鉴别硫酸根离子(SO42-)的方法:
先滴入硝酸钡Ba(NO)3溶液,产生白色沉淀,再滴入稀硝酸HNO3,白色沉淀不消失。
②鉴别氯离子(Cl-)的方法:
先滴入硝酸银AgNO3溶液,产生白色沉淀,再滴入稀硝酸HNO3,白色沉淀不消失。
(4)气体燃烧
根据气体燃烧现象及产物的不同,区别气体。如:H2、CO2、O2、CO
探究实践
一般为:
物理方法:观颜色、闻气味、溶解性、蒸发。
化学方法:加热分解法、测PH值法、指示剂法、点燃法、
加入化学试剂法、互滴法。
4.操作方法
3.实验步骤
取样→操作→ 现象→ 结论
探究实践
1.下列鉴别物质的方法错误的是 ( )
A.用闻气味的方法鉴别NH3和O2
B.用酚酞试液鉴别稀盐酸和NaCl溶液
C.用沉淀法鉴别Na2SO4溶液和NaNO3溶液
D.用燃烧法鉴别H2和CO
B
[解析] 氧气无色无味,氨气有刺激性的气味,所以用闻气味的方法可以将其鉴别;酚酞遇酸性或中性溶液均不变色,所以用酚酞不能鉴别开氯化钠溶液和稀盐酸;可以向待鉴别的硫酸钠溶液和硝酸钠溶液中分别滴加含钡离子的溶液,所有的硝酸盐都溶于水,而硫酸钡不溶于水;氢气燃烧生成水,一氧化碳燃烧生成二氧化碳,通过鉴别生成物,来鉴别氢气和一氧化碳。
迁移应用
3.在科学实验室,对某种化合物的溶液进行了以下实验:
①取少量该溶液加入适量K2SO4溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解。
②另取少量该溶液加入适量AgNO3溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解。
则溶液中的溶质一定是( )
A.BaCl2 B.CuCl2 C.Na2CO3 D.Ba(NO3)2
A
迁移应用
【解析】所有的钾盐都会溶于水,加入硫酸钾后生成了不溶于硝酸的白色沉淀只能是硫酸钡,所以原化合物提供了钡离子;加入硝酸银也出现了不溶于硝酸的白色沉淀,只能是氯化银沉淀,所以原溶液提供了氯离子。
迁移应用
3.不用其它任何试剂鉴别下列5种物质的溶液:
①NaOH、②MgSO4、③Ba(NO3)2、④Cu(NO3)2、⑤KNO3。
被鉴别出来的正确顺序是( )
A.⑤④③②① B.④①②③⑤ C.②③①④⑤ D.④①⑤②③
【解析】首先观察颜色,第一个被鉴别出来的是蓝色的Cu(NO3)2溶液,其余为无色溶液;向少许剩余的溶液中分别滴加Cu(NO3)2溶液,产生蓝色沉淀是NaOH溶液,所以第二个被鉴别出来的物质是NaOH溶液;再将NaOH溶液分别入少许剩余的三种溶液中,有白色沉淀产生的是MgSO4溶液,所以第三个被鉴别出来的物质是MgSO4溶液;再将MgSO4溶液分别入少许剩余的两种溶液中,有白色沉淀产生的是Ba(NO3)2溶液,无明显现象的为KNO3溶液.故被鉴别出来的正确顺序是④①②③⑤。故选B。
B
4.只用一种试剂就能将NaOH、NaCl、BaCl2三种溶液鉴别出来,它是 ( )
A.CuSO4溶液 B.Na2SO4溶液 C.酚酞试液 D.Fe(NO3)3溶液
A
迁移应用
【解析】硫酸铜与氢氧化钠可生成蓝色氢氧化铜沉淀、与氯化钠不反应而无明显现象、与氯化钡可生成白色硫酸钡沉淀,因此使用硫酸铜溶液能将NaOH、NaCl、BaCl2三种溶液鉴别出来。
物质的鉴别
-红色
物理方法
(1)观察颜色
① 沉淀
Cu(OH)2
Fe(OH)3
-蓝色沉淀
-红褐色沉淀
BaSO4、AgCl、BaCO3、CaCO3、Mg(OH)2等
-白色沉淀
② 固体
CuO、MnO2、C、Fe3O4等
-黑色
Fe2O3、红磷等
S
-黄色
KMnO4
-紫黑色
硫酸铜晶体
-----蓝色
③ 溶液
含铜离子(Cu2+)的溶液
----蓝色
含铁离子(Fe3+)的溶液
----棕黄色
含亚铁离子(Fe2+)的溶液
----浅绿色
(2)气味
SO2、HCl、NH3
不同的刺激性气味;
(3)溶解性
化学方法
(1)利用酸碱性:
(2)生成气体: CO32 _加盐酸产生CO2
(3)生成沉淀:SO42-+Ba2+=BaSO4↓;Cl-+Ag+=AgCl↓
(4)气体燃烧
根据气体燃烧现象及产物的不同,区别气体。
指示剂或PH试纸,酸通性--H+,碱通性--OH-。
第5节 物质的转化(第4课时)
板书设计
https://www.21cnjy.com/help/help_extract.php
浙教版 九年级上
第5节 物质的转化
(第4课时)
教材解析
【核心概念】
1.物质的结构与性质 结构与功能
【学习内容与要求】
1.4 常见的化合物
认识酸、碱、盐的主要性质
物质是不断变化的,性质决定用途。
运用酸和碱的通性及盐的性质进行物质的鉴别。
探究实践
物质的鉴别
目标
1.进一步了解酸、碱、盐和氧化物的化学性质及相互间的关系。
2.能根据物质的特征反应进行物质的鉴别。
3.进一步体验科学家通过实验研究物质性质的方法。
氯化钡溶液,硝酸银溶液,稀硝酸,碳酸钠溶液,紫色石蕊试液,酚酞试液,蒸馏水,试管 6 支。
器材
探究实践
1.鉴别下表中的各对物质。
被检物质 所用试剂 现象与结论 有关化学方程式
稀硫酸与稀盐酸
食盐水与稀盐酸
烧碱溶液与石灰水
BaCl2或
Ba(OH)2
出现白色沉淀是稀硫酸
H2SO4 + BaCl2 = BaSO4↓ + 2HCl
Zn或石蕊试液
有气泡、试液变红是稀盐酸
Zn + 2HCl =ZnCl2 + H2↑
通入CO2或滴加Na2CO3
有白色沉淀的是石灰水
Ca(OH)2+ CO2 =CaCO3↓ + H2O
Ca(OH)2+Na2CO3 =CaCO3↓ +2NaOH
过程
你可能还有其它试剂来鉴别,请写下列,课后与同学交流。
探究实践
2.现有4包白色粉末,编号为A、B、C、D,它们是硫酸铜、氯化钠、硝酸钾、氢氧化钠,请通过实验,一一加以区别。
(1)设计实验方案:依据物质的性质特征,设计相应的实验方案,区别物质。
(2)按实验方案进行实验,并记录实验现象。
(3)根据实验现象,得出结论。
(4)写出实验过程中所发生反应的化学方程式。
A是_________,B是_________,
C是_________,D是_________。
探究实践
CuSO4
NaCl KNO3 NaOH
白色粉末
取样加足量水
NaCl NaOH KNO3
CuSO4
形成蓝色溶液
形成无色溶液
加CuSO4 溶液
NaOH
生成蓝色沉淀
无现象
NaCl KNO3
取样加AgNO3
生成白色沉淀
NaCl
无现象
KNO3
实验过程:
分别取4包白色粉末,按如下方案进行实验,据现象确定物质。
画出树状分类图,逐级分类确认。
探究实践
1.以上物质的鉴别方法是否只有一种?还可以用其他方法加以鉴别吗?
不是。
NaCl、NaOH、KNO3可以先滴加酚酞试验,鉴别出NaOH。
讨论
步骤 硫酸铜 NaCl KNO3 NaOH 结论
1.加水溶解
蓝色
无色
无色
无色
溶于水呈蓝色的是CuSO4
2.加酚酞
无色
无色
红色
溶液显红色的是NaOH
3.加AgNO3
白色沉淀
无变化
产生白色沉淀的是NaCl
无明显变化的是KNO3
设计表格,进行实验,记录现象,养成良好的实验习惯!
根据物质性质制作二歧分类检索表设计、进行实验,得出结论。
1a加水溶解溶液蓝色
1b加水溶解溶液无色
…………………………CuSO4
…………………………2
2a溶液中加酚酞显红色
2b溶液中加酚酞显无色
…………………………NaOH
…………………………3
3a溶液中加AgNO3溶液,产生白色沉淀
3b溶液中加AgNO3溶液,没有明显变化
…………NaCl
…………KNO3
如果还有其它方法,请写下来,课后与同学交流!
探究实践
探究实践
2.你的实验结果是否与其他组的同学不同?请找出原因。
3.只用一种试剂鉴别氯化钠、盐酸、氯化钡 三种无色溶液?
BaCl2
HCl
NaCl
加K2CO3
或Na2CO3
产生白色沉淀的是氯化钡
产生无色气体盐酸
无现象的是氯化钠
探究实践
物质的鉴别的方法
依据物质的物理性质(颜色、气味、状态、溶解性、溶于水是否放热等)的差异性分析。
1.物理方法
(1)观察颜色
① 沉淀
Cu(OH)2
Fe(OH)3
----蓝色沉淀
-----红褐色沉淀
BaSO4、AgCl、BaCO3、CaCO3、Mg(OH)2等
-----白色沉淀
② 固体
CuO、MnO2、C、Fe3O4等
-----黑色
Fe2O3、红磷等
③ 溶液
含铜离子(Cu2+)的溶液
----蓝色
含铁离子(Fe3+)的溶液
----棕黄色
含亚铁离子(Fe2+)的溶液
----浅绿色
(2)气味
SO2、HCl、NH3
S
-----黄色
KMnO4
-----紫黑色
硫酸铜晶体
-----蓝色
不同的刺激性气味
-----红色
探究实践
探究实践
(3)溶解性
探究实践
钾盐、钠盐、铵盐、硝酸盐都溶于水;
盐酸盐:除AgCl难溶外,其余可溶于水;
碳酸盐:大多难溶(除钾盐、钠盐、铵盐可溶外)。
② 盐的溶解性
①碱的溶解性
可溶性碱有NaOH、KOH、Ca(OH)2、Ba(OH)2。
硫酸盐:除BaSO4难溶,CaSO4、Ag2SO4 微溶外,其余可溶于水;
探究实践
2.化学方法
根据化学反应时产生的不同现象或产物进行分析,将已知的多种物质逐一区分开来。
(1)利用酸碱性
指示剂或PH试纸变色,区别酸性、碱性物质。
(2)生成气体
碳酸根离子(CO32 _)的检验:
加入稀盐酸溶液,生成能使澄清石灰水变浑浊的气体。
(3)生成沉淀
①鉴别硫酸根离子(SO42-)的方法:
先滴入硝酸钡Ba(NO)3溶液,产生白色沉淀,再滴入稀硝酸HNO3,白色沉淀不消失。
②鉴别氯离子(Cl-)的方法:
先滴入硝酸银AgNO3溶液,产生白色沉淀,再滴入稀硝酸HNO3,白色沉淀不消失。
(4)气体燃烧
根据气体燃烧现象及产物的不同,区别气体。如:H2、CO2、O2、CO
探究实践
一般为:
物理方法:观颜色、闻气味、溶解性、蒸发。
化学方法:加热分解法、测PH值法、指示剂法、点燃法、
加入化学试剂法、互滴法。
4.操作方法
3.实验步骤
取样→操作→ 现象→ 结论
探究实践
1.下列鉴别物质的方法错误的是 ( )
A.用闻气味的方法鉴别NH3和O2
B.用酚酞试液鉴别稀盐酸和NaCl溶液
C.用沉淀法鉴别Na2SO4溶液和NaNO3溶液
D.用燃烧法鉴别H2和CO
B
[解析] 氧气无色无味,氨气有刺激性的气味,所以用闻气味的方法可以将其鉴别;酚酞遇酸性或中性溶液均不变色,所以用酚酞不能鉴别开氯化钠溶液和稀盐酸;可以向待鉴别的硫酸钠溶液和硝酸钠溶液中分别滴加含钡离子的溶液,所有的硝酸盐都溶于水,而硫酸钡不溶于水;氢气燃烧生成水,一氧化碳燃烧生成二氧化碳,通过鉴别生成物,来鉴别氢气和一氧化碳。
迁移应用
3.在科学实验室,对某种化合物的溶液进行了以下实验:
①取少量该溶液加入适量K2SO4溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解。
②另取少量该溶液加入适量AgNO3溶液,产生白色沉淀,再加入稀硝酸,沉淀不溶解。
则溶液中的溶质一定是( )
A.BaCl2 B.CuCl2 C.Na2CO3 D.Ba(NO3)2
A
迁移应用
【解析】所有的钾盐都会溶于水,加入硫酸钾后生成了不溶于硝酸的白色沉淀只能是硫酸钡,所以原化合物提供了钡离子;加入硝酸银也出现了不溶于硝酸的白色沉淀,只能是氯化银沉淀,所以原溶液提供了氯离子。
迁移应用
3.不用其它任何试剂鉴别下列5种物质的溶液:
①NaOH、②MgSO4、③Ba(NO3)2、④Cu(NO3)2、⑤KNO3。
被鉴别出来的正确顺序是( )
A.⑤④③②① B.④①②③⑤ C.②③①④⑤ D.④①⑤②③
【解析】首先观察颜色,第一个被鉴别出来的是蓝色的Cu(NO3)2溶液,其余为无色溶液;向少许剩余的溶液中分别滴加Cu(NO3)2溶液,产生蓝色沉淀是NaOH溶液,所以第二个被鉴别出来的物质是NaOH溶液;再将NaOH溶液分别入少许剩余的三种溶液中,有白色沉淀产生的是MgSO4溶液,所以第三个被鉴别出来的物质是MgSO4溶液;再将MgSO4溶液分别入少许剩余的两种溶液中,有白色沉淀产生的是Ba(NO3)2溶液,无明显现象的为KNO3溶液.故被鉴别出来的正确顺序是④①②③⑤。故选B。
B
4.只用一种试剂就能将NaOH、NaCl、BaCl2三种溶液鉴别出来,它是 ( )
A.CuSO4溶液 B.Na2SO4溶液 C.酚酞试液 D.Fe(NO3)3溶液
A
迁移应用
【解析】硫酸铜与氢氧化钠可生成蓝色氢氧化铜沉淀、与氯化钠不反应而无明显现象、与氯化钡可生成白色硫酸钡沉淀,因此使用硫酸铜溶液能将NaOH、NaCl、BaCl2三种溶液鉴别出来。
物质的鉴别
-红色
物理方法
(1)观察颜色
① 沉淀
Cu(OH)2
Fe(OH)3
-蓝色沉淀
-红褐色沉淀
BaSO4、AgCl、BaCO3、CaCO3、Mg(OH)2等
-白色沉淀
② 固体
CuO、MnO2、C、Fe3O4等
-黑色
Fe2O3、红磷等
S
-黄色
KMnO4
-紫黑色
硫酸铜晶体
-----蓝色
③ 溶液
含铜离子(Cu2+)的溶液
----蓝色
含铁离子(Fe3+)的溶液
----棕黄色
含亚铁离子(Fe2+)的溶液
----浅绿色
(2)气味
SO2、HCl、NH3
不同的刺激性气味;
(3)溶解性
化学方法
(1)利用酸碱性:
(2)生成气体: CO32 _加盐酸产生CO2
(3)生成沉淀:SO42-+Ba2+=BaSO4↓;Cl-+Ag+=AgCl↓
(4)气体燃烧
根据气体燃烧现象及产物的不同,区别气体。
指示剂或PH试纸,酸通性--H+,碱通性--OH-。
第5节 物质的转化(第4课时)
板书设计
https://www.21cnjy.com/help/help_extract.php
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
