高中化学人教版2019选择性必修1 3.2.4 酸碱中和滴定(共29张ppt)
文档属性
| 名称 | 高中化学人教版2019选择性必修1 3.2.4 酸碱中和滴定(共29张ppt) |

|
|
| 格式 | zip | ||
| 文件大小 | 4.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-16 00:00:00 | ||
图片预览






文档简介
(共29张PPT)
走进奇妙的化学世界
选择性必修1
第三章 水溶液中的离子
反应与平衡
第二节 水的电离
溶液的酸碱性
第4课时 酸碱中和滴定
生活中常见物质的pH
【思考】pH的测定和调控对生产生活有着重要意义,在实验室是如何实现pH的调控呢?
学习
目标
第4课时
酸碱中和滴定
PART
01
PART
02
了解酸碱中和滴定的原理和指示剂的选择方法
知道酸碱中和滴定的主要仪器及其用途
掌握酸碱中和滴定的实验操作并会进行数据处理和误差分析
PART
02
一. 酸碱中和滴定的基础知识
1.概念:依据中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸) 的方法,叫做酸碱中和滴定。
标准液
待测液
2、原理:
H++OH-=H2O
c(H+)·V酸=c(OH-)·V碱
用0.1000mol/L的HCl溶液滴定20.00mL未知浓度的NaOH溶液,滴定完成时,用去HCl溶液28.00mL。通过中和滴定测得NaOH溶液的物质的量浓度是多少?
0.1400mol/L
把上题中HCl改成H2SO4,则NaOH的物质的量浓度为多少?
C标V标
V测
=
C测
实验:现在我们用0.1032mol/L的盐酸标准溶液测定未知浓度的NaOH溶液。该怎么做?
c(HCl)·V[HCl(aq)]
V[NaOH(aq)]
=
c(NaOH )
【问题1】需测得哪些数据能计算出c(NaOH)?
已知0.1032 mol/L
量取一定体积
待测定
【问题2】你认为中和滴定实验要解决的关键问题是什么?
3、实验的关键:
(1)准确测量参加反应的两种溶液的体积
(2)准确判断中和反应是否恰好完全反应
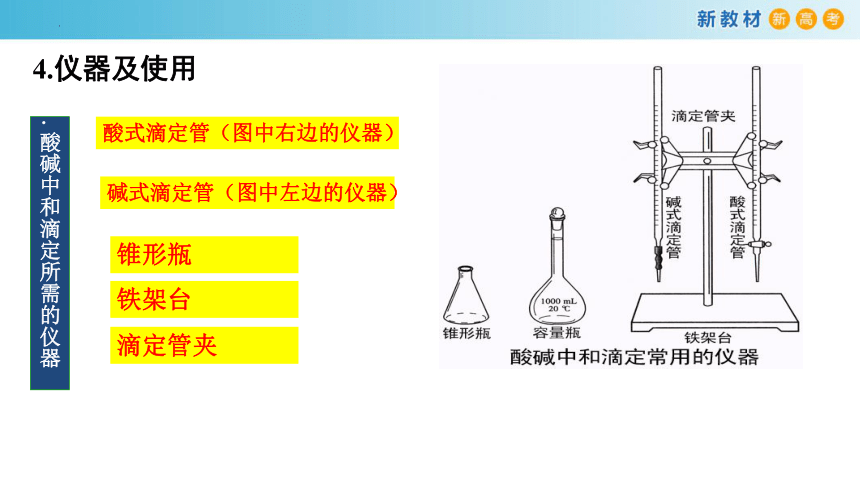
4.仪器及使用
.酸碱中和滴定所需的仪器
酸式滴定管(图中右边的仪器)
碱式滴定管(图中左边的仪器)
锥形瓶
铁架台
滴定管夹
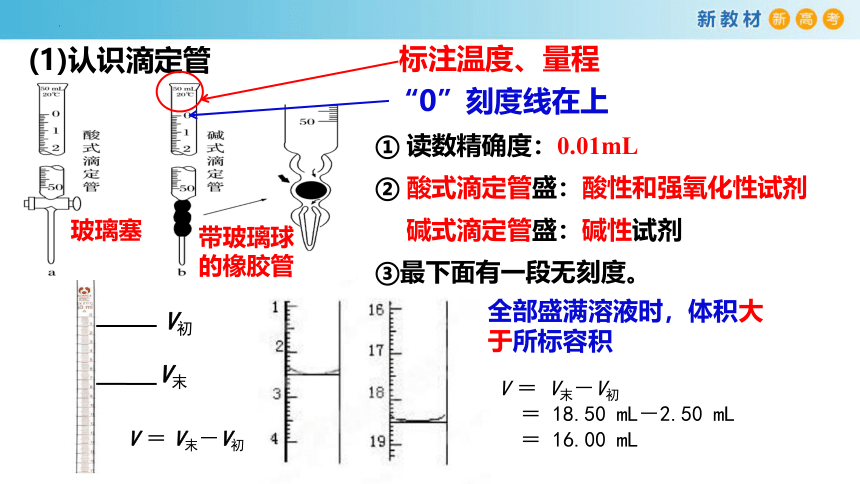
V初
V末
V = V末-V初
V = V末-V初
= 18.50 mL-2.50 mL
= 16.00 mL
(1)认识滴定管
标注温度、量程
“0”刻度线在上
玻璃塞
带玻璃球的橡胶管
① 读数精确度:0.01mL
② 酸式滴定管盛:酸性和强氧化性试剂
碱式滴定管盛:碱性试剂
③最下面有一段无刻度。
全部盛满溶液时,体积大于所标容积
1、量取25.00mL,KMnO4溶液可选用仪器( )
A.50mL量筒, B.100mL量筒
C.50mL酸式滴定管 D.50mL碱式滴定管
C
2.某同学在实验报告中有以下实验数据,其中数据合理的是
A.用托盘天平称取11.70 g食盐
B.用量筒量取5.26 mL盐酸
C.用广范pH试纸测得溶液的pH是3.5
D.用标准NaOH溶液滴定未知浓度的盐酸用去23.10 mL溶液
D
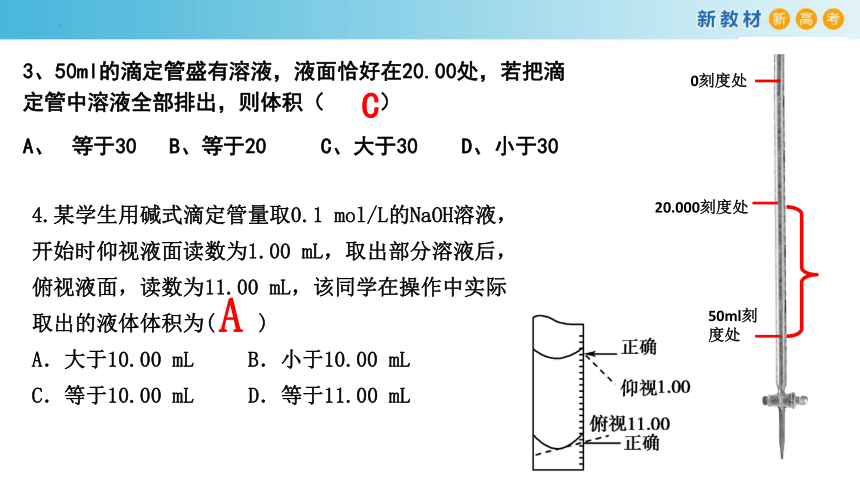
3、50ml的滴定管盛有溶液,液面恰好在20.00处,若把滴定管中溶液全部排出,则体积( )
A、 等于30 B、等于20 C、大于30 D、小于30
C
0刻度处
50ml刻
度处
4.某学生用碱式滴定管量取0.1 mol/L的NaOH溶液,
开始时仰视液面读数为1.00 mL,取出部分溶液后,
俯视液面,读数为11.00 mL,该同学在操作中实际
取出的液体体积为( )
A.大于10.00 mL B.小于10.00 mL
C.等于10.00 mL D.等于11.00 mL
A
20.000刻度处
(2)滴定管的使用方法:
①检查仪器:使用前先检查滴定管活塞是否漏水。
②润洗仪器:滴定管在加入反应液之前,先用蒸馏水洗涤干净,再用所要盛装的溶液润洗2~3遍。
③加入反应液:分别将反应液加入相应滴定管中,使液面位于滴定管“0”刻度线以上2~3mL处。
④调节起始读数:在滴定管下放一烧杯,调节活塞,使滴定管尖嘴部分充满反应液,并使液面处于“0”刻度或以下某刻度,读数并记录。
查漏
洗涤
装液
赶气泡
(3)指示剂的选择原则:
③酸碱指示剂:一般是有机弱酸或有机弱碱
①滴定终点时颜色变化要明显,指示剂变色范围要窄(不用石蕊)
②指示剂变色范围尽量接近终点时溶液的pH。
浅红色
无色
红色
——— 8.2 ——— 10.0 ———
——— 3.1 ——— 4.4 ———
甲基橙
酚 酞
红色 橙色
黄色
【问题3】 如何判断中和反应什么时候“恰好”反应完全(即判断滴定终点)?
① 强酸——强碱:
② 强酸滴定弱碱:
③ 强碱滴定弱酸:
选酚酞或甲基橙都可以
滴定终点为酸性,选甲基橙
滴定终点为碱性,选酚酞
【困惑】强酸与强碱“恰好”反应时,所得溶液的pH=7,用酚酞作指示剂时,实际滴定终点的pH=8.2,为什么可以将滴定终点当成“恰好”反应的点?
滴定终点的确定
原理:由曲线可以看出,在酸、碱中和滴定过程中,溶液的pH在接近滴定终点时有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显,所以即使酚酞、甲基橙的变色不在恰好中和的pH=7的点上,但体积差距很小,可以忽略不计。
甲基橙
酚 酞
“pH 突变”
当接近滴定终点时,极少量的碱和酸就会引起 pH 突变。
⑷滴定终点的判断:
当滴入最后一滴××标准溶液后,溶液由××色变成××色,且半分钟内不变色,说明达到滴定终点。
酚 酞 甲基橙
强碱滴定强酸
强酸滴定强碱
红色→无色
橙色→黄色
无色→浅红色
黄色→橙色
说明:解答此类题目注意三个关键点:
(1)最后一滴:必须说明是滴入“最后一滴”溶液。
(2)颜色变化:必须说明滴入“最后一滴”溶液后,溶液“颜色的变化”。
(3)半分钟:必须说明溶液颜色变化后“半分钟内不褪色”。
二. 酸碱中和滴定的操作
⑴滴定前准备:
①检查:先检查酸、碱滴定管是否漏水。
②润洗:先用水将滴定管洗涤干净,再分别用待装液
润洗2~3次。
③装液:将酸、碱分别装入滴定管,使液面位于0刻度
以上2~3 mL处。
④调液:调节活塞或玻璃球,赶气泡,使液面处于0刻
度或0刻度以下。
⑤放液:从碱式滴定管中放出20mL的NaOH溶液于锥
形瓶中,并滴2~3滴指示剂(甲基橙或酚酞)。
用0.1200mol/L盐酸标准液测定未知浓度NaOH溶液。
锥形瓶用水洗干净即可,不能用待测液润洗
滴速:先快后慢,当接近终点时,应一滴一摇。利用锥形瓶内壁承接尖嘴处悬挂的半滴溶液。
终点判断:当滴入最后一滴标准液时,刚好使锥形瓶中的溶液变色,且在半分钟内不变色,即到滴定终点。读数并记录。
⑵滴定:
左手
右手
视线与凹液
面水平相切
滴加速度先快后慢
眼睛注视瓶内颜色变化
半分钟颜色不变
滴定管保持垂直
盐酸滴定未知浓度的NaOH溶液,滴定终点的判断:
①若用酚酞作指示剂,当滴入最后一滴盐酸时,溶液的颜色由 ,说明达到滴定终点。
②若用甲基橙作指示剂,当滴入最后一滴盐酸时,溶液的颜色由 ,说明达到滴定终点。
红色突变为无色,且半分钟内不变色
黄色变为橙色,且半分钟内不变色
特别提醒:1.中和滴定终点是指示剂颜色发生突变的点,但不一定是酸碱恰好中和的点。通常有一定误差(允许误差)。
(3)实验数据的处理重复实验2~3次,取消耗标准液体积的平均值,根据c(NaOH)= ,计算出待测NaOH溶液的浓度。
滴定前
滴定后
V(盐酸)=26.10mL
c(盐酸)=0.1200mol/L
V(NaOH)=20.00mL
三、中和滴定曲线
向20.00mL 0.10mol/L HCl中滴加0.10mol/L NaOH溶液过程中,溶液的pH变化如下,你发现了什么现象与规律?
问题1:滴定终点消耗碱多少 PH等于多少
问题2:滴定终点时多一滴和少一滴溶液的PH发生怎样改变
0.04 mL约1滴
pH=10
pH=3.9
在NaOH体积为20mL时pH出现突变
强碱滴定强酸
反应终点
加入NaOH(ml)
突变范围
pH
酸碱指示剂的颜色在此pH值突跃范围发生明显的改变,则就能以较小的误差指示出滴定终点的到达。
颜色突变范围
指示剂选择
PH
12
10
8
6
4
2
10
20
30
40
0
7
酚 酞
8
10
颜色突变范围
7
PH
12
10
8
6
4
2
10
20
30
40
0
甲基橙
3.1
4.4
指示剂选择
四、滴定的误差分析:
C(待)=
C(标)×V(标)
V(待)
C(标)、 V(测)是已知的数据,因此C(测)的大小只由V(标) ——“读数”决定,只要直接或者间接的能引起“读数”的变化,则C(测)也随着变化,且二者的变化是成正比例变化。
已知
已知
读数
决定误差原因:
⑴、参加反应的酸或碱溶液的体积测量不准确
⑵、中和反应终点判断不准确
结论:
c(待)与V(标)成正比;
V(标)偏大,结果偏大;
V(标)偏小,结果偏小
操作方法 误差分析
1.放标准液的滴定管未用标准液润洗
2.盛放待测液的锥形瓶使用前用待测液润洗
3.滴定前滴定管尖嘴有气泡,完毕气泡消失
4.滴定前仰视读数,滴定毕正确读数
5.滴定前正确读数,滴定毕俯视读数
6.滴定中,滴定管漏液
7.锥形瓶摇动时部分碱液溅出
8.滴定中向锥形瓶加入蒸馏水
V标偏大
c待偏高
V标偏大
c待偏高
V标偏大
c待偏高
V标偏小
c待偏低
c待偏低
V标偏小
V标偏大
c待偏高
V标偏小
c待偏低
c待无影响
V标不变
c(标)·V(标)
V(待)
=
c(待 )
所有的误差都体现到V标上来分析!
俯视图
仰视图
滴定管的俯视和仰视
正确视线
仰视视线
正确读数
仰视读数
读数偏大
正确视线
俯视视线
正确读数
俯视读数
读数偏小
0
先偏大
后偏小
先偏小
后偏大
课堂小结
酸
碱
中
和
滴
定
定义
已知物质的量的浓度的酸(或碱)来测定未知浓度的碱(或酸)
原理
c酸v酸=c碱v碱 (一元酸和一元碱)
仪器及试剂
酸、碱式滴定管等
标准液、待测液、 酸碱指示剂
步骤
查漏
洗涤、润洗
装液、调液和取液(记下读数)
滴定操作
记录(记下读数)并计算
误差分析
c酸v酸=c碱v碱 (一元酸和一元碱)
(2)滴定阶段:
(3)数据处理阶段:
(1)准备阶段:
①检查是否漏水
②水洗、润洗
③装液、赶气泡、调液面
④记录初读数V1
⑩计算待测液浓度
⑨记录末读数V2
⑧滴加标准液直至颜色发生变化,且半分钟不变
⑥取待测液V(待)
⑦加指示剂
⑤水洗
滴定管:
锥形瓶:
小结:中和滴定步骤
c(标)·V(标)
V(aq)
=
c(待 )
无润洗!
有时你会抱怨:何时才能到滴定终点?
有时你会迫不及待,怎么颜色还不改变?
但只要你专注用心做好每一步,
未来和终点就会在你的指尖实现!
走进奇妙的化学世界
选择性必修1
第三章 水溶液中的离子
反应与平衡
第二节 水的电离
溶液的酸碱性
第4课时 酸碱中和滴定
生活中常见物质的pH
【思考】pH的测定和调控对生产生活有着重要意义,在实验室是如何实现pH的调控呢?
学习
目标
第4课时
酸碱中和滴定
PART
01
PART
02
了解酸碱中和滴定的原理和指示剂的选择方法
知道酸碱中和滴定的主要仪器及其用途
掌握酸碱中和滴定的实验操作并会进行数据处理和误差分析
PART
02
一. 酸碱中和滴定的基础知识
1.概念:依据中和反应,用已知浓度的酸(或碱)来测定未知浓度的碱(或酸) 的方法,叫做酸碱中和滴定。
标准液
待测液
2、原理:
H++OH-=H2O
c(H+)·V酸=c(OH-)·V碱
用0.1000mol/L的HCl溶液滴定20.00mL未知浓度的NaOH溶液,滴定完成时,用去HCl溶液28.00mL。通过中和滴定测得NaOH溶液的物质的量浓度是多少?
0.1400mol/L
把上题中HCl改成H2SO4,则NaOH的物质的量浓度为多少?
C标V标
V测
=
C测
实验:现在我们用0.1032mol/L的盐酸标准溶液测定未知浓度的NaOH溶液。该怎么做?
c(HCl)·V[HCl(aq)]
V[NaOH(aq)]
=
c(NaOH )
【问题1】需测得哪些数据能计算出c(NaOH)?
已知0.1032 mol/L
量取一定体积
待测定
【问题2】你认为中和滴定实验要解决的关键问题是什么?
3、实验的关键:
(1)准确测量参加反应的两种溶液的体积
(2)准确判断中和反应是否恰好完全反应
4.仪器及使用
.酸碱中和滴定所需的仪器
酸式滴定管(图中右边的仪器)
碱式滴定管(图中左边的仪器)
锥形瓶
铁架台
滴定管夹
V初
V末
V = V末-V初
V = V末-V初
= 18.50 mL-2.50 mL
= 16.00 mL
(1)认识滴定管
标注温度、量程
“0”刻度线在上
玻璃塞
带玻璃球的橡胶管
① 读数精确度:0.01mL
② 酸式滴定管盛:酸性和强氧化性试剂
碱式滴定管盛:碱性试剂
③最下面有一段无刻度。
全部盛满溶液时,体积大于所标容积
1、量取25.00mL,KMnO4溶液可选用仪器( )
A.50mL量筒, B.100mL量筒
C.50mL酸式滴定管 D.50mL碱式滴定管
C
2.某同学在实验报告中有以下实验数据,其中数据合理的是
A.用托盘天平称取11.70 g食盐
B.用量筒量取5.26 mL盐酸
C.用广范pH试纸测得溶液的pH是3.5
D.用标准NaOH溶液滴定未知浓度的盐酸用去23.10 mL溶液
D
3、50ml的滴定管盛有溶液,液面恰好在20.00处,若把滴定管中溶液全部排出,则体积( )
A、 等于30 B、等于20 C、大于30 D、小于30
C
0刻度处
50ml刻
度处
4.某学生用碱式滴定管量取0.1 mol/L的NaOH溶液,
开始时仰视液面读数为1.00 mL,取出部分溶液后,
俯视液面,读数为11.00 mL,该同学在操作中实际
取出的液体体积为( )
A.大于10.00 mL B.小于10.00 mL
C.等于10.00 mL D.等于11.00 mL
A
20.000刻度处
(2)滴定管的使用方法:
①检查仪器:使用前先检查滴定管活塞是否漏水。
②润洗仪器:滴定管在加入反应液之前,先用蒸馏水洗涤干净,再用所要盛装的溶液润洗2~3遍。
③加入反应液:分别将反应液加入相应滴定管中,使液面位于滴定管“0”刻度线以上2~3mL处。
④调节起始读数:在滴定管下放一烧杯,调节活塞,使滴定管尖嘴部分充满反应液,并使液面处于“0”刻度或以下某刻度,读数并记录。
查漏
洗涤
装液
赶气泡
(3)指示剂的选择原则:
③酸碱指示剂:一般是有机弱酸或有机弱碱
①滴定终点时颜色变化要明显,指示剂变色范围要窄(不用石蕊)
②指示剂变色范围尽量接近终点时溶液的pH。
浅红色
无色
红色
——— 8.2 ——— 10.0 ———
——— 3.1 ——— 4.4 ———
甲基橙
酚 酞
红色 橙色
黄色
【问题3】 如何判断中和反应什么时候“恰好”反应完全(即判断滴定终点)?
① 强酸——强碱:
② 强酸滴定弱碱:
③ 强碱滴定弱酸:
选酚酞或甲基橙都可以
滴定终点为酸性,选甲基橙
滴定终点为碱性,选酚酞
【困惑】强酸与强碱“恰好”反应时,所得溶液的pH=7,用酚酞作指示剂时,实际滴定终点的pH=8.2,为什么可以将滴定终点当成“恰好”反应的点?
滴定终点的确定
原理:由曲线可以看出,在酸、碱中和滴定过程中,溶液的pH在接近滴定终点时有一个突变过程,在此范围内,滴加很少的酸(或碱),溶液的pH就有很大的变化,能使指示剂的颜色变化明显,所以即使酚酞、甲基橙的变色不在恰好中和的pH=7的点上,但体积差距很小,可以忽略不计。
甲基橙
酚 酞
“pH 突变”
当接近滴定终点时,极少量的碱和酸就会引起 pH 突变。
⑷滴定终点的判断:
当滴入最后一滴××标准溶液后,溶液由××色变成××色,且半分钟内不变色,说明达到滴定终点。
酚 酞 甲基橙
强碱滴定强酸
强酸滴定强碱
红色→无色
橙色→黄色
无色→浅红色
黄色→橙色
说明:解答此类题目注意三个关键点:
(1)最后一滴:必须说明是滴入“最后一滴”溶液。
(2)颜色变化:必须说明滴入“最后一滴”溶液后,溶液“颜色的变化”。
(3)半分钟:必须说明溶液颜色变化后“半分钟内不褪色”。
二. 酸碱中和滴定的操作
⑴滴定前准备:
①检查:先检查酸、碱滴定管是否漏水。
②润洗:先用水将滴定管洗涤干净,再分别用待装液
润洗2~3次。
③装液:将酸、碱分别装入滴定管,使液面位于0刻度
以上2~3 mL处。
④调液:调节活塞或玻璃球,赶气泡,使液面处于0刻
度或0刻度以下。
⑤放液:从碱式滴定管中放出20mL的NaOH溶液于锥
形瓶中,并滴2~3滴指示剂(甲基橙或酚酞)。
用0.1200mol/L盐酸标准液测定未知浓度NaOH溶液。
锥形瓶用水洗干净即可,不能用待测液润洗
滴速:先快后慢,当接近终点时,应一滴一摇。利用锥形瓶内壁承接尖嘴处悬挂的半滴溶液。
终点判断:当滴入最后一滴标准液时,刚好使锥形瓶中的溶液变色,且在半分钟内不变色,即到滴定终点。读数并记录。
⑵滴定:
左手
右手
视线与凹液
面水平相切
滴加速度先快后慢
眼睛注视瓶内颜色变化
半分钟颜色不变
滴定管保持垂直
盐酸滴定未知浓度的NaOH溶液,滴定终点的判断:
①若用酚酞作指示剂,当滴入最后一滴盐酸时,溶液的颜色由 ,说明达到滴定终点。
②若用甲基橙作指示剂,当滴入最后一滴盐酸时,溶液的颜色由 ,说明达到滴定终点。
红色突变为无色,且半分钟内不变色
黄色变为橙色,且半分钟内不变色
特别提醒:1.中和滴定终点是指示剂颜色发生突变的点,但不一定是酸碱恰好中和的点。通常有一定误差(允许误差)。
(3)实验数据的处理重复实验2~3次,取消耗标准液体积的平均值,根据c(NaOH)= ,计算出待测NaOH溶液的浓度。
滴定前
滴定后
V(盐酸)=26.10mL
c(盐酸)=0.1200mol/L
V(NaOH)=20.00mL
三、中和滴定曲线
向20.00mL 0.10mol/L HCl中滴加0.10mol/L NaOH溶液过程中,溶液的pH变化如下,你发现了什么现象与规律?
问题1:滴定终点消耗碱多少 PH等于多少
问题2:滴定终点时多一滴和少一滴溶液的PH发生怎样改变
0.04 mL约1滴
pH=10
pH=3.9
在NaOH体积为20mL时pH出现突变
强碱滴定强酸
反应终点
加入NaOH(ml)
突变范围
pH
酸碱指示剂的颜色在此pH值突跃范围发生明显的改变,则就能以较小的误差指示出滴定终点的到达。
颜色突变范围
指示剂选择
PH
12
10
8
6
4
2
10
20
30
40
0
7
酚 酞
8
10
颜色突变范围
7
PH
12
10
8
6
4
2
10
20
30
40
0
甲基橙
3.1
4.4
指示剂选择
四、滴定的误差分析:
C(待)=
C(标)×V(标)
V(待)
C(标)、 V(测)是已知的数据,因此C(测)的大小只由V(标) ——“读数”决定,只要直接或者间接的能引起“读数”的变化,则C(测)也随着变化,且二者的变化是成正比例变化。
已知
已知
读数
决定误差原因:
⑴、参加反应的酸或碱溶液的体积测量不准确
⑵、中和反应终点判断不准确
结论:
c(待)与V(标)成正比;
V(标)偏大,结果偏大;
V(标)偏小,结果偏小
操作方法 误差分析
1.放标准液的滴定管未用标准液润洗
2.盛放待测液的锥形瓶使用前用待测液润洗
3.滴定前滴定管尖嘴有气泡,完毕气泡消失
4.滴定前仰视读数,滴定毕正确读数
5.滴定前正确读数,滴定毕俯视读数
6.滴定中,滴定管漏液
7.锥形瓶摇动时部分碱液溅出
8.滴定中向锥形瓶加入蒸馏水
V标偏大
c待偏高
V标偏大
c待偏高
V标偏大
c待偏高
V标偏小
c待偏低
c待偏低
V标偏小
V标偏大
c待偏高
V标偏小
c待偏低
c待无影响
V标不变
c(标)·V(标)
V(待)
=
c(待 )
所有的误差都体现到V标上来分析!
俯视图
仰视图
滴定管的俯视和仰视
正确视线
仰视视线
正确读数
仰视读数
读数偏大
正确视线
俯视视线
正确读数
俯视读数
读数偏小
0
先偏大
后偏小
先偏小
后偏大
课堂小结
酸
碱
中
和
滴
定
定义
已知物质的量的浓度的酸(或碱)来测定未知浓度的碱(或酸)
原理
c酸v酸=c碱v碱 (一元酸和一元碱)
仪器及试剂
酸、碱式滴定管等
标准液、待测液、 酸碱指示剂
步骤
查漏
洗涤、润洗
装液、调液和取液(记下读数)
滴定操作
记录(记下读数)并计算
误差分析
c酸v酸=c碱v碱 (一元酸和一元碱)
(2)滴定阶段:
(3)数据处理阶段:
(1)准备阶段:
①检查是否漏水
②水洗、润洗
③装液、赶气泡、调液面
④记录初读数V1
⑩计算待测液浓度
⑨记录末读数V2
⑧滴加标准液直至颜色发生变化,且半分钟不变
⑥取待测液V(待)
⑦加指示剂
⑤水洗
滴定管:
锥形瓶:
小结:中和滴定步骤
c(标)·V(标)
V(aq)
=
c(待 )
无润洗!
有时你会抱怨:何时才能到滴定终点?
有时你会迫不及待,怎么颜色还不改变?
但只要你专注用心做好每一步,
未来和终点就会在你的指尖实现!
