化学人教版2019必修第一册1.3.1氧化还原反应(共69张ppt)
文档属性
| 名称 | 化学人教版2019必修第一册1.3.1氧化还原反应(共69张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 10.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-17 22:43:05 | ||
图片预览






文档简介
(共69张PPT)
氧化还原反应
第三节
第一章 物质及其变化
第一课时-概念和电子转移表示
合成氨
制硫酸
以下图示中包含了什么反应类型
学习目标01
学习目标
反应特征
反应前后价态发生改变的必是氧化还原反应
从价态考虑
学习目标02
反应本质
氧化还原反应中,发生了电子的得失
电子得失
学习目标03
认识概念
氧化剂、还原剂
氧化反应、还原反应
据电子得失理解
学习目标04
电子转移
单线桥
双线桥
表示方法
从拉瓦锡的氧化学说说起
01
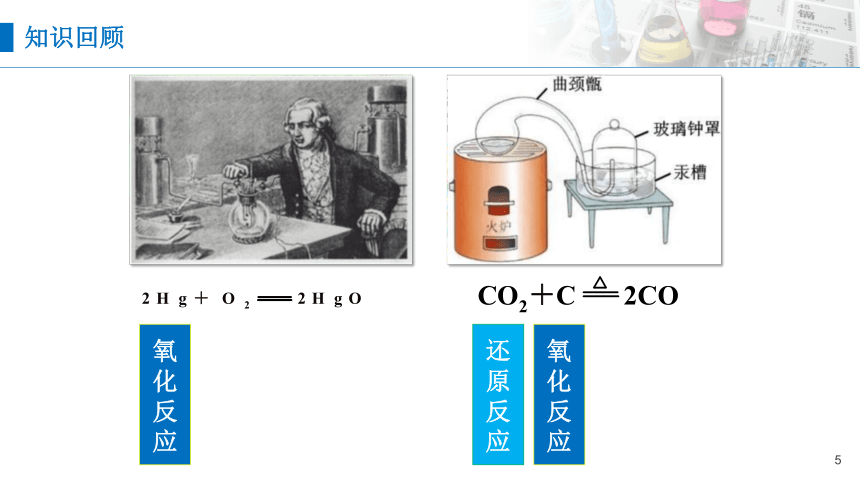
知识回顾
还
原
反
应
氧
化
反
应
氧
化
反
应
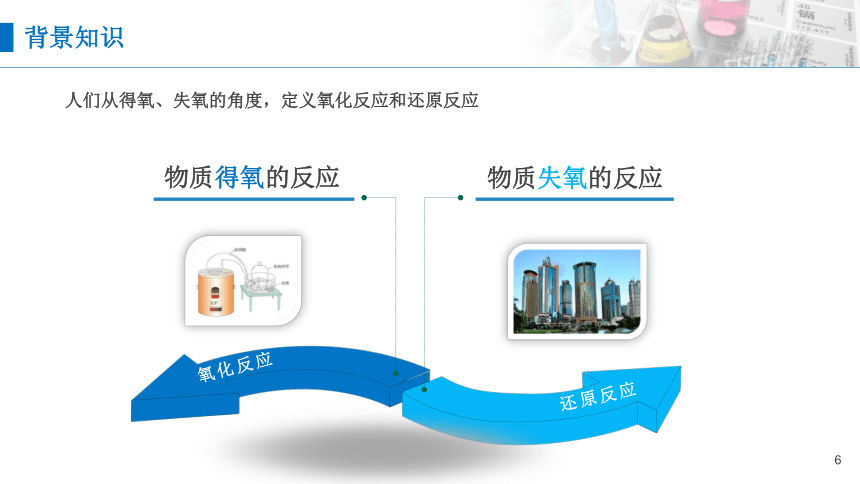
物质得氧的反应
物质失氧的反应
氧化反应
还原反应
人们从得氧、失氧的角度,定义氧化反应和还原反应
背景知识
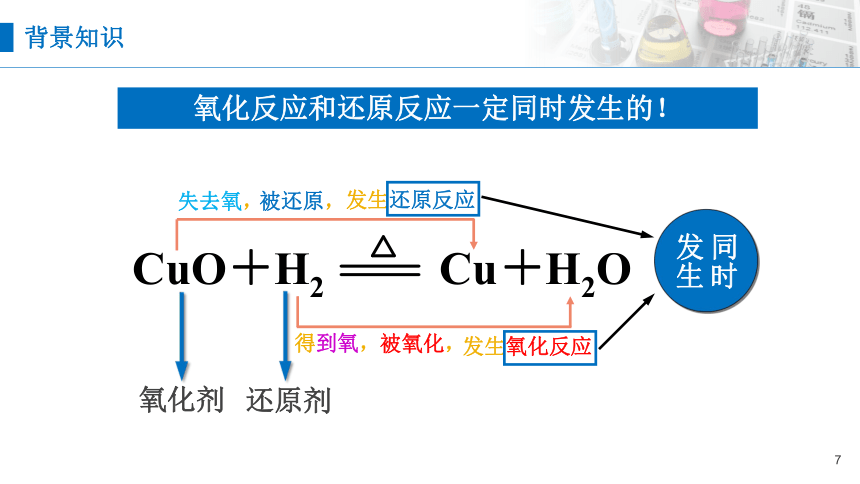
失去氧,
得到氧,
氧化剂
还原剂
被氧化,
发生氧化反应
被还原,
发生还原反应
同时发生
背景知识
氧化反应和还原反应一定同时发生的!
得氧的反应
1. 从得失氧角度分析
氧化反应
失氧的反应
还原反应
提供氧的反应物
氧化剂
得到氧的反应物
还原剂
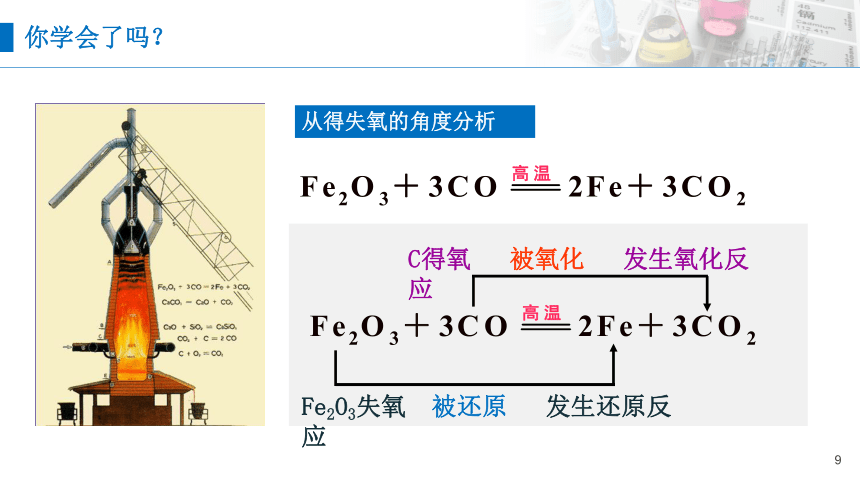
从得失氧的角度分析
C得氧 被氧化 发生氧化反应
Fe2O3失氧 被还原 发生还原反应
你学会了吗?
从弗兰克兰的化合价概念说起
02
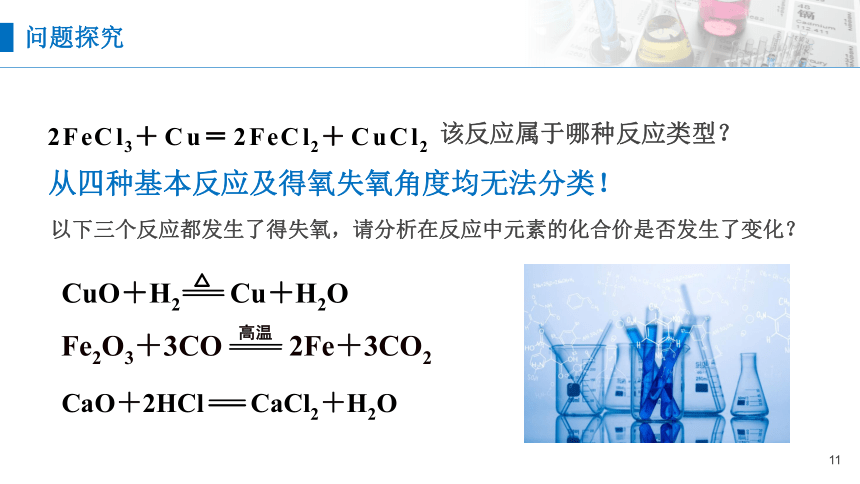
从四种基本反应及得氧失氧角度均无法分类!
该反应属于哪种反应类型?
以下三个反应都发生了得失氧,请分析在反应中元素的化合价是否发生了变化?
问题探究
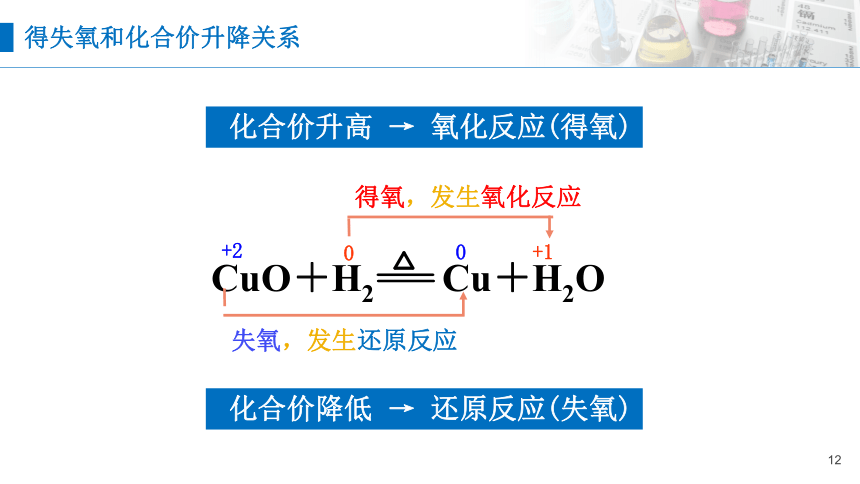
0
得氧,发生氧化反应
0
+1
化合价升高 → 氧化反应(得氧)
失氧,发生还原反应
+2
化合价降低 → 还原反应(失氧)
得失氧和化合价升降关系
得失氧和化合价升降关系
氧化铜
氢气
还原反应
氧化反应
化
合
价
降
低
化
合
价
升
高
共热
从化合价升降角度关系
化合价
降低
还原反应
化合价
升高
氧化反应
从化合价角度,分析以下氧化还原反应
0
+1
0
-1
化合价升高,氧化反应
化合价降低,还原反应
请你试一试
从化合价角度,分析以下氧化还原反应
化合价降低 还原反应(被还原)
+2
0
0
+2
化合价升高 氧化反应(被氧化)
并非只有得氧、失氧的反应才是氧化还原反应。
凡是有元素化合价升降的化学反应都是氧化还原反应。
你学会了吗?
2. 从化合价改变分析
2.1 氧化还原反应与非氧化还原反应
元素化合价发生变化的反应
氧化还原反应
元素化合价不发生变化的反应
非氧化还原反应
2.2 氧化反应与还原反应
反应物中元素化合价升高的反应
氧化反应
反应物中元素化合价降低的反应
还原反应
2. 从化合价改变分析
氧化剂
还原剂
从化合价升降角度关系
0
化合价 升高 氧化反应
0
+1
化合价 降低 还原反应
+2
2. 从化合价改变分析
2.3 氧化剂与还原剂
元素化合价降低的反应物
氧化剂
元素化合价升高的反应物
还原剂
请你试一试
化合价
升高
被氧化
化合价
降低
被还原
氧
化
剂
还
原
剂
请按左图形式,完成以下反应。
1. Cu+Cl2=CuCl2
2. Cu+2FeCl3=CuCl2+2FeCl2
氧化剂
还原剂
还原产物
氧化产物
化合价升高
被氧化
化合价降低
被还原
归纳与整理
A . Fe是氧化剂
B . CuSO4 是氧化剂
C . Fe被氧化
D . CuSO4 发生氧化反应
例题
我国古代有湿法炼铜的记载“曾青得铁化为铜”,反应为
0
+2
+2
0
有关该反应的下列说法正确的是
A.HCl→Cl2
B.CO→CO2
C.SO2→SO3
D.FeCl3→FeCl2
考考你的智慧
下列变化中,加入还原剂可以实现的是
感受氧化还原反应的存在
人体正常血红蛋白中含有Fe2+,若误食亚硝酸钠,会导致Fe2+转化为Fe3+而中毒,服用维生素C可以解毒。
对上述事实分析正确的是
学以致用
A.维生素C是氧化剂
B.维生素C将Fe3+还原成Fe2+
C.亚硝酸钠是还原剂
D.亚硝酸钠被氧化
氧化还原反应与四种基本反应类型关系?
03
化学反应 基本类型 氧化还原反应
分解反应
分解反应
化合反应
化合反应
置换反应
复分解反应
×
√
×
√
√
×
从中你发现什么结论?
交流与研讨
氧化还原反应和四种基本反应类型之间有何关系?
问题探究
化合反应
置换反应
复分解反应
分解反应
氧化还原反应
非氧化还原反应
化合价发生改变
化合价发生改变
化合价无改变
化合价无改变
氧化还原反应
置换反应
复分解反应
3. 四种基本反应类型与氧化还原反应关系
化合反应
分解反应
能正确表示四种基本反应类型与氧化还原反应关系的示意图是
你学会了吗?
√
从汤姆孙发现电子说起
04
0
+1
-1
0
Na显+1价,Cl呈-1价?
问题探究
钠和氯的反应
元素的化合价为什么会发生变化?
化合价的升降原因是什么?
Na
Cl
化合价升降的原因是
电子的得失
问题探究
电子得失
共用电子对偏移
电子的转移
Na+离子
Cl-离子
4. 本质及概念
4.1 本质
氧化反应
还原反应
4. 本质及概念
氧化还原反应与电子转移示意图
0
+1
-1
0
化合价升高
被氧化
还原剂
化合价降低
被还原
氧化剂
失电子
得电子
4. 本质及概念
氧化剂和还原剂
氧化剂
还原剂
得到电子,被还原
失去电子,被氧化
n个e-
4. 本质及概念
从电子得失认识氧化还原反应
4. 本质及概念
4.2 两剂
得到电子的物质
氧化剂
失去电子的物质
还原剂
电子从还原剂转移到氧化剂的示意图
C-
还原剂
氧化剂
4. 本质及概念
4.2 两剂
Mg、Al在反应中作什么剂?
Mg、Al在反应中表现什么性质?
还原性
问题探究
问题探究
S、Cl2在反应中作什么剂?
S、Cl2在反应中表现什么性质?
氧化性
4.3.1 氧化性
物质得到电子的性质
4.3.2 还原性
物质失去电子的性质
氧化剂
氧化性
还原反应
还原产物
具有
发生
生成
4. 本质及概念
4.3 两性
下图为反应Fe+CuSO4=Cu+FeSO4中电子转移的关系图,则图中的元素甲、乙分别表示
A.Fe、S B.Cu、S
C.Fe、O D.Fe、Cu
你学会了吗?
氧化还原反应中电子转移如何表示?
05
Na
Cl
Na+
Cl-
如何表示反应中电子的得失?
2
氯化钠的形成过程
5.1.1 表示谁给谁
5.1.2 书写步骤
2
表示氧化剂与还原剂之间电子转移的方向和数目
5. 电子转移表示方法
5.1 单线桥法
1
2
3
标出价态发生改变元素的化合价
在反应物中从失电子元素指向得电子元素
注电子 定数目
三步骤
0
+1
0
-1
0
+1
0
-1
0
+1
0
-1
2
5. 电子转移表示方法
标变价
画单桥
标总数
2e-
失去
e-
2e-
5. 电子转移表示方法
以下表示方法,是否合理?
箭头由失电子元素指向得电子元素
只标明电子转移的数目,不标“得到”或“失去”
温馨提醒
用单线桥表示电子转移的方向和数目。
Zn+H2SO4 = ZnSO4+H2↑
你学会了吗?
标变价
画单桥
标总数
标出价态发生改变元素的化合价
Zn+H2SO4 = ZnSO4+H2↑
在反应物中从失电子元素指向得电子元素
注电子,定数目
0
+2
+1
0
Zn+H2SO4 = ZnSO4+H2↑
0
+2
+1
0
Zn+H2SO4 = ZnSO4+H2↑
0
+2
+1
0
2e-
失电子总数=得电子总数=转移电子总数
ne-
特别提醒
如何验证锌与稀硫酸的反应中,有电子转移 ?
实验探究
用单线桥表示电子转移的方向和数目。
你学会了吗?
钠与氯反应中的电子转移还可以这样表示。
0
+1
失去 e-
失电子
×
2
1
0
-1
得电子
×
2
得到 e-
1
你知道吗?
5.2.1 表示谁变谁
5.2.2 书写步骤
表示在反应前后同一元素电子得失的数目
0
+1
失去 e-
×
2
0
-1
×
2
得到 e-
5. 电子转移表示方法
5.2 双线桥法
1
2
3
标出价态发生改变元素的化合价
用双箭头表示,箭头从反应物中的变价元素指向生成物的同一种元素
注电子 定数目
三步骤
0
+1
0
-1
0
+1
0
-1
5. 电子转移表示方法
标变价
画单桥
标总数
0
+1
0
-1
失去
e-
×
2
得到
e-
×
2
你学会了吗?
用双线桥表示电子转移的方向和数目。
Zn+H2SO4 = ZnSO4+H2↑
标出价态发生改变元素的化合价
Zn+H2SO4 = ZnSO4+H2↑
在反应物中从失电子元素指向得电子元素
注电子,定数目
0
+2
+1
0
Zn+H2SO4 = ZnSO4+H2↑
0
+2
+1
0
Zn+H2SO4 = ZnSO4+H2↑
0
+2
+1
0
失去
2e-
×
1
得到
e-
×
2
价态变化原子个数 × 每个原子得失电子数
失电子总数=得电子总数
标变价
画单桥
标总数
特别提醒
电子转移数以m×ne-的形式表示
m表示发生氧化还原反应的原子个数
n表示每个原子得到或失去电子的数目
当n=1时,要省略。
2
6
温馨提醒
判断下列电子转移的方向和数目是否正确
考考你的智慧
用双线桥表示以下反应中电子转移的方向和数目。
①Fe+CuSO4=FeSO4+Cu
②2H2O2=2H2O+O2↑
③2KMnO4=K2MnO4+MnO2+O2↑
④Cl2+H2O HCl+HClO
⑤Cl2+2NaI=2NaCl+I2
请你试一试
课堂小结
(1)NaCl→Cl2
(2)KMnO4→MnCl2
(3)Fe2O3→Fe
(4)CO→CO2
被氧化
被还原
被还原
被氧化
考考你自己
下列转化关系中,当左边物质生成右边物质时,画横线的元素是被氧化还是被还原?
在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,__________是氧化剂,______是还原剂,______元素被氧化,______元素被还原,氧化产物是_______,还原产物是_______。
K2Cr2O7
HCl
Cl
Cr
Cl2
CrCl3
考考你自己
看谁做得既准又快!
A. CuO+2HCl=CuCl2+H2O
B. 2NaI+Cl2=2NaCl+I2
C. Zn+CuSO4=ZnSO4+Cu
D. Ca(OH)2+CO2=CaCO3 ↓+ H2O
下列反应属于氧化还原反应的是
有单质参加或生成的化学反应一定是氧化还原反应吗?
挑战自我
放电
分别用单线桥和双线桥表示下列反应电子转移的方向和数目。
考考你自己
看谁做得既准又快!
下列化学方程式中电子转移方向、数目正确的是
感谢观看
氧化还原反应
第三节
第一章 物质及其变化
第一课时-概念和电子转移表示
合成氨
制硫酸
以下图示中包含了什么反应类型
学习目标01
学习目标
反应特征
反应前后价态发生改变的必是氧化还原反应
从价态考虑
学习目标02
反应本质
氧化还原反应中,发生了电子的得失
电子得失
学习目标03
认识概念
氧化剂、还原剂
氧化反应、还原反应
据电子得失理解
学习目标04
电子转移
单线桥
双线桥
表示方法
从拉瓦锡的氧化学说说起
01
知识回顾
还
原
反
应
氧
化
反
应
氧
化
反
应
物质得氧的反应
物质失氧的反应
氧化反应
还原反应
人们从得氧、失氧的角度,定义氧化反应和还原反应
背景知识
失去氧,
得到氧,
氧化剂
还原剂
被氧化,
发生氧化反应
被还原,
发生还原反应
同时发生
背景知识
氧化反应和还原反应一定同时发生的!
得氧的反应
1. 从得失氧角度分析
氧化反应
失氧的反应
还原反应
提供氧的反应物
氧化剂
得到氧的反应物
还原剂
从得失氧的角度分析
C得氧 被氧化 发生氧化反应
Fe2O3失氧 被还原 发生还原反应
你学会了吗?
从弗兰克兰的化合价概念说起
02
从四种基本反应及得氧失氧角度均无法分类!
该反应属于哪种反应类型?
以下三个反应都发生了得失氧,请分析在反应中元素的化合价是否发生了变化?
问题探究
0
得氧,发生氧化反应
0
+1
化合价升高 → 氧化反应(得氧)
失氧,发生还原反应
+2
化合价降低 → 还原反应(失氧)
得失氧和化合价升降关系
得失氧和化合价升降关系
氧化铜
氢气
还原反应
氧化反应
化
合
价
降
低
化
合
价
升
高
共热
从化合价升降角度关系
化合价
降低
还原反应
化合价
升高
氧化反应
从化合价角度,分析以下氧化还原反应
0
+1
0
-1
化合价升高,氧化反应
化合价降低,还原反应
请你试一试
从化合价角度,分析以下氧化还原反应
化合价降低 还原反应(被还原)
+2
0
0
+2
化合价升高 氧化反应(被氧化)
并非只有得氧、失氧的反应才是氧化还原反应。
凡是有元素化合价升降的化学反应都是氧化还原反应。
你学会了吗?
2. 从化合价改变分析
2.1 氧化还原反应与非氧化还原反应
元素化合价发生变化的反应
氧化还原反应
元素化合价不发生变化的反应
非氧化还原反应
2.2 氧化反应与还原反应
反应物中元素化合价升高的反应
氧化反应
反应物中元素化合价降低的反应
还原反应
2. 从化合价改变分析
氧化剂
还原剂
从化合价升降角度关系
0
化合价 升高 氧化反应
0
+1
化合价 降低 还原反应
+2
2. 从化合价改变分析
2.3 氧化剂与还原剂
元素化合价降低的反应物
氧化剂
元素化合价升高的反应物
还原剂
请你试一试
化合价
升高
被氧化
化合价
降低
被还原
氧
化
剂
还
原
剂
请按左图形式,完成以下反应。
1. Cu+Cl2=CuCl2
2. Cu+2FeCl3=CuCl2+2FeCl2
氧化剂
还原剂
还原产物
氧化产物
化合价升高
被氧化
化合价降低
被还原
归纳与整理
A . Fe是氧化剂
B . CuSO4 是氧化剂
C . Fe被氧化
D . CuSO4 发生氧化反应
例题
我国古代有湿法炼铜的记载“曾青得铁化为铜”,反应为
0
+2
+2
0
有关该反应的下列说法正确的是
A.HCl→Cl2
B.CO→CO2
C.SO2→SO3
D.FeCl3→FeCl2
考考你的智慧
下列变化中,加入还原剂可以实现的是
感受氧化还原反应的存在
人体正常血红蛋白中含有Fe2+,若误食亚硝酸钠,会导致Fe2+转化为Fe3+而中毒,服用维生素C可以解毒。
对上述事实分析正确的是
学以致用
A.维生素C是氧化剂
B.维生素C将Fe3+还原成Fe2+
C.亚硝酸钠是还原剂
D.亚硝酸钠被氧化
氧化还原反应与四种基本反应类型关系?
03
化学反应 基本类型 氧化还原反应
分解反应
分解反应
化合反应
化合反应
置换反应
复分解反应
×
√
×
√
√
×
从中你发现什么结论?
交流与研讨
氧化还原反应和四种基本反应类型之间有何关系?
问题探究
化合反应
置换反应
复分解反应
分解反应
氧化还原反应
非氧化还原反应
化合价发生改变
化合价发生改变
化合价无改变
化合价无改变
氧化还原反应
置换反应
复分解反应
3. 四种基本反应类型与氧化还原反应关系
化合反应
分解反应
能正确表示四种基本反应类型与氧化还原反应关系的示意图是
你学会了吗?
√
从汤姆孙发现电子说起
04
0
+1
-1
0
Na显+1价,Cl呈-1价?
问题探究
钠和氯的反应
元素的化合价为什么会发生变化?
化合价的升降原因是什么?
Na
Cl
化合价升降的原因是
电子的得失
问题探究
电子得失
共用电子对偏移
电子的转移
Na+离子
Cl-离子
4. 本质及概念
4.1 本质
氧化反应
还原反应
4. 本质及概念
氧化还原反应与电子转移示意图
0
+1
-1
0
化合价升高
被氧化
还原剂
化合价降低
被还原
氧化剂
失电子
得电子
4. 本质及概念
氧化剂和还原剂
氧化剂
还原剂
得到电子,被还原
失去电子,被氧化
n个e-
4. 本质及概念
从电子得失认识氧化还原反应
4. 本质及概念
4.2 两剂
得到电子的物质
氧化剂
失去电子的物质
还原剂
电子从还原剂转移到氧化剂的示意图
C-
还原剂
氧化剂
4. 本质及概念
4.2 两剂
Mg、Al在反应中作什么剂?
Mg、Al在反应中表现什么性质?
还原性
问题探究
问题探究
S、Cl2在反应中作什么剂?
S、Cl2在反应中表现什么性质?
氧化性
4.3.1 氧化性
物质得到电子的性质
4.3.2 还原性
物质失去电子的性质
氧化剂
氧化性
还原反应
还原产物
具有
发生
生成
4. 本质及概念
4.3 两性
下图为反应Fe+CuSO4=Cu+FeSO4中电子转移的关系图,则图中的元素甲、乙分别表示
A.Fe、S B.Cu、S
C.Fe、O D.Fe、Cu
你学会了吗?
氧化还原反应中电子转移如何表示?
05
Na
Cl
Na+
Cl-
如何表示反应中电子的得失?
2
氯化钠的形成过程
5.1.1 表示谁给谁
5.1.2 书写步骤
2
表示氧化剂与还原剂之间电子转移的方向和数目
5. 电子转移表示方法
5.1 单线桥法
1
2
3
标出价态发生改变元素的化合价
在反应物中从失电子元素指向得电子元素
注电子 定数目
三步骤
0
+1
0
-1
0
+1
0
-1
0
+1
0
-1
2
5. 电子转移表示方法
标变价
画单桥
标总数
2e-
失去
e-
2e-
5. 电子转移表示方法
以下表示方法,是否合理?
箭头由失电子元素指向得电子元素
只标明电子转移的数目,不标“得到”或“失去”
温馨提醒
用单线桥表示电子转移的方向和数目。
Zn+H2SO4 = ZnSO4+H2↑
你学会了吗?
标变价
画单桥
标总数
标出价态发生改变元素的化合价
Zn+H2SO4 = ZnSO4+H2↑
在反应物中从失电子元素指向得电子元素
注电子,定数目
0
+2
+1
0
Zn+H2SO4 = ZnSO4+H2↑
0
+2
+1
0
Zn+H2SO4 = ZnSO4+H2↑
0
+2
+1
0
2e-
失电子总数=得电子总数=转移电子总数
ne-
特别提醒
如何验证锌与稀硫酸的反应中,有电子转移 ?
实验探究
用单线桥表示电子转移的方向和数目。
你学会了吗?
钠与氯反应中的电子转移还可以这样表示。
0
+1
失去 e-
失电子
×
2
1
0
-1
得电子
×
2
得到 e-
1
你知道吗?
5.2.1 表示谁变谁
5.2.2 书写步骤
表示在反应前后同一元素电子得失的数目
0
+1
失去 e-
×
2
0
-1
×
2
得到 e-
5. 电子转移表示方法
5.2 双线桥法
1
2
3
标出价态发生改变元素的化合价
用双箭头表示,箭头从反应物中的变价元素指向生成物的同一种元素
注电子 定数目
三步骤
0
+1
0
-1
0
+1
0
-1
5. 电子转移表示方法
标变价
画单桥
标总数
0
+1
0
-1
失去
e-
×
2
得到
e-
×
2
你学会了吗?
用双线桥表示电子转移的方向和数目。
Zn+H2SO4 = ZnSO4+H2↑
标出价态发生改变元素的化合价
Zn+H2SO4 = ZnSO4+H2↑
在反应物中从失电子元素指向得电子元素
注电子,定数目
0
+2
+1
0
Zn+H2SO4 = ZnSO4+H2↑
0
+2
+1
0
Zn+H2SO4 = ZnSO4+H2↑
0
+2
+1
0
失去
2e-
×
1
得到
e-
×
2
价态变化原子个数 × 每个原子得失电子数
失电子总数=得电子总数
标变价
画单桥
标总数
特别提醒
电子转移数以m×ne-的形式表示
m表示发生氧化还原反应的原子个数
n表示每个原子得到或失去电子的数目
当n=1时,要省略。
2
6
温馨提醒
判断下列电子转移的方向和数目是否正确
考考你的智慧
用双线桥表示以下反应中电子转移的方向和数目。
①Fe+CuSO4=FeSO4+Cu
②2H2O2=2H2O+O2↑
③2KMnO4=K2MnO4+MnO2+O2↑
④Cl2+H2O HCl+HClO
⑤Cl2+2NaI=2NaCl+I2
请你试一试
课堂小结
(1)NaCl→Cl2
(2)KMnO4→MnCl2
(3)Fe2O3→Fe
(4)CO→CO2
被氧化
被还原
被还原
被氧化
考考你自己
下列转化关系中,当左边物质生成右边物质时,画横线的元素是被氧化还是被还原?
在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中,__________是氧化剂,______是还原剂,______元素被氧化,______元素被还原,氧化产物是_______,还原产物是_______。
K2Cr2O7
HCl
Cl
Cr
Cl2
CrCl3
考考你自己
看谁做得既准又快!
A. CuO+2HCl=CuCl2+H2O
B. 2NaI+Cl2=2NaCl+I2
C. Zn+CuSO4=ZnSO4+Cu
D. Ca(OH)2+CO2=CaCO3 ↓+ H2O
下列反应属于氧化还原反应的是
有单质参加或生成的化学反应一定是氧化还原反应吗?
挑战自我
放电
分别用单线桥和双线桥表示下列反应电子转移的方向和数目。
考考你自己
看谁做得既准又快!
下列化学方程式中电子转移方向、数目正确的是
感谢观看
