化学人教版(2019)选择性必修3 1.1.2有机化合物中的化学键和同分异构体(共31张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 1.1.2有机化合物中的化学键和同分异构体(共31张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 20.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-18 08:42:32 | ||
图片预览





文档简介
(共31张PPT)
第一章 有机化合物的结构特点与研究方法
第一节 有机化合物的结构特点
第2课时
有机化合物中的化学键和同分异构体
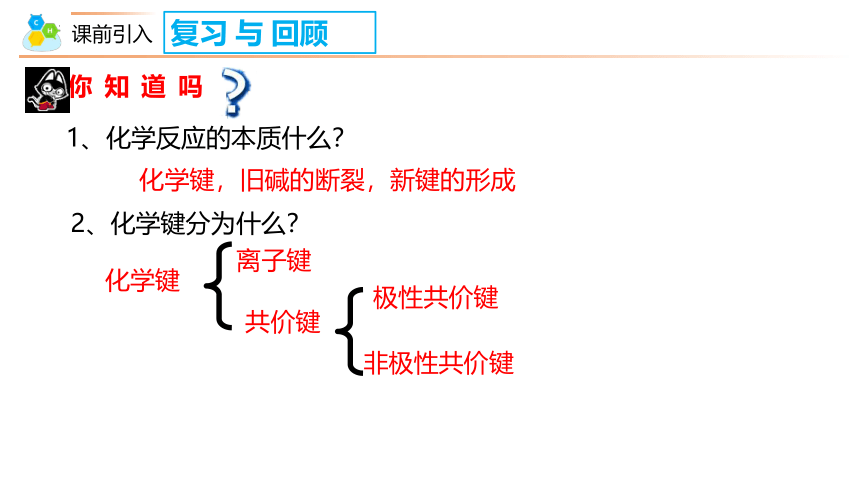
你知道吗
复习 与 回顾
1、化学反应的本质什么?
化学键
化学键,旧碱的断裂,新键的形成
2、化学键分为什么?
离子键
共价键
极性共价键
非极性共价键
你知道吗
在有机化合物的分子中,碳原子通过共用电子对与其它原子形成不同类型的共价键,共价键的类型和极性对有机化合物的性质有很大影响。
例如:乙烷不能发生加成反应,乙烯含有碳碳双键,能发生加成反应,二者碳碳共价键的类型有什么不同呢?
模块2 有机化中的共价键
【化学史话】
有机化合物的三维结构
19世纪中叶前,人们对有机化合物结构的认识还停留在二维空间。随着有机化学的发展,大量异构体被合成和发现,人们的认识逐步深入。当时人们认为二取代甲烷(如CH2R2)有两种异构体,但是无法合成它的第二种异构体。1874年9月,荷兰化学家范特霍夫(J.H.van’t Hoff)提出碳原子成键的新解释,成功地解决了这个问题。
立体结构的CH2R2
平面结构的CH2R2
S轨道
杂化轨道理论与有机化合物空间形状
拓展视野
P轨道
科学视野:《碳原子SP3的杂化与甲烷分子的结构》
S-S σ键
S-P σ键
P-P σ键
“头碰头”
共价键可形成两种键型:
特征:轴对称,强度较大,组成的两个原子可以围绕键轴旋转。
思考交流
1.共价键根据重叠方式不同如何分类?碳形成的是哪类共价键?
σ键
“肩并肩”
π键
P
P
p-pπ键
特征:镜面对称,不如σ键牢固易断裂,不能旋转。
单键为σ键,双键为1个σ键1个π键,三键为1个σ键2个π键。
思考交流
2.根据甲烷分子的结构,CH4的空间构型是?杂化轨道为?键角为多少?如何证明甲烷是正四面体而不是平面结构?
分子式 电子式 结构式 空间结构
CH4
球棍摸型 比例模型
正四面体
H
..
H C H
H
..
..
..
H-C-H
H
H
109°28′
那么,共价键的空间构型由哪些因素决定呢?
甲烷的二氯代物只有一种,证明甲烷是正四面体而不是平面结构。
有机分子 CH4 CH2=CH2 CH≡CH C6H6
碳原子轨道杂化方式 SP3 SP2 SP
SP2
分子形状 特点 正四面体 平面 直线 平面
几种简单有机分子中碳原子轨道的杂化方式
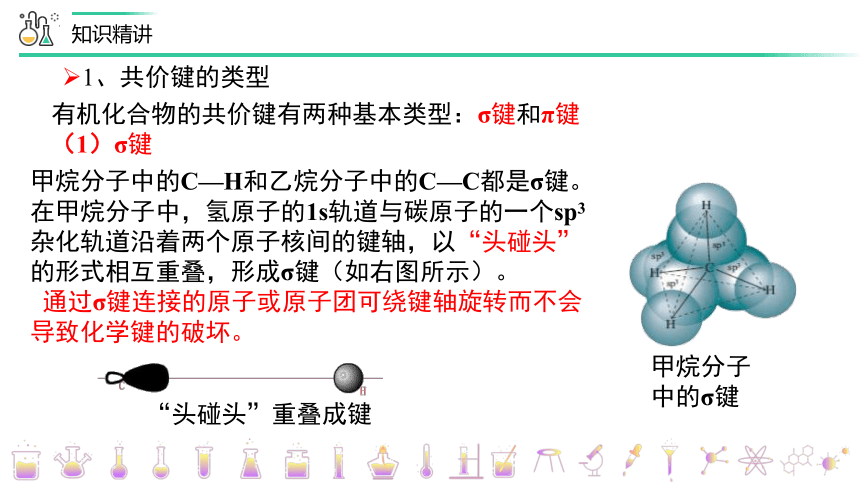
有机化合物的共价键有两种基本类型:σ键和π键
(1)σ键
1、共价键的类型
甲烷分子中的C—H和乙烷分子中的C—C都是σ键。在甲烷分子中,氢原子的1s轨道与碳原子的一个sp3杂化轨道沿着两个原子核间的键轴,以“头碰头”的形式相互重叠,形成σ键(如右图所示)。
通过σ键连接的原子或原子团可绕键轴旋转而不会导致化学键的破坏。
“头碰头”重叠成键
甲烷分子中的σ键
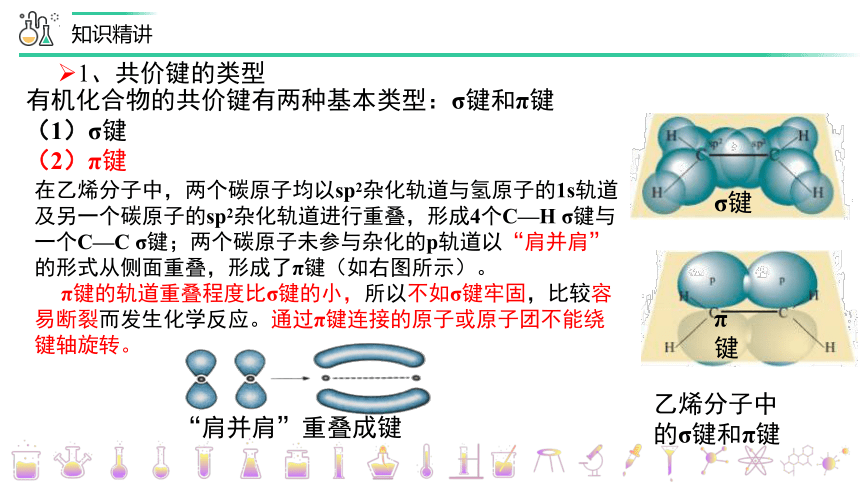
在乙烯分子中,两个碳原子均以sp2杂化轨道与氢原子的1s轨道及另一个碳原子的sp2杂化轨道进行重叠,形成4个C—H σ键与一个C—C σ键;两个碳原子未参与杂化的p轨道以“肩并肩”的形式从侧面重叠,形成了π键(如右图所示)。
π键的轨道重叠程度比σ键的小,所以不如σ键牢固,比较容易断裂而发生化学反应。通过π键连接的原子或原子团不能绕键轴旋转。
有机化合物的共价键有两种基本类型:σ键和π键
(1)σ键
(2)π键
σ键
π键
乙烯分子中
的σ键和π键
1、共价键的类型
“肩并肩”重叠成键
应用探究
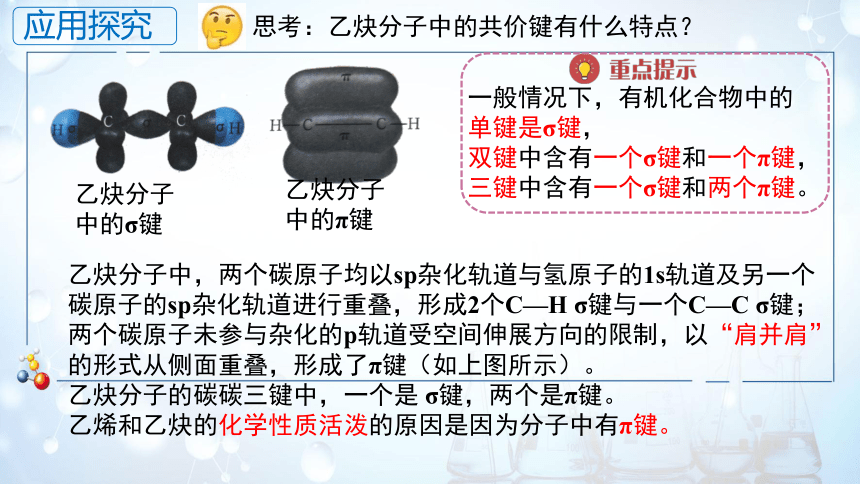
思考:乙炔分子中的共价键有什么特点?
乙炔分子中的σ键
乙炔分子中的π键
乙炔分子中,两个碳原子均以sp杂化轨道与氢原子的1s轨道及另一个碳原子的sp杂化轨道进行重叠,形成2个C—H σ键与一个C—C σ键;两个碳原子未参与杂化的p轨道受空间伸展方向的限制,以“肩并肩”的形式从侧面重叠,形成了π键(如上图所示)。
乙炔分子的碳碳三键中,一个是 σ键,两个是π键。
乙烯和乙炔的化学性质活泼的原因是因为分子中有π键。
一般情况下,有机化合物中的单键是σ键,
双键中含有一个σ键和一个π键,
三键中含有一个σ键和两个π键。
思考:1.为什么乙烯是平面型分子,乙烯所有原子一定共平面吗?
σ键
π键
乙烯分子中
的σ键和π键
CH2=CH2+Br2 CH2Br—CH2Br
共价键类型与反应类型密切相关。
例如,甲烷分子中含有C—H σ键,能发生取代反应;
乙烯和乙炔分子的双键和三键中含有π键,它们都能发生加成反应。
解题通法
应用探究
2.烯烃在发生加成反应时,
断裂的是σ键还是π键?
π键不能绕轴旋转
断裂的是π键,烯烃在发生加成、加聚反应时,都是π键断裂,比较牢固的σ键保留。
题型1:判断碳σ键和π键
请从化学键和官能团的角度分析下列反应中有机化合物的变化。
思考与讨论:
(1)CH4+Cl2 CH3Cl+HCl
光
(2)CH2=CH2+Br2 CH2Br—CH2Br
σ键断裂
π键断裂
题型1:判断碳σ键和π键
【例】写出丙烯与溴单质、乙醇催化氧化反应的化学方程式,分析反应前后有机化合物官能团与化学键的变化。
CH2=CH—CH3+Br2
CH2—CH—CH3
Br
Br
2CH3CH2OH+O2
Cu△
2CH3—C—H+2H2O
=
O
碳碳双键(含有π键)
碳溴键(不含π键)
羟基
(不含π键)
醛基
(含有π键)
【实验】向两只分别盛有蒸馏水和无水乙醇的烧杯中各加入同样大小的钠(约绿豆大),观察现象。
水和钠 无水乙醇和钠
实验 原理 2Na+2H2O=2NaOH+H2↑ 2CH3CH2OH+2Na→2CH3CH2ONa(乙醇钠)+H2↑
实验现象 浮、熔、游、响、红 钠沉入底部,有气体产生,最终钠粒消失,液体仍为无色透明。
剧烈程度 剧烈程度:H2O>CH3CH2OH 受乙基的影响,乙醇分子中氢氧键的极性比水分子氢氧键的极性弱,乙醇比水更难电离出氢离子
基团之间的相互影响使得官能团中化学键的极性发生变化,从而影响官能团和物质的性质。
思考与讨论
H—C—C—O—H
H
H
H
H
思考:乙醇分子的结构如下图,全为σ键,在一定条件下可以发生与Na、HBr的反应,方程式如下,断键有什么特点?
H—C—C—O—H+H—Br
H
H
H
H
△
H—C—C—Br+H2O
H
H
H
H
思考与讨论
思考1:乙醇分子的结构如下图,全为σ键,在一定条件下可以发生与Na、HBr的反应,方程式如下,断键有什么特点?
为什么乙醇与钠能发生反应放出氢气?
原因在于乙醇分子中的氢氧键极性较强,能够发生断裂
同样条件下,为什么乙醇与钠的反应没有水与钠的反应剧烈?
这是由于乙醇分子中氢氧键的极性比水分子中氢氧键的极性弱。
基团之间的相互影响使官能团中化学键的极性发生变化,从而影响官能团和物质的性质。
思考:分析以上反应,为什么碳氧键发生断裂?
由于不同的成键原子间电负性的差异,共用电子对会发生偏移。
偏移的程度越大,共价键极性越强,在反应中越容易发生断裂。
因此有机化合物的官能团及其邻近的化学键往往是发生化学反应的活性部位。
H—C—C—O—H+H—Br
H
H
H
H
△
H—C—C—Br+H2O
2、共价键的极性和有机反应
由于羟基中氧原子的电负性比较大,乙醇分子中的碳氧键极性也较强,在乙醇与氢溴酸的反应中,碳氧键发生了断裂。
H
H
H
H
1.共价键的断裂需要吸收能量,而且有机化合物分子中的共价键断裂的位置存在多种可能。相对无机反应,有机反应一般反应速率较小,副反应较多,产物比较复杂。
2.共价键是否具有极性以及极性的强弱程度对有机化合物的性质有着重要的影响。应注意的是,键的极性并不是一成不变的,受分子中邻近基团或外界环境的影响,键的极性及其强弱程度可能会发生变化。
共价键的极性和有机反应
易错提醒
思考与讨论
由于不同的成键原子间电负性的差异,共用电子对会发生偏移。偏移的程度越大,共价键极性越强,在反应中越容易断裂。因此有机化合物的官能团及其邻近的化学键往往是发生化学反应的活性部位。
思考2:根据刚才的学习,试想丙烯酸可能断裂的化学键,并举例说明断裂该化学键发生的化学反应。
题型2:有机物的综合知识
【例2】维生素C是重要的营养素,其分子结构如右图所示:
(1)维生素C的分子式为 ,相对分子质量为 ,
含氧的质量分数为 。
(2)维生素C含有的官能团的名称是 。
(3)维生素C易溶于水,可能的原因是 。
(4)维生素C具有较强的还原性,向碘和淀粉的混合液中加入维生素C,可观察到的现象是 。
C6H8O6
176
54.5%
酯基,羟基,碳碳双键
多个羟基,可与水形成分子间氢键
溶液由蓝色变为无色
CH2—CH
OH
OH
CH
C
C
C
O
OH
HO
O
课堂小结:
1、共价键根据原子轨道的重叠方式可以分为几类?
共价键的类型
σ键
Π键
可绕键轴旋转
不能绕键轴旋转
2、共价键根据共用电子对数多少又可分为单键、双键、三键,单键、双键、三键与σ键、Π键之间有什么关系?
有机化合物的共价键
双键中含有一个σ键和一个Π键
单键是σ键
三键中含有一个σ键和两个Π键
3、烷烃与溴水不反应,而烯烃、炔烃可以与溴水发生加成反应,
说明在有机物中哪一类共价键较活泼?
一般有机物中Π键比σ键活泼,易与发生反应
共价键
两种基本类型
(和有机反应)
σ键
π键
共价键的极性越强,
在有机反应中越容易断裂
有机化物中单键是σ键,
双键中含有一个σ键和一个π键,
三键中含有一个σ键和两个π键。
可绕键轴旋转
不能绕键轴旋转
易取代反应;
易加成反应。
有机物 甲烷 乙烯 乙炔 苯
分子式
结构式
球棍模型
比例模型
分子的 空间构型
碳原子轨道杂化方式 /化学键 SP3 SP2 SP
SP2
C=C
H
H
H
H
H-C≡C-H
CH4
C2H4
C2H2
正四面体
平面型
“2+4共面”
直线型
“2+2共线”
空间的结构
平面型
“6+6共面”
C6H6
σ键
σ键
Π键
σ键
Π键
Π键
【补充】 键角:决定分子的空间结构 键长越短,键越牢固;键能越大,键越牢固。
109 28′
109 28′
直线型,键角1800
平面型,键角120°
120
180
四面体,键角120°
2、共价键的三个键参数
(1)键能气态原子形成1 mol共价单键所释放的能量(破坏1 mol单键所吸收的能量)叫做键能。
(2)键长 分子中两个成键原子的核间距离叫做键长。
(3)键角 在分子中键和键之间的夹角叫做键角。
共价键参数
共价键 键能大小(kJ/mol) 键长pm
CH4 C-H 413.4 109.3
NH3 N-H 100.8
H2O O-H 463 95.8
HF H-F 566 91.8
分子的稳定性
分子空间构型
一般说来,键长越短,键能越大,键越牢固。
1.下列分子中的14个碳原子不可能共面的是( )
A.
B.
C.
D.
BD
课堂练习
2.下列关于CH3—CH=CH—C≡C—CF3分子的结构叙述正确的是( )
A、6个碳原子有可能都在一条直线上
B、6个碳原子不可能都在一条直线上
C、6个碳原子一定都在同一平面上
D、6个碳原子不可能都在同一平面上
BC
课堂练习
3.下列分子中的所有碳原子一定都共面的是( )
A.
B.
C.
D.
CD
课堂练习
第一章 有机化合物的结构特点与研究方法
第一节 有机化合物的结构特点
第2课时
有机化合物中的化学键和同分异构体
你知道吗
复习 与 回顾
1、化学反应的本质什么?
化学键
化学键,旧碱的断裂,新键的形成
2、化学键分为什么?
离子键
共价键
极性共价键
非极性共价键
你知道吗
在有机化合物的分子中,碳原子通过共用电子对与其它原子形成不同类型的共价键,共价键的类型和极性对有机化合物的性质有很大影响。
例如:乙烷不能发生加成反应,乙烯含有碳碳双键,能发生加成反应,二者碳碳共价键的类型有什么不同呢?
模块2 有机化中的共价键
【化学史话】
有机化合物的三维结构
19世纪中叶前,人们对有机化合物结构的认识还停留在二维空间。随着有机化学的发展,大量异构体被合成和发现,人们的认识逐步深入。当时人们认为二取代甲烷(如CH2R2)有两种异构体,但是无法合成它的第二种异构体。1874年9月,荷兰化学家范特霍夫(J.H.van’t Hoff)提出碳原子成键的新解释,成功地解决了这个问题。
立体结构的CH2R2
平面结构的CH2R2
S轨道
杂化轨道理论与有机化合物空间形状
拓展视野
P轨道
科学视野:《碳原子SP3的杂化与甲烷分子的结构》
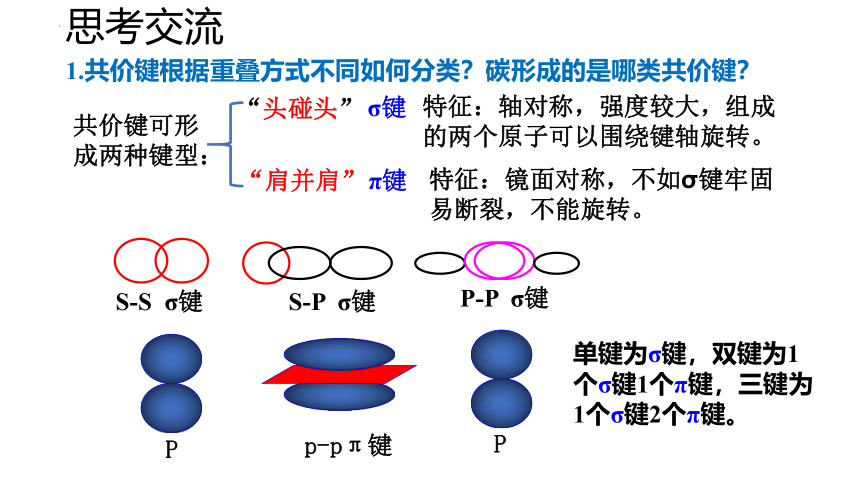
S-S σ键
S-P σ键
P-P σ键
“头碰头”
共价键可形成两种键型:
特征:轴对称,强度较大,组成的两个原子可以围绕键轴旋转。
思考交流
1.共价键根据重叠方式不同如何分类?碳形成的是哪类共价键?
σ键
“肩并肩”
π键
P
P
p-pπ键
特征:镜面对称,不如σ键牢固易断裂,不能旋转。
单键为σ键,双键为1个σ键1个π键,三键为1个σ键2个π键。
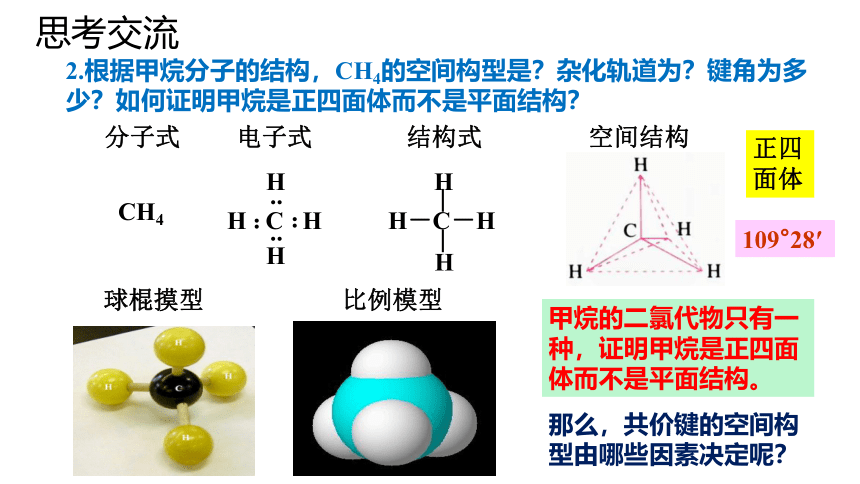
思考交流
2.根据甲烷分子的结构,CH4的空间构型是?杂化轨道为?键角为多少?如何证明甲烷是正四面体而不是平面结构?
分子式 电子式 结构式 空间结构
CH4
球棍摸型 比例模型
正四面体
H
..
H C H
H
..
..
..
H-C-H
H
H
109°28′
那么,共价键的空间构型由哪些因素决定呢?
甲烷的二氯代物只有一种,证明甲烷是正四面体而不是平面结构。
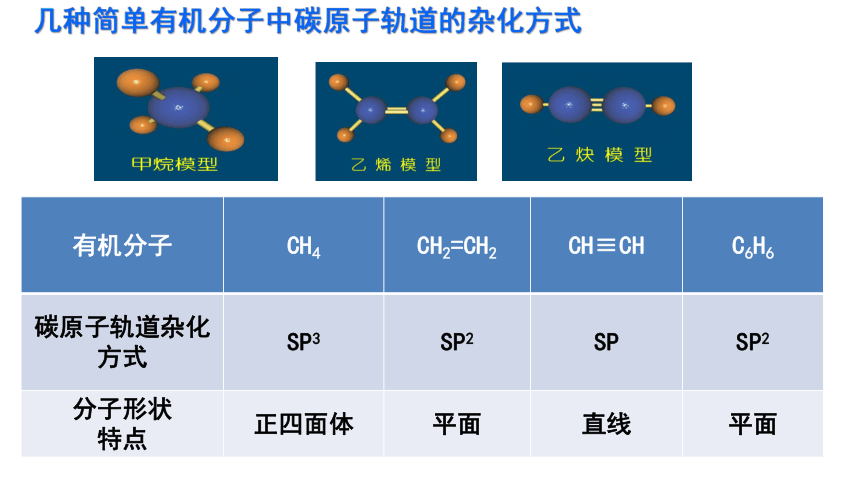
有机分子 CH4 CH2=CH2 CH≡CH C6H6
碳原子轨道杂化方式 SP3 SP2 SP
SP2
分子形状 特点 正四面体 平面 直线 平面
几种简单有机分子中碳原子轨道的杂化方式
有机化合物的共价键有两种基本类型:σ键和π键
(1)σ键
1、共价键的类型
甲烷分子中的C—H和乙烷分子中的C—C都是σ键。在甲烷分子中,氢原子的1s轨道与碳原子的一个sp3杂化轨道沿着两个原子核间的键轴,以“头碰头”的形式相互重叠,形成σ键(如右图所示)。
通过σ键连接的原子或原子团可绕键轴旋转而不会导致化学键的破坏。
“头碰头”重叠成键
甲烷分子中的σ键
在乙烯分子中,两个碳原子均以sp2杂化轨道与氢原子的1s轨道及另一个碳原子的sp2杂化轨道进行重叠,形成4个C—H σ键与一个C—C σ键;两个碳原子未参与杂化的p轨道以“肩并肩”的形式从侧面重叠,形成了π键(如右图所示)。
π键的轨道重叠程度比σ键的小,所以不如σ键牢固,比较容易断裂而发生化学反应。通过π键连接的原子或原子团不能绕键轴旋转。
有机化合物的共价键有两种基本类型:σ键和π键
(1)σ键
(2)π键
σ键
π键
乙烯分子中
的σ键和π键
1、共价键的类型
“肩并肩”重叠成键
应用探究
思考:乙炔分子中的共价键有什么特点?
乙炔分子中的σ键
乙炔分子中的π键
乙炔分子中,两个碳原子均以sp杂化轨道与氢原子的1s轨道及另一个碳原子的sp杂化轨道进行重叠,形成2个C—H σ键与一个C—C σ键;两个碳原子未参与杂化的p轨道受空间伸展方向的限制,以“肩并肩”的形式从侧面重叠,形成了π键(如上图所示)。
乙炔分子的碳碳三键中,一个是 σ键,两个是π键。
乙烯和乙炔的化学性质活泼的原因是因为分子中有π键。
一般情况下,有机化合物中的单键是σ键,
双键中含有一个σ键和一个π键,
三键中含有一个σ键和两个π键。
思考:1.为什么乙烯是平面型分子,乙烯所有原子一定共平面吗?
σ键
π键
乙烯分子中
的σ键和π键
CH2=CH2+Br2 CH2Br—CH2Br
共价键类型与反应类型密切相关。
例如,甲烷分子中含有C—H σ键,能发生取代反应;
乙烯和乙炔分子的双键和三键中含有π键,它们都能发生加成反应。
解题通法
应用探究
2.烯烃在发生加成反应时,
断裂的是σ键还是π键?
π键不能绕轴旋转
断裂的是π键,烯烃在发生加成、加聚反应时,都是π键断裂,比较牢固的σ键保留。
题型1:判断碳σ键和π键
请从化学键和官能团的角度分析下列反应中有机化合物的变化。
思考与讨论:
(1)CH4+Cl2 CH3Cl+HCl
光
(2)CH2=CH2+Br2 CH2Br—CH2Br
σ键断裂
π键断裂
题型1:判断碳σ键和π键
【例】写出丙烯与溴单质、乙醇催化氧化反应的化学方程式,分析反应前后有机化合物官能团与化学键的变化。
CH2=CH—CH3+Br2
CH2—CH—CH3
Br
Br
2CH3CH2OH+O2
Cu△
2CH3—C—H+2H2O
=
O
碳碳双键(含有π键)
碳溴键(不含π键)
羟基
(不含π键)
醛基
(含有π键)
【实验】向两只分别盛有蒸馏水和无水乙醇的烧杯中各加入同样大小的钠(约绿豆大),观察现象。
水和钠 无水乙醇和钠
实验 原理 2Na+2H2O=2NaOH+H2↑ 2CH3CH2OH+2Na→2CH3CH2ONa(乙醇钠)+H2↑
实验现象 浮、熔、游、响、红 钠沉入底部,有气体产生,最终钠粒消失,液体仍为无色透明。
剧烈程度 剧烈程度:H2O>CH3CH2OH 受乙基的影响,乙醇分子中氢氧键的极性比水分子氢氧键的极性弱,乙醇比水更难电离出氢离子
基团之间的相互影响使得官能团中化学键的极性发生变化,从而影响官能团和物质的性质。
思考与讨论
H—C—C—O—H
H
H
H
H
思考:乙醇分子的结构如下图,全为σ键,在一定条件下可以发生与Na、HBr的反应,方程式如下,断键有什么特点?
H—C—C—O—H+H—Br
H
H
H
H
△
H—C—C—Br+H2O
H
H
H
H
思考与讨论
思考1:乙醇分子的结构如下图,全为σ键,在一定条件下可以发生与Na、HBr的反应,方程式如下,断键有什么特点?
为什么乙醇与钠能发生反应放出氢气?
原因在于乙醇分子中的氢氧键极性较强,能够发生断裂
同样条件下,为什么乙醇与钠的反应没有水与钠的反应剧烈?
这是由于乙醇分子中氢氧键的极性比水分子中氢氧键的极性弱。
基团之间的相互影响使官能团中化学键的极性发生变化,从而影响官能团和物质的性质。
思考:分析以上反应,为什么碳氧键发生断裂?
由于不同的成键原子间电负性的差异,共用电子对会发生偏移。
偏移的程度越大,共价键极性越强,在反应中越容易发生断裂。
因此有机化合物的官能团及其邻近的化学键往往是发生化学反应的活性部位。
H—C—C—O—H+H—Br
H
H
H
H
△
H—C—C—Br+H2O
2、共价键的极性和有机反应
由于羟基中氧原子的电负性比较大,乙醇分子中的碳氧键极性也较强,在乙醇与氢溴酸的反应中,碳氧键发生了断裂。
H
H
H
H
1.共价键的断裂需要吸收能量,而且有机化合物分子中的共价键断裂的位置存在多种可能。相对无机反应,有机反应一般反应速率较小,副反应较多,产物比较复杂。
2.共价键是否具有极性以及极性的强弱程度对有机化合物的性质有着重要的影响。应注意的是,键的极性并不是一成不变的,受分子中邻近基团或外界环境的影响,键的极性及其强弱程度可能会发生变化。
共价键的极性和有机反应
易错提醒
思考与讨论
由于不同的成键原子间电负性的差异,共用电子对会发生偏移。偏移的程度越大,共价键极性越强,在反应中越容易断裂。因此有机化合物的官能团及其邻近的化学键往往是发生化学反应的活性部位。
思考2:根据刚才的学习,试想丙烯酸可能断裂的化学键,并举例说明断裂该化学键发生的化学反应。
题型2:有机物的综合知识
【例2】维生素C是重要的营养素,其分子结构如右图所示:
(1)维生素C的分子式为 ,相对分子质量为 ,
含氧的质量分数为 。
(2)维生素C含有的官能团的名称是 。
(3)维生素C易溶于水,可能的原因是 。
(4)维生素C具有较强的还原性,向碘和淀粉的混合液中加入维生素C,可观察到的现象是 。
C6H8O6
176
54.5%
酯基,羟基,碳碳双键
多个羟基,可与水形成分子间氢键
溶液由蓝色变为无色
CH2—CH
OH
OH
CH
C
C
C
O
OH
HO
O
课堂小结:
1、共价键根据原子轨道的重叠方式可以分为几类?
共价键的类型
σ键
Π键
可绕键轴旋转
不能绕键轴旋转
2、共价键根据共用电子对数多少又可分为单键、双键、三键,单键、双键、三键与σ键、Π键之间有什么关系?
有机化合物的共价键
双键中含有一个σ键和一个Π键
单键是σ键
三键中含有一个σ键和两个Π键
3、烷烃与溴水不反应,而烯烃、炔烃可以与溴水发生加成反应,
说明在有机物中哪一类共价键较活泼?
一般有机物中Π键比σ键活泼,易与发生反应
共价键
两种基本类型
(和有机反应)
σ键
π键
共价键的极性越强,
在有机反应中越容易断裂
有机化物中单键是σ键,
双键中含有一个σ键和一个π键,
三键中含有一个σ键和两个π键。
可绕键轴旋转
不能绕键轴旋转
易取代反应;
易加成反应。
有机物 甲烷 乙烯 乙炔 苯
分子式
结构式
球棍模型
比例模型
分子的 空间构型
碳原子轨道杂化方式 /化学键 SP3 SP2 SP
SP2
C=C
H
H
H
H
H-C≡C-H
CH4
C2H4
C2H2
正四面体
平面型
“2+4共面”
直线型
“2+2共线”
空间的结构
平面型
“6+6共面”
C6H6
σ键
σ键
Π键
σ键
Π键
Π键
【补充】 键角:决定分子的空间结构 键长越短,键越牢固;键能越大,键越牢固。
109 28′
109 28′
直线型,键角1800
平面型,键角120°
120
180
四面体,键角120°
2、共价键的三个键参数
(1)键能气态原子形成1 mol共价单键所释放的能量(破坏1 mol单键所吸收的能量)叫做键能。
(2)键长 分子中两个成键原子的核间距离叫做键长。
(3)键角 在分子中键和键之间的夹角叫做键角。
共价键参数
共价键 键能大小(kJ/mol) 键长pm
CH4 C-H 413.4 109.3
NH3 N-H 100.8
H2O O-H 463 95.8
HF H-F 566 91.8
分子的稳定性
分子空间构型
一般说来,键长越短,键能越大,键越牢固。
1.下列分子中的14个碳原子不可能共面的是( )
A.
B.
C.
D.
BD
课堂练习
2.下列关于CH3—CH=CH—C≡C—CF3分子的结构叙述正确的是( )
A、6个碳原子有可能都在一条直线上
B、6个碳原子不可能都在一条直线上
C、6个碳原子一定都在同一平面上
D、6个碳原子不可能都在同一平面上
BC
课堂练习
3.下列分子中的所有碳原子一定都共面的是( )
A.
B.
C.
D.
CD
课堂练习
