化学人教版(2019)选择性必修2 3.2 分子晶体与原子晶体(共26张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修2 3.2 分子晶体与原子晶体(共26张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-18 11:14:26 | ||
图片预览





文档简介
(共26张PPT)
§3-2
分子晶体与原子晶体
人教版高中化学选择性必修二 第三章 晶体结构与性质
目录
分子晶体
1
原子晶体
2
人教版高中化学选修三 第二章 分子结构与性质
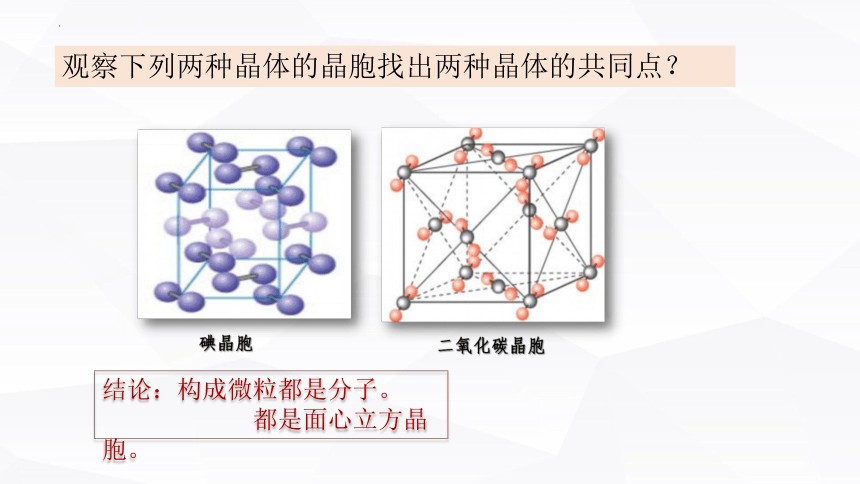
观察下列两种晶体的晶胞找出两种晶体的共同点?
结论:构成微粒都是分子。
都是面心立方晶胞。
碘晶胞
二氧化碳晶胞
分子间以分子间作用力相结合形成的晶体。
分子
分子内(共价键) 分子间(范德华力或氢键)
一.分子晶体
1、定义
分子晶体中存在的微粒:
粒子间的作用力:
熔化或气化需要破坏的作用力:
分子间作用力(范德华力或氢键)
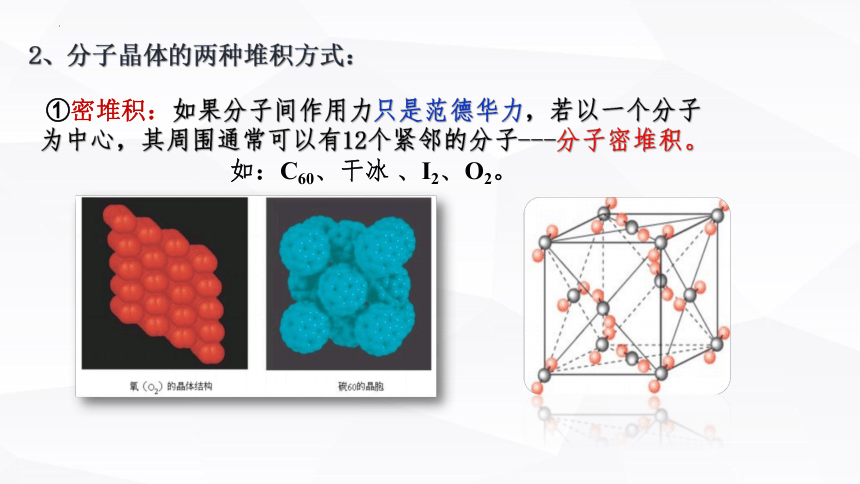
2、分子晶体的两种堆积方式:
①密堆积:如果分子间作用力只是范德华力,若以一个分子为中心,其周围通常可以有12个紧邻的分子---分子密堆积。如:C60、干冰 、I2、O2。
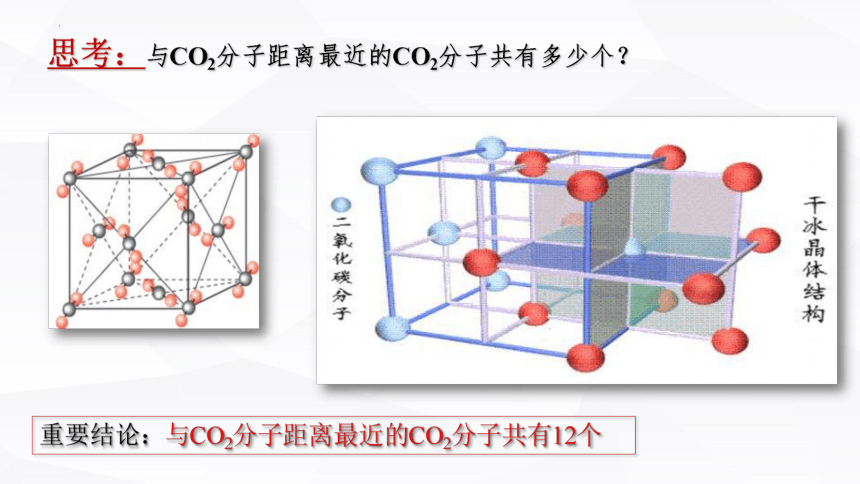
思考:与CO2分子距离最近的CO2分子共有多少个?
重要结论:与CO2分子距离最近的CO2分子共有12个
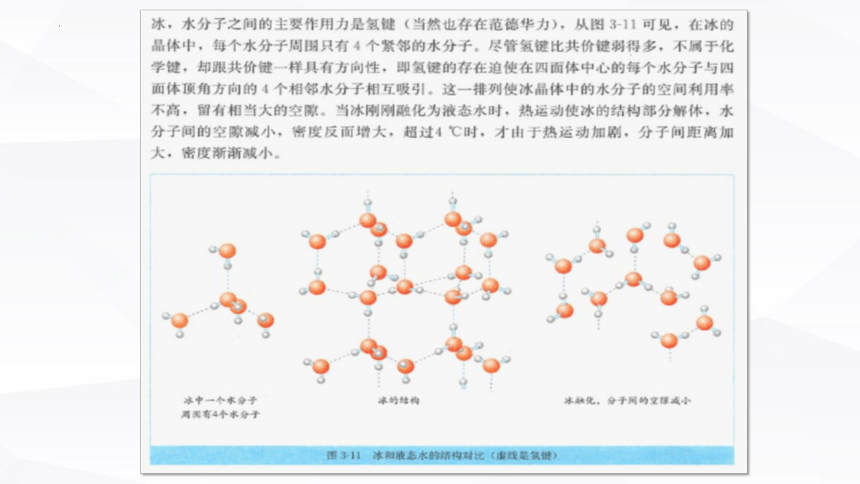
②非密堆积:如果除分子间作用力还有分子间氢键,则空间利用率不高,采用非密堆积(如:HF 、冰、NH3 )
重要结论:1个水分子周围距离最近有4个水分子
冰的结构
氢键具有方向性
3、常见的分子晶体
①所有非金属氢化物:
②几乎所有的酸:
③部分非金属单质:
④部分非金属氧化物:
⑤绝大多数有机物的晶体:
H2O、H2S、NH3、CH4、HX
H2SO4、HNO3、H3PO4(碱和盐则是离子晶体)
X2、O2、H2、 S8、P4、C60 、稀有气体
CO2、SO2、NO2、 P4O6、 P4O10
乙醇、冰醋酸、蔗糖、 苯、萘、蒽、苯甲酸等
4、分子晶体物理特性
①较低的熔点和沸点(易升华或易挥发)
②较小的硬度
③只存在分子,不存在离子,一般都是绝缘体,固态及熔融 状态也不导电。溶于水时部分导电
④多数能溶于适当的溶剂(相似相溶)。
1、分子晶体是否导电?什么条件下可以导电?
由于构成分子晶体的粒子是分子,不管是晶体或晶体熔化成的液体,都没有带电荷的离子存在,因此,分子晶体以及它熔化成的液体都不导电。
分子晶体溶于水时,水溶液有的能导电,如HCl溶于水,有的不导电,如C2H5OH溶于水。
深入探究:
2、为何分子晶体的硬度小,熔沸点低?
①构成晶体的微粒是分子
②分子之间以分子间作用力(主要是范德华力)相结合,范德华力远小于化学键的作用
3、为何干冰的熔沸点比冰低,密度却比冰大?
由于冰中除了范德华力外还有氢键作用,破坏分子间作用力较难,所以熔沸点比干冰高。
在冰中由于氢键的方向性,导致晶体中有相当大的空隙,所以相同状况下冰的体积较大,密度比干冰小。
4、如何比较分子晶体熔沸点的高低?
①一般来说,分子晶体中范德华力越大,物质的熔、沸点越高。
②分子间氢键的形成使物质的熔、沸点升高;分子内氢键的形成使物质的熔、沸点降低。
相邻原子间以共价键相结合而形成空间立体网状结构的晶体。
原子
共价键
二.原子晶体
1、定义
原子晶体中存在的微粒:
粒子间的作用力:
熔化时需要克服的作用:
共价键
2、常见的原子晶体
①某些非金属或金属单质
②某些非金属化合物
③某些氧化物
金刚石(C)、晶体硅(Si)、晶体硼(B)、金属锗(Ge)等
碳化硅(SiC)晶体、氮化硼(BN)晶体等
二氧化硅( SiO2)晶体
如果你有一颗钻石,千万不要砸哟!
3、原子晶体物理特性
在原子晶体中,由于原子间以较强的共价键(一般是共价单键)相结合,所以原子晶体有以下物理性质:
熔点和沸点很高
硬度很大(但硬而脆)
一般不导电
难溶于一些常见的溶剂
4、典型的原子晶体——金刚石、二氧化硅
109 28
共价键
金刚石的晶体结构
【碳正四面体】
1、在金刚石的晶体中每个碳原子的价层轨道杂化方式?
2、在金刚石晶体中每个碳原子形成几个共价单键?
3、在金刚石晶体中碳原子个数与C-C共价键个数之比是多少?
4、在金刚石晶体中,最小碳环由几个碳原子来组成
5、在金刚石晶胞中含有的碳原子数?
4个
1:2
6个
sp3
思考:与金刚石有关的重要问题和结论
在金刚石晶胞中含有的碳原子数:
8×1/8+6×1/2+4=8
180
109 28
Si
O
共价键
联想水分子的立体构型
【硅氧正四面体】
SiO2的晶体结构
1、在SiO2晶体中,每个硅原子与 个氧原子结合;每个氧原子与 个硅原子结合;在SiO2晶体中硅原子与氧原子个数之比是 。
2、在SiO2 晶体中,每个硅原子形成 个共价键;每个氧原子形成 个共价键;硅原子个数与Si-O 共价键个数之比是 ;氧原子个数与Si-O 共价键个数之比是 。
3、在SiO2晶体中,最小环为 元环。
2
1:2
4
4
2
1:4
1:2
12
思考:与SiO2有关的重要问题和结论
晶体类型 分子晶体 原子晶体
结 构 构成晶体的粒子
晶体粒子间的作用力
性 质 硬度
溶、沸点
导电性
分子
原子
分子间作用力
(范德华力或氢键)
共价键
较小
较低
很高
固态和熔融状态都不导电
不导电
较大
结构、性质
小结:
随堂练习:
D
§3-2
分子晶体与原子晶体
人教版高中化学选择性必修二 第三章 晶体结构与性质
目录
分子晶体
1
原子晶体
2
人教版高中化学选修三 第二章 分子结构与性质
观察下列两种晶体的晶胞找出两种晶体的共同点?
结论:构成微粒都是分子。
都是面心立方晶胞。
碘晶胞
二氧化碳晶胞
分子间以分子间作用力相结合形成的晶体。
分子
分子内(共价键) 分子间(范德华力或氢键)
一.分子晶体
1、定义
分子晶体中存在的微粒:
粒子间的作用力:
熔化或气化需要破坏的作用力:
分子间作用力(范德华力或氢键)
2、分子晶体的两种堆积方式:
①密堆积:如果分子间作用力只是范德华力,若以一个分子为中心,其周围通常可以有12个紧邻的分子---分子密堆积。如:C60、干冰 、I2、O2。
思考:与CO2分子距离最近的CO2分子共有多少个?
重要结论:与CO2分子距离最近的CO2分子共有12个
②非密堆积:如果除分子间作用力还有分子间氢键,则空间利用率不高,采用非密堆积(如:HF 、冰、NH3 )
重要结论:1个水分子周围距离最近有4个水分子
冰的结构
氢键具有方向性
3、常见的分子晶体
①所有非金属氢化物:
②几乎所有的酸:
③部分非金属单质:
④部分非金属氧化物:
⑤绝大多数有机物的晶体:
H2O、H2S、NH3、CH4、HX
H2SO4、HNO3、H3PO4(碱和盐则是离子晶体)
X2、O2、H2、 S8、P4、C60 、稀有气体
CO2、SO2、NO2、 P4O6、 P4O10
乙醇、冰醋酸、蔗糖、 苯、萘、蒽、苯甲酸等
4、分子晶体物理特性
①较低的熔点和沸点(易升华或易挥发)
②较小的硬度
③只存在分子,不存在离子,一般都是绝缘体,固态及熔融 状态也不导电。溶于水时部分导电
④多数能溶于适当的溶剂(相似相溶)。
1、分子晶体是否导电?什么条件下可以导电?
由于构成分子晶体的粒子是分子,不管是晶体或晶体熔化成的液体,都没有带电荷的离子存在,因此,分子晶体以及它熔化成的液体都不导电。
分子晶体溶于水时,水溶液有的能导电,如HCl溶于水,有的不导电,如C2H5OH溶于水。
深入探究:
2、为何分子晶体的硬度小,熔沸点低?
①构成晶体的微粒是分子
②分子之间以分子间作用力(主要是范德华力)相结合,范德华力远小于化学键的作用
3、为何干冰的熔沸点比冰低,密度却比冰大?
由于冰中除了范德华力外还有氢键作用,破坏分子间作用力较难,所以熔沸点比干冰高。
在冰中由于氢键的方向性,导致晶体中有相当大的空隙,所以相同状况下冰的体积较大,密度比干冰小。
4、如何比较分子晶体熔沸点的高低?
①一般来说,分子晶体中范德华力越大,物质的熔、沸点越高。
②分子间氢键的形成使物质的熔、沸点升高;分子内氢键的形成使物质的熔、沸点降低。
相邻原子间以共价键相结合而形成空间立体网状结构的晶体。
原子
共价键
二.原子晶体
1、定义
原子晶体中存在的微粒:
粒子间的作用力:
熔化时需要克服的作用:
共价键
2、常见的原子晶体
①某些非金属或金属单质
②某些非金属化合物
③某些氧化物
金刚石(C)、晶体硅(Si)、晶体硼(B)、金属锗(Ge)等
碳化硅(SiC)晶体、氮化硼(BN)晶体等
二氧化硅( SiO2)晶体
如果你有一颗钻石,千万不要砸哟!
3、原子晶体物理特性
在原子晶体中,由于原子间以较强的共价键(一般是共价单键)相结合,所以原子晶体有以下物理性质:
熔点和沸点很高
硬度很大(但硬而脆)
一般不导电
难溶于一些常见的溶剂
4、典型的原子晶体——金刚石、二氧化硅
109 28
共价键
金刚石的晶体结构
【碳正四面体】
1、在金刚石的晶体中每个碳原子的价层轨道杂化方式?
2、在金刚石晶体中每个碳原子形成几个共价单键?
3、在金刚石晶体中碳原子个数与C-C共价键个数之比是多少?
4、在金刚石晶体中,最小碳环由几个碳原子来组成
5、在金刚石晶胞中含有的碳原子数?
4个
1:2
6个
sp3
思考:与金刚石有关的重要问题和结论
在金刚石晶胞中含有的碳原子数:
8×1/8+6×1/2+4=8
180
109 28
Si
O
共价键
联想水分子的立体构型
【硅氧正四面体】
SiO2的晶体结构
1、在SiO2晶体中,每个硅原子与 个氧原子结合;每个氧原子与 个硅原子结合;在SiO2晶体中硅原子与氧原子个数之比是 。
2、在SiO2 晶体中,每个硅原子形成 个共价键;每个氧原子形成 个共价键;硅原子个数与Si-O 共价键个数之比是 ;氧原子个数与Si-O 共价键个数之比是 。
3、在SiO2晶体中,最小环为 元环。
2
1:2
4
4
2
1:4
1:2
12
思考:与SiO2有关的重要问题和结论
晶体类型 分子晶体 原子晶体
结 构 构成晶体的粒子
晶体粒子间的作用力
性 质 硬度
溶、沸点
导电性
分子
原子
分子间作用力
(范德华力或氢键)
共价键
较小
较低
很高
固态和熔融状态都不导电
不导电
较大
结构、性质
小结:
随堂练习:
D
