化学人教版(2019)必修第一册1.1.2分散系及胶体的性质(共31张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.1.2分散系及胶体的性质(共31张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-19 15:14:44 | ||
图片预览







文档简介
(共31张PPT)
第一节 物质的分类及转化
第二课时
三、分散系
1. 定义:
把一种或多种物质分散在另一种或多种物质中得到的混合体系
2. 组成:分散质:分散系中___________的物质;
分散剂:分散系中_____________的物质。
被分散
容纳分散质
一般规律:
1.分散系中有水,水是分散剂;
2.分散系中是两种液体(没有水),量多的是分散剂。
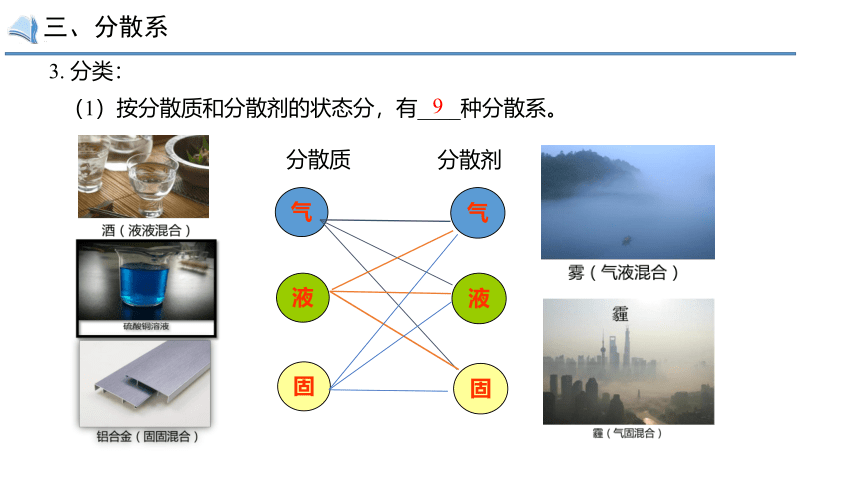
3. 分类:
(1)按分散质和分散剂的状态分,有____种分散系。
9
分散质
分散剂
气
液
固
气
液
固
三、分散系
三、分散系
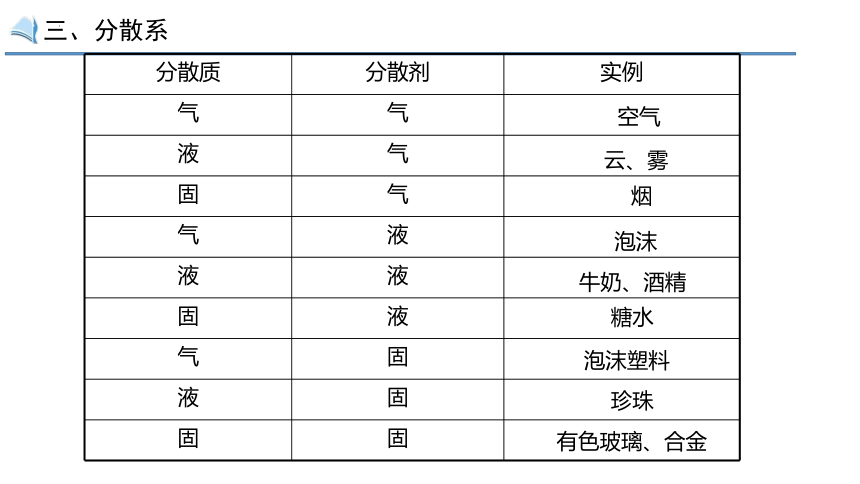
分散质 分散剂 实例
气 气
液 气
固 气
气 液
液 液
固 液
气 固
液 固
固 固
空气
云、雾
烟
泡沫
牛奶、酒精
糖水
泡沫塑料
珍珠
有色玻璃、合金
三、分散系
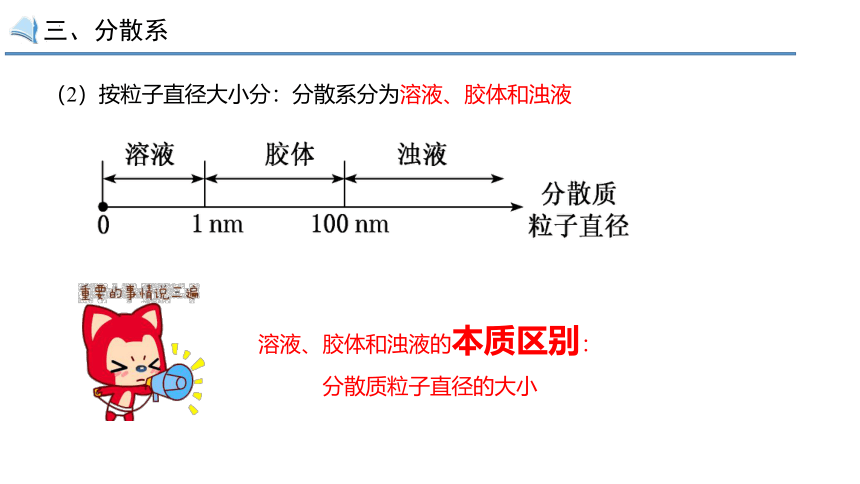
(2)按粒子直径大小分:分散系分为溶液、胶体和浊液
溶液、胶体和浊液的本质区别:
分散质粒子直径的大小
1.概念:分散质粒子直径在1-100nm之间的分散系
2.分类:
胶体
根据分散剂的状态分类
根据胶体粒子的组成分类
气溶胶:烟,云,雾
液溶胶:豆浆,墨水
固溶胶:烟水晶,有色玻璃
粒子胶体:Fe(OH)3胶体
分子胶体:淀粉胶体
常见的胶体有:淀粉溶液、豆浆、牛奶、血液、墨汁、Al(OH)3胶体、Fe(OH)3胶体、硅酸胶体、土壤胶体等。
烟水晶
四、胶体
有色玻璃
科学探究
把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处,分别用激光笔(或手电筒)照射烧杯中的液体,在与光束垂直的方向进行观察,并记录实验现象。
CuSO4溶液
Fe(OH)3胶体
2.胶体和溶液的鉴别
四、胶体
当可见光束通过胶体时,在入射光侧面可观察到明亮的“通路”,这种现象叫做丁达尔效应。
丁达尔效应:
原因:胶粒直径大小与光的波长相近,胶粒对光有散射作用;而溶液分散质的粒子太小,不发生散射。
只有胶体有丁达尔效应
四、胶体
四、胶体
科学探究
将Fe(OH)3胶体和泥水分别进行过滤,观察并记录实验现象。
过滤后的现象
Fe(OH)3胶体
泥水
滤纸上无滤渣,滤液颜色不变,(无现象)
在滤纸上带有泥沙,由浑浊变澄清
结论2、胶体能透过滤纸,而悬浊液无法通过滤纸, 说明胶体粒子比悬浊液粒子小。
3.溶液、胶体和浊液的分离和提纯
(1)食盐溶液中有少量的泥沙,用什么方法将他们分离呢?
四、胶体
利用半透膜可以分离胶体和溶液
(渗析作用)
思考:渗析操作中如何改进实验可使胶体更纯净?
更换蒸馏水,或在流动的蒸馏水中进行操作。
半透膜是一种孔隙比滤纸更小,可以让小分子或离子通过,大分子不能通过的一类膜的总称
半透膜
细胞膜,动物膀胱,鸡蛋膜
四、胶体
根据粒径分离示意图
滤纸
半透膜
四、胶体
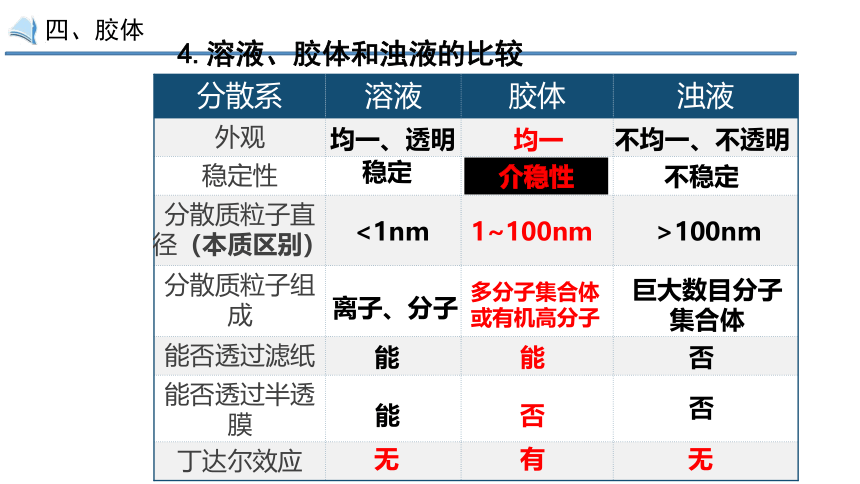
分散系 溶液 胶体 浊液
外观
稳定性
分散质粒子直径(本质区别)
分散质粒子组成
能否透过滤纸
能否透过半透膜
丁达尔效应
均一、透明
均一
不均一、不透明
不稳定
稳定
介稳性
<1nm
1~100nm
>100nm
离子、分子
多分子集合体或有机高分子
巨大数目分子集合体
能
能
否
能
否
否
无
有
无
4.溶液、胶体和浊液的比较
?
四、胶体
分散系 分散系外观
CuSO4溶液
Fe(OH)3胶体
泥水
蓝色、均一透明稳定
红褐色、澄清略透明(介稳性)
浑浊,静置分层,不稳定
(1)丁达尔效应:胶体特有的性质
(2)介稳性:胶体在一定条件下能稳定存在, 属于介稳体系
观察制得的Fe(OH)3胶体,并与CuSO4溶液和泥水比较
5、胶体的性质
四、胶体
原因:
胶体粒子带电荷,同种胶体粒子所带的电荷相同,相互排斥不易聚沉成大颗粒(主要原因)
注意:胶体呈中性。
四、胶体
Fe(OH)3
Fe3+
Fe3+
Fe3+
Fe3+
Fe3+
Fe3+
Cl-
OH-
Cl-
OH-
Cl-
Cl-
OH-
Cl-
Cl-
OH-
OH-
Cl-
OH-
Cl-
Cl-
Cl-
Cl-
Cl-
整个体系不带电性
胶粒表面积大 →
吸附能力强→
吸附阳、阴离子
胶体微粒带正、负电
四、胶体
原因:
胶体粒子带电荷,同种胶体粒子所带的电荷相同,相互排斥不易聚沉成大颗粒(主要原因)注意:胶体呈中性。
胶体粒子做布朗运动(动力学性质),使得它们不容易聚集成质量较大的颗粒沉降下来,这是胶体具有介稳性的次要原因。
布朗运动(动力学性质):胶体中的分散质粒子在分散剂里作不停的、无秩序的运动的现象叫做布朗运动
布朗运动并不是胶体特有的性质
例如氢氧化铁胶体粒子带有正电荷,在电场的作用下,带正电的红褐色的氢氧化铁胶体粒子向阴极移动
(3)电学性质(电泳)
定义:由于胶体粒子带有电荷,在外加电场的条件下,胶体粒子向直流电源的正极或负极定向移动的现象
四、胶体
应用:静电除尘
【思考】电泳现象可以区分胶体和溶液吗?
丁达尔效应
拓展:带正电荷:金属氧化物、金属氢氧化物。
如:Fe(OH)3 胶体胶粒, Al(OH)3胶体胶粒
带负电荷:非金属氧化物、金属硫化物
如:硅酸胶体胶粒,土壤胶体胶粒
不带电荷:分子胶体
如:淀粉溶液、蛋白质溶液
思考:
是否所有的液溶胶在电场作用下都会发生电泳?
四、胶体
(4)胶体的聚沉
概念:当外在条件改变时,破坏了胶体的介稳性,使胶体粒子凝聚成更大的颗粒,形成沉淀,从分散剂里析出的过程叫胶体的聚沉
原理:中和胶体粒子的电性,破坏稳定因素
稳定因素
破坏
部分中和表面所带电荷(主要)
加快或减慢布朗运动(次要)
破坏
四、胶体
聚沉的方法:
加入酸碱盐溶液
向胶体中加入电解质溶液,产生的阳离子或阴离子与胶体粒子所带的电荷中和,从而使其聚集成较大的粒子,在重力作用下形成沉淀析出
(实验:MgSO4 溶液加入Fe(OH)3胶体中)
四、胶体
应用:
土壤保肥
氯化铁溶液止血
卤水点豆腐
“卤水点豆腐”是把CaCl2(或MgCl2)加入豆浆中发生凝聚
四、胶体
带相反电荷的胶体粒子相混合时,也会发生聚沉。
加热
能量升高,胶体粒子运动加剧,它们之间的碰撞机会增多,减弱胶体的稳定因素,导致聚沉。
加入带相反电荷的胶粒的胶体
应用:明矾净水
四、胶体
(1)实验步骤:取一个小烧杯,向烧杯中加入25mL蒸馏水,将烧杯中的蒸馏水加热至沸腾,在沸水中逐滴加入饱和FeCl3溶液,继续煮沸至液体呈红褐色停止加热(注意不能用玻璃棒搅拌)
(2)实验方程式:
FeCl3+3H2O = Fe(OH)3(胶体)+3HCl
红褐色液体
△
6、胶体的制备(制备Fe(OH)3胶体)
四、胶体
(3)注意:
不能用自来水代替蒸馏水制备Fe(OH)3胶体。因为自来水中含有的阴离子会使胶体粒子聚集成更大的颗粒,产生Fe(OH)3沉淀
当液体呈红褐色时应立即停止加热,因为过度加热会破坏胶体,使其生成沉淀。
饱和FeCl3溶液过多、一次性加入、先加再煮,用玻璃棒搅拌使其碰撞形成大颗粒都会产生沉淀
四、胶体
1.胶体区别于其他分散系的本质特点是( )
A. 胶体微粒带电
B. 能产生丁达尔现象
C. 胶体微粒做布朗运动
D. 分散质直径在10-9~10-7m之间
【随堂练习】
D
【随堂练习】
2.下列分散系最稳定的是( )
A.悬浊液 B.乳浊液
C.胶体 D.溶液
D
3.区别溶液和胶体的最简单的方法是( )
A. 观察外观 B.丁达尔效应
C. 加热
B
4.下列关于胶体和溶液的区别的叙述中正确的是( )
A.胶体带电荷,溶液不带电荷
B.一束光线通过溶液时没有明显现象,而通过胶体时会出现明显的光路
C.溶液中分散质可通过滤纸,胶体中分散质不能通过滤纸
D.溶液长时间静置易产生浑浊,胶体长时间静置不产生浑浊
【随堂练习】
B
5.鸡蛋白水溶胶不具备的性质是 ( )
A. 加热煮沸发生凝聚
B. 丁达尔现象
C. 通过半透膜
D. 布朗运动
C
【随堂练习】
6. 胶体的下列性质主要是由胶粒带电决定的是( )
① 丁达尔现象;②布朗运动; ③电泳; ④加入电解质发生凝聚;⑤渗析;⑥水溶胶是稳定的分散系.
A.①③④ B.②③④ C.③④⑤ D.③④⑥
D
7、不能证明胶体微粒比溶液中溶质微粒直径大的实验( )
A.电泳 B.丁达尔现象 C.布朗运动 D.渗析
AC
【随堂练习】
8.在水泥厂和冶金工厂常用高压电对气溶胶作用,以除去大量烟尘,以减少对空气的污染,这种作法应用的原理是( )
A 电泳 B 渗析
C 凝聚 D 丁达尔现象
A
9. 如图是制备Fe(OH)3胶体的示意图,下列关于制备过程的叙述正确的是
( )
A.将FeCl3稀溶液滴入温水中即可
B.将饱和FeCl3溶液滴入NaOH溶液中
C.将饱和FeCl3溶液滴入加热沸腾的水中
D.将浓氨水滴入沸腾的饱和FeCl3溶液中
练习:
C
第一节 物质的分类及转化
第二课时
三、分散系
1. 定义:
把一种或多种物质分散在另一种或多种物质中得到的混合体系
2. 组成:分散质:分散系中___________的物质;
分散剂:分散系中_____________的物质。
被分散
容纳分散质
一般规律:
1.分散系中有水,水是分散剂;
2.分散系中是两种液体(没有水),量多的是分散剂。
3. 分类:
(1)按分散质和分散剂的状态分,有____种分散系。
9
分散质
分散剂
气
液
固
气
液
固
三、分散系
三、分散系
分散质 分散剂 实例
气 气
液 气
固 气
气 液
液 液
固 液
气 固
液 固
固 固
空气
云、雾
烟
泡沫
牛奶、酒精
糖水
泡沫塑料
珍珠
有色玻璃、合金
三、分散系
(2)按粒子直径大小分:分散系分为溶液、胶体和浊液
溶液、胶体和浊液的本质区别:
分散质粒子直径的大小
1.概念:分散质粒子直径在1-100nm之间的分散系
2.分类:
胶体
根据分散剂的状态分类
根据胶体粒子的组成分类
气溶胶:烟,云,雾
液溶胶:豆浆,墨水
固溶胶:烟水晶,有色玻璃
粒子胶体:Fe(OH)3胶体
分子胶体:淀粉胶体
常见的胶体有:淀粉溶液、豆浆、牛奶、血液、墨汁、Al(OH)3胶体、Fe(OH)3胶体、硅酸胶体、土壤胶体等。
烟水晶
四、胶体
有色玻璃
科学探究
把盛有CuSO4溶液和Fe(OH)3胶体的烧杯置于暗处,分别用激光笔(或手电筒)照射烧杯中的液体,在与光束垂直的方向进行观察,并记录实验现象。
CuSO4溶液
Fe(OH)3胶体
2.胶体和溶液的鉴别
四、胶体
当可见光束通过胶体时,在入射光侧面可观察到明亮的“通路”,这种现象叫做丁达尔效应。
丁达尔效应:
原因:胶粒直径大小与光的波长相近,胶粒对光有散射作用;而溶液分散质的粒子太小,不发生散射。
只有胶体有丁达尔效应
四、胶体
四、胶体
科学探究
将Fe(OH)3胶体和泥水分别进行过滤,观察并记录实验现象。
过滤后的现象
Fe(OH)3胶体
泥水
滤纸上无滤渣,滤液颜色不变,(无现象)
在滤纸上带有泥沙,由浑浊变澄清
结论2、胶体能透过滤纸,而悬浊液无法通过滤纸, 说明胶体粒子比悬浊液粒子小。
3.溶液、胶体和浊液的分离和提纯
(1)食盐溶液中有少量的泥沙,用什么方法将他们分离呢?
四、胶体
利用半透膜可以分离胶体和溶液
(渗析作用)
思考:渗析操作中如何改进实验可使胶体更纯净?
更换蒸馏水,或在流动的蒸馏水中进行操作。
半透膜是一种孔隙比滤纸更小,可以让小分子或离子通过,大分子不能通过的一类膜的总称
半透膜
细胞膜,动物膀胱,鸡蛋膜
四、胶体
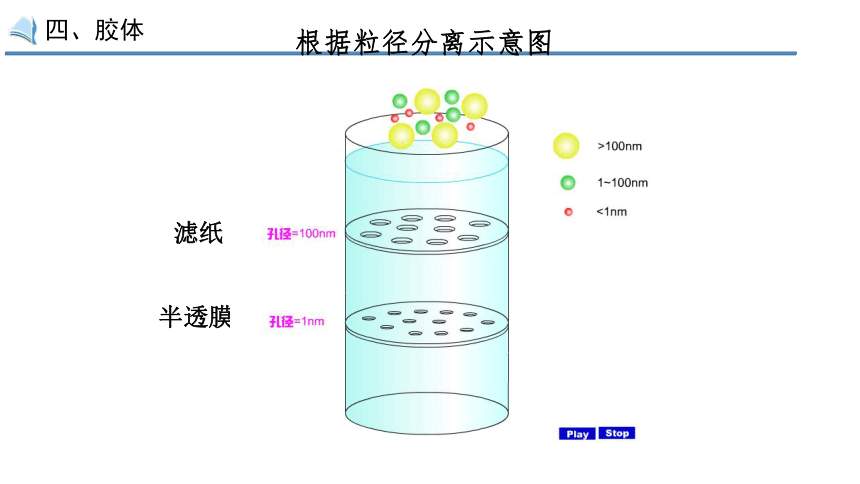
根据粒径分离示意图
滤纸
半透膜
四、胶体
分散系 溶液 胶体 浊液
外观
稳定性
分散质粒子直径(本质区别)
分散质粒子组成
能否透过滤纸
能否透过半透膜
丁达尔效应
均一、透明
均一
不均一、不透明
不稳定
稳定
介稳性
<1nm
1~100nm
>100nm
离子、分子
多分子集合体或有机高分子
巨大数目分子集合体
能
能
否
能
否
否
无
有
无
4.溶液、胶体和浊液的比较
?
四、胶体
分散系 分散系外观
CuSO4溶液
Fe(OH)3胶体
泥水
蓝色、均一透明稳定
红褐色、澄清略透明(介稳性)
浑浊,静置分层,不稳定
(1)丁达尔效应:胶体特有的性质
(2)介稳性:胶体在一定条件下能稳定存在, 属于介稳体系
观察制得的Fe(OH)3胶体,并与CuSO4溶液和泥水比较
5、胶体的性质
四、胶体
原因:
胶体粒子带电荷,同种胶体粒子所带的电荷相同,相互排斥不易聚沉成大颗粒(主要原因)
注意:胶体呈中性。
四、胶体
Fe(OH)3
Fe3+
Fe3+
Fe3+
Fe3+
Fe3+
Fe3+
Cl-
OH-
Cl-
OH-
Cl-
Cl-
OH-
Cl-
Cl-
OH-
OH-
Cl-
OH-
Cl-
Cl-
Cl-
Cl-
Cl-
整个体系不带电性
胶粒表面积大 →
吸附能力强→
吸附阳、阴离子
胶体微粒带正、负电
四、胶体
原因:
胶体粒子带电荷,同种胶体粒子所带的电荷相同,相互排斥不易聚沉成大颗粒(主要原因)注意:胶体呈中性。
胶体粒子做布朗运动(动力学性质),使得它们不容易聚集成质量较大的颗粒沉降下来,这是胶体具有介稳性的次要原因。
布朗运动(动力学性质):胶体中的分散质粒子在分散剂里作不停的、无秩序的运动的现象叫做布朗运动
布朗运动并不是胶体特有的性质
例如氢氧化铁胶体粒子带有正电荷,在电场的作用下,带正电的红褐色的氢氧化铁胶体粒子向阴极移动
(3)电学性质(电泳)
定义:由于胶体粒子带有电荷,在外加电场的条件下,胶体粒子向直流电源的正极或负极定向移动的现象
四、胶体
应用:静电除尘
【思考】电泳现象可以区分胶体和溶液吗?
丁达尔效应
拓展:带正电荷:金属氧化物、金属氢氧化物。
如:Fe(OH)3 胶体胶粒, Al(OH)3胶体胶粒
带负电荷:非金属氧化物、金属硫化物
如:硅酸胶体胶粒,土壤胶体胶粒
不带电荷:分子胶体
如:淀粉溶液、蛋白质溶液
思考:
是否所有的液溶胶在电场作用下都会发生电泳?
四、胶体
(4)胶体的聚沉
概念:当外在条件改变时,破坏了胶体的介稳性,使胶体粒子凝聚成更大的颗粒,形成沉淀,从分散剂里析出的过程叫胶体的聚沉
原理:中和胶体粒子的电性,破坏稳定因素
稳定因素
破坏
部分中和表面所带电荷(主要)
加快或减慢布朗运动(次要)
破坏
四、胶体
聚沉的方法:
加入酸碱盐溶液
向胶体中加入电解质溶液,产生的阳离子或阴离子与胶体粒子所带的电荷中和,从而使其聚集成较大的粒子,在重力作用下形成沉淀析出
(实验:MgSO4 溶液加入Fe(OH)3胶体中)
四、胶体
应用:
土壤保肥
氯化铁溶液止血
卤水点豆腐
“卤水点豆腐”是把CaCl2(或MgCl2)加入豆浆中发生凝聚
四、胶体
带相反电荷的胶体粒子相混合时,也会发生聚沉。
加热
能量升高,胶体粒子运动加剧,它们之间的碰撞机会增多,减弱胶体的稳定因素,导致聚沉。
加入带相反电荷的胶粒的胶体
应用:明矾净水
四、胶体
(1)实验步骤:取一个小烧杯,向烧杯中加入25mL蒸馏水,将烧杯中的蒸馏水加热至沸腾,在沸水中逐滴加入饱和FeCl3溶液,继续煮沸至液体呈红褐色停止加热(注意不能用玻璃棒搅拌)
(2)实验方程式:
FeCl3+3H2O = Fe(OH)3(胶体)+3HCl
红褐色液体
△
6、胶体的制备(制备Fe(OH)3胶体)
四、胶体
(3)注意:
不能用自来水代替蒸馏水制备Fe(OH)3胶体。因为自来水中含有的阴离子会使胶体粒子聚集成更大的颗粒,产生Fe(OH)3沉淀
当液体呈红褐色时应立即停止加热,因为过度加热会破坏胶体,使其生成沉淀。
饱和FeCl3溶液过多、一次性加入、先加再煮,用玻璃棒搅拌使其碰撞形成大颗粒都会产生沉淀
四、胶体
1.胶体区别于其他分散系的本质特点是( )
A. 胶体微粒带电
B. 能产生丁达尔现象
C. 胶体微粒做布朗运动
D. 分散质直径在10-9~10-7m之间
【随堂练习】
D
【随堂练习】
2.下列分散系最稳定的是( )
A.悬浊液 B.乳浊液
C.胶体 D.溶液
D
3.区别溶液和胶体的最简单的方法是( )
A. 观察外观 B.丁达尔效应
C. 加热
B
4.下列关于胶体和溶液的区别的叙述中正确的是( )
A.胶体带电荷,溶液不带电荷
B.一束光线通过溶液时没有明显现象,而通过胶体时会出现明显的光路
C.溶液中分散质可通过滤纸,胶体中分散质不能通过滤纸
D.溶液长时间静置易产生浑浊,胶体长时间静置不产生浑浊
【随堂练习】
B
5.鸡蛋白水溶胶不具备的性质是 ( )
A. 加热煮沸发生凝聚
B. 丁达尔现象
C. 通过半透膜
D. 布朗运动
C
【随堂练习】
6. 胶体的下列性质主要是由胶粒带电决定的是( )
① 丁达尔现象;②布朗运动; ③电泳; ④加入电解质发生凝聚;⑤渗析;⑥水溶胶是稳定的分散系.
A.①③④ B.②③④ C.③④⑤ D.③④⑥
D
7、不能证明胶体微粒比溶液中溶质微粒直径大的实验( )
A.电泳 B.丁达尔现象 C.布朗运动 D.渗析
AC
【随堂练习】
8.在水泥厂和冶金工厂常用高压电对气溶胶作用,以除去大量烟尘,以减少对空气的污染,这种作法应用的原理是( )
A 电泳 B 渗析
C 凝聚 D 丁达尔现象
A
9. 如图是制备Fe(OH)3胶体的示意图,下列关于制备过程的叙述正确的是
( )
A.将FeCl3稀溶液滴入温水中即可
B.将饱和FeCl3溶液滴入NaOH溶液中
C.将饱和FeCl3溶液滴入加热沸腾的水中
D.将浓氨水滴入沸腾的饱和FeCl3溶液中
练习:
C
