化学人教版(2019)选择性必修3 第4章第2节 蛋白质(共56张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 第4章第2节 蛋白质(共56张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 30.3MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-12-22 16:15:50 | ||
图片预览









文档简介
(共56张PPT)
学习
目标
第2节 蛋白质
1. 认识氨基酸的组成和结构特点。
从官能团的角度学习氨基酸的性质。
3. 了解蛋白质的组成、结构和性质(盐析、变性、水解、颜色反应等)。4. 认识蛋白质、酶、核酸等物质与人体健康的关系,体会化学学科在生命科学发展中所起的重要作用。
第1课时 氨基酸
化学与生活
你知道吗
实验演示:氨基酸与茚三酮溶液的反应
提问:我们体内的蛋白质分解的最终产物是什么?
能否设计实验检验体内氨基酸的存在?
化学与生活
你知道吗
手指分泌的细微汗液中含有氨基酸,
聚集于独特的手指纹路表面,
经过茚三酮处理可以将氨基酸指纹变为可见的紫色。
法医常用此方法进行指纹的检验。
化学上我们可用于氨基酸的检验。
1839年,荷兰化学家穆尔德提出蛋白质(protein)这个名词,源于希腊文“proteios”,意为原始的,
引申为第一位的,最重要的意思。
【环节一】认识 蛋白质
【想一想】蛋白质在生命活动中起着何种重要作用?
蛋白质是生物体内一类极为重要的_____________,是生命活动的主要物质基础。它不仅是_____的重要成分,而且具有多种生物学功能。
人体内起催化作用的_________、一些调节代谢的______和发生免疫反应的______等均为蛋白质。
生物大分子
细胞
大多数酶
激素
抗体
没有蛋白质就没有生命
【环节一】认识 蛋白质
【练习1】书写丙氨酸发生与盐酸、NaOH溶液的反应
一、氨基酸
4分钟时间阅读课本P109-110完成下列问题
1、氨基酸中一定含有哪些官能团?组成蛋白质的氨基酸主要是什么氨基酸?试着写出几种氨基酸的结构简式。
2、人体必需氨基酸有几种?由此你可以得到什么健康建议?
3、氨基酸的物理性质有哪些?从结构的角度来解释下氨基酸溶于水的原因。
4、从官能团角度分析氨基酸的化学性质。
【环节二】认识氨基酸
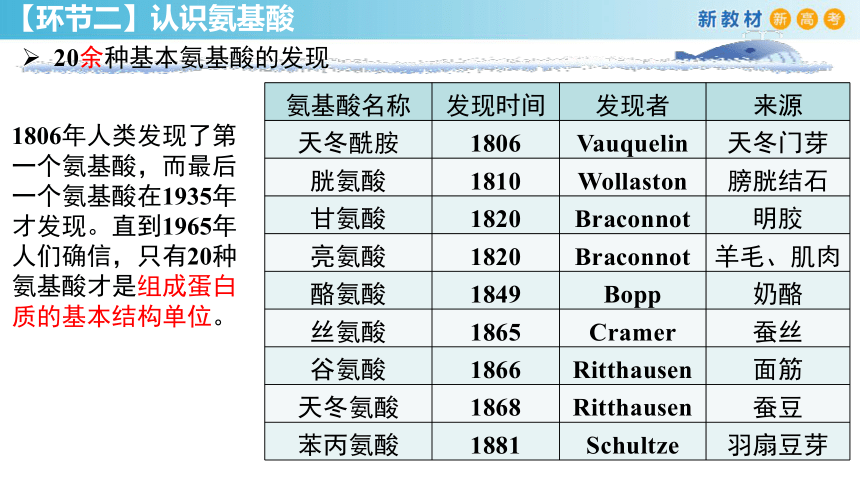
氨基酸名称 发现时间 发现者 来源
天冬酰胺 1806 Vauquelin 天冬门芽
胱氨酸 1810 Wollaston 膀胱结石
甘氨酸 1820 Braconnot 明胶
亮氨酸 1820 Braconnot 羊毛、肌肉
酪氨酸 1849 Bopp 奶酪
丝氨酸 1865 Cramer 蚕丝
谷氨酸 1866 Ritthausen 面筋
天冬氨酸 1868 Ritthausen 蚕豆
苯丙氨酸 1881 Schultze 羽扇豆芽
1806年人类发现了第一个氨基酸,而最后一个氨基酸在1935年才发现。直到1965年人们确信,只有20种氨基酸才是组成蛋白质的基本结构单位。
20余种基本氨基酸的发现
【环节二】认识氨基酸
氨基酸名称 发现时间 发现者 来源
丙氨酸 1881 Weyl 丝心蛋白
谷氨酰胺 1883 Schulze 甜菜汁
赖氨酸 1889 Drechsel 珊瑚
精氨酸 1895 Hedin 牛角
组氨酸 1896 Kossel,Hedin 奶酪
缬氨酸 1901 Fischer 奶酪
脯氨酸 1901 Fischer 奶酪
色氨酸 1901 Hopkins 奶酪
异亮氨酸 1904 Erhlich 纤维蛋白
甲硫氨酸 1922 Murller 奶酪
苏氨酸 1935 W.C.Rose 奶酪
20余种基本氨基酸的发现
1986年发现了第21种组成生物体内蛋白质的氨基酸——硒代半胱氨酸,2002年又发现了第22种——吡咯[bǐ luò]赖氨酸。
【环节二】认识氨基酸
羧酸分子烃基上的氢原子被氨基取代得到的化合物称为氨基酸。
α-氨基酸结构:
【学习任务1】建立氨基酸的组成和结构的认识模型
R—COOH
—NH2
属于取代羧酸
1.氨基酸的结构
R—CH—COOH
NH2
归纳
氨基酸的结构
氨基酸的组成
_________是组成蛋白质的基本结构单位。
为了人体的健康,应注意合理膳食、科学营养,保证人体必需氨基酸的摄取。
自然界中存在的氨基酸
组成生物体内
人体内不能合成
一般只有20种
8种氨基酸
几百种
必需氨基酸
ɑ-氨基酸
【环节二】认识氨基酸
【学习任务1】建立氨基酸的组成和结构的认识模型
α碳原子,手性碳原子(R不为H)
C
H
H2N
COOH
R
L-型氨基酸
费歇尔投影式
归纳
氨基酸的结构
氨基酸的组成
氨基酸的结构及手性特征
对映异构
α-氨基酸除甘氨酸外,一般均含有连接4个不同原子或原子团的手性碳原子,具有对映异构体。
【环节二】认识氨基酸
【学习任务1】建立氨基酸的组成和结构的认识模型
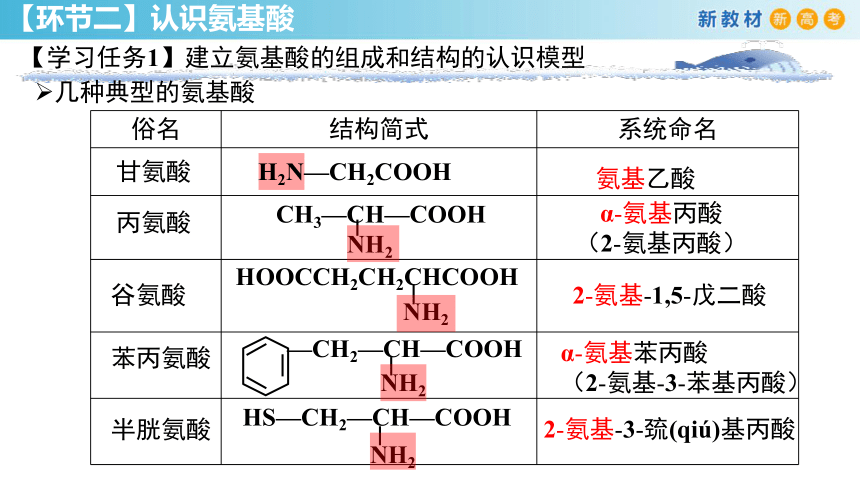
俗名 结构简式 系统命名
甘氨酸
丙氨酸
谷氨酸
苯丙氨酸
几种典型的氨基酸
氨基乙酸
α-氨基丙酸
(2-氨基丙酸)
2-氨基-1,5-戊二酸
α-氨基苯丙酸
(2-氨基-3-苯基丙酸)
H2N—CH2COOH
HOOCCH2CH2CHCOOH
NH2
CH3—CH—COOH
NH2
—CH2—CH—COOH
NH2
半胱氨酸
HS—CH2—CH—COOH
NH2
2-氨基-3-巯(qiú)基丙酸
【环节二】认识氨基酸
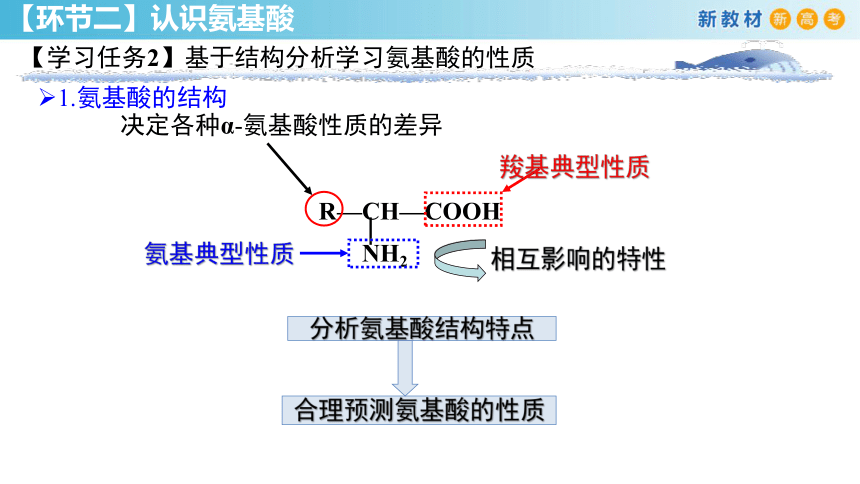
【学习任务2】基于结构分析学习氨基酸的性质
R—CH—COOH
NH2
氨基典型性质
相互影响的特性
羧基典型性质
决定各种α-氨基酸性质的差异
合理预测氨基酸的性质
分析氨基酸结构特点
1.氨基酸的结构
【环节二】认识氨基酸
【学习任务2】基于结构分析学习氨基酸的性质
“天然的氨基酸均为无色晶体,熔点较高,200~300℃熔化分解。
能溶于强酸或强碱溶液中,一般能溶于水,难溶于乙醇、乙醚。”
2.氨基酸的物理性质
【环节二】认识氨基酸
【学习任务2】基于结构分析学习氨基酸的性质
含有—COOH,提供 ,具有 ,能与 反应
含有—NH2,接受 ,具有 ,能与 反应
(1)氨基酸的两性
阳离子
两性化合物
阴离子
H+
酸性
碱
H+
碱性
酸
H+
OH-
结构分析
R—CH—COOH
NH3+
R—CH—COOH
NH2
H+
OH-
R—CH—COO-
NH2
【思考】氨基酸一定含有的官能团有哪些?从而思考氨基酸可能有的性质
3.氨基酸的化学性质
【环节二】认识氨基酸
【学习任务2】基于结构分析学习氨基酸的性质
氨基酸分子中既含有羧基,又含有氨基
酸性基团
碱性基团
氨基酸是两性化合物
R-CH-COOH + NaOH
NH2
R-CH-COONa + H2O
NH2
CH2COOH+HCl CH2COOH
NH2
NH3Cl
(1)氨基酸的两性
3.氨基酸的化学性质
【环节二】认识氨基酸
【学习任务2】基于结构分析学习氨基酸的性质
H2N—CH2COOH
CH3COOH
CH3COOH+NaHCO3→CH3COONa+H2O+CO2↑
H2N—CH2COOH+NaHCO3→
?
结构分析→合理预测
3.氨基酸的化学性质
【环节二】认识氨基酸
【学习任务2】基于结构分析学习氨基酸的性质
实验药品:1%甘氨酸, 1%醋酸,NaHCO3 (s)
实验记录:
NaHCO3 (s)一小勺
1%甘氨酸2mL
1%醋酸2mL
结构分析→合理预测→实验验证
无气泡
有气泡
【环节二】认识氨基酸
【学习任务2】基于结构分析学习氨基酸的性质
结构分析→合理预测→实验验证→问题探究
Ka=1.75×10-5
CH3COOH
H2CO3
Ka1=4.4×10-7
Ka2=4.7×10-11
NH4+
Ka=5.7×10-10
酸性:
(室温)
CH3COOH > H2CO3 >NH4+>HCO3-
结论:
甘氨酸不能与NaHCO3反应放出CO2
易错警示
碱性:
CH3COO-<HCO3-<NH3<CO32-
【环节二】认识氨基酸
【学习任务2】基于结构分析学习氨基酸的性质
阳离子
两性化合物
阴离子
H+
OH-
结构分析→合理预测→实验验证→问题探究
R—CH—COOH
NH3+
R—CH—COOH
NH2
H+
OH-
R—CH—COO-
NH2
H+
OH-
H+
OH-
氨基酸的内盐形式
(两性离子)
R—CH—COO-
NH3+
模型建构:
氨基酸的熔点较高,氨基酸形成内盐之后分子极性很大,相互静电作用比较强。
【环节二】认识氨基酸
【学习任务2】基于结构分析学习氨基酸的性质
结构分析
H2N—CH2—COOH+H2N—CH2—COOH→
肽键
H2N—CH2—C—N—CH2—COOH+H2O
O
H
氨基酸在酸或碱的存在下加热,
通过一分子的氨基与另一分子的羧基间脱去一分子水,缩合形成含有肽键的化合物,叫做成肽反应。
费歇尔(德),被誉为生物化学创始人,因合成糖类和嘌呤衍生物而获得1902年诺贝尔化学奖。
(2)氨基酸的成肽反应(从氨基酸——蛋白质)
3.氨基酸的化学性质
二肽
注意:肽键是一种酰胺基
【环节二】认识氨基酸
(2)氨基酸的成肽反应(从氨基酸——蛋白质)
3.氨基酸的化学性质
两分子氨基酸
缩合
二肽
三肽
缩合
+氨基酸
缩合
+氨基酸
四肽
缩合
+氨基酸
多肽
· · · · · ·
呈链状
肽链
又称
相互结合形成
盘曲、折叠
蛋白质
Mr>10000
具有一定的空间结构
题型1:氨基酸的化学性质
【练习1】书写的成肽的反应
(1)两分子间缩合成二肽
CH2—COOH
H2N
(2)分子内缩合成环
CH2—CH2—CH2—COOH
H2N
(3)多个分子缩合成多肽或蛋白质
CH3—CH—COOH
NH2
学习
目标
第2节 蛋白质
1. 认识氨基酸的组成和结构特点。
从官能团的角度学习氨基酸的性质。
3. 了解蛋白质的组成、结构和性质(盐析、变性、水解、颜色反应等)。4. 认识蛋白质、酶、核酸等物质与人体健康的关系,体会化学学科在生命科学发展中所起的重要作用。
第2课时 蛋白质和酶
化学与生活
你知道吗
健身增肌
美容冻龄
鸡蛋清
银耳
桃胶
用什么方法可以检验蛋白质呢?
化学与生活
你知道吗
用什么方法可以检验蛋白质呢?
胶原蛋白
鸡蛋清
银耳
桃胶
检验蛋白质的方法:灼烧或双缩脲试剂
活动1:
胶原蛋白水溶液+双缩脲试剂
(紫色)
活动2:
银耳水溶液+双缩脲试剂
(未出现紫色)
活动4:
桃胶溶液+双缩脲试剂
(未出现紫色)
活动3:
鸡蛋清溶液+双缩脲试剂
(紫色)
化学与生活
你知道吗
胶原蛋白
鸡蛋清
银耳
桃胶
鸡蛋清和胶原蛋白溶液中含有蛋白质,而银耳和桃胶中不含蛋白质。其实银耳和桃胶煮出来的东西看上去粘稠有弹性,像是一种胶,但并不是胶原蛋白,从化学的角度来看,他们是我们前面学过的多糖。
【环节三】认识蛋白质的结构与性质
【课前预习】4分钟阅读课本P111、114、115完成下列问题
1、蛋白质主要由哪些元素组成?
2、了解蛋白质的四级结构,从而体会蛋白质种类繁多的原因
3、酶的成分是什么?在生物体内的作用有哪些?
酶的催化作用的特点有哪些?
问题:那什么样的组成和结构才算是蛋白质呢?
【环节三】认识蛋白质的结构与性质
H2N—CH—C—OH+H—N—CH—COOH
O
R
R'
H
H2N—CH—C—N—CH—COOH+H2O
O
R
R'
H
氨基酸
氨基酸
二肽
H2N—CH—C—N—CH—C—N—CH—C—…—N—CH—COOH
O
R
R'
H
O
H
R''
O
H
R'''
多肽
蛋白质是由多种氨基酸脱水缩合形成肽键,通过肽键等相互连接形成的一类生物大分子,相对分子质量达几万至几千万,一个分子就能达到胶体粒子大小,我们可以用蛋白质溶液来验证。
【环节三】认识蛋白质的结构与性质
【实验】用激光笔照射蛋白质溶液
实验过程 用激光笔照射蛋白质溶液
实验现象
实验结论 我们看到用激光笔照射蛋白质溶液会有一条光亮的通路,
即蛋白质溶于水形成的是胶体。
【环节三】认识蛋白质的结构与性质
组成主要元素:
C、H、O、N、S 等
有些蛋白质还含有:
蛋白质属于:
人体内所具有的蛋白质种类达到了10万种以上。
P、Fe、Zn、Cu等
天然高分子化合物
1.蛋白质的组成元素
蛋白质是一般细胞中含量最多的有机分子,约占细胞干重的一半以上。
蛋白质主要由C、H、O、N、S等元素组成,有些蛋白质还含有P、Fe、Zn、Cu等元素。人体含有的蛋白质种类超过10万种。
【环节三】认识蛋白质的结构与性质
你知道吗
蛋白质含量如何测定的?
由于生物组织中绝大部分氮元素都来自于蛋白质,而且各种来源不同的蛋白质的含氮量都比较接近,
平均为16%。
因此生物样品中1 g氮元素大致相当于6.25 g蛋白质,由此可以通过测定样品中氮元素的质量分数计算出其中蛋白质的含量。
题型1:蛋白质的组成
【练习1】下列哪种元素不是蛋白质的组成元素( )
A. 碳 B. 氢 C. 氮 D. 氯
【练习2】牛胰岛素中硫元素的含量为3.355%,
经测定它的分子中只含有6个硫原子,计算牛胰岛素的相对分子质量。
【解析】6×32/3.355%=11087.93
【环节三】认识蛋白质的结构与性质
种类、数目及排列顺序
特定的空间结构
多肽链的氨基酸
蛋白质的结构
各种蛋白质都有其特殊功能和活性
一级结构
二级结构
三级结构
四级结构
2.蛋白质的结构
【环节三】认识蛋白质的结构与性质
一级结构
二级结构
氢键
2.蛋白质的结构
【环节三】认识蛋白质的结构与性质
…
C=O
H—N
H—C—R1
C=O
H—N
H—C—R2
C=O
H—N
H—C—R3
C=O
H—N
H—C—R4
…
2.蛋白质的结构
三级结构
二级结构
四级结构
氢键
COOH
蛋白质的结构示意图
一级结构:蛋白质分子中的氨基酸单体的排列顺序称为蛋白质的一级结构,它是蛋白质高级结构的基础,对蛋白质的性质和功能起着决定性的作用。
二级结构:肽键中的氧原子与氢原子之间存在氢键,会使肽链盘绕或折叠成特定的空间结构,形成蛋白质的二级结构。
一级结构
【环节三】认识蛋白质的结构与性质
…
C=O
H—N
H—C—R1
C=O
H—N
H—C—R2
C=O
H—N
H—C—R3
C=O
H—N
H—C—R4
…
2.蛋白质的结构
三级结构
二级结构
四级结构
氢键
COOH
蛋白质的结构示意图
三级结构:肽链在二级结构基础上还会进一步盘曲折叠,形成更复杂的三级结构。
四级结构:多个具有特定三级结构的多肽链通过非共价键相互作用(如氢键等)排列组装,形成蛋白质的四级结构。
一级结构
【环节三】认识蛋白质的结构与性质
科普环节
科普1:当蛋白质分子中的某一种氨基酸改变时,蛋白质的生物性质也将改变。
镰状细胞贫血症:由于人体血红蛋白b链N端的六个氨基酸由谷氨酸变为 缬[xié]氨酸而导致,红细胞的形态由正常的圆饼状变为异常的镰刀状。
显微镜下的正常红细胞和镰刀状红细胞
【环节三】认识蛋白质的结构与性质
科普环节
科普2:桑格在20世纪40年代测定出牛胰岛素分子中全部氨基酸的排列顺序,并证明了其内部氨基酸的结合方式,于1958年获得诺贝尔化学奖。这一发现首次揭示了蛋白质结构的奥秘,为人工合成牛胰岛素奠定了基础。
A链
Gly—Ile—Val—Glu—Gln—Cys—Cys—Ala—Ser—Val—Cys—Ser—Leu—Tyr—Gln—Leu—Glu—Asn—Tyr—Cys—Asn
B链
Phe—Val—Asn—Gln—His—Leu—Cys—Cly—Ser—His—Leu—Val—Glu—Ala—Leu—Tyr—Leu—Val—Cys—Gly—Glu—Arg—Gly—Phe—Phe—Tyr—Thr—Pro—Lys—Ala
S————————————S
— — —
S
S
— — —
S
S
【环节三】认识蛋白质的结构与性质
科普环节
科普3:蛋白质的四级空间结构比较复杂,是至今科学界尚未突破的难题,但是经过不懈的努力,近几年取得了一定的进展,2017年的诺贝尔奖颁发给了在这方面有突出贡献的三位科学家,他们研发了冷冻电子显微镜技术。
冷冻电子显微镜技术
题型2:蛋白质的结构
【练习3】蛋白质的( )与肽键的形成有关。
A. 一级结构 B. 二级结构 C. 三级结构 D. 四级结构
【解析】蛋白质分子中各种氨基酸的连接方式和排列顺序称为蛋白质的一级结构。故选A。
二级结构是指蛋白质主链原子的局部空间结构,并不涉及氨基酸残基侧链构象,二级结构的种类有α-螺旋、β-折叠、β-转角和无规卷曲,氢键是维系二级结构最主要的键;三级结构是指多肽链主链和侧链原子的空间排布,次级键维持其稳定,最主要的键是疏水键;
四级结构是指两条以上具有三级结构的多肽链之间缔合在一起的结构,其中每条具有三级结构的多肽链称为亚基,一般具有四级结构的蛋白质才有生物学活性,维持其稳定的是次级键,如氢键、盐键、疏水键、范德华力等。
【环节三】认识蛋白质的结构与性质
【课前预习2】3分钟时间阅读课本P112-113思考下列问题
1、蛋白质的盐析与变性有什么不同?怎么判断是发生了盐板还是变性?
2、蛋白质的变性有哪些因素?
3、分离提纯蛋白质的方法是什么?
4、误服重金属盐中毒如何急救?
5、怎么鉴别丝制品和棉制品?
6、在新冠疫情防控中,可以怎样对教室进行消毒处理?消毒处理时要注意什么?
【环节三】认识蛋白质的结构与性质
问题:具有复杂结构的高分子蛋白质进入人体后,会发生怎样的变化呢?
3.蛋白质的性质——(1)水解
实验过程 取适量鸡蛋清放入烧杯中,加入一滴管盐溶液,再加入适量沸水,形成乳白色蛋花溶液。
取两支试管各加入5ml蛋花溶液,其中一只加5ml蒸馏水,另一支滴加3滴醋酸,再加入5ml胃蛋白酶溶液。
混合均匀后置于温水浴中,静置,对比两支试管中的现象。
实验现象 滴加醋酸和胃蛋白酶的试管比加蒸馏水的澄清一些。
实验结论 蛋白质在酸、碱或酶作用下,水解成相对分子质量较小的肽类化合物,最终逐步水解得到各种氨基酸。未水解的蛋白质是大分子,溶解性没有小分子好。
模拟实验
【环节三】认识蛋白质的结构与性质
①在酸、碱或酶作用下,
逐步水解成相对分子质量较小的_____,最终水解得到________。
多肽
氨基酸
3.蛋白质的性质——(1)水解
(1)水解反应
②蛋白质在人体内的水解过程
胃蛋白酶或胰蛋白酶
水解
蛋白质
氨基酸
在人体内吸收
后重新组合
蛋白质
氧化反应
放出热量
食物中的蛋白质在人体内各种_______的作用下水解成_______,
氨基酸被_____吸收进入_____,再在体内_________人体所需要的蛋白质。
蛋白酶
氨基酸
肠壁
血液
重新合成
化学与生活
你知道吗
问题:蛋白粉和胶原蛋白液有用吗?
结论:健身时,喝蛋白粉,提高了蛋白质的摄入,确实可以帮助增肌;而胶原蛋白粉,提高了胶原蛋白最终水解为氨基酸,再重新合成胶原蛋白量比较少,到脸上的就更少了。所以想通过和胶原蛋白冻龄恐怕有些困难。同学们正处于生长发育阶段,应该摄取足够的蛋白质,建议每天和一杯牛奶、吃一个鸡蛋。
健身增肌
美容冻龄
题型3:蛋白质的性质
【练习3】下图表示蛋白质分子结构的一部分,请指出蛋白质发生水解时可能断裂的化学键。( )
A 只有①②
B 只有①
C 只有②
D ①②③④
…—NH—CH—C—NH—CH—C—…
R
O
R'
O
④
①
②
③
【解析】蛋白质是氨基酸中氨基和羧基脱水形成肽键而进一步形成的,则蛋白质发生水解反应时,从肽键中断开“C—N”键
【环节三】认识蛋白质的结构与性质
3.蛋白质的性质——(2)变性与盐析
问题:关于怎么吃鸡蛋,网上众说纷纭,有些主张生吃,有些觉得熟的更好,大家更倾向于哪一种呢?
科普:鸡蛋加热后,蛋白质的空间结构被破坏,原有的生物活性会丧失,溶解度降低,黏度增大,肽链松散,更易被水解消化。所以更多的人会选择将鸡蛋煮熟了再吃,这是有一定科学依据的(这样更利于消化吸收)。
提示
变性:像这样在某些因素影响下,蛋白质的理化性质和生理功能发生改变的现象,我们称之为变性。
【环节三】认识蛋白质的结构与性质
3.蛋白质的性质——(2)变性与盐析
学生活动
1、蛋白质溶液+醋酸铅+水/蛋白质溶液加热
2、蛋白质溶液+硫酸铵+水/蛋白质溶液+硫酸钠溶液+水
盐析作用析出的蛋白质仍具有原来的活性,因此经常用盐析来分离、提纯蛋白质。
盐析:向蛋白质中加入浓的无机盐,能够破坏溶解形成的胶体结构而降低蛋白质的溶解性,使蛋白质转化为沉淀析出,这种现象称为盐析。
【环节三】认识蛋白质的结构与性质
3.蛋白质的性质——(2)变性与盐析
(2)变性与盐析
①变性:像这样在某些因素影响下,蛋白质的理化性质和生理功能发生改变的现象,我们称之为变性。
②盐析:向蛋白质中加入浓的无机盐,能够破坏溶解形成的胶体结构而降低蛋白质的溶解性,使蛋白质转化为沉淀析出,这种现象称为盐析。
盐析作用析出的蛋白质仍具有原来的活性,
是可逆过程,经常用盐析分离提纯蛋白质。
影响因素 物理 ______、加压、搅拌、振荡、紫外线和放射线、超声波等
化学因素 ______、 、 、乙醇、苯酚、碘、甲醛、丙酮等
特点 变性会使蛋白质的结构发生变化,使其失去原有的______,在水中不能重新溶解,是 过程
加热
强酸
强碱
重金属盐
不可逆
生理活性
化学与生活
你知道吗
蛋白质变性
【在日常生活中有时需要利用蛋白质变性】
食物加热后,其中的蛋白质发生了变性,有利于人体消化吸收
乙醇、苯酚和碘等作为消毒防腐药可以使微生物的蛋白质变性,导致其死亡,达到消毒的目的
紫外线可用于杀菌消毒。有时也要注意防止蛋白质变性。
疫苗等生物制剂需要在低温下保存
攀登高山时为防止强紫外线引起皮肤和眼睛的蛋白质变性灼伤,需要防晒护目。
【环节三】认识蛋白质的结构与性质
3.蛋白质的性质
变性与盐析
的对比
盐析 变性
相同点 加入某种物质后有沉淀生成
不同点 盐不同 加入某些浓盐溶液, 如Na2SO4、浓食盐水,(NH4)2SO4等 重金属盐、醛、加热、紫外线或剧烈震动
可逆性 可逆,加水即可 不可逆
生理活性 保持生理活性 失去生理活性
用途 分离、提纯蛋白质 杀菌、消毒、防中毒
【环节三】认识蛋白质的结构与性质
3.蛋白质的性质——(3)显色反应
(3)显色反应
向蛋白质溶液加入浓硝酸会有___色沉淀产生,加热后沉淀变_____色。
可用于蛋白质的分析检测
白
黄
含有苯环
固体蛋白质如皮肤、指甲遇浓硝酸变______色。
黄
其他一些试剂也可以与蛋白质作用,呈现特定颜色
【环节三】认识蛋白质的结构与性质
3.蛋白质的性质——(4)燃烧反应
(4)燃烧反应
可用于蛋白质的鉴别
一般生成CO2、H2O、N2、SO2、P2O5等物质。烧焦羽毛味。
【环节4】认识 酶 的结构与性质
①高效性:一般是普通催化剂的107倍。
②催化反应条件温和:一般在接近体温和中性的条件下进行,此时酶的活性最强。超过适宜的温度时,酶将失去活性。
③高度的专一性:例如,蛋白酶只能催化蛋白质的水解反应,淀粉酶只能对淀粉和糖原等多糖的水解起催化作用。
(1)酶的定义:酶是一类由细胞产生的、对生物体内的化学反应具有催化作用的有机化合物,其中绝大多数是蛋白质。
在酶的作用下,生物才能进行新陈代谢、完成消化、呼吸、运动、生长、发育、繁殖等生命活动。
(3)酶的应用:酶得到广泛应用,如蛋白酶用于医药、制革等工业,淀粉酶用于食品、发酵、纺织等工业,有的酶还可用于疾病的诊断。
酶
(2)酶的催化特点:
化学与生活
你知道吗
酶
日常生活中还有哪些事例与蛋白质的盐析和变性有关?
请同学们当个小科学家,辨析一下性质是否可信?
1、夏天打太阳伞和戴墨镜只是为了耍酷,没什么作用?
2、用煮沸的方法可使医疗器械消毒。
3、喝大量盐水可以预防埃博拉病毒感染。
4、农业上用波尔多液(硫酸铜、生石灰和水制成)来消灭害虫
5、常用福尔马林(40%的甲醛溶液)保存生物标本。
6、注射针剂前要用医用酒精对皮肤进行消毒。
题型4:蛋白质的性质
【练习3】下列过程中不涉及蛋白质的变性的是( )
A、煮鸡蛋
B、福尔马林(40%的甲醛溶液)保存生物标本
C、以粮食为原料酿酒
D、使用医用酒精、紫外线杀菌消毒
课堂小结
谈谈你有哪些收获?
氨基酸
多肽
蛋白质
缩合
水解
缩合
水解
氨基羧酸
两性
变性
盐析
显色反应
谢谢欣赏
学习
目标
第2节 蛋白质
1. 认识氨基酸的组成和结构特点。
从官能团的角度学习氨基酸的性质。
3. 了解蛋白质的组成、结构和性质(盐析、变性、水解、颜色反应等)。4. 认识蛋白质、酶、核酸等物质与人体健康的关系,体会化学学科在生命科学发展中所起的重要作用。
第1课时 氨基酸
化学与生活
你知道吗
实验演示:氨基酸与茚三酮溶液的反应
提问:我们体内的蛋白质分解的最终产物是什么?
能否设计实验检验体内氨基酸的存在?
化学与生活
你知道吗
手指分泌的细微汗液中含有氨基酸,
聚集于独特的手指纹路表面,
经过茚三酮处理可以将氨基酸指纹变为可见的紫色。
法医常用此方法进行指纹的检验。
化学上我们可用于氨基酸的检验。
1839年,荷兰化学家穆尔德提出蛋白质(protein)这个名词,源于希腊文“proteios”,意为原始的,
引申为第一位的,最重要的意思。
【环节一】认识 蛋白质
【想一想】蛋白质在生命活动中起着何种重要作用?
蛋白质是生物体内一类极为重要的_____________,是生命活动的主要物质基础。它不仅是_____的重要成分,而且具有多种生物学功能。
人体内起催化作用的_________、一些调节代谢的______和发生免疫反应的______等均为蛋白质。
生物大分子
细胞
大多数酶
激素
抗体
没有蛋白质就没有生命
【环节一】认识 蛋白质
【练习1】书写丙氨酸发生与盐酸、NaOH溶液的反应
一、氨基酸
4分钟时间阅读课本P109-110完成下列问题
1、氨基酸中一定含有哪些官能团?组成蛋白质的氨基酸主要是什么氨基酸?试着写出几种氨基酸的结构简式。
2、人体必需氨基酸有几种?由此你可以得到什么健康建议?
3、氨基酸的物理性质有哪些?从结构的角度来解释下氨基酸溶于水的原因。
4、从官能团角度分析氨基酸的化学性质。
【环节二】认识氨基酸
氨基酸名称 发现时间 发现者 来源
天冬酰胺 1806 Vauquelin 天冬门芽
胱氨酸 1810 Wollaston 膀胱结石
甘氨酸 1820 Braconnot 明胶
亮氨酸 1820 Braconnot 羊毛、肌肉
酪氨酸 1849 Bopp 奶酪
丝氨酸 1865 Cramer 蚕丝
谷氨酸 1866 Ritthausen 面筋
天冬氨酸 1868 Ritthausen 蚕豆
苯丙氨酸 1881 Schultze 羽扇豆芽
1806年人类发现了第一个氨基酸,而最后一个氨基酸在1935年才发现。直到1965年人们确信,只有20种氨基酸才是组成蛋白质的基本结构单位。
20余种基本氨基酸的发现
【环节二】认识氨基酸
氨基酸名称 发现时间 发现者 来源
丙氨酸 1881 Weyl 丝心蛋白
谷氨酰胺 1883 Schulze 甜菜汁
赖氨酸 1889 Drechsel 珊瑚
精氨酸 1895 Hedin 牛角
组氨酸 1896 Kossel,Hedin 奶酪
缬氨酸 1901 Fischer 奶酪
脯氨酸 1901 Fischer 奶酪
色氨酸 1901 Hopkins 奶酪
异亮氨酸 1904 Erhlich 纤维蛋白
甲硫氨酸 1922 Murller 奶酪
苏氨酸 1935 W.C.Rose 奶酪
20余种基本氨基酸的发现
1986年发现了第21种组成生物体内蛋白质的氨基酸——硒代半胱氨酸,2002年又发现了第22种——吡咯[bǐ luò]赖氨酸。
【环节二】认识氨基酸
羧酸分子烃基上的氢原子被氨基取代得到的化合物称为氨基酸。
α-氨基酸结构:
【学习任务1】建立氨基酸的组成和结构的认识模型
R—COOH
—NH2
属于取代羧酸
1.氨基酸的结构
R—CH—COOH
NH2
归纳
氨基酸的结构
氨基酸的组成
_________是组成蛋白质的基本结构单位。
为了人体的健康,应注意合理膳食、科学营养,保证人体必需氨基酸的摄取。
自然界中存在的氨基酸
组成生物体内
人体内不能合成
一般只有20种
8种氨基酸
几百种
必需氨基酸
ɑ-氨基酸
【环节二】认识氨基酸
【学习任务1】建立氨基酸的组成和结构的认识模型
α碳原子,手性碳原子(R不为H)
C
H
H2N
COOH
R
L-型氨基酸
费歇尔投影式
归纳
氨基酸的结构
氨基酸的组成
氨基酸的结构及手性特征
对映异构
α-氨基酸除甘氨酸外,一般均含有连接4个不同原子或原子团的手性碳原子,具有对映异构体。
【环节二】认识氨基酸
【学习任务1】建立氨基酸的组成和结构的认识模型
俗名 结构简式 系统命名
甘氨酸
丙氨酸
谷氨酸
苯丙氨酸
几种典型的氨基酸
氨基乙酸
α-氨基丙酸
(2-氨基丙酸)
2-氨基-1,5-戊二酸
α-氨基苯丙酸
(2-氨基-3-苯基丙酸)
H2N—CH2COOH
HOOCCH2CH2CHCOOH
NH2
CH3—CH—COOH
NH2
—CH2—CH—COOH
NH2
半胱氨酸
HS—CH2—CH—COOH
NH2
2-氨基-3-巯(qiú)基丙酸
【环节二】认识氨基酸
【学习任务2】基于结构分析学习氨基酸的性质
R—CH—COOH
NH2
氨基典型性质
相互影响的特性
羧基典型性质
决定各种α-氨基酸性质的差异
合理预测氨基酸的性质
分析氨基酸结构特点
1.氨基酸的结构
【环节二】认识氨基酸
【学习任务2】基于结构分析学习氨基酸的性质
“天然的氨基酸均为无色晶体,熔点较高,200~300℃熔化分解。
能溶于强酸或强碱溶液中,一般能溶于水,难溶于乙醇、乙醚。”
2.氨基酸的物理性质
【环节二】认识氨基酸
【学习任务2】基于结构分析学习氨基酸的性质
含有—COOH,提供 ,具有 ,能与 反应
含有—NH2,接受 ,具有 ,能与 反应
(1)氨基酸的两性
阳离子
两性化合物
阴离子
H+
酸性
碱
H+
碱性
酸
H+
OH-
结构分析
R—CH—COOH
NH3+
R—CH—COOH
NH2
H+
OH-
R—CH—COO-
NH2
【思考】氨基酸一定含有的官能团有哪些?从而思考氨基酸可能有的性质
3.氨基酸的化学性质
【环节二】认识氨基酸
【学习任务2】基于结构分析学习氨基酸的性质
氨基酸分子中既含有羧基,又含有氨基
酸性基团
碱性基团
氨基酸是两性化合物
R-CH-COOH + NaOH
NH2
R-CH-COONa + H2O
NH2
CH2COOH+HCl CH2COOH
NH2
NH3Cl
(1)氨基酸的两性
3.氨基酸的化学性质
【环节二】认识氨基酸
【学习任务2】基于结构分析学习氨基酸的性质
H2N—CH2COOH
CH3COOH
CH3COOH+NaHCO3→CH3COONa+H2O+CO2↑
H2N—CH2COOH+NaHCO3→
?
结构分析→合理预测
3.氨基酸的化学性质
【环节二】认识氨基酸
【学习任务2】基于结构分析学习氨基酸的性质
实验药品:1%甘氨酸, 1%醋酸,NaHCO3 (s)
实验记录:
NaHCO3 (s)一小勺
1%甘氨酸2mL
1%醋酸2mL
结构分析→合理预测→实验验证
无气泡
有气泡
【环节二】认识氨基酸
【学习任务2】基于结构分析学习氨基酸的性质
结构分析→合理预测→实验验证→问题探究
Ka=1.75×10-5
CH3COOH
H2CO3
Ka1=4.4×10-7
Ka2=4.7×10-11
NH4+
Ka=5.7×10-10
酸性:
(室温)
CH3COOH > H2CO3 >NH4+>HCO3-
结论:
甘氨酸不能与NaHCO3反应放出CO2
易错警示
碱性:
CH3COO-<HCO3-<NH3<CO32-
【环节二】认识氨基酸
【学习任务2】基于结构分析学习氨基酸的性质
阳离子
两性化合物
阴离子
H+
OH-
结构分析→合理预测→实验验证→问题探究
R—CH—COOH
NH3+
R—CH—COOH
NH2
H+
OH-
R—CH—COO-
NH2
H+
OH-
H+
OH-
氨基酸的内盐形式
(两性离子)
R—CH—COO-
NH3+
模型建构:
氨基酸的熔点较高,氨基酸形成内盐之后分子极性很大,相互静电作用比较强。
【环节二】认识氨基酸
【学习任务2】基于结构分析学习氨基酸的性质
结构分析
H2N—CH2—COOH+H2N—CH2—COOH→
肽键
H2N—CH2—C—N—CH2—COOH+H2O
O
H
氨基酸在酸或碱的存在下加热,
通过一分子的氨基与另一分子的羧基间脱去一分子水,缩合形成含有肽键的化合物,叫做成肽反应。
费歇尔(德),被誉为生物化学创始人,因合成糖类和嘌呤衍生物而获得1902年诺贝尔化学奖。
(2)氨基酸的成肽反应(从氨基酸——蛋白质)
3.氨基酸的化学性质
二肽
注意:肽键是一种酰胺基
【环节二】认识氨基酸
(2)氨基酸的成肽反应(从氨基酸——蛋白质)
3.氨基酸的化学性质
两分子氨基酸
缩合
二肽
三肽
缩合
+氨基酸
缩合
+氨基酸
四肽
缩合
+氨基酸
多肽
· · · · · ·
呈链状
肽链
又称
相互结合形成
盘曲、折叠
蛋白质
Mr>10000
具有一定的空间结构
题型1:氨基酸的化学性质
【练习1】书写的成肽的反应
(1)两分子间缩合成二肽
CH2—COOH
H2N
(2)分子内缩合成环
CH2—CH2—CH2—COOH
H2N
(3)多个分子缩合成多肽或蛋白质
CH3—CH—COOH
NH2
学习
目标
第2节 蛋白质
1. 认识氨基酸的组成和结构特点。
从官能团的角度学习氨基酸的性质。
3. 了解蛋白质的组成、结构和性质(盐析、变性、水解、颜色反应等)。4. 认识蛋白质、酶、核酸等物质与人体健康的关系,体会化学学科在生命科学发展中所起的重要作用。
第2课时 蛋白质和酶
化学与生活
你知道吗
健身增肌
美容冻龄
鸡蛋清
银耳
桃胶
用什么方法可以检验蛋白质呢?
化学与生活
你知道吗
用什么方法可以检验蛋白质呢?
胶原蛋白
鸡蛋清
银耳
桃胶
检验蛋白质的方法:灼烧或双缩脲试剂
活动1:
胶原蛋白水溶液+双缩脲试剂
(紫色)
活动2:
银耳水溶液+双缩脲试剂
(未出现紫色)
活动4:
桃胶溶液+双缩脲试剂
(未出现紫色)
活动3:
鸡蛋清溶液+双缩脲试剂
(紫色)
化学与生活
你知道吗
胶原蛋白
鸡蛋清
银耳
桃胶
鸡蛋清和胶原蛋白溶液中含有蛋白质,而银耳和桃胶中不含蛋白质。其实银耳和桃胶煮出来的东西看上去粘稠有弹性,像是一种胶,但并不是胶原蛋白,从化学的角度来看,他们是我们前面学过的多糖。
【环节三】认识蛋白质的结构与性质
【课前预习】4分钟阅读课本P111、114、115完成下列问题
1、蛋白质主要由哪些元素组成?
2、了解蛋白质的四级结构,从而体会蛋白质种类繁多的原因
3、酶的成分是什么?在生物体内的作用有哪些?
酶的催化作用的特点有哪些?
问题:那什么样的组成和结构才算是蛋白质呢?
【环节三】认识蛋白质的结构与性质
H2N—CH—C—OH+H—N—CH—COOH
O
R
R'
H
H2N—CH—C—N—CH—COOH+H2O
O
R
R'
H
氨基酸
氨基酸
二肽
H2N—CH—C—N—CH—C—N—CH—C—…—N—CH—COOH
O
R
R'
H
O
H
R''
O
H
R'''
多肽
蛋白质是由多种氨基酸脱水缩合形成肽键,通过肽键等相互连接形成的一类生物大分子,相对分子质量达几万至几千万,一个分子就能达到胶体粒子大小,我们可以用蛋白质溶液来验证。
【环节三】认识蛋白质的结构与性质
【实验】用激光笔照射蛋白质溶液
实验过程 用激光笔照射蛋白质溶液
实验现象
实验结论 我们看到用激光笔照射蛋白质溶液会有一条光亮的通路,
即蛋白质溶于水形成的是胶体。
【环节三】认识蛋白质的结构与性质
组成主要元素:
C、H、O、N、S 等
有些蛋白质还含有:
蛋白质属于:
人体内所具有的蛋白质种类达到了10万种以上。
P、Fe、Zn、Cu等
天然高分子化合物
1.蛋白质的组成元素
蛋白质是一般细胞中含量最多的有机分子,约占细胞干重的一半以上。
蛋白质主要由C、H、O、N、S等元素组成,有些蛋白质还含有P、Fe、Zn、Cu等元素。人体含有的蛋白质种类超过10万种。
【环节三】认识蛋白质的结构与性质
你知道吗
蛋白质含量如何测定的?
由于生物组织中绝大部分氮元素都来自于蛋白质,而且各种来源不同的蛋白质的含氮量都比较接近,
平均为16%。
因此生物样品中1 g氮元素大致相当于6.25 g蛋白质,由此可以通过测定样品中氮元素的质量分数计算出其中蛋白质的含量。
题型1:蛋白质的组成
【练习1】下列哪种元素不是蛋白质的组成元素( )
A. 碳 B. 氢 C. 氮 D. 氯
【练习2】牛胰岛素中硫元素的含量为3.355%,
经测定它的分子中只含有6个硫原子,计算牛胰岛素的相对分子质量。
【解析】6×32/3.355%=11087.93
【环节三】认识蛋白质的结构与性质
种类、数目及排列顺序
特定的空间结构
多肽链的氨基酸
蛋白质的结构
各种蛋白质都有其特殊功能和活性
一级结构
二级结构
三级结构
四级结构
2.蛋白质的结构
【环节三】认识蛋白质的结构与性质
一级结构
二级结构
氢键
2.蛋白质的结构
【环节三】认识蛋白质的结构与性质
…
C=O
H—N
H—C—R1
C=O
H—N
H—C—R2
C=O
H—N
H—C—R3
C=O
H—N
H—C—R4
…
2.蛋白质的结构
三级结构
二级结构
四级结构
氢键
COOH
蛋白质的结构示意图
一级结构:蛋白质分子中的氨基酸单体的排列顺序称为蛋白质的一级结构,它是蛋白质高级结构的基础,对蛋白质的性质和功能起着决定性的作用。
二级结构:肽键中的氧原子与氢原子之间存在氢键,会使肽链盘绕或折叠成特定的空间结构,形成蛋白质的二级结构。
一级结构
【环节三】认识蛋白质的结构与性质
…
C=O
H—N
H—C—R1
C=O
H—N
H—C—R2
C=O
H—N
H—C—R3
C=O
H—N
H—C—R4
…
2.蛋白质的结构
三级结构
二级结构
四级结构
氢键
COOH
蛋白质的结构示意图
三级结构:肽链在二级结构基础上还会进一步盘曲折叠,形成更复杂的三级结构。
四级结构:多个具有特定三级结构的多肽链通过非共价键相互作用(如氢键等)排列组装,形成蛋白质的四级结构。
一级结构
【环节三】认识蛋白质的结构与性质
科普环节
科普1:当蛋白质分子中的某一种氨基酸改变时,蛋白质的生物性质也将改变。
镰状细胞贫血症:由于人体血红蛋白b链N端的六个氨基酸由谷氨酸变为 缬[xié]氨酸而导致,红细胞的形态由正常的圆饼状变为异常的镰刀状。
显微镜下的正常红细胞和镰刀状红细胞
【环节三】认识蛋白质的结构与性质
科普环节
科普2:桑格在20世纪40年代测定出牛胰岛素分子中全部氨基酸的排列顺序,并证明了其内部氨基酸的结合方式,于1958年获得诺贝尔化学奖。这一发现首次揭示了蛋白质结构的奥秘,为人工合成牛胰岛素奠定了基础。
A链
Gly—Ile—Val—Glu—Gln—Cys—Cys—Ala—Ser—Val—Cys—Ser—Leu—Tyr—Gln—Leu—Glu—Asn—Tyr—Cys—Asn
B链
Phe—Val—Asn—Gln—His—Leu—Cys—Cly—Ser—His—Leu—Val—Glu—Ala—Leu—Tyr—Leu—Val—Cys—Gly—Glu—Arg—Gly—Phe—Phe—Tyr—Thr—Pro—Lys—Ala
S————————————S
— — —
S
S
— — —
S
S
【环节三】认识蛋白质的结构与性质
科普环节
科普3:蛋白质的四级空间结构比较复杂,是至今科学界尚未突破的难题,但是经过不懈的努力,近几年取得了一定的进展,2017年的诺贝尔奖颁发给了在这方面有突出贡献的三位科学家,他们研发了冷冻电子显微镜技术。
冷冻电子显微镜技术
题型2:蛋白质的结构
【练习3】蛋白质的( )与肽键的形成有关。
A. 一级结构 B. 二级结构 C. 三级结构 D. 四级结构
【解析】蛋白质分子中各种氨基酸的连接方式和排列顺序称为蛋白质的一级结构。故选A。
二级结构是指蛋白质主链原子的局部空间结构,并不涉及氨基酸残基侧链构象,二级结构的种类有α-螺旋、β-折叠、β-转角和无规卷曲,氢键是维系二级结构最主要的键;三级结构是指多肽链主链和侧链原子的空间排布,次级键维持其稳定,最主要的键是疏水键;
四级结构是指两条以上具有三级结构的多肽链之间缔合在一起的结构,其中每条具有三级结构的多肽链称为亚基,一般具有四级结构的蛋白质才有生物学活性,维持其稳定的是次级键,如氢键、盐键、疏水键、范德华力等。
【环节三】认识蛋白质的结构与性质
【课前预习2】3分钟时间阅读课本P112-113思考下列问题
1、蛋白质的盐析与变性有什么不同?怎么判断是发生了盐板还是变性?
2、蛋白质的变性有哪些因素?
3、分离提纯蛋白质的方法是什么?
4、误服重金属盐中毒如何急救?
5、怎么鉴别丝制品和棉制品?
6、在新冠疫情防控中,可以怎样对教室进行消毒处理?消毒处理时要注意什么?
【环节三】认识蛋白质的结构与性质
问题:具有复杂结构的高分子蛋白质进入人体后,会发生怎样的变化呢?
3.蛋白质的性质——(1)水解
实验过程 取适量鸡蛋清放入烧杯中,加入一滴管盐溶液,再加入适量沸水,形成乳白色蛋花溶液。
取两支试管各加入5ml蛋花溶液,其中一只加5ml蒸馏水,另一支滴加3滴醋酸,再加入5ml胃蛋白酶溶液。
混合均匀后置于温水浴中,静置,对比两支试管中的现象。
实验现象 滴加醋酸和胃蛋白酶的试管比加蒸馏水的澄清一些。
实验结论 蛋白质在酸、碱或酶作用下,水解成相对分子质量较小的肽类化合物,最终逐步水解得到各种氨基酸。未水解的蛋白质是大分子,溶解性没有小分子好。
模拟实验
【环节三】认识蛋白质的结构与性质
①在酸、碱或酶作用下,
逐步水解成相对分子质量较小的_____,最终水解得到________。
多肽
氨基酸
3.蛋白质的性质——(1)水解
(1)水解反应
②蛋白质在人体内的水解过程
胃蛋白酶或胰蛋白酶
水解
蛋白质
氨基酸
在人体内吸收
后重新组合
蛋白质
氧化反应
放出热量
食物中的蛋白质在人体内各种_______的作用下水解成_______,
氨基酸被_____吸收进入_____,再在体内_________人体所需要的蛋白质。
蛋白酶
氨基酸
肠壁
血液
重新合成
化学与生活
你知道吗
问题:蛋白粉和胶原蛋白液有用吗?
结论:健身时,喝蛋白粉,提高了蛋白质的摄入,确实可以帮助增肌;而胶原蛋白粉,提高了胶原蛋白最终水解为氨基酸,再重新合成胶原蛋白量比较少,到脸上的就更少了。所以想通过和胶原蛋白冻龄恐怕有些困难。同学们正处于生长发育阶段,应该摄取足够的蛋白质,建议每天和一杯牛奶、吃一个鸡蛋。
健身增肌
美容冻龄
题型3:蛋白质的性质
【练习3】下图表示蛋白质分子结构的一部分,请指出蛋白质发生水解时可能断裂的化学键。( )
A 只有①②
B 只有①
C 只有②
D ①②③④
…—NH—CH—C—NH—CH—C—…
R
O
R'
O
④
①
②
③
【解析】蛋白质是氨基酸中氨基和羧基脱水形成肽键而进一步形成的,则蛋白质发生水解反应时,从肽键中断开“C—N”键
【环节三】认识蛋白质的结构与性质
3.蛋白质的性质——(2)变性与盐析
问题:关于怎么吃鸡蛋,网上众说纷纭,有些主张生吃,有些觉得熟的更好,大家更倾向于哪一种呢?
科普:鸡蛋加热后,蛋白质的空间结构被破坏,原有的生物活性会丧失,溶解度降低,黏度增大,肽链松散,更易被水解消化。所以更多的人会选择将鸡蛋煮熟了再吃,这是有一定科学依据的(这样更利于消化吸收)。
提示
变性:像这样在某些因素影响下,蛋白质的理化性质和生理功能发生改变的现象,我们称之为变性。
【环节三】认识蛋白质的结构与性质
3.蛋白质的性质——(2)变性与盐析
学生活动
1、蛋白质溶液+醋酸铅+水/蛋白质溶液加热
2、蛋白质溶液+硫酸铵+水/蛋白质溶液+硫酸钠溶液+水
盐析作用析出的蛋白质仍具有原来的活性,因此经常用盐析来分离、提纯蛋白质。
盐析:向蛋白质中加入浓的无机盐,能够破坏溶解形成的胶体结构而降低蛋白质的溶解性,使蛋白质转化为沉淀析出,这种现象称为盐析。
【环节三】认识蛋白质的结构与性质
3.蛋白质的性质——(2)变性与盐析
(2)变性与盐析
①变性:像这样在某些因素影响下,蛋白质的理化性质和生理功能发生改变的现象,我们称之为变性。
②盐析:向蛋白质中加入浓的无机盐,能够破坏溶解形成的胶体结构而降低蛋白质的溶解性,使蛋白质转化为沉淀析出,这种现象称为盐析。
盐析作用析出的蛋白质仍具有原来的活性,
是可逆过程,经常用盐析分离提纯蛋白质。
影响因素 物理 ______、加压、搅拌、振荡、紫外线和放射线、超声波等
化学因素 ______、 、 、乙醇、苯酚、碘、甲醛、丙酮等
特点 变性会使蛋白质的结构发生变化,使其失去原有的______,在水中不能重新溶解,是 过程
加热
强酸
强碱
重金属盐
不可逆
生理活性
化学与生活
你知道吗
蛋白质变性
【在日常生活中有时需要利用蛋白质变性】
食物加热后,其中的蛋白质发生了变性,有利于人体消化吸收
乙醇、苯酚和碘等作为消毒防腐药可以使微生物的蛋白质变性,导致其死亡,达到消毒的目的
紫外线可用于杀菌消毒。有时也要注意防止蛋白质变性。
疫苗等生物制剂需要在低温下保存
攀登高山时为防止强紫外线引起皮肤和眼睛的蛋白质变性灼伤,需要防晒护目。
【环节三】认识蛋白质的结构与性质
3.蛋白质的性质
变性与盐析
的对比
盐析 变性
相同点 加入某种物质后有沉淀生成
不同点 盐不同 加入某些浓盐溶液, 如Na2SO4、浓食盐水,(NH4)2SO4等 重金属盐、醛、加热、紫外线或剧烈震动
可逆性 可逆,加水即可 不可逆
生理活性 保持生理活性 失去生理活性
用途 分离、提纯蛋白质 杀菌、消毒、防中毒
【环节三】认识蛋白质的结构与性质
3.蛋白质的性质——(3)显色反应
(3)显色反应
向蛋白质溶液加入浓硝酸会有___色沉淀产生,加热后沉淀变_____色。
可用于蛋白质的分析检测
白
黄
含有苯环
固体蛋白质如皮肤、指甲遇浓硝酸变______色。
黄
其他一些试剂也可以与蛋白质作用,呈现特定颜色
【环节三】认识蛋白质的结构与性质
3.蛋白质的性质——(4)燃烧反应
(4)燃烧反应
可用于蛋白质的鉴别
一般生成CO2、H2O、N2、SO2、P2O5等物质。烧焦羽毛味。
【环节4】认识 酶 的结构与性质
①高效性:一般是普通催化剂的107倍。
②催化反应条件温和:一般在接近体温和中性的条件下进行,此时酶的活性最强。超过适宜的温度时,酶将失去活性。
③高度的专一性:例如,蛋白酶只能催化蛋白质的水解反应,淀粉酶只能对淀粉和糖原等多糖的水解起催化作用。
(1)酶的定义:酶是一类由细胞产生的、对生物体内的化学反应具有催化作用的有机化合物,其中绝大多数是蛋白质。
在酶的作用下,生物才能进行新陈代谢、完成消化、呼吸、运动、生长、发育、繁殖等生命活动。
(3)酶的应用:酶得到广泛应用,如蛋白酶用于医药、制革等工业,淀粉酶用于食品、发酵、纺织等工业,有的酶还可用于疾病的诊断。
酶
(2)酶的催化特点:
化学与生活
你知道吗
酶
日常生活中还有哪些事例与蛋白质的盐析和变性有关?
请同学们当个小科学家,辨析一下性质是否可信?
1、夏天打太阳伞和戴墨镜只是为了耍酷,没什么作用?
2、用煮沸的方法可使医疗器械消毒。
3、喝大量盐水可以预防埃博拉病毒感染。
4、农业上用波尔多液(硫酸铜、生石灰和水制成)来消灭害虫
5、常用福尔马林(40%的甲醛溶液)保存生物标本。
6、注射针剂前要用医用酒精对皮肤进行消毒。
题型4:蛋白质的性质
【练习3】下列过程中不涉及蛋白质的变性的是( )
A、煮鸡蛋
B、福尔马林(40%的甲醛溶液)保存生物标本
C、以粮食为原料酿酒
D、使用医用酒精、紫外线杀菌消毒
课堂小结
谈谈你有哪些收获?
氨基酸
多肽
蛋白质
缩合
水解
缩合
水解
氨基羧酸
两性
变性
盐析
显色反应
谢谢欣赏
