2022-2023学年九年级上册化学同步精品讲义(人教版):第三单元物质构成的奥秘复习(课件21页)+
文档属性
| 名称 | 2022-2023学年九年级上册化学同步精品讲义(人教版):第三单元物质构成的奥秘复习(课件21页)+ |  | |
| 格式 | pptx | ||
| 文件大小 | 20.6MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-22 11:27:28 | ||
图片预览





文档简介
(共21张PPT)
第三单元 物质构成的奥秘 单元复习
一、物质的构成
1. 物质是由________、________等微观粒子构成的。
分子
原子
2. 通常分子的________和________都很小。
质量
体积
二、分子的运动
微观粒子(如分子)总是在_____________。
在受热的情况下,分子能量增大,运动速率_______。
不断运动着
加快
三、分子与体积变化
1. 气体可压缩储存于钢瓶中,是因为____________________。
2. 在受压的情况下气体液化,分子间的_______减小。
3. 同一种物质在固态、液态和气态时所占体积不同,是因为它们____________________。
4. 物体的热胀冷缩现象,是物质分子间的间隔受热时_______,遇冷时_______的缘故。
分子之间有间隔
间隔
分子间的间隔不同
增大
缩小
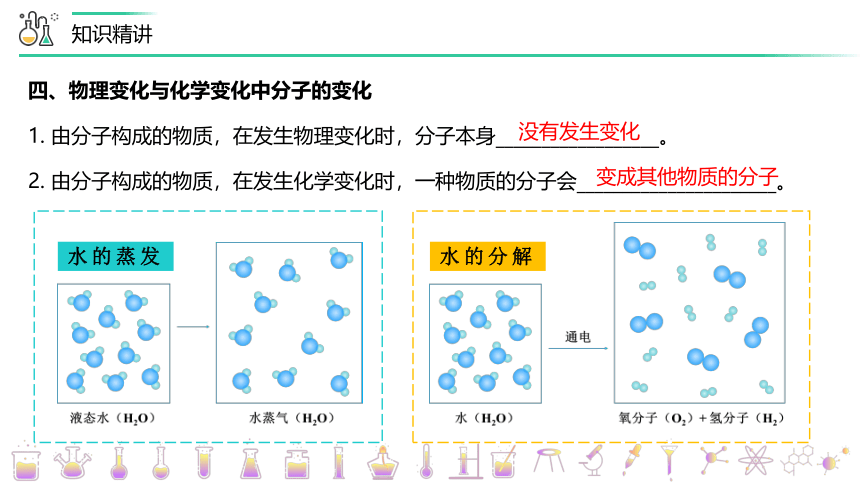
四、物理变化与化学变化中分子的变化
1. 由分子构成的物质,在发生物理变化时,分子本身__________________。
2. 由分子构成的物质,在发生化学变化时,一种物质的分子会______________________。
没有发生变化
变成其他物质的分子
水的蒸发
水的分解
四、物理变化与化学变化中分子的变化
1. 由分子构成的物质,在发生物理变化时,分子本身__________________。
2. 由分子构成的物质,在发生化学变化时,一种物质的分子会______________________。
没有发生变化
变成其他物质的分子
(1)在化学变化中,_______________________________________________________。
(2)在化学变化中,分子的种类______发生变化,而原子的种类______发生变化。
(3)在化学变化中,______是化学变化中的最小粒子。
分子可以分成原子,原子又可以结合成新的分子
可以
不会
原子
五、分子的构成
1.由分子构成的物质,___________是保持其化学性质的最小粒子。
2. 分子是由________构成的。
(1)有些分子由同种原子构成,如1个氧分子是由2个氧原子构成的,1个氢分子是由2个氢原子构成;
(2)大多数分子由两种或两种以上原子构成,如1个二氧化碳分子是由1个碳原子和2个氧原子构成的,1个氨分子是由1个氮原子和3个氢原子构成的。
分子
原子
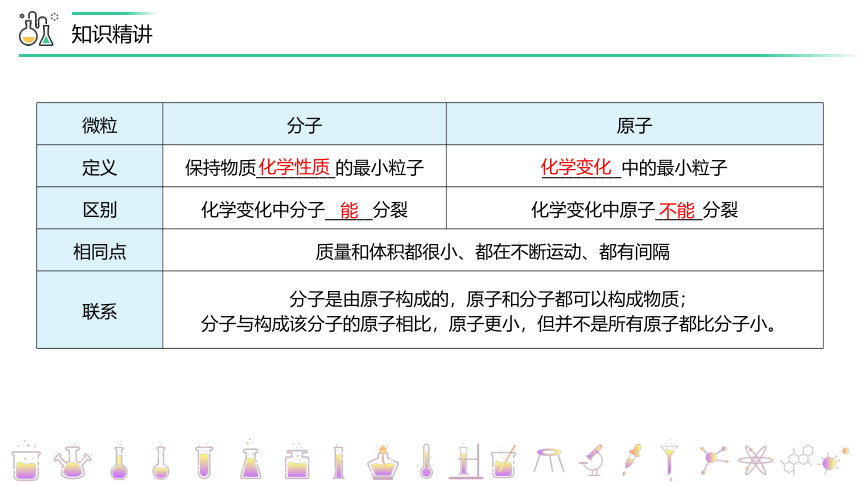
微粒 分子 原子
定义 保持物质__________的最小粒子 __________中的最小粒子
区别 化学变化中分子______分裂 化学变化中原子______分裂
相同点 质量和体积都很小、都在不断运动、都有间隔 联系 分子是由原子构成的,原子和分子都可以构成物质; 分子与构成该分子的原子相比,原子更小,但并不是所有原子都比分子小。 化学性质
化学变化
能
不能
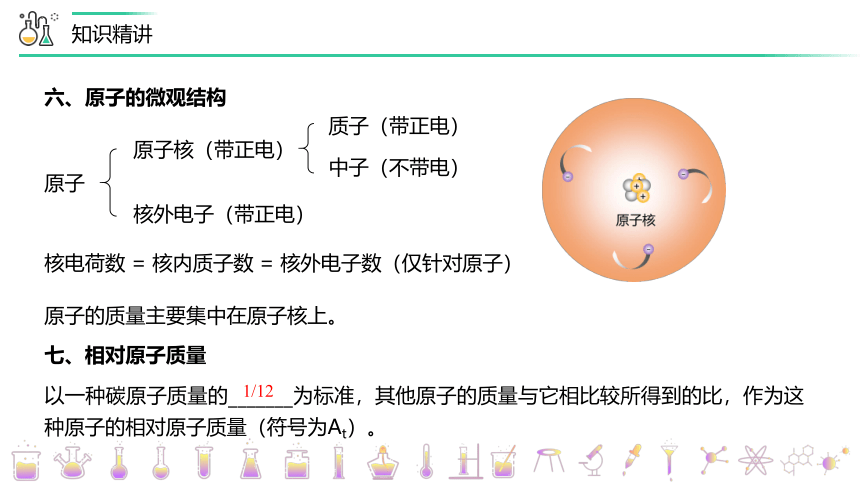
六、原子的微观结构
原子
原子核(带正电)
核外电子(带正电)
质子(带正电)
中子(不带电)
核电荷数 = 核内质子数 = 核外电子数(仅针对原子)
原子的质量主要集中在原子核上。
七、相对原子质量
以一种碳原子质量的_______为标准,其他原子的质量与它相比较所得到的比,作为这种原子的相对原子质量(符号为At)。
1/12
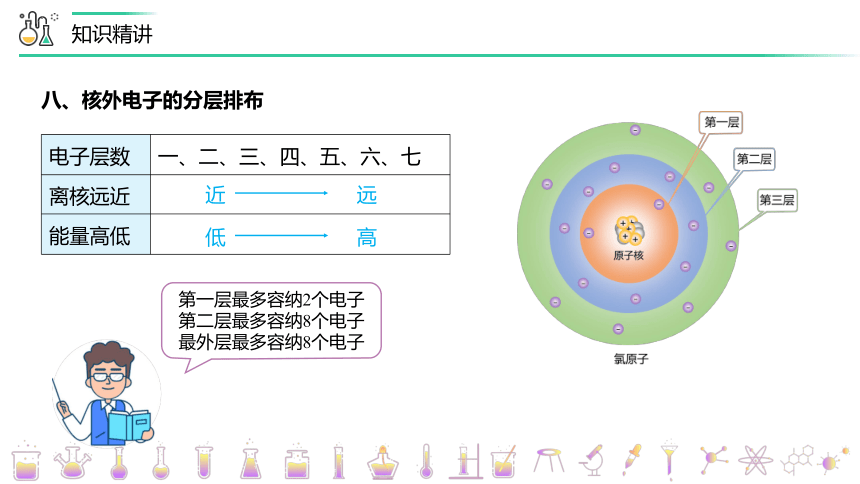
电子层数 一、二、三、四、五、六、七
离核远近
能量高低
近 远
低 高
八、核外电子的分层排布
第一层最多容纳2个电子
第二层最多容纳8个电子
最外层最多容纳8个电子
九、原子结构示意图
表示原子核电荷数和电子层排布的图示形式。
(1)小圈表示原子核,圈内的数字表示核内质子数;
(2)弧线表示电子层,弧线上的数字表示该层的电子数。
+11
2 8 1
原子核
核内质子数
第一层
第二层
第三层
各层的电子数
原子种类 实例 最外层电子数 得失电子 结构稳定性 化学性质
稀有气体
金属
非金属
He、Ne、Ar
8(He为2)
不易得,不易失
稳定
稳定
Na、Mg、Al
N、O、S
< 4
> 4
易失去
易得到
不稳定
不稳定
不稳定
不稳定
原子的化学性质,与其原子的核外电子排布,特别是与最外层电子的数目有关。
换言之,原子的最外层电子数决定原子的化学性质。
3. 离子符号的含义
带正电的原子叫做阳离子,如钠离子(Na+)
带负电的原子叫做阴离子,如氯离子(Cl-)
元素符号右上角的“+”“﹣”表示电性,如Na+ 表示钠离子带 1 个单位正电荷,Cl- 表示氯离子带 1个单位负电荷。
十、元素的定义
元素是具有相同_________(即_________)的一类原子的总称。
质子数
核电荷数
十一、物质是由元素组成的
1. 宏观上,一切物质都是由元素组成的。
2. 微观上,物质有的是由分子构成的,有的是由原子构成的,也有的是由离子构成的。
注意固定搭配
(1)宏观——元素——组成。水是由氢元素和氧元素组成的
(2)微观——原子——构成。1 个水分子是由 2 个氢原子和 1 个氧原子构成的
十二、化学变化中元素、原子的变化
在物质发生化学变化时,原子的_________不变,_________也不会改变。
种类
元素
十三、地壳中各种元素的含量
地壳中含量前五的元素分别为:
_____、_____、_____、 _____、 _____。
氧 硅 铝 铁 钙
(1)地壳含量最多金属元素_________;
(2)生物细胞中含量最多_________ ;
(3)人体中最多金属元素_________ 。
铝(Al)
氧(O)
钙(Ca)
十四、元素符号的书写与意义
1. 书写
(1)由一个字母表示的元素符号要________;
(2)由两个字母表示的元素符号,第一个字母________,第二个字母________。
2. 意义
元素符号表示_________,还表示这种元素的_________。
如元素符号“O”既表示氧元素,又表示氧元素的一个原子。
大写
大写
小写
一种元素
一个原子
元素
金属元素
非金属元素
十五、元素的分类
带“钅”旁, “汞”例外
带“石”“气”“氵”旁
十六、元素周期表
定义:根据元素的原子结构和性质,将已知的100多种元素按原子序数科学有序地排列起来所得的表,叫做元素周期表。
2. 结构
(1)周期:每一横行为一个周期,共有 7个周期。
(2)族:每个纵行为一族,共18个纵行,16个族(8,9,10三个纵行为一个族)。
3. 周期表中的元素分类
在周期表中,用不同颜色对金属元素、非金属元素做出了区分。
元素周期表的始末:金属元素→非金属元素(→稀有气体元素)。
十七、元素周期表的信息
根据元素周期表能确定元素的分类、元素名称、元素符号、相对原子质量及核电荷数、质子数、核外电子数等。
6 C
碳
12.01
元素符号
元素名称
相对原子质量
原子序数
十八、元素周期表与原子结构的关系
电子层数 = ________数。同周期元素,电子层数________。
2. 同一周期的元素,原子序数、最外层电子数(前三周期)从左到右依次________。
3. 同一族的元素,原子的最外层电子数________,化学性质________。
周期
相同
增加
相同
相似
第三单元 物质构成的奥秘 单元复习
一、物质的构成
1. 物质是由________、________等微观粒子构成的。
分子
原子
2. 通常分子的________和________都很小。
质量
体积
二、分子的运动
微观粒子(如分子)总是在_____________。
在受热的情况下,分子能量增大,运动速率_______。
不断运动着
加快
三、分子与体积变化
1. 气体可压缩储存于钢瓶中,是因为____________________。
2. 在受压的情况下气体液化,分子间的_______减小。
3. 同一种物质在固态、液态和气态时所占体积不同,是因为它们____________________。
4. 物体的热胀冷缩现象,是物质分子间的间隔受热时_______,遇冷时_______的缘故。
分子之间有间隔
间隔
分子间的间隔不同
增大
缩小
四、物理变化与化学变化中分子的变化
1. 由分子构成的物质,在发生物理变化时,分子本身__________________。
2. 由分子构成的物质,在发生化学变化时,一种物质的分子会______________________。
没有发生变化
变成其他物质的分子
水的蒸发
水的分解
四、物理变化与化学变化中分子的变化
1. 由分子构成的物质,在发生物理变化时,分子本身__________________。
2. 由分子构成的物质,在发生化学变化时,一种物质的分子会______________________。
没有发生变化
变成其他物质的分子
(1)在化学变化中,_______________________________________________________。
(2)在化学变化中,分子的种类______发生变化,而原子的种类______发生变化。
(3)在化学变化中,______是化学变化中的最小粒子。
分子可以分成原子,原子又可以结合成新的分子
可以
不会
原子
五、分子的构成
1.由分子构成的物质,___________是保持其化学性质的最小粒子。
2. 分子是由________构成的。
(1)有些分子由同种原子构成,如1个氧分子是由2个氧原子构成的,1个氢分子是由2个氢原子构成;
(2)大多数分子由两种或两种以上原子构成,如1个二氧化碳分子是由1个碳原子和2个氧原子构成的,1个氨分子是由1个氮原子和3个氢原子构成的。
分子
原子
微粒 分子 原子
定义 保持物质__________的最小粒子 __________中的最小粒子
区别 化学变化中分子______分裂 化学变化中原子______分裂
相同点 质量和体积都很小、都在不断运动、都有间隔 联系 分子是由原子构成的,原子和分子都可以构成物质; 分子与构成该分子的原子相比,原子更小,但并不是所有原子都比分子小。 化学性质
化学变化
能
不能
六、原子的微观结构
原子
原子核(带正电)
核外电子(带正电)
质子(带正电)
中子(不带电)
核电荷数 = 核内质子数 = 核外电子数(仅针对原子)
原子的质量主要集中在原子核上。
七、相对原子质量
以一种碳原子质量的_______为标准,其他原子的质量与它相比较所得到的比,作为这种原子的相对原子质量(符号为At)。
1/12
电子层数 一、二、三、四、五、六、七
离核远近
能量高低
近 远
低 高
八、核外电子的分层排布
第一层最多容纳2个电子
第二层最多容纳8个电子
最外层最多容纳8个电子
九、原子结构示意图
表示原子核电荷数和电子层排布的图示形式。
(1)小圈表示原子核,圈内的数字表示核内质子数;
(2)弧线表示电子层,弧线上的数字表示该层的电子数。
+11
2 8 1
原子核
核内质子数
第一层
第二层
第三层
各层的电子数
原子种类 实例 最外层电子数 得失电子 结构稳定性 化学性质
稀有气体
金属
非金属
He、Ne、Ar
8(He为2)
不易得,不易失
稳定
稳定
Na、Mg、Al
N、O、S
< 4
> 4
易失去
易得到
不稳定
不稳定
不稳定
不稳定
原子的化学性质,与其原子的核外电子排布,特别是与最外层电子的数目有关。
换言之,原子的最外层电子数决定原子的化学性质。
3. 离子符号的含义
带正电的原子叫做阳离子,如钠离子(Na+)
带负电的原子叫做阴离子,如氯离子(Cl-)
元素符号右上角的“+”“﹣”表示电性,如Na+ 表示钠离子带 1 个单位正电荷,Cl- 表示氯离子带 1个单位负电荷。
十、元素的定义
元素是具有相同_________(即_________)的一类原子的总称。
质子数
核电荷数
十一、物质是由元素组成的
1. 宏观上,一切物质都是由元素组成的。
2. 微观上,物质有的是由分子构成的,有的是由原子构成的,也有的是由离子构成的。
注意固定搭配
(1)宏观——元素——组成。水是由氢元素和氧元素组成的
(2)微观——原子——构成。1 个水分子是由 2 个氢原子和 1 个氧原子构成的
十二、化学变化中元素、原子的变化
在物质发生化学变化时,原子的_________不变,_________也不会改变。
种类
元素
十三、地壳中各种元素的含量
地壳中含量前五的元素分别为:
_____、_____、_____、 _____、 _____。
氧 硅 铝 铁 钙
(1)地壳含量最多金属元素_________;
(2)生物细胞中含量最多_________ ;
(3)人体中最多金属元素_________ 。
铝(Al)
氧(O)
钙(Ca)
十四、元素符号的书写与意义
1. 书写
(1)由一个字母表示的元素符号要________;
(2)由两个字母表示的元素符号,第一个字母________,第二个字母________。
2. 意义
元素符号表示_________,还表示这种元素的_________。
如元素符号“O”既表示氧元素,又表示氧元素的一个原子。
大写
大写
小写
一种元素
一个原子
元素
金属元素
非金属元素
十五、元素的分类
带“钅”旁, “汞”例外
带“石”“气”“氵”旁
十六、元素周期表
定义:根据元素的原子结构和性质,将已知的100多种元素按原子序数科学有序地排列起来所得的表,叫做元素周期表。
2. 结构
(1)周期:每一横行为一个周期,共有 7个周期。
(2)族:每个纵行为一族,共18个纵行,16个族(8,9,10三个纵行为一个族)。
3. 周期表中的元素分类
在周期表中,用不同颜色对金属元素、非金属元素做出了区分。
元素周期表的始末:金属元素→非金属元素(→稀有气体元素)。
十七、元素周期表的信息
根据元素周期表能确定元素的分类、元素名称、元素符号、相对原子质量及核电荷数、质子数、核外电子数等。
6 C
碳
12.01
元素符号
元素名称
相对原子质量
原子序数
十八、元素周期表与原子结构的关系
电子层数 = ________数。同周期元素,电子层数________。
2. 同一周期的元素,原子序数、最外层电子数(前三周期)从左到右依次________。
3. 同一族的元素,原子的最外层电子数________,化学性质________。
周期
相同
增加
相同
相似
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
