2022年秋学期高中化学人教版(2019)必修1课后作业:1-2-1 电解质的电离Word版含解析
文档属性
| 名称 | 2022年秋学期高中化学人教版(2019)必修1课后作业:1-2-1 电解质的电离Word版含解析 |  | |
| 格式 | doc | ||
| 文件大小 | 404.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-22 21:55:16 | ||
图片预览


文档简介
1-2-1 电解质的电离
一、选择题(每小题4分,共48分,每小题只有一个正确选项)
1. 下列说法正确的是( )
A.硫酸钡不溶于水,所以硫酸钡是非电解质
B.二氧化碳溶于水可以导电,所以二氧化碳是电解质
C.硫酸是电解质,所以硫酸在熔融态或溶于水时都能导电
D.液态氯化氢不导电,但氯化氢是电解质
2.若A+酸===盐+水,则A不可能属于( )
A.氧化物 B.单质 C.碱 D.电解质
3.下列说法正确的一组是( )
①难溶于水的盐(CaCO3、BaSO4等)都是非电解质
②不是电解质的物质一定是非电解质
③强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
④电解质溶液导电的原因是溶液中有自由移动的阴离子和阳离子
⑤熔融的电解质都能导电
A.①③⑤⑥ B.②④⑤
C.只有④ D.只有⑤
4.仅能在水溶液中导电的电解质是( )
A. KOH B. KCl
C. CO2 D. NH4HCO3
5. 下列物质中,含有自由移动的Cl-的是( )
A.KClO3溶液 B.CaCl2溶液
C.KCl晶体 D.液态HCl
6. 下列说法正确的是( )
A.水导电性很差,所以水是非电解质
B.电解质与非电解质的本质区别,是在一定条件下能否电离
C.酸、碱和盐类都属于电解质,其他化合物都是非电解质
D.NaCl和HCl都是电解质,所以它们熔融状态下都能导电
7.下列物质分类正确的组合是( )
选项 混合物 纯净物 单质 电解质
A 盐酸 NaOH 石墨 K2SO4溶液
B 空气 Fe(OH)3胶体 铁 Na2CO3
C CuSO4·5H2O CaCl2 水银 铜
D 氯水 KNO3晶体 O3 NaCl
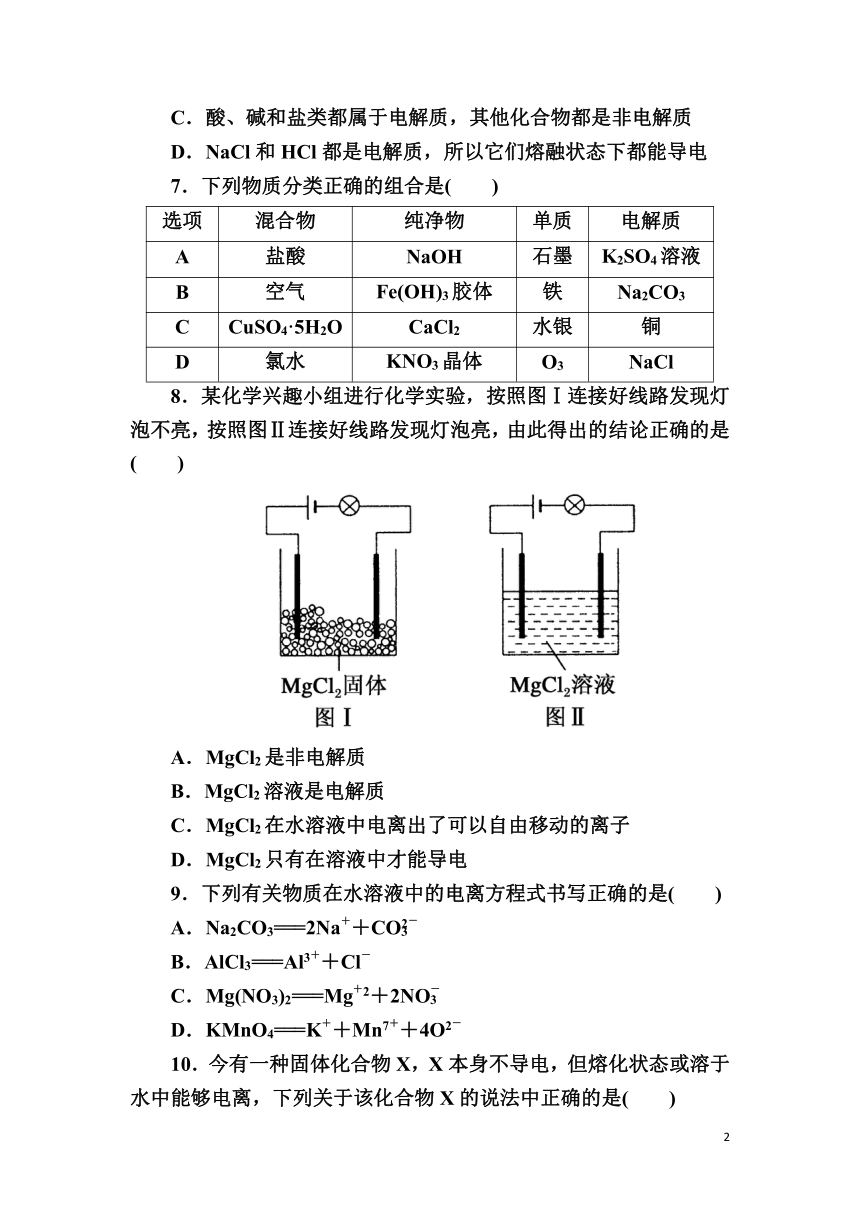
8.某化学兴趣小组进行化学实验,按照图Ⅰ连接好线路发现灯泡不亮,按照图Ⅱ连接好线路发现灯泡亮,由此得出的结论正确的是( )
A.MgCl2是非电解质
B.MgCl2溶液是电解质
C.MgCl2在水溶液中电离出了可以自由移动的离子
D.MgCl2只有在溶液中才能导电
9.下列有关物质在水溶液中的电离方程式书写正确的是( )
A.Na2CO3===2Na++CO
B.AlCl3===Al3++Cl-
C.Mg(NO3)2===Mg+2+2NO
D.KMnO4===K++Mn7++4O2-
10.今有一种固体化合物X,X本身不导电,但熔化状态或溶于水中能够电离,下列关于该化合物X的说法中正确的是( )
A.X一定是电解质
B.X可能是非电解质
C.X只能是盐
D.X可以是任何化合物
11.下列各组均为两种化合物溶于水时电离出的离子,其中按照仅由酸、碱、盐依次电离的是( )
①Na+、OH-、SO ②H+、Cl-、SO
③Na+、K+、OH- ④Na+、K+、NO
A.②③④ B.②①④ C.②③① D.②①③
12.下列实验过程中产生的现象与图示相符的是( )
A.稀盐酸滴加到一定量的NaOH溶液中(横坐标是稀盐酸的体积,纵坐标为钠离子的物质的量)
B.铁粉加入一定量的CuSO4溶液中(横坐标是铁粉的质量,纵坐标为固体的质量)
C.CO2通入一定量的NaOH溶液中(横坐标是CO2的体积,纵坐标为溶液的导电能力)
D.稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
二、非选择题(共52分)
13.(10分)现有以下物质:①NaCl晶体;②液态SO3;③液态醋酸;④汞;⑤BaSO4晶体;⑥纯蔗糖;⑦酒精;⑧熔融KNO3;⑨O2。请回答下列问题(用序号填写):
(1)以上物质能导电的是 。
(2)以上物质属于电解质的是 。
(3)以上物质属于非电解质的是 。
(4)以上物质溶于水后形成的水溶液能导电的是 。
(5)以上物质既不是电解质,又不是非电解质的是 。
14.(9分)在如图所示的串联装置中,发现灯泡不亮,但若向其中一个烧杯中加水,则灯泡会亮起来。
则:(1)加水的烧杯为 。
(2)将烧杯B和 混合后溶液的导电性会减弱。
(3)写出D烧杯中电解质的电离方程式: 。
15.(15分)NaHSO4通常为晶体,易溶于水,它溶于水时电离出三种不同的离子,溶液显酸性。NaHSO4受热熔化时只能电离出两种不同的离子。
(1)NaHSO4在水溶液中的电离方程式为 。
(2)NaHSO4在熔融状态下的电离方程式为 。
(3)下列说法中正确的是 (填序号)。
A.NaHSO4属于酸
B.NaHSO4属于盐
C.NaHSO4属于电解质
D.NaHSO4溶液能与Zn反应生成氢气
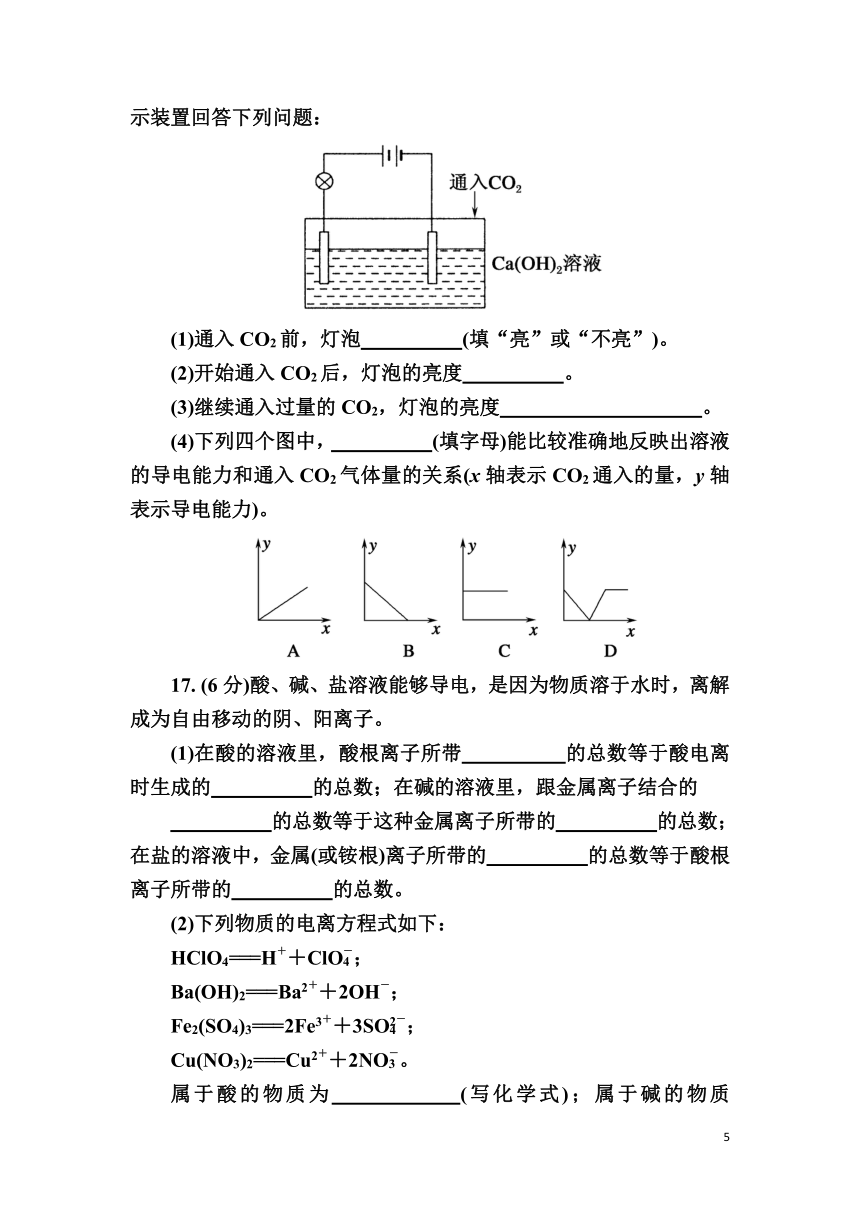
16. (12分)已知:CO2+Ca(OH)2===CaCO3↓+H2O,CaCO3+CO2+H2O===Ca(HCO3)2,且Ca(HCO3)2易溶于水。试根据如图所示装置回答下列问题:
(1)通入CO2前,灯泡 (填“亮”或“不亮”)。
(2)开始通入CO2后,灯泡的亮度 。
(3)继续通入过量的CO2,灯泡的亮度 。
(4)下列四个图中, (填字母)能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)。
17. (6分)酸、碱、盐溶液能够导电,是因为物质溶于水时,离解成为自由移动的阴、阳离子。
(1)在酸的溶液里,酸根离子所带 的总数等于酸电离时生成的 的总数;在碱的溶液里,跟金属离子结合的
的总数等于这种金属离子所带的 的总数;在盐的溶液中,金属(或铵根)离子所带的 的总数等于酸根离子所带的 的总数。
(2)下列物质的电离方程式如下:
HClO4===H++ClO;
Ba(OH)2===Ba2++2OH-;
Fe2(SO4)3===2Fe3++3SO;
Cu(NO3)2===Cu2++2NO。
属于酸的物质为 (写化学式);属于碱的物质为 ;属于盐的物质为 。
(3)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
①从物质的分类角度看,不恰当的一种物质是 。
②上述物质中既不是电解质也不是非电解质的是盐酸。依据是 。
③写出纯碱的电离方程式: 。
1-2-1 电解质的电离
一、选择题(每小题4分,共48分,每小题只有一个正确选项)
1. 下列说法正确的是( D )
A.硫酸钡不溶于水,所以硫酸钡是非电解质
B.二氧化碳溶于水可以导电,所以二氧化碳是电解质
C.硫酸是电解质,所以硫酸在熔融态或溶于水时都能导电
D.液态氯化氢不导电,但氯化氢是电解质
解析:硫酸钡不溶于水但受热熔化时可导电,故硫酸钡是电解质,故A错误;虽然二氧化碳溶于水可以导电,但在水溶液中能直接电离出自由移动离子的不是二氧化碳,而是碳酸,故B错误;硫酸是由硫酸分子构成的,在熔融态时不能导电,故C错误;液态氯化氢不导电,但氯化氢的水溶液能导电,氯化氢是电解质,故D正确。
2.若A+酸===盐+水,则A不可能属于( B )
A.氧化物 B.单质 C.碱 D.电解质
解析:单质与酸反应,可能生成盐和H2,也可能生成盐、水和另一种还原产物,还可能只生成氧化物,不可能只生成盐和水。金属氧化物(如Na2O)、碱(如NaOH)与酸反应都生成盐和水。
3.下列说法正确的一组是( C )
①难溶于水的盐(CaCO3、BaSO4等)都是非电解质
②不是电解质的物质一定是非电解质
③强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
④电解质溶液导电的原因是溶液中有自由移动的阴离子和阳离子
⑤熔融的电解质都能导电
A.①③⑤⑥ B.②④⑤
C.只有④ D.只有⑤
解析:CaCO3、BaSO4虽难溶于水,但它们是电解质,故①错误;单质既不是电解质,也不是非电解质,故②错误;熔融的H2SO4不能导电,故⑤错误。
4.仅能在水溶液中导电的电解质是( D )
A. KOH B. KCl
C. CO2 D. NH4HCO3
解析:KOH、KCl在水溶液中和熔融状态下都能导电;CO2水溶液能导电,但是导电的原因是CO2与水反应生成了H2CO3,CO2不属于电解质;NH4HCO3溶于水电离成NH和HCO能导电,但在加热情况下,NH4HCO3会分解,NH4HCO3NH3↑+H2O+
CO2↑,故选D。
5. 下列物质中,含有自由移动的Cl-的是( B )
A.KClO3溶液 B.CaCl2溶液
C.KCl晶体 D.液态HCl
解析:KClO3溶液中存在K+、ClO;KCl晶体中Cl-不能自由移动;液态HCl中只存在HCl分子。
6. 下列说法正确的是( B )
A.水导电性很差,所以水是非电解质
B.电解质与非电解质的本质区别,是在一定条件下能否电离
C.酸、碱和盐类都属于电解质,其他化合物都是非电解质
D.NaCl和HCl都是电解质,所以它们熔融状态下都能导电
解析:A项,水能电离出OH-与H+,所以水是电解质;C项,部分氧化物也属于电解质,如Na2O、CaO;D项,HCl在熔融状态下不导电。
7.下列物质分类正确的组合是( D )
选项 混合物 纯净物 单质 电解质
A 盐酸 NaOH 石墨 K2SO4溶液
B 空气 Fe(OH)3胶体 铁 Na2CO3
C CuSO4·5H2O CaCl2 水银 铜
D 氯水 KNO3晶体 O3 NaCl
解析:A项,K2SO4溶液是混合物,不是电解质;B项,胶体是混合物;C项,CuSO4·5H2O是纯净物,不是混合物,铜是单质,其既不是电解质也不是非电解质。
8.某化学兴趣小组进行化学实验,按照图Ⅰ连接好线路发现灯泡不亮,按照图Ⅱ连接好线路发现灯泡亮,由此得出的结论正确的是( C )
A.MgCl2是非电解质
B.MgCl2溶液是电解质
C.MgCl2在水溶液中电离出了可以自由移动的离子
D.MgCl2只有在溶液中才能导电
解析:MgCl2固体中离子不能自由移动,不导电;MgCl2固体在溶液中电离生成能够自由移动的Mg2+和Cl-,MgCl2溶液导电;MgCl2在熔融状态也能导电,D错。
9.下列有关物质在水溶液中的电离方程式书写正确的是( A )
A.Na2CO3===2Na++CO
B.AlCl3===Al3++Cl-
C.Mg(NO3)2===Mg+2+2NO
D.KMnO4===K++Mn7++4O2-
解析:AlCl3在水溶液中的电离方程式为AlCl3===Al3++3Cl-,B项错误;镁离子的正确写法为Mg2+,C项错误;MnO不能拆分,D项错误。
10.今有一种固体化合物X,X本身不导电,但熔化状态或溶于水中能够电离,下列关于该化合物X的说法中正确的是( A )
A.X一定是电解质
B.X可能是非电解质
C.X只能是盐
D.X可以是任何化合物
解析:既然熔化时该化合物可以导电,说明一定是电解质,A正确,B、D错误;X为固体,则可能是盐,也可能是碱或金属氧化物,C错误。
11.下列各组均为两种化合物溶于水时电离出的离子,其中按照仅由酸、碱、盐依次电离的是( A )
①Na+、OH-、SO ②H+、Cl-、SO
③Na+、K+、OH- ④Na+、K+、NO
A.②③④ B.②①④ C.②③① D.②①③
解析:此题从电离的角度理解酸、碱、盐的概念。酸电离出的阳离子只有H+,②符合要求;碱电离出的阴离子只有OH-,③符合要求;盐电离出金属阳离子(或铵根离子)和酸根离子,④符合要求,故A选项正确。
12.下列实验过程中产生的现象与图示相符的是( D )
A.稀盐酸滴加到一定量的NaOH溶液中(横坐标是稀盐酸的体积,纵坐标为钠离子的物质的量)
B.铁粉加入一定量的CuSO4溶液中(横坐标是铁粉的质量,纵坐标为固体的质量)
C.CO2通入一定量的NaOH溶液中(横坐标是CO2的体积,纵坐标为溶液的导电能力)
D.稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
解析:A项,HCl+NaOH===NaCl+H2O,氢氧化钠和氯化钠都是强电解质,在水中完全电离,所以钠离子的物质的量不变,而图像中的钠离子的物质的量先变小后变大,故A项错误;B项,铁粉加入一定量的CuSO4溶液中,发生反应:Fe+CuSO4===FeSO4+Cu,根据方程式可知,每消耗56 g铁,生成64 g固体,所以固体的质量一直在增加,而图像中固体的质量先变小后变大,B项错误;C项,CO2通入一定量的NaOH溶液中,发生反应:CO2+2NaOH===Na2CO3+H2O、Na2CO3+CO2+H2O===2NaHCO3,根据方程式可知,溶液中离子的总电荷数基本不变,所以导电能力基本不变,C项错误;D项,滴入的硫酸与氢氧化钡反应,生成硫酸钡沉淀和水,溶液中离子浓度减少,导电能力下降,恰好完全反应时导电性接近于零,再随着稀硫酸的滴入,溶液的导电能力增强,D项正确。
二、非选择题(共52分)
13.(10分)现有以下物质:①NaCl晶体;②液态SO3;③液态醋酸;④汞;⑤BaSO4晶体;⑥纯蔗糖;⑦酒精;⑧熔融KNO3;⑨O2。请回答下列问题(用序号填写):
(1)以上物质能导电的是④⑧。
(2)以上物质属于电解质的是①③⑤⑧。
(3)以上物质属于非电解质的是②⑥⑦。
(4)以上物质溶于水后形成的水溶液能导电的是①②③⑧。
(5)以上物质既不是电解质,又不是非电解质的是④⑨。
解析:①NaCl晶体是电解质,但其Na+、Cl-不能自由移动,不能导电;②液态SO3不能导电,是非电解质;③液态醋酸溶于水能导电,是电解质,但液态醋酸自身不能电离,不能导电;④汞是金属单质,能导电,既不是电解质也不是非电解质;⑤BaSO4晶体尽管溶解度很小,但溶解的部分BaSO4能全部电离,且熔融状态下能导电,是电解质;⑥纯蔗糖无论溶于水还是熔融状态下均不导电,是非电解质;⑦酒精无论溶于水还是熔融状态下均不导电,是非电解质;⑧熔融KNO3电离出K+和NO,是电解质,能导电;⑨O2是非金属单质,本身不导电,既不是电解质也不是非电解质。
14.(9分)在如图所示的串联装置中,发现灯泡不亮,但若向其中一个烧杯中加水,则灯泡会亮起来。
则:(1)加水的烧杯为C。
(2)将烧杯B和D混合后溶液的导电性会减弱。
(3)写出D烧杯中电解质的电离方程式:Ba(OH)2===Ba2++2OH-。
解析:四个烧杯中只有C中没有发生电解质电离,没有自由移动的离子,当加水时,H3PO4电离而导电;当CuSO4溶液与Ba(OH)2溶液混合后,由于发生反应:CuSO4+Ba(OH)2===BaSO4↓+Cu(OH)2↓,从而溶液中离子浓度减小,混合后溶液体积增大,导电能力减弱。
15.(15分)NaHSO4通常为晶体,易溶于水,它溶于水时电离出三种不同的离子,溶液显酸性。NaHSO4受热熔化时只能电离出两种不同的离子。
(1)NaHSO4在水溶液中的电离方程式为NaHSO4===Na++H++SO。
(2)NaHSO4在熔融状态下的电离方程式为NaHSO4===Na++HSO。
(3)下列说法中正确的是BCD(填序号)。
A.NaHSO4属于酸
B.NaHSO4属于盐
C.NaHSO4属于电解质
D.NaHSO4溶液能与Zn反应生成氢气
解析:NaHSO4溶于水电离出三种离子,且呈酸性,则它电离出的离子是Na+、H+、SO;NaHSO4受热熔化时只能电离出两种离子,分别是Na+和HSO;由其电离情况知,NaHSO4既是盐又是强电解质,不属于酸,NaHSO4溶液中含有H+,故能与Zn反应生成H2。
16. (12分)已知:CO2+Ca(OH)2===CaCO3↓+H2O,CaCO3+CO2+H2O===Ca(HCO3)2,且Ca(HCO3)2易溶于水。试根据如图所示装置回答下列问题:
(1)通入CO2前,灯泡亮(填“亮”或“不亮”)。
(2)开始通入CO2后,灯泡的亮度先变暗后熄灭。
(3)继续通入过量的CO2,灯泡的亮度熄灭后又逐渐变亮。
(4)下列四个图中,D(填字母)能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)。
解析:(1)灯泡亮,因为Ca(OH)2溶于水后完全电离出离子,溶液中离子的浓度比较大,故灯泡亮。
(2)灯泡先变暗后熄灭,因为发生了CO2+Ca(OH)2===CaCO3↓+H2O,溶液中自由移动的离子减少。
(3)灯泡熄灭后又逐渐变亮:CaCO3+CO2+H2O===Ca(HCO3)2,Ca(HCO3)2完全电离出自由移动的离子,溶液中离子浓度增大。
(4)由于通入CO2后溶液中自由移动的离子的浓度逐渐减小,所以一开始导电能力逐渐下降,随着反应的进行,离子浓度逐渐增大,导电能力又逐渐增大,所以选D。
17. (6分)酸、碱、盐溶液能够导电,是因为物质溶于水时,离解成为自由移动的阴、阳离子。
(1)在酸的溶液里,酸根离子所带负电荷的总数等于酸电离时生成的H+的总数;在碱的溶液里,跟金属离子结合的OH-的总数等于这种金属离子所带的正电荷的总数;在盐的溶液中,金属(或铵根)离子所带的正电荷的总数等于酸根离子所带的负电荷的总数。
(2)下列物质的电离方程式如下:
HClO4===H++ClO;
Ba(OH)2===Ba2++2OH-;
Fe2(SO4)3===2Fe3++3SO;
Cu(NO3)2===Cu2++2NO。
属于酸的物质为HClO4(写化学式);属于碱的物质为Ba(OH)2;属于盐的物质为Fe2(SO4)3、Cu(NO3)2。
(3)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
①从物质的分类角度看,不恰当的一种物质是纯碱。
②上述物质中既不是电解质也不是非电解质的是盐酸。依据是盐酸是混合物,不是化合物。
③写出纯碱的电离方程式:Na2CO3===2Na++CO。
解析:(1)溶液呈电中性,阴离子所带的负电荷总数等于阳离子所带的正电荷总数。(2)根据酸、碱、盐的概念判断。(3)纯碱是Na2CO3,属于盐,不是碱;盐酸是HCl的水溶液,是混合物,既不是电解质也不是非电解质。Na2CO3的电离方程式为Na2CO3===2Na++CO。
PAGE
2
一、选择题(每小题4分,共48分,每小题只有一个正确选项)
1. 下列说法正确的是( )
A.硫酸钡不溶于水,所以硫酸钡是非电解质
B.二氧化碳溶于水可以导电,所以二氧化碳是电解质
C.硫酸是电解质,所以硫酸在熔融态或溶于水时都能导电
D.液态氯化氢不导电,但氯化氢是电解质
2.若A+酸===盐+水,则A不可能属于( )
A.氧化物 B.单质 C.碱 D.电解质
3.下列说法正确的一组是( )
①难溶于水的盐(CaCO3、BaSO4等)都是非电解质
②不是电解质的物质一定是非电解质
③强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
④电解质溶液导电的原因是溶液中有自由移动的阴离子和阳离子
⑤熔融的电解质都能导电
A.①③⑤⑥ B.②④⑤
C.只有④ D.只有⑤
4.仅能在水溶液中导电的电解质是( )
A. KOH B. KCl
C. CO2 D. NH4HCO3
5. 下列物质中,含有自由移动的Cl-的是( )
A.KClO3溶液 B.CaCl2溶液
C.KCl晶体 D.液态HCl
6. 下列说法正确的是( )
A.水导电性很差,所以水是非电解质
B.电解质与非电解质的本质区别,是在一定条件下能否电离
C.酸、碱和盐类都属于电解质,其他化合物都是非电解质
D.NaCl和HCl都是电解质,所以它们熔融状态下都能导电
7.下列物质分类正确的组合是( )
选项 混合物 纯净物 单质 电解质
A 盐酸 NaOH 石墨 K2SO4溶液
B 空气 Fe(OH)3胶体 铁 Na2CO3
C CuSO4·5H2O CaCl2 水银 铜
D 氯水 KNO3晶体 O3 NaCl
8.某化学兴趣小组进行化学实验,按照图Ⅰ连接好线路发现灯泡不亮,按照图Ⅱ连接好线路发现灯泡亮,由此得出的结论正确的是( )
A.MgCl2是非电解质
B.MgCl2溶液是电解质
C.MgCl2在水溶液中电离出了可以自由移动的离子
D.MgCl2只有在溶液中才能导电
9.下列有关物质在水溶液中的电离方程式书写正确的是( )
A.Na2CO3===2Na++CO
B.AlCl3===Al3++Cl-
C.Mg(NO3)2===Mg+2+2NO
D.KMnO4===K++Mn7++4O2-
10.今有一种固体化合物X,X本身不导电,但熔化状态或溶于水中能够电离,下列关于该化合物X的说法中正确的是( )
A.X一定是电解质
B.X可能是非电解质
C.X只能是盐
D.X可以是任何化合物
11.下列各组均为两种化合物溶于水时电离出的离子,其中按照仅由酸、碱、盐依次电离的是( )
①Na+、OH-、SO ②H+、Cl-、SO
③Na+、K+、OH- ④Na+、K+、NO
A.②③④ B.②①④ C.②③① D.②①③
12.下列实验过程中产生的现象与图示相符的是( )
A.稀盐酸滴加到一定量的NaOH溶液中(横坐标是稀盐酸的体积,纵坐标为钠离子的物质的量)
B.铁粉加入一定量的CuSO4溶液中(横坐标是铁粉的质量,纵坐标为固体的质量)
C.CO2通入一定量的NaOH溶液中(横坐标是CO2的体积,纵坐标为溶液的导电能力)
D.稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
二、非选择题(共52分)
13.(10分)现有以下物质:①NaCl晶体;②液态SO3;③液态醋酸;④汞;⑤BaSO4晶体;⑥纯蔗糖;⑦酒精;⑧熔融KNO3;⑨O2。请回答下列问题(用序号填写):
(1)以上物质能导电的是 。
(2)以上物质属于电解质的是 。
(3)以上物质属于非电解质的是 。
(4)以上物质溶于水后形成的水溶液能导电的是 。
(5)以上物质既不是电解质,又不是非电解质的是 。
14.(9分)在如图所示的串联装置中,发现灯泡不亮,但若向其中一个烧杯中加水,则灯泡会亮起来。
则:(1)加水的烧杯为 。
(2)将烧杯B和 混合后溶液的导电性会减弱。
(3)写出D烧杯中电解质的电离方程式: 。
15.(15分)NaHSO4通常为晶体,易溶于水,它溶于水时电离出三种不同的离子,溶液显酸性。NaHSO4受热熔化时只能电离出两种不同的离子。
(1)NaHSO4在水溶液中的电离方程式为 。
(2)NaHSO4在熔融状态下的电离方程式为 。
(3)下列说法中正确的是 (填序号)。
A.NaHSO4属于酸
B.NaHSO4属于盐
C.NaHSO4属于电解质
D.NaHSO4溶液能与Zn反应生成氢气
16. (12分)已知:CO2+Ca(OH)2===CaCO3↓+H2O,CaCO3+CO2+H2O===Ca(HCO3)2,且Ca(HCO3)2易溶于水。试根据如图所示装置回答下列问题:
(1)通入CO2前,灯泡 (填“亮”或“不亮”)。
(2)开始通入CO2后,灯泡的亮度 。
(3)继续通入过量的CO2,灯泡的亮度 。
(4)下列四个图中, (填字母)能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)。
17. (6分)酸、碱、盐溶液能够导电,是因为物质溶于水时,离解成为自由移动的阴、阳离子。
(1)在酸的溶液里,酸根离子所带 的总数等于酸电离时生成的 的总数;在碱的溶液里,跟金属离子结合的
的总数等于这种金属离子所带的 的总数;在盐的溶液中,金属(或铵根)离子所带的 的总数等于酸根离子所带的 的总数。
(2)下列物质的电离方程式如下:
HClO4===H++ClO;
Ba(OH)2===Ba2++2OH-;
Fe2(SO4)3===2Fe3++3SO;
Cu(NO3)2===Cu2++2NO。
属于酸的物质为 (写化学式);属于碱的物质为 ;属于盐的物质为 。
(3)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
①从物质的分类角度看,不恰当的一种物质是 。
②上述物质中既不是电解质也不是非电解质的是盐酸。依据是 。
③写出纯碱的电离方程式: 。
1-2-1 电解质的电离
一、选择题(每小题4分,共48分,每小题只有一个正确选项)
1. 下列说法正确的是( D )
A.硫酸钡不溶于水,所以硫酸钡是非电解质
B.二氧化碳溶于水可以导电,所以二氧化碳是电解质
C.硫酸是电解质,所以硫酸在熔融态或溶于水时都能导电
D.液态氯化氢不导电,但氯化氢是电解质
解析:硫酸钡不溶于水但受热熔化时可导电,故硫酸钡是电解质,故A错误;虽然二氧化碳溶于水可以导电,但在水溶液中能直接电离出自由移动离子的不是二氧化碳,而是碳酸,故B错误;硫酸是由硫酸分子构成的,在熔融态时不能导电,故C错误;液态氯化氢不导电,但氯化氢的水溶液能导电,氯化氢是电解质,故D正确。
2.若A+酸===盐+水,则A不可能属于( B )
A.氧化物 B.单质 C.碱 D.电解质
解析:单质与酸反应,可能生成盐和H2,也可能生成盐、水和另一种还原产物,还可能只生成氧化物,不可能只生成盐和水。金属氧化物(如Na2O)、碱(如NaOH)与酸反应都生成盐和水。
3.下列说法正确的一组是( C )
①难溶于水的盐(CaCO3、BaSO4等)都是非电解质
②不是电解质的物质一定是非电解质
③强酸溶液中氢离子浓度一定大于弱酸溶液中氢离子浓度
④电解质溶液导电的原因是溶液中有自由移动的阴离子和阳离子
⑤熔融的电解质都能导电
A.①③⑤⑥ B.②④⑤
C.只有④ D.只有⑤
解析:CaCO3、BaSO4虽难溶于水,但它们是电解质,故①错误;单质既不是电解质,也不是非电解质,故②错误;熔融的H2SO4不能导电,故⑤错误。
4.仅能在水溶液中导电的电解质是( D )
A. KOH B. KCl
C. CO2 D. NH4HCO3
解析:KOH、KCl在水溶液中和熔融状态下都能导电;CO2水溶液能导电,但是导电的原因是CO2与水反应生成了H2CO3,CO2不属于电解质;NH4HCO3溶于水电离成NH和HCO能导电,但在加热情况下,NH4HCO3会分解,NH4HCO3NH3↑+H2O+
CO2↑,故选D。
5. 下列物质中,含有自由移动的Cl-的是( B )
A.KClO3溶液 B.CaCl2溶液
C.KCl晶体 D.液态HCl
解析:KClO3溶液中存在K+、ClO;KCl晶体中Cl-不能自由移动;液态HCl中只存在HCl分子。
6. 下列说法正确的是( B )
A.水导电性很差,所以水是非电解质
B.电解质与非电解质的本质区别,是在一定条件下能否电离
C.酸、碱和盐类都属于电解质,其他化合物都是非电解质
D.NaCl和HCl都是电解质,所以它们熔融状态下都能导电
解析:A项,水能电离出OH-与H+,所以水是电解质;C项,部分氧化物也属于电解质,如Na2O、CaO;D项,HCl在熔融状态下不导电。
7.下列物质分类正确的组合是( D )
选项 混合物 纯净物 单质 电解质
A 盐酸 NaOH 石墨 K2SO4溶液
B 空气 Fe(OH)3胶体 铁 Na2CO3
C CuSO4·5H2O CaCl2 水银 铜
D 氯水 KNO3晶体 O3 NaCl
解析:A项,K2SO4溶液是混合物,不是电解质;B项,胶体是混合物;C项,CuSO4·5H2O是纯净物,不是混合物,铜是单质,其既不是电解质也不是非电解质。
8.某化学兴趣小组进行化学实验,按照图Ⅰ连接好线路发现灯泡不亮,按照图Ⅱ连接好线路发现灯泡亮,由此得出的结论正确的是( C )
A.MgCl2是非电解质
B.MgCl2溶液是电解质
C.MgCl2在水溶液中电离出了可以自由移动的离子
D.MgCl2只有在溶液中才能导电
解析:MgCl2固体中离子不能自由移动,不导电;MgCl2固体在溶液中电离生成能够自由移动的Mg2+和Cl-,MgCl2溶液导电;MgCl2在熔融状态也能导电,D错。
9.下列有关物质在水溶液中的电离方程式书写正确的是( A )
A.Na2CO3===2Na++CO
B.AlCl3===Al3++Cl-
C.Mg(NO3)2===Mg+2+2NO
D.KMnO4===K++Mn7++4O2-
解析:AlCl3在水溶液中的电离方程式为AlCl3===Al3++3Cl-,B项错误;镁离子的正确写法为Mg2+,C项错误;MnO不能拆分,D项错误。
10.今有一种固体化合物X,X本身不导电,但熔化状态或溶于水中能够电离,下列关于该化合物X的说法中正确的是( A )
A.X一定是电解质
B.X可能是非电解质
C.X只能是盐
D.X可以是任何化合物
解析:既然熔化时该化合物可以导电,说明一定是电解质,A正确,B、D错误;X为固体,则可能是盐,也可能是碱或金属氧化物,C错误。
11.下列各组均为两种化合物溶于水时电离出的离子,其中按照仅由酸、碱、盐依次电离的是( A )
①Na+、OH-、SO ②H+、Cl-、SO
③Na+、K+、OH- ④Na+、K+、NO
A.②③④ B.②①④ C.②③① D.②①③
解析:此题从电离的角度理解酸、碱、盐的概念。酸电离出的阳离子只有H+,②符合要求;碱电离出的阴离子只有OH-,③符合要求;盐电离出金属阳离子(或铵根离子)和酸根离子,④符合要求,故A选项正确。
12.下列实验过程中产生的现象与图示相符的是( D )
A.稀盐酸滴加到一定量的NaOH溶液中(横坐标是稀盐酸的体积,纵坐标为钠离子的物质的量)
B.铁粉加入一定量的CuSO4溶液中(横坐标是铁粉的质量,纵坐标为固体的质量)
C.CO2通入一定量的NaOH溶液中(横坐标是CO2的体积,纵坐标为溶液的导电能力)
D.稀硫酸滴加到Ba(OH)2溶液中(横坐标是稀硫酸的体积,纵坐标为溶液的导电能力)
解析:A项,HCl+NaOH===NaCl+H2O,氢氧化钠和氯化钠都是强电解质,在水中完全电离,所以钠离子的物质的量不变,而图像中的钠离子的物质的量先变小后变大,故A项错误;B项,铁粉加入一定量的CuSO4溶液中,发生反应:Fe+CuSO4===FeSO4+Cu,根据方程式可知,每消耗56 g铁,生成64 g固体,所以固体的质量一直在增加,而图像中固体的质量先变小后变大,B项错误;C项,CO2通入一定量的NaOH溶液中,发生反应:CO2+2NaOH===Na2CO3+H2O、Na2CO3+CO2+H2O===2NaHCO3,根据方程式可知,溶液中离子的总电荷数基本不变,所以导电能力基本不变,C项错误;D项,滴入的硫酸与氢氧化钡反应,生成硫酸钡沉淀和水,溶液中离子浓度减少,导电能力下降,恰好完全反应时导电性接近于零,再随着稀硫酸的滴入,溶液的导电能力增强,D项正确。
二、非选择题(共52分)
13.(10分)现有以下物质:①NaCl晶体;②液态SO3;③液态醋酸;④汞;⑤BaSO4晶体;⑥纯蔗糖;⑦酒精;⑧熔融KNO3;⑨O2。请回答下列问题(用序号填写):
(1)以上物质能导电的是④⑧。
(2)以上物质属于电解质的是①③⑤⑧。
(3)以上物质属于非电解质的是②⑥⑦。
(4)以上物质溶于水后形成的水溶液能导电的是①②③⑧。
(5)以上物质既不是电解质,又不是非电解质的是④⑨。
解析:①NaCl晶体是电解质,但其Na+、Cl-不能自由移动,不能导电;②液态SO3不能导电,是非电解质;③液态醋酸溶于水能导电,是电解质,但液态醋酸自身不能电离,不能导电;④汞是金属单质,能导电,既不是电解质也不是非电解质;⑤BaSO4晶体尽管溶解度很小,但溶解的部分BaSO4能全部电离,且熔融状态下能导电,是电解质;⑥纯蔗糖无论溶于水还是熔融状态下均不导电,是非电解质;⑦酒精无论溶于水还是熔融状态下均不导电,是非电解质;⑧熔融KNO3电离出K+和NO,是电解质,能导电;⑨O2是非金属单质,本身不导电,既不是电解质也不是非电解质。
14.(9分)在如图所示的串联装置中,发现灯泡不亮,但若向其中一个烧杯中加水,则灯泡会亮起来。
则:(1)加水的烧杯为C。
(2)将烧杯B和D混合后溶液的导电性会减弱。
(3)写出D烧杯中电解质的电离方程式:Ba(OH)2===Ba2++2OH-。
解析:四个烧杯中只有C中没有发生电解质电离,没有自由移动的离子,当加水时,H3PO4电离而导电;当CuSO4溶液与Ba(OH)2溶液混合后,由于发生反应:CuSO4+Ba(OH)2===BaSO4↓+Cu(OH)2↓,从而溶液中离子浓度减小,混合后溶液体积增大,导电能力减弱。
15.(15分)NaHSO4通常为晶体,易溶于水,它溶于水时电离出三种不同的离子,溶液显酸性。NaHSO4受热熔化时只能电离出两种不同的离子。
(1)NaHSO4在水溶液中的电离方程式为NaHSO4===Na++H++SO。
(2)NaHSO4在熔融状态下的电离方程式为NaHSO4===Na++HSO。
(3)下列说法中正确的是BCD(填序号)。
A.NaHSO4属于酸
B.NaHSO4属于盐
C.NaHSO4属于电解质
D.NaHSO4溶液能与Zn反应生成氢气
解析:NaHSO4溶于水电离出三种离子,且呈酸性,则它电离出的离子是Na+、H+、SO;NaHSO4受热熔化时只能电离出两种离子,分别是Na+和HSO;由其电离情况知,NaHSO4既是盐又是强电解质,不属于酸,NaHSO4溶液中含有H+,故能与Zn反应生成H2。
16. (12分)已知:CO2+Ca(OH)2===CaCO3↓+H2O,CaCO3+CO2+H2O===Ca(HCO3)2,且Ca(HCO3)2易溶于水。试根据如图所示装置回答下列问题:
(1)通入CO2前,灯泡亮(填“亮”或“不亮”)。
(2)开始通入CO2后,灯泡的亮度先变暗后熄灭。
(3)继续通入过量的CO2,灯泡的亮度熄灭后又逐渐变亮。
(4)下列四个图中,D(填字母)能比较准确地反映出溶液的导电能力和通入CO2气体量的关系(x轴表示CO2通入的量,y轴表示导电能力)。
解析:(1)灯泡亮,因为Ca(OH)2溶于水后完全电离出离子,溶液中离子的浓度比较大,故灯泡亮。
(2)灯泡先变暗后熄灭,因为发生了CO2+Ca(OH)2===CaCO3↓+H2O,溶液中自由移动的离子减少。
(3)灯泡熄灭后又逐渐变亮:CaCO3+CO2+H2O===Ca(HCO3)2,Ca(HCO3)2完全电离出自由移动的离子,溶液中离子浓度增大。
(4)由于通入CO2后溶液中自由移动的离子的浓度逐渐减小,所以一开始导电能力逐渐下降,随着反应的进行,离子浓度逐渐增大,导电能力又逐渐增大,所以选D。
17. (6分)酸、碱、盐溶液能够导电,是因为物质溶于水时,离解成为自由移动的阴、阳离子。
(1)在酸的溶液里,酸根离子所带负电荷的总数等于酸电离时生成的H+的总数;在碱的溶液里,跟金属离子结合的OH-的总数等于这种金属离子所带的正电荷的总数;在盐的溶液中,金属(或铵根)离子所带的正电荷的总数等于酸根离子所带的负电荷的总数。
(2)下列物质的电离方程式如下:
HClO4===H++ClO;
Ba(OH)2===Ba2++2OH-;
Fe2(SO4)3===2Fe3++3SO;
Cu(NO3)2===Cu2++2NO。
属于酸的物质为HClO4(写化学式);属于碱的物质为Ba(OH)2;属于盐的物质为Fe2(SO4)3、Cu(NO3)2。
(3)化工生产中常常用到“三酸两碱”,“三酸”指硝酸、硫酸和盐酸,“两碱”指烧碱和纯碱。
①从物质的分类角度看,不恰当的一种物质是纯碱。
②上述物质中既不是电解质也不是非电解质的是盐酸。依据是盐酸是混合物,不是化合物。
③写出纯碱的电离方程式:Na2CO3===2Na++CO。
解析:(1)溶液呈电中性,阴离子所带的负电荷总数等于阳离子所带的正电荷总数。(2)根据酸、碱、盐的概念判断。(3)纯碱是Na2CO3,属于盐,不是碱;盐酸是HCl的水溶液,是混合物,既不是电解质也不是非电解质。Na2CO3的电离方程式为Na2CO3===2Na++CO。
PAGE
2
