2022年秋学期高中化学人教版(2019)必修1课后作业:2-1-1 活泼的金属单质——钠Word版含解析
文档属性
| 名称 | 2022年秋学期高中化学人教版(2019)必修1课后作业:2-1-1 活泼的金属单质——钠Word版含解析 |

|
|
| 格式 | doc | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-23 15:40:51 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2-1-1 活泼的金属单质——钠
一、选择题(每小题4分,共48分,每小题只有一个正确选项)
1. 钠在自然界中最主要的存在形式是( )
A.游离态 B.氯化钠
C.硫酸钠 D.硝酸钠
2. 钠与水反应的现象和钠的下列性质无关的是( )
A.钠的熔点较低 B.钠的密度小于水
C.钠的硬度较小 D.钠的还原性强
3. 2.3 g纯净的金属钠在干燥的空气中被氧化后得到3.5 g固体,由此判断其产物是( )
A.只有Na2O B.只有Na2O2
C.Na2O和Na2O2 D.无法确定
4. 下列有关钠与水反应实验的叙述中,不正确的是( )
A.用小刀切割钠块 B.钠沉入水中
C.钠熔化成小球 D.发出“嘶嘶”的响声
5. 化学之美无处不在,有一位学生将一小块钠投入盛有煤油和水的试管中(煤油和水均足够多),可能观察到的现象是( )
A.钠浮在试管中的液面上 B.钠沉入试管底部
C.钠燃烧起来 D.钠处于煤油和水的交界处
6. 向硫酸铜溶液中加入一小块金属钠后,观察到的现象有( )
①钠浮于液面上 ②熔化成小球 ③发出嘶嘶的响声,放出气体
④钠周围蓝色沉淀部分变黑 ⑤有蓝色沉淀产生 ⑥析出大量红色的铜 ⑦小球在溶液中沉浮 ⑧小球在液面上游动,逐渐变小,直至消失
A.①②③⑤⑦⑧ B.①②③④⑤⑧
C.①②③⑤⑥⑧ D.①②③④⑤⑥⑦⑧
7. 下列关于金属钠的叙述中正确的是( )
A.钠在空气中能发生缓慢氧化而自燃
B.金属钠可保存在煤油中,也可保存在CCl4中
C.钠能和CuSO4溶液反应置换出Cu
D.钠投入到水中立即熔化成小球,说明其熔点低,且钠与水的反应是放热反应
8. 下列反应的离子方程式书写正确的是( )
A.钠和水反应:Na+H2O===Na++OH-+H2↑
B.钠投入足量盐酸中:2Na+2H+===2Na++H2↑
C.铁和稀硫酸反应:2Fe+6H+===2Fe3++3H2↑
D.钠投入氯化铁溶液中:3Na+Fe3+===3Na++Fe
9. 将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是( )
A.HCl B.NaOH
C.K2SO4 D.CuSO4
10. 若将4.6 g钠块置于过量O2中燃烧后,生成7.2 g固体物质,则下列推断合理的是( )
A.钠在燃烧前未被氧化
B.钠在燃烧前已有部分被氧化
C.生成物中只有过氧化钠
D.生成物中只有氧化钠
11. 某化学兴趣小组的同学,在学习了钠的性质后,用小刀切割了一小块钠,然后放入盛有空气的集气瓶中,充分燃烧后发现瓶壁上有黑色固体附着,下面是该兴趣小组的几点推测,你认为不合理的是( )
A.黑色固体是碳
B.钠在燃烧时只发生了一个反应
C.钠也可能与二氧化碳发生反应:4Na+CO22Na2O+C
D.钠保存在煤油中,可能滤纸没有完全吸收煤油,煤油不完全燃烧产生碳
12. 往烧杯内注入煤油和水各100 mL,静置后将一小块钠投入烧杯内。发生的现象是( )
A.钠沉到液柱1/2处,钠块下部有许多气泡放出,附有气泡的钠块徐徐上升到液体上部,一会儿又沉到液柱1/2处,如此反复多次,最后消失
B.钠块一直沉到烧杯底部,并停留在杯底,放出气泡,最后消失
C.钠块浮在液柱表面上,很快熔成一个闪亮的小球,小球四处游动,最后消失
D.钠块沉到液柱1/2处,很快熔成一个闪亮的小球,小球在液柱1/2处沿水平方向迅速游来游去,最后消失
二、非选择题(共52分)
13. (16分)A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):
(1)若A是一种金属,C是淡黄色固体,则B的化学式为______,A→C反应的化学方程式为__________。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为___,B→C反应的化学方程式为_____________。
A和C是否能反应?____ (填“能”或“不能”)。若能,写出反应的化学方程式:___________。(若不能,此空不填)
14. (12分)甲、乙两同学分别用如图所示装置测定空气中氧气的含量。先用弹簧夹夹住橡胶管,点燃钠,伸入瓶中并塞上瓶塞。待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面的变化情况。
(1)上述实验过程中发生反应的化学方程式为____________________
(2)甲同学实验中广口瓶内水面上升明显小于瓶内空气体积的1/5,乙同学实验中广口瓶内水面上升明显大于瓶内空气体积的1/5。下列对这两种现象解释合理的是_________ (填序号)。
a.甲同学可能使用的钠的量不足,瓶内氧气没有消耗完
b.甲同学可能未塞紧瓶塞,钠熄灭冷却后外界空气进入瓶内
c.乙同学可能没有夹紧弹簧夹,钠燃烧时瓶内部分空气受热从导管口逸出
d.乙同学可能插入燃烧匙太慢,塞紧瓶塞之前瓶内部分空气受热逸出
15. (7分)如图所示,在烧杯中盛有100 mL蒸馏水,水中悬浮着一个表面光滑、耐碱、耐热的小球(此球稳定于水的中央),将10 g金属钠分多次投入到水中,最后使烧杯内的液体恢复到原来蒸馏水的温度。
回答下列问题:
(1)10 g钠要分多次投入的主要原因是________________________。
(2)将10 g钠全部投入完毕所进行的次数可能是____ (填序号)。
A.5次 B.10次 C.大于10次
(3)实验结束后,从烧杯内小球的位置观察到的现象是小球上升,出现这种现象的主要原因是__________________________________________。
(4)实验过程中所发生反应的离子方程式是_____________________________________________。
16. (8分)某实验小组对Na与水反应产生的H2进行探究,为点燃反应生成的H2,他们设计了如图所示的装置。请回答下列问题:
(1)写出Na与H2O反应的化学方程式:_______________________。
(2)实验小组在点燃利用①装置制得的H2时,实验失败了。他们认为失败的原因是Na的用量太少,Na与H2O的反应速率太快。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是_________________________________________________________________ (3)已知钠、煤油、水的密度分别为0.97 g·cm-3、0.80 g·cm-3、1.00 g·cm-3。在②装置中H2的生成速率减慢,原因是__________________________________________________________________________________________________________________________________
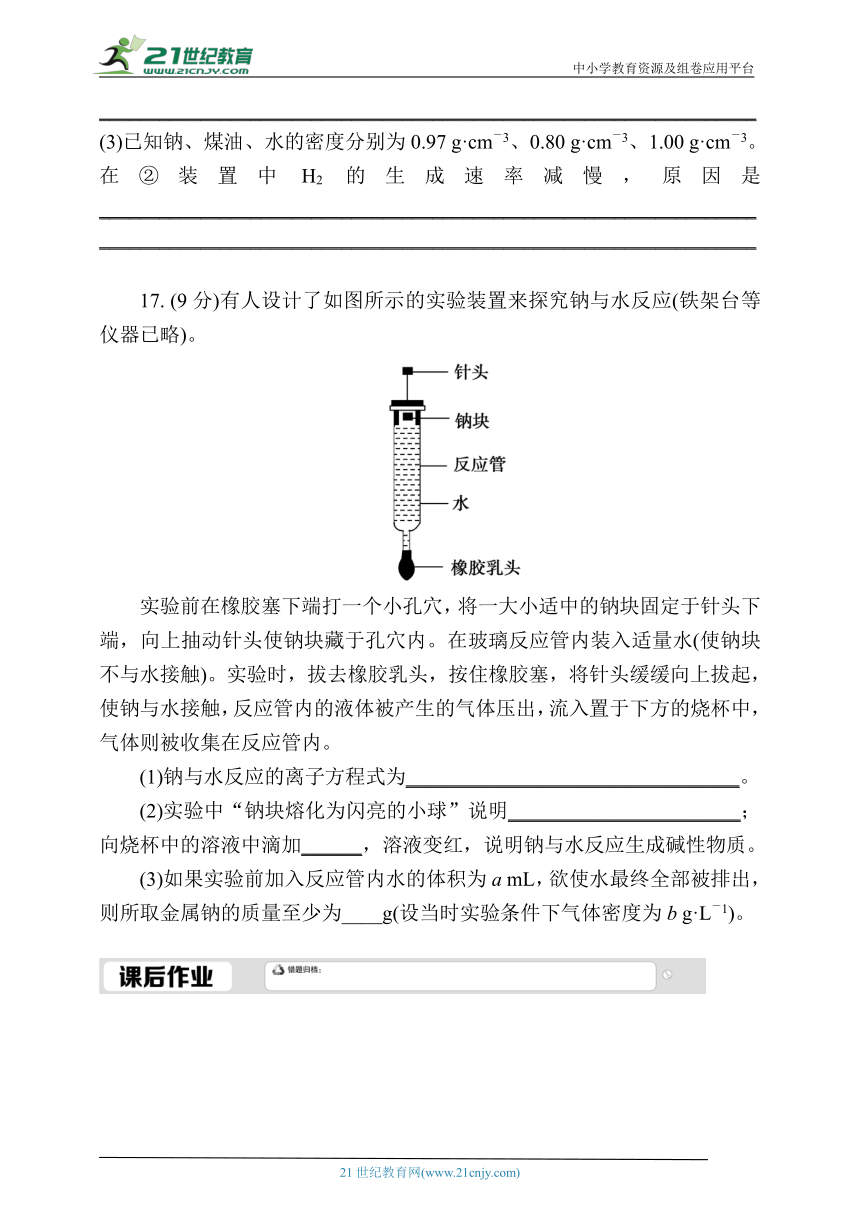
17. (9分)有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器已略)。
实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内。在玻璃反应管内装入适量水(使钠块不与水接触)。实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起,使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内。
(1)钠与水反应的离子方程式为_________________________________。
(2)实验中“钠块熔化为闪亮的小球”说明_______________________;向烧杯中的溶液中滴加______,溶液变红,说明钠与水反应生成碱性物质。
(3)如果实验前加入反应管内水的体积为a mL,欲使水最终全部被排出,则所取金属钠的质量至少为____g(设当时实验条件下气体密度为b g·L-1)。
答案
2-1-1 活泼的金属单质——钠
一、选择题(每小题4分,共48分,每小题只有一个正确选项)
1. 钠在自然界中最主要的存在形式是( B )
A.游离态 B.氯化钠
C.硫酸钠 D.硝酸钠
解析:钠的性质非常活泼,在自然界不可能以游离态存在;主要以NaCl的形式存在。
2. 钠与水反应的现象和钠的下列性质无关的是( C )
A.钠的熔点较低 B.钠的密度小于水
C.钠的硬度较小 D.钠的还原性强
解析:由钠熔化为闪亮的小球可知钠的熔点较低,由钠浮在水面上可知钠的密度小于水,由生成NaOH可知钠的还原性强;故C项符合题意。
3. 2.3 g纯净的金属钠在干燥的空气中被氧化后得到3.5 g固体,由此判断其产物是( C )
A.只有Na2O B.只有Na2O2
C.Na2O和Na2O2 D.无法确定
解析:若2.3 g钠全部生成Na2O,质量为3.1 g;若2.3 g钠全部生成Na2O2,质量为3.9 g,因为3.1 g<3.5 g<3.9 g,故氧化产物应为Na2O和Na2O2的混合物。
4. 下列有关钠与水反应实验的叙述中,不正确的是( B )
A.用小刀切割钠块 B.钠沉入水中
C.钠熔化成小球 D.发出“嘶嘶”的响声
解析:钠软,可以用小刀切割钠块,A正确;钠密度比水小,浮在水上面,B不正确;钠和水剧烈反应生成氢氧化钠和氢气,且该反应是放热反应,放出的热量使钠熔成小球,C正确;钠和水剧烈反应生成氢氧化钠和氢气,且会有嘶嘶的响声,D正确。
5. 化学之美无处不在,有一位学生将一小块钠投入盛有煤油和水的试管中(煤油和水均足够多),可能观察到的现象是( D )
A.钠浮在试管中的液面上 B.钠沉入试管底部
C.钠燃烧起来 D.钠处于煤油和水的交界处
解析:煤油的密度比水小,所以煤油在上层,水在下层,又因钠的密度比水小,比煤油大,因此介于两者之间,而钠能与水反应产生氢气,在与水反应生成气体后被气体带离水层,进入煤油层后停止反应又下沉,如此往复,直至钠反应完,反应没有氧气,钠不能燃烧,所以钠处于煤油和水的交界处,上下浮动。
6. 向硫酸铜溶液中加入一小块金属钠后,观察到的现象有( B )
①钠浮于液面上 ②熔化成小球 ③发出嘶嘶的响声,放出气体
④钠周围蓝色沉淀部分变黑 ⑤有蓝色沉淀产生 ⑥析出大量红色的铜 ⑦小球在溶液中沉浮 ⑧小球在液面上游动,逐渐变小,直至消失
A.①②③⑤⑦⑧ B.①②③④⑤⑧
C.①②③⑤⑥⑧ D.①②③④⑤⑥⑦⑧
解析:将钠块加入CuSO4溶液中时,反应的实质是钠先与水反应生成NaOH和H2,NaOH再与CuSO4反应生成蓝色Cu(OH)2沉淀,反应放出的热量会导致Cu(OH)2分解生成黑色的CuO,不会置换出单质Cu;因为钠的密度小于水,故反应过程中钠浮于水面而不能在溶液中沉浮,⑥⑦错误。
7. 下列关于金属钠的叙述中正确的是( D )
A.钠在空气中能发生缓慢氧化而自燃
B.金属钠可保存在煤油中,也可保存在CCl4中
C.钠能和CuSO4溶液反应置换出Cu
D.钠投入到水中立即熔化成小球,说明其熔点低,且钠与水的反应是放热反应
解析:钠在空气中能发生缓慢氧化但不会自燃;钠的密度小于CCl4的密度,不能保存在CCl4中;钠放入CuSO4溶液中,钠先与水发生反应生成NaOH,NaOH可与CuSO4发生反应生成Cu(OH)2蓝色沉淀,不会将Cu置换出来;钠与水反应放热且钠熔点低,故钠熔化成小球。
8. 下列反应的离子方程式书写正确的是( B )
A.钠和水反应:Na+H2O===Na++OH-+H2↑
B.钠投入足量盐酸中:2Na+2H+===2Na++H2↑
C.铁和稀硫酸反应:2Fe+6H+===2Fe3++3H2↑
D.钠投入氯化铁溶液中:3Na+Fe3+===3Na++Fe
解析:A项,配平错误;C项,铁与酸反应生成的是Fe2+;D项,Na会与水反应,所以在溶液中不能置换出其他金属。
9. 将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是( D )
A.HCl B.NaOH
C.K2SO4 D.CuSO4
解析:在A、B、C三个选项中只有H2放出,故溶液质量是增加的。D选项中由于Na与H2O反应生成的NaOH还能继续与CuSO4反应析出Cu(OH)2沉淀:2Na+CuSO4+2H2O===Cu(OH)2↓+Na2SO4+H2↑,故反应后溶液质量减轻。
10. 若将4.6 g钠块置于过量O2中燃烧后,生成7.2 g固体物质,则下列推断合理的是( B )
A.钠在燃烧前未被氧化
B.钠在燃烧前已有部分被氧化
C.生成物中只有过氧化钠
D.生成物中只有氧化钠
解析:若4.6 g Na完全转化为Na2O2,则生成固体的质量为7.8 g,现反应后固体质量为7.2 g,说明其中含有Na2O,由于Na燃烧的产物为Na2O2,故在燃烧前钠块中就含有Na2O,说明Na燃烧前已部分被氧化。
11. 某化学兴趣小组的同学,在学习了钠的性质后,用小刀切割了一小块钠,然后放入盛有空气的集气瓶中,充分燃烧后发现瓶壁上有黑色固体附着,下面是该兴趣小组的几点推测,你认为不合理的是( B )
A.黑色固体是碳
B.钠在燃烧时只发生了一个反应
C.钠也可能与二氧化碳发生反应:4Na+CO22Na2O+C
D.钠保存在煤油中,可能滤纸没有完全吸收煤油,煤油不完全燃烧产生碳
解析:金属钠保存在煤油中,因此金属钠表面沾有煤油,在燃烧过程中,可能是煤油不完全燃烧产生了碳,即黑色固体是碳,A、D正确;金属钠表面沾有煤油,金属钠燃烧时,煤油也燃烧,另外由于金属钠的还原性特别强,故金属钠也能与CO2发生反应:4Na+CO22Na2O+C,B错误,C正确。
12. 往烧杯内注入煤油和水各100 mL,静置后将一小块钠投入烧杯内。发生的现象是( A )
A.钠沉到液柱1/2处,钠块下部有许多气泡放出,附有气泡的钠块徐徐上升到液体上部,一会儿又沉到液柱1/2处,如此反复多次,最后消失
B.钠块一直沉到烧杯底部,并停留在杯底,放出气泡,最后消失
C.钠块浮在液柱表面上,很快熔成一个闪亮的小球,小球四处游动,最后消失
D.钠块沉到液柱1/2处,很快熔成一个闪亮的小球,小球在液柱1/2处沿水平方向迅速游来游去,最后消失
解析:因为钠比水轻,比煤油重,最初钠沉在液柱1/2处。由于钠跟下层水反应产生H2,H2的冲力使钠徐徐上升至液柱上部,待H2放出后钠又沉于液柱1/2处,再跟下层水反应再上升,如此反复直至消失。
二、非选择题(共52分)
13. (16分)A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):
(1)若A是一种金属,C是淡黄色固体,则B的化学式为Na2O,A→C反应的化学方程式为2Na+O2Na2O2。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为CO2,B→C反应的化学方程式为2CO+O22CO2。
A和C是否能反应?能(填“能”或“不能”)。若能,写出反应的化学方程式:C+CO22CO。(若不能,此空不填)
解析:(1)根据C为淡黄色固体,推知C为Na2O2,则B为Na2O,A为Na,A→C的反应为2Na+O2Na2O2。
(2)根据C是最主要的温室气体,推知C为CO2,则A为C,B为CO,A与C能反应,化学方程式为C+CO22CO。
14. (12分)甲、乙两同学分别用如图所示装置测定空气中氧气的含量。先用弹簧夹夹住橡胶管,点燃钠,伸入瓶中并塞上瓶塞。待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面的变化情况。
(1)上述实验过程中发生反应的化学方程式为2Na+O2Na2O2。
(2)甲同学实验中广口瓶内水面上升明显小于瓶内空气体积的1/5,乙同学实验中广口瓶内水面上升明显大于瓶内空气体积的1/5。下列对这两种现象解释合理的是abcd(填序号)。
a.甲同学可能使用的钠的量不足,瓶内氧气没有消耗完
b.甲同学可能未塞紧瓶塞,钠熄灭冷却后外界空气进入瓶内
c.乙同学可能没有夹紧弹簧夹,钠燃烧时瓶内部分空气受热从导管口逸出
d.乙同学可能插入燃烧匙太慢,塞紧瓶塞之前瓶内部分空气受热逸出
解析:a项,若钠的量不足,则氧气消耗不完,造成进入广口瓶内的水量少于容器容积的1/5,结果偏低,合理。b项,若瓶塞未塞紧,钠熄灭冷却后,瓶内气体收缩,外面的空气会进入瓶内,使气体得到补充,造成结果偏低,合理。c项,若弹簧夹未夹紧,钠燃烧时瓶内气体膨胀,使部分气体从导管口逸出,造成结果偏高,合理。d项,若插入燃烧匙太慢,钠燃烧时瓶内气体膨胀,在塞紧瓶塞前,瓶内部分气体从瓶口逸出,造成结果偏高,合理。
15. (7分)如图所示,在烧杯中盛有100 mL蒸馏水,水中悬浮着一个表面光滑、耐碱、耐热的小球(此球稳定于水的中央),将10 g金属钠分多次投入到水中,最后使烧杯内的液体恢复到原来蒸馏水的温度。
回答下列问题:
(1)10 g钠要分多次投入的主要原因是钠与水反应剧烈,放出的热量多,易发生爆炸。
(2)将10 g钠全部投入完毕所进行的次数可能是C(填序号)。
A.5次 B.10次 C.大于10次
(3)实验结束后,从烧杯内小球的位置观察到的现象是小球上升,出现这种现象的主要原因是钠与水反应生成氢氧化钠,导致烧杯中液体的密度增大,故小球受到的浮力增大。
(4)实验过程中所发生反应的离子方程式是2Na+2H2O===2Na++2OH-+H2↑。
解析:钠与水反应剧烈,易发生爆炸,投入时要严格控制用量;钠的密度小于1 g·cm-3,黄豆粒大小的一块钠的体积小于1 cm3,则其质量小于1 g,故10 g钠全部投入完毕所进行的次数要大于10次;钠与水反应生成氢氧化钠,氢氧化钠溶液的密度大于水的密度,小球受到的浮力增大。
16. (8分)某实验小组对Na与水反应产生的H2进行探究,为点燃反应生成的H2,他们设计了如图所示的装置。请回答下列问题:
(1)写出Na与H2O反应的化学方程式:2Na+2H2O===2NaOH+H2↑。
(2)实验小组在点燃利用①装置制得的H2时,实验失败了。他们认为失败的原因是Na的用量太少,Na与H2O的反应速率太快。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是钠与水反应放出大量的热,使试管内H2与O2的混合气体受热而爆炸。
(3)已知钠、煤油、水的密度分别为0.97 g·cm-3、0.80 g·cm-3、1.00 g·cm-3。在②装置中H2的生成速率减慢,原因是钠的密度比水小,比煤油大,在煤油与水的交界处,Na与H2O反应产生的H2使钠上浮,脱离水面,反应停止;当钠表面的H2逸出,钠又回落,与水反应,如此反复,减慢了Na与H2O的反应速率。
解析:(2)Na与H2O反应的产物是NaOH和H2,反应速率很快,并放出大量的热,若Na的用量多,使试管内H2与O2的混合气体受热而发生爆炸。(3)由于ρ(煤油)<ρ(钠)<ρ(水),故钠块放入后在煤油和水的界面处。钠与水反应有氢气生成,氢气推动钠块上浮,当氢气逸出后,钠块又下沉到煤油与水的界面处与H2O发生反应,重复发生上述现象,减慢了Na与H2O反应生成氢气的速率。
17. (9分)有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器已略)。
实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内。在玻璃反应管内装入适量水(使钠块不与水接触)。实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起,使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内。
(1)钠与水反应的离子方程式为2Na+2H2O===2Na++2OH-+H2↑。
(2)实验中“钠块熔化为闪亮的小球”说明钠与水的反应过程中有热量放出,Na熔点较低;向烧杯中的溶液中滴加酚酞溶液,溶液变红,说明钠与水反应生成碱性物质。
(3)如果实验前加入反应管内水的体积为a mL,欲使水最终全部被排出,则所取金属钠的质量至少为 g(设当时实验条件下气体密度为b g·L-1)。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
2-1-1 活泼的金属单质——钠
一、选择题(每小题4分,共48分,每小题只有一个正确选项)
1. 钠在自然界中最主要的存在形式是( )
A.游离态 B.氯化钠
C.硫酸钠 D.硝酸钠
2. 钠与水反应的现象和钠的下列性质无关的是( )
A.钠的熔点较低 B.钠的密度小于水
C.钠的硬度较小 D.钠的还原性强
3. 2.3 g纯净的金属钠在干燥的空气中被氧化后得到3.5 g固体,由此判断其产物是( )
A.只有Na2O B.只有Na2O2
C.Na2O和Na2O2 D.无法确定
4. 下列有关钠与水反应实验的叙述中,不正确的是( )
A.用小刀切割钠块 B.钠沉入水中
C.钠熔化成小球 D.发出“嘶嘶”的响声
5. 化学之美无处不在,有一位学生将一小块钠投入盛有煤油和水的试管中(煤油和水均足够多),可能观察到的现象是( )
A.钠浮在试管中的液面上 B.钠沉入试管底部
C.钠燃烧起来 D.钠处于煤油和水的交界处
6. 向硫酸铜溶液中加入一小块金属钠后,观察到的现象有( )
①钠浮于液面上 ②熔化成小球 ③发出嘶嘶的响声,放出气体
④钠周围蓝色沉淀部分变黑 ⑤有蓝色沉淀产生 ⑥析出大量红色的铜 ⑦小球在溶液中沉浮 ⑧小球在液面上游动,逐渐变小,直至消失
A.①②③⑤⑦⑧ B.①②③④⑤⑧
C.①②③⑤⑥⑧ D.①②③④⑤⑥⑦⑧
7. 下列关于金属钠的叙述中正确的是( )
A.钠在空气中能发生缓慢氧化而自燃
B.金属钠可保存在煤油中,也可保存在CCl4中
C.钠能和CuSO4溶液反应置换出Cu
D.钠投入到水中立即熔化成小球,说明其熔点低,且钠与水的反应是放热反应
8. 下列反应的离子方程式书写正确的是( )
A.钠和水反应:Na+H2O===Na++OH-+H2↑
B.钠投入足量盐酸中:2Na+2H+===2Na++H2↑
C.铁和稀硫酸反应:2Fe+6H+===2Fe3++3H2↑
D.钠投入氯化铁溶液中:3Na+Fe3+===3Na++Fe
9. 将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是( )
A.HCl B.NaOH
C.K2SO4 D.CuSO4
10. 若将4.6 g钠块置于过量O2中燃烧后,生成7.2 g固体物质,则下列推断合理的是( )
A.钠在燃烧前未被氧化
B.钠在燃烧前已有部分被氧化
C.生成物中只有过氧化钠
D.生成物中只有氧化钠
11. 某化学兴趣小组的同学,在学习了钠的性质后,用小刀切割了一小块钠,然后放入盛有空气的集气瓶中,充分燃烧后发现瓶壁上有黑色固体附着,下面是该兴趣小组的几点推测,你认为不合理的是( )
A.黑色固体是碳
B.钠在燃烧时只发生了一个反应
C.钠也可能与二氧化碳发生反应:4Na+CO22Na2O+C
D.钠保存在煤油中,可能滤纸没有完全吸收煤油,煤油不完全燃烧产生碳
12. 往烧杯内注入煤油和水各100 mL,静置后将一小块钠投入烧杯内。发生的现象是( )
A.钠沉到液柱1/2处,钠块下部有许多气泡放出,附有气泡的钠块徐徐上升到液体上部,一会儿又沉到液柱1/2处,如此反复多次,最后消失
B.钠块一直沉到烧杯底部,并停留在杯底,放出气泡,最后消失
C.钠块浮在液柱表面上,很快熔成一个闪亮的小球,小球四处游动,最后消失
D.钠块沉到液柱1/2处,很快熔成一个闪亮的小球,小球在液柱1/2处沿水平方向迅速游来游去,最后消失
二、非选择题(共52分)
13. (16分)A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):
(1)若A是一种金属,C是淡黄色固体,则B的化学式为______,A→C反应的化学方程式为__________。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为___,B→C反应的化学方程式为_____________。
A和C是否能反应?____ (填“能”或“不能”)。若能,写出反应的化学方程式:___________。(若不能,此空不填)
14. (12分)甲、乙两同学分别用如图所示装置测定空气中氧气的含量。先用弹簧夹夹住橡胶管,点燃钠,伸入瓶中并塞上瓶塞。待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面的变化情况。
(1)上述实验过程中发生反应的化学方程式为____________________
(2)甲同学实验中广口瓶内水面上升明显小于瓶内空气体积的1/5,乙同学实验中广口瓶内水面上升明显大于瓶内空气体积的1/5。下列对这两种现象解释合理的是_________ (填序号)。
a.甲同学可能使用的钠的量不足,瓶内氧气没有消耗完
b.甲同学可能未塞紧瓶塞,钠熄灭冷却后外界空气进入瓶内
c.乙同学可能没有夹紧弹簧夹,钠燃烧时瓶内部分空气受热从导管口逸出
d.乙同学可能插入燃烧匙太慢,塞紧瓶塞之前瓶内部分空气受热逸出
15. (7分)如图所示,在烧杯中盛有100 mL蒸馏水,水中悬浮着一个表面光滑、耐碱、耐热的小球(此球稳定于水的中央),将10 g金属钠分多次投入到水中,最后使烧杯内的液体恢复到原来蒸馏水的温度。
回答下列问题:
(1)10 g钠要分多次投入的主要原因是________________________。
(2)将10 g钠全部投入完毕所进行的次数可能是____ (填序号)。
A.5次 B.10次 C.大于10次
(3)实验结束后,从烧杯内小球的位置观察到的现象是小球上升,出现这种现象的主要原因是__________________________________________。
(4)实验过程中所发生反应的离子方程式是_____________________________________________。
16. (8分)某实验小组对Na与水反应产生的H2进行探究,为点燃反应生成的H2,他们设计了如图所示的装置。请回答下列问题:
(1)写出Na与H2O反应的化学方程式:_______________________。
(2)实验小组在点燃利用①装置制得的H2时,实验失败了。他们认为失败的原因是Na的用量太少,Na与H2O的反应速率太快。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是_________________________________________________________________ (3)已知钠、煤油、水的密度分别为0.97 g·cm-3、0.80 g·cm-3、1.00 g·cm-3。在②装置中H2的生成速率减慢,原因是__________________________________________________________________________________________________________________________________
17. (9分)有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器已略)。
实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内。在玻璃反应管内装入适量水(使钠块不与水接触)。实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起,使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内。
(1)钠与水反应的离子方程式为_________________________________。
(2)实验中“钠块熔化为闪亮的小球”说明_______________________;向烧杯中的溶液中滴加______,溶液变红,说明钠与水反应生成碱性物质。
(3)如果实验前加入反应管内水的体积为a mL,欲使水最终全部被排出,则所取金属钠的质量至少为____g(设当时实验条件下气体密度为b g·L-1)。
答案
2-1-1 活泼的金属单质——钠
一、选择题(每小题4分,共48分,每小题只有一个正确选项)
1. 钠在自然界中最主要的存在形式是( B )
A.游离态 B.氯化钠
C.硫酸钠 D.硝酸钠
解析:钠的性质非常活泼,在自然界不可能以游离态存在;主要以NaCl的形式存在。
2. 钠与水反应的现象和钠的下列性质无关的是( C )
A.钠的熔点较低 B.钠的密度小于水
C.钠的硬度较小 D.钠的还原性强
解析:由钠熔化为闪亮的小球可知钠的熔点较低,由钠浮在水面上可知钠的密度小于水,由生成NaOH可知钠的还原性强;故C项符合题意。
3. 2.3 g纯净的金属钠在干燥的空气中被氧化后得到3.5 g固体,由此判断其产物是( C )
A.只有Na2O B.只有Na2O2
C.Na2O和Na2O2 D.无法确定
解析:若2.3 g钠全部生成Na2O,质量为3.1 g;若2.3 g钠全部生成Na2O2,质量为3.9 g,因为3.1 g<3.5 g<3.9 g,故氧化产物应为Na2O和Na2O2的混合物。
4. 下列有关钠与水反应实验的叙述中,不正确的是( B )
A.用小刀切割钠块 B.钠沉入水中
C.钠熔化成小球 D.发出“嘶嘶”的响声
解析:钠软,可以用小刀切割钠块,A正确;钠密度比水小,浮在水上面,B不正确;钠和水剧烈反应生成氢氧化钠和氢气,且该反应是放热反应,放出的热量使钠熔成小球,C正确;钠和水剧烈反应生成氢氧化钠和氢气,且会有嘶嘶的响声,D正确。
5. 化学之美无处不在,有一位学生将一小块钠投入盛有煤油和水的试管中(煤油和水均足够多),可能观察到的现象是( D )
A.钠浮在试管中的液面上 B.钠沉入试管底部
C.钠燃烧起来 D.钠处于煤油和水的交界处
解析:煤油的密度比水小,所以煤油在上层,水在下层,又因钠的密度比水小,比煤油大,因此介于两者之间,而钠能与水反应产生氢气,在与水反应生成气体后被气体带离水层,进入煤油层后停止反应又下沉,如此往复,直至钠反应完,反应没有氧气,钠不能燃烧,所以钠处于煤油和水的交界处,上下浮动。
6. 向硫酸铜溶液中加入一小块金属钠后,观察到的现象有( B )
①钠浮于液面上 ②熔化成小球 ③发出嘶嘶的响声,放出气体
④钠周围蓝色沉淀部分变黑 ⑤有蓝色沉淀产生 ⑥析出大量红色的铜 ⑦小球在溶液中沉浮 ⑧小球在液面上游动,逐渐变小,直至消失
A.①②③⑤⑦⑧ B.①②③④⑤⑧
C.①②③⑤⑥⑧ D.①②③④⑤⑥⑦⑧
解析:将钠块加入CuSO4溶液中时,反应的实质是钠先与水反应生成NaOH和H2,NaOH再与CuSO4反应生成蓝色Cu(OH)2沉淀,反应放出的热量会导致Cu(OH)2分解生成黑色的CuO,不会置换出单质Cu;因为钠的密度小于水,故反应过程中钠浮于水面而不能在溶液中沉浮,⑥⑦错误。
7. 下列关于金属钠的叙述中正确的是( D )
A.钠在空气中能发生缓慢氧化而自燃
B.金属钠可保存在煤油中,也可保存在CCl4中
C.钠能和CuSO4溶液反应置换出Cu
D.钠投入到水中立即熔化成小球,说明其熔点低,且钠与水的反应是放热反应
解析:钠在空气中能发生缓慢氧化但不会自燃;钠的密度小于CCl4的密度,不能保存在CCl4中;钠放入CuSO4溶液中,钠先与水发生反应生成NaOH,NaOH可与CuSO4发生反应生成Cu(OH)2蓝色沉淀,不会将Cu置换出来;钠与水反应放热且钠熔点低,故钠熔化成小球。
8. 下列反应的离子方程式书写正确的是( B )
A.钠和水反应:Na+H2O===Na++OH-+H2↑
B.钠投入足量盐酸中:2Na+2H+===2Na++H2↑
C.铁和稀硫酸反应:2Fe+6H+===2Fe3++3H2↑
D.钠投入氯化铁溶液中:3Na+Fe3+===3Na++Fe
解析:A项,配平错误;C项,铁与酸反应生成的是Fe2+;D项,Na会与水反应,所以在溶液中不能置换出其他金属。
9. 将少量金属钠分别投入下列物质的水溶液中,有气体放出,且溶液质量减轻的是( D )
A.HCl B.NaOH
C.K2SO4 D.CuSO4
解析:在A、B、C三个选项中只有H2放出,故溶液质量是增加的。D选项中由于Na与H2O反应生成的NaOH还能继续与CuSO4反应析出Cu(OH)2沉淀:2Na+CuSO4+2H2O===Cu(OH)2↓+Na2SO4+H2↑,故反应后溶液质量减轻。
10. 若将4.6 g钠块置于过量O2中燃烧后,生成7.2 g固体物质,则下列推断合理的是( B )
A.钠在燃烧前未被氧化
B.钠在燃烧前已有部分被氧化
C.生成物中只有过氧化钠
D.生成物中只有氧化钠
解析:若4.6 g Na完全转化为Na2O2,则生成固体的质量为7.8 g,现反应后固体质量为7.2 g,说明其中含有Na2O,由于Na燃烧的产物为Na2O2,故在燃烧前钠块中就含有Na2O,说明Na燃烧前已部分被氧化。
11. 某化学兴趣小组的同学,在学习了钠的性质后,用小刀切割了一小块钠,然后放入盛有空气的集气瓶中,充分燃烧后发现瓶壁上有黑色固体附着,下面是该兴趣小组的几点推测,你认为不合理的是( B )
A.黑色固体是碳
B.钠在燃烧时只发生了一个反应
C.钠也可能与二氧化碳发生反应:4Na+CO22Na2O+C
D.钠保存在煤油中,可能滤纸没有完全吸收煤油,煤油不完全燃烧产生碳
解析:金属钠保存在煤油中,因此金属钠表面沾有煤油,在燃烧过程中,可能是煤油不完全燃烧产生了碳,即黑色固体是碳,A、D正确;金属钠表面沾有煤油,金属钠燃烧时,煤油也燃烧,另外由于金属钠的还原性特别强,故金属钠也能与CO2发生反应:4Na+CO22Na2O+C,B错误,C正确。
12. 往烧杯内注入煤油和水各100 mL,静置后将一小块钠投入烧杯内。发生的现象是( A )
A.钠沉到液柱1/2处,钠块下部有许多气泡放出,附有气泡的钠块徐徐上升到液体上部,一会儿又沉到液柱1/2处,如此反复多次,最后消失
B.钠块一直沉到烧杯底部,并停留在杯底,放出气泡,最后消失
C.钠块浮在液柱表面上,很快熔成一个闪亮的小球,小球四处游动,最后消失
D.钠块沉到液柱1/2处,很快熔成一个闪亮的小球,小球在液柱1/2处沿水平方向迅速游来游去,最后消失
解析:因为钠比水轻,比煤油重,最初钠沉在液柱1/2处。由于钠跟下层水反应产生H2,H2的冲力使钠徐徐上升至液柱上部,待H2放出后钠又沉于液柱1/2处,再跟下层水反应再上升,如此反复直至消失。
二、非选择题(共52分)
13. (16分)A、B、C是中学化学中常见的三种物质,它们之间的相互转化关系如下(部分反应条件及产物略去):
(1)若A是一种金属,C是淡黄色固体,则B的化学式为Na2O,A→C反应的化学方程式为2Na+O2Na2O2。
(2)若A是一种非金属,其常见单质为黑色固体,C是最主要的温室气体,则C的分子式为CO2,B→C反应的化学方程式为2CO+O22CO2。
A和C是否能反应?能(填“能”或“不能”)。若能,写出反应的化学方程式:C+CO22CO。(若不能,此空不填)
解析:(1)根据C为淡黄色固体,推知C为Na2O2,则B为Na2O,A为Na,A→C的反应为2Na+O2Na2O2。
(2)根据C是最主要的温室气体,推知C为CO2,则A为C,B为CO,A与C能反应,化学方程式为C+CO22CO。
14. (12分)甲、乙两同学分别用如图所示装置测定空气中氧气的含量。先用弹簧夹夹住橡胶管,点燃钠,伸入瓶中并塞上瓶塞。待钠熄灭并冷却后,打开弹簧夹,观察广口瓶内水面的变化情况。
(1)上述实验过程中发生反应的化学方程式为2Na+O2Na2O2。
(2)甲同学实验中广口瓶内水面上升明显小于瓶内空气体积的1/5,乙同学实验中广口瓶内水面上升明显大于瓶内空气体积的1/5。下列对这两种现象解释合理的是abcd(填序号)。
a.甲同学可能使用的钠的量不足,瓶内氧气没有消耗完
b.甲同学可能未塞紧瓶塞,钠熄灭冷却后外界空气进入瓶内
c.乙同学可能没有夹紧弹簧夹,钠燃烧时瓶内部分空气受热从导管口逸出
d.乙同学可能插入燃烧匙太慢,塞紧瓶塞之前瓶内部分空气受热逸出
解析:a项,若钠的量不足,则氧气消耗不完,造成进入广口瓶内的水量少于容器容积的1/5,结果偏低,合理。b项,若瓶塞未塞紧,钠熄灭冷却后,瓶内气体收缩,外面的空气会进入瓶内,使气体得到补充,造成结果偏低,合理。c项,若弹簧夹未夹紧,钠燃烧时瓶内气体膨胀,使部分气体从导管口逸出,造成结果偏高,合理。d项,若插入燃烧匙太慢,钠燃烧时瓶内气体膨胀,在塞紧瓶塞前,瓶内部分气体从瓶口逸出,造成结果偏高,合理。
15. (7分)如图所示,在烧杯中盛有100 mL蒸馏水,水中悬浮着一个表面光滑、耐碱、耐热的小球(此球稳定于水的中央),将10 g金属钠分多次投入到水中,最后使烧杯内的液体恢复到原来蒸馏水的温度。
回答下列问题:
(1)10 g钠要分多次投入的主要原因是钠与水反应剧烈,放出的热量多,易发生爆炸。
(2)将10 g钠全部投入完毕所进行的次数可能是C(填序号)。
A.5次 B.10次 C.大于10次
(3)实验结束后,从烧杯内小球的位置观察到的现象是小球上升,出现这种现象的主要原因是钠与水反应生成氢氧化钠,导致烧杯中液体的密度增大,故小球受到的浮力增大。
(4)实验过程中所发生反应的离子方程式是2Na+2H2O===2Na++2OH-+H2↑。
解析:钠与水反应剧烈,易发生爆炸,投入时要严格控制用量;钠的密度小于1 g·cm-3,黄豆粒大小的一块钠的体积小于1 cm3,则其质量小于1 g,故10 g钠全部投入完毕所进行的次数要大于10次;钠与水反应生成氢氧化钠,氢氧化钠溶液的密度大于水的密度,小球受到的浮力增大。
16. (8分)某实验小组对Na与水反应产生的H2进行探究,为点燃反应生成的H2,他们设计了如图所示的装置。请回答下列问题:
(1)写出Na与H2O反应的化学方程式:2Na+2H2O===2NaOH+H2↑。
(2)实验小组在点燃利用①装置制得的H2时,实验失败了。他们认为失败的原因是Na的用量太少,Na与H2O的反应速率太快。于是他们准备增加钠的用量,可老师说太危险,你认为产生危险的原因是钠与水反应放出大量的热,使试管内H2与O2的混合气体受热而爆炸。
(3)已知钠、煤油、水的密度分别为0.97 g·cm-3、0.80 g·cm-3、1.00 g·cm-3。在②装置中H2的生成速率减慢,原因是钠的密度比水小,比煤油大,在煤油与水的交界处,Na与H2O反应产生的H2使钠上浮,脱离水面,反应停止;当钠表面的H2逸出,钠又回落,与水反应,如此反复,减慢了Na与H2O的反应速率。
解析:(2)Na与H2O反应的产物是NaOH和H2,反应速率很快,并放出大量的热,若Na的用量多,使试管内H2与O2的混合气体受热而发生爆炸。(3)由于ρ(煤油)<ρ(钠)<ρ(水),故钠块放入后在煤油和水的界面处。钠与水反应有氢气生成,氢气推动钠块上浮,当氢气逸出后,钠块又下沉到煤油与水的界面处与H2O发生反应,重复发生上述现象,减慢了Na与H2O反应生成氢气的速率。
17. (9分)有人设计了如图所示的实验装置来探究钠与水反应(铁架台等仪器已略)。
实验前在橡胶塞下端打一个小孔穴,将一大小适中的钠块固定于针头下端,向上抽动针头使钠块藏于孔穴内。在玻璃反应管内装入适量水(使钠块不与水接触)。实验时,拔去橡胶乳头,按住橡胶塞,将针头缓缓向上拔起,使钠与水接触,反应管内的液体被产生的气体压出,流入置于下方的烧杯中,气体则被收集在反应管内。
(1)钠与水反应的离子方程式为2Na+2H2O===2Na++2OH-+H2↑。
(2)实验中“钠块熔化为闪亮的小球”说明钠与水的反应过程中有热量放出,Na熔点较低;向烧杯中的溶液中滴加酚酞溶液,溶液变红,说明钠与水反应生成碱性物质。
(3)如果实验前加入反应管内水的体积为a mL,欲使水最终全部被排出,则所取金属钠的质量至少为 g(设当时实验条件下气体密度为b g·L-1)。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
