2022年秋学期高中化学人教版(2019)必修1课后作业:2-1-2 钠的几种化合物、焰色试验Word版含解析
文档属性
| 名称 | 2022年秋学期高中化学人教版(2019)必修1课后作业:2-1-2 钠的几种化合物、焰色试验Word版含解析 |

|
|
| 格式 | doc | ||
| 文件大小 | 1.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-23 16:00:08 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2-1-2 钠的几种化合物、焰色试验
一、选择题(每小题4分,共48分,每小题只有一个正确选项)
1.向含有HCO、CO、NO、Na+的溶液中加入一定量Na2O2后,下列离子的浓度减小的是( )
A.HCO B.CO C.NO D.Na+
2.下列叙述中正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
③Na2O主要有氧化性,Na2O2主要有还原性
④Na2O2可作供氧剂,而Na2O不能
⑤Na2O2是强氧化剂,Na2O是一种碱性氧化物
A. 都正确 B. ②③④⑤ C. ②③⑤ D. ④⑤
3.有两份质量相同的NaHCO3,向第一份中加入盐酸使其充分反应;将第二份加热使其完全分解,冷却至原温度再加入相同浓度的盐酸充分反应,则它们所耗用的盐酸的体积比为( )
A. 2∶1 B. 1∶1 C. 1∶2 D. 4∶1
4.纯碱和小苏打都是白色晶体,在日常生活中都可以找到。若要在家中将它们区分开来,下面的方法中可行的是( )
A.分别放在炒锅中加热,观察是否有残留物
B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色
C.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀
D.在水杯中各盛相同质量的样品,分别加入等体积、等浓度的白醋,观察反应的剧烈程度
5.已知A是一种金属单质,B显淡黄色,相关物质的转化关系如图所示,则下列关于C的性质的叙述错误的是( )
A.易溶于水
B.与澄清石灰水反应产生白色沉淀
C.与足量盐酸反应放出气体
D.属于碱
6. 下列有关焰色反应操作的描述正确的是( )
A.取一根洁净的细铂丝,放在酒精灯上灼烧至无色,再蘸取少量NaCl溶液,进行焰色反应
B.在观察焰色反应时均要透过蓝色钴玻璃片,以便排除钠元素的黄光的干扰
C.铂丝在做完氯化钠溶液的焰色反应后,用稀硫酸洗净,再蘸取少量的K2SO4溶液,重复以上实验
D.用洁净的铂丝蘸取某溶液,放在火焰上灼烧,观察到黄色火焰,则证明该溶液中一定有Na+,没有K+
7. 下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断正确的是( )
选项 陈述Ⅰ 陈述Ⅱ 判断
A 碳酸钠可用于治疗胃酸 Na2CO3可与盐酸反应 Ⅰ对,Ⅱ对,有
B 向Na2O2的水溶液中滴入酚酞变红色 Na2O2与水反应生成氢氧化钠 Ⅰ对,Ⅱ错,无
C 金属钠具有强还原性 高压钠灯发出透光性强的黄光 Ⅰ对,Ⅱ对,有
D 过氧化钠可为航天员供氧 Na2O2能与CO2、H2O反应生成O2 Ⅰ对,Ⅱ对,有
8. 下列实验装置及操作均正确的是( )
A.图Ⅰ中A盛放碳酸氢钠,B盛放碳酸钠,可对比二者的热稳定性
B.图Ⅱ可用于从碳酸钠溶液中提取碳酸钠固体
C.图Ⅲ为探究钠与水的反应现象实验的装置
D.图Ⅳ为实验室制备碳酸钠溶液的装置(NaHCO3溶液与NaOH溶液等体积、等浓度)
9. Na2O2与足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的固体物质是( )
A.Na2O2、Na2CO3 B.Na2CO3
C.Na2CO3、NaOH D.Na2O2、NaOH
10. 将7.2 g CO和H2的混合气体与足量O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加( )
A.2.1 g B.3.6 g C.7.2 g D.无法确定
11. 观察是研究物质性质的一种基本方法。一同学将一小块金属钠露置于空气中,观察到下列现象:银白色变灰暗变白色出现液滴白色固体白色粉末,下列说法正确的是( )
A.①发生了氧化还原反应
B.②变白色是因为生成了碳酸钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化
12. 焰火与高中化学中“焰色反应”知识有关。下列有关“焰色反应”说法中正确的是( )
A.非金属单质燃烧时火焰均为无色
B.NaCl与Na2CO3灼烧时火焰颜色相同
C.焰色反应均应透过蓝色钴玻璃观察
D.所有金属及其化合物灼烧时火焰均有颜色
二、非选择题(共52分)
13. (12分)某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,B和酸性气体D反应能生成C,A露置在空气中足够长时间也会变为C,E与D反应也能生成C,A、B都能与水反应生成E。回答下列问题:
(1)写出下列物质的化学式:A ,B ,C ,D ,E 。
(2)写出下列反应的化学方程式:
①A生成B: ;
②B与水反应生成E: 。
14.(12分)如何除去下列物质中的杂质,请写出相应的除杂方法或试剂名称及有关反应的实验现象和化学反应方程式。
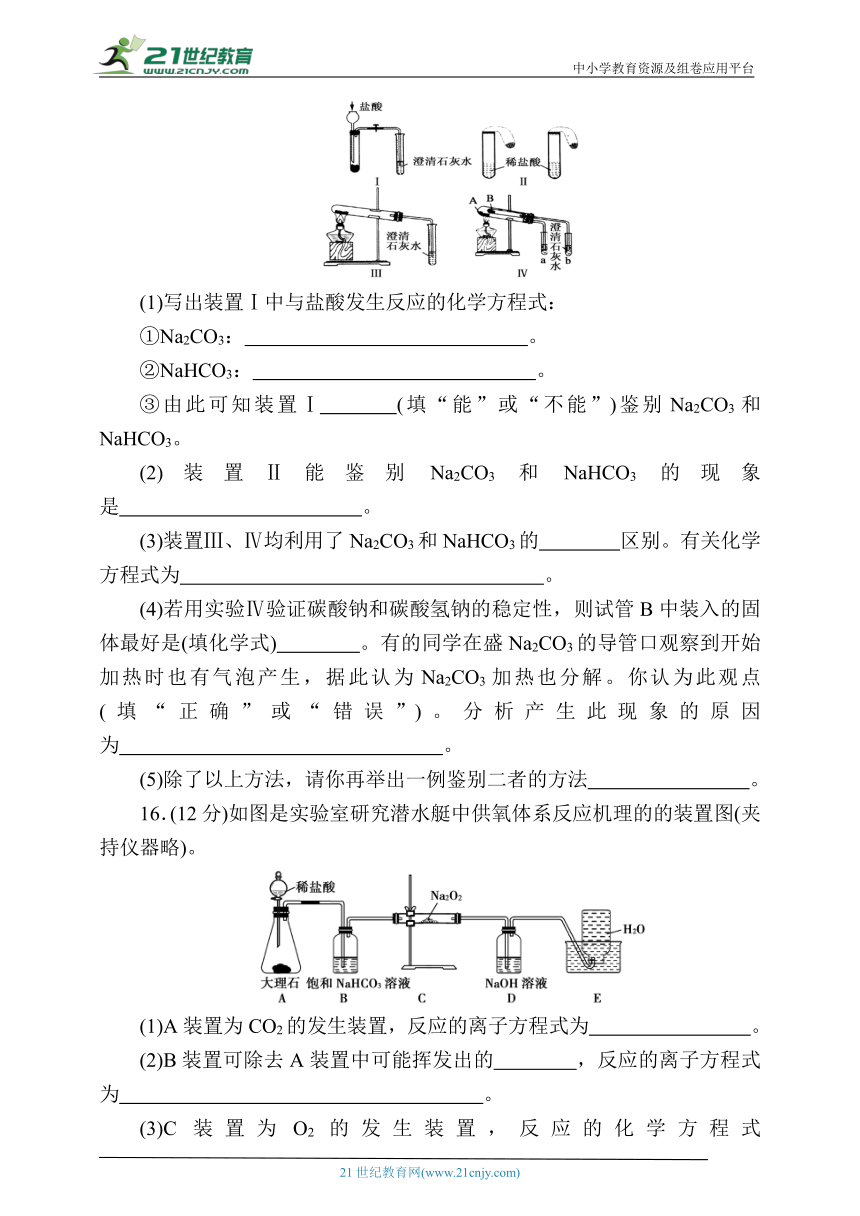
15.(16分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做以下实验,如下图所示。
(1)写出装置Ⅰ中与盐酸发生反应的化学方程式:
①Na2CO3: 。
②NaHCO3: 。
③由此可知装置Ⅰ (填“能”或“不能”)鉴别Na2CO3和NaHCO3。
(2)装置Ⅱ能鉴别Na2CO3和NaHCO3的现象是 。
(3)装置Ⅲ、Ⅳ均利用了Na2CO3和NaHCO3的 区别。有关化学方程式为 。
(4)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式) 。有的同学在盛Na2CO3的导管口观察到开始加热时也有气泡产生,据此认为Na2CO3加热也分解。你认为此观点 (填“正确”或“错误”)。分析产生此现象的原因为 。
(5)除了以上方法,请你再举出一例鉴别二者的方法 。
16.(12分)如图是实验室研究潜水艇中供氧体系反应机理的的装置图(夹持仪器略)。
(1)A装置为CO2的发生装置,反应的离子方程式为 。
(2)B装置可除去A装置中可能挥发出的 ,反应的离子方程式为 。
(3)C装置为O2的发生装置,反应的化学方程式为 。
(4)D装置可除去C装置中未反应的 ,反应的离子方程式为
。
(5)E装置为排水法收集O2的装置,检验所收集的气体为O2的方法为 。
(6)C装置中固体由淡黄色完全变为白色,检验固体成分的实验方案为取少量C装置中反应后的固体溶于水,向溶液中滴入过量 溶液,若有白色沉淀生成,则证明固体中含有 ;过滤,向滤液中滴入几滴酚酞试液,若 且不褪色,则证明固体中含有 。
2-1-2 钠的几种化合物、焰色试验
一、选择题(每小题4分,共48分,每小题只有一个正确选项)
1.向含有HCO、CO、NO、Na+的溶液中加入一定量Na2O2后,下列离子的浓度减小的是( A )
A.HCO B.CO C.NO D.Na+
解析:由于2Na2O2+2H2O===4NaOH+O2↑,HCO可与OH-发生反应HCO+OH-===CO+H2O,因此HCO的浓度减小。
2.下列叙述中正确的是( D )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
③Na2O主要有氧化性,Na2O2主要有还原性
④Na2O2可作供氧剂,而Na2O不能
⑤Na2O2是强氧化剂,Na2O是一种碱性氧化物
A. 都正确 B. ②③④⑤ C. ②③⑤ D. ④⑤
解析:Na2O是碱性氧化物,但Na2O2与水反应时还生成O2,不是碱性氧化物;Na2O2与CO2的反应不符合置换反应的特点;Na2O2有强氧化性,因其中-1价O易得电子变为其稳定价态-2价,而Na2O的氧化性、还原性都很弱。
3.有两份质量相同的NaHCO3,向第一份中加入盐酸使其充分反应;将第二份加热使其完全分解,冷却至原温度再加入相同浓度的盐酸充分反应,则它们所耗用的盐酸的体积比为( B )
A. 2∶1 B. 1∶1 C. 1∶2 D. 4∶1
解析:方法一 取168 g NaHCO3,第一份:
NaHCO3+HCl===NaCl+H2O+CO2↑
84 36.5
168 g 36.5×2 g
第二份:
2NaHCO3Na2CO3+H2O+CO2↑
2×84 106
168 g 106 g
Na2CO3+2HCl2NaCl+H2O+CO2↑
106 36.5×2
106 g 36.5×2 g
通过比较耗酸量相同。
方法二 不论NaHCO3是直接与酸反应,还是受热分解后的固体再与酸反应,其中的Na+均转化为NaCl,因Na+的含量一定,则需Cl-的量一定,即需HCl的量一定,所以由守恒式可直接判断出答案。
4.纯碱和小苏打都是白色晶体,在日常生活中都可以找到。若要在家中将它们区分开来,下面的方法中可行的是( D )
A.分别放在炒锅中加热,观察是否有残留物
B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色
C.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀
D.在水杯中各盛相同质量的样品,分别加入等体积、等浓度的白醋,观察反应的剧烈程度
解析:Na2CO3很稳定,加热不发生分解,NaHCO3加热时分解生成碳酸钠,A错误;Na2CO3与NaHCO3进行焰色反应时,火焰均是黄色,B错误;Na2CO3与NaHCO3都能与澄清石灰水反应产生白色沉淀,C错误;相同质量的样品,分别加入等体积、等浓度的白醋,碳酸氢钠反应更剧烈,D正确。
5.已知A是一种金属单质,B显淡黄色,相关物质的转化关系如图所示,则下列关于C的性质的叙述错误的是( D )
A.易溶于水
B.与澄清石灰水反应产生白色沉淀
C.与足量盐酸反应放出气体
D.属于碱
解析:根据已知信息,可以推断出A为Na,B为Na2O2,C为Na2CO3,D为NaOH。Na2CO3属于盐,D项错误。
6. 下列有关焰色反应操作的描述正确的是( A )
A.取一根洁净的细铂丝,放在酒精灯上灼烧至无色,再蘸取少量NaCl溶液,进行焰色反应
B.在观察焰色反应时均要透过蓝色钴玻璃片,以便排除钠元素的黄光的干扰
C.铂丝在做完氯化钠溶液的焰色反应后,用稀硫酸洗净,再蘸取少量的K2SO4溶液,重复以上实验
D.用洁净的铂丝蘸取某溶液,放在火焰上灼烧,观察到黄色火焰,则证明该溶液中一定有Na+,没有K+
解析:焰色反应用稀盐酸清洗金属丝,C项错误;钾的焰色反应容易被钠的焰色反应掩盖,故应透过蓝色钴玻璃观察,B、D错误。
7. 下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断正确的是( D )
选项 陈述Ⅰ 陈述Ⅱ 判断
A 碳酸钠可用于治疗胃酸 Na2CO3可与盐酸反应 Ⅰ对,Ⅱ对,有
B 向Na2O2的水溶液中滴入酚酞变红色 Na2O2与水反应生成氢氧化钠 Ⅰ对,Ⅱ错,无
C 金属钠具有强还原性 高压钠灯发出透光性强的黄光 Ⅰ对,Ⅱ对,有
D 过氧化钠可为航天员供氧 Na2O2能与CO2、H2O反应生成O2 Ⅰ对,Ⅱ对,有
解析:A项,陈述Ⅰ错误,治疗胃酸过多要用NaHCO3而不是Na2CO3;B项,陈述Ⅰ错误,酚酞在Na2O2的溶液中最终呈无色;C项,陈述Ⅰ与Ⅱ之间无因果关系。
8. 下列实验装置及操作均正确的是( D )
A.图Ⅰ中A盛放碳酸氢钠,B盛放碳酸钠,可对比二者的热稳定性
B.图Ⅱ可用于从碳酸钠溶液中提取碳酸钠固体
C.图Ⅲ为探究钠与水的反应现象实验的装置
D.图Ⅳ为实验室制备碳酸钠溶液的装置(NaHCO3溶液与NaOH溶液等体积、等浓度)
解析:应该是NaHCO3放在小试管B中,Na2CO3放在大试管A中,试管A直接加热,温度较高,试管B间接加热,温度较低,如果温度较高的不分解,而温度较低的物质分解,可判断稳定性强弱,A错误;从碳酸钠溶液中提取碳酸钠固体应该用蒸发皿,B错误;烧杯中盛水量不能超过烧杯容积的一半,否则容易发生危险,C错误;NaHCO3溶液与NaOH溶液等体积、等浓度混合,恰好生成碳酸钠和水:NaHCO3+NaOH===Na2CO3+H2O,D正确。
9. Na2O2与足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的固体物质是( B )
A.Na2O2、Na2CO3 B.Na2CO3
C.Na2CO3、NaOH D.Na2O2、NaOH
解析:NaHCO3分解生成CO2和H2O,通常CO2先与Na2O2反应,然后H2O再与Na2O2反应,否则先生成的NaOH也会与CO2发生反应,生成Na2CO3。又题中为足量的NaHCO3,故最后固体为Na2CO3。
10. 将7.2 g CO和H2的混合气体与足量O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加( C )
A.2.1 g B.3.6 g C.7.2 g D.无法确定
解析:题中整个过程发生四个反应。
①2H2+O22H2O
②2H2O+2Na2O2===4NaOH+O2↑
③2CO+O22CO2
④2CO2+2Na2O2===2Na2CO3+O2↑
由①、②叠加得2H2+2Na2O2===4NaOH,由③、④叠加得2CO+2Na2O2===2Na2CO3,由叠加方程式不难看出,Na2O2将全部的CO和H2吸收,因此增重的质量为CO与H2的质量之和。
11. 观察是研究物质性质的一种基本方法。一同学将一小块金属钠露置于空气中,观察到下列现象:银白色变灰暗变白色出现液滴白色固体白色粉末,下列说法正确的是( A )
A.①发生了氧化还原反应
B.②变白色是因为生成了碳酸钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化
解析:钠在空气中露置,物质转化如下:NaNa2ONaOHNaOH潮解Na2CO3·10H2ONa2CO3粉末,可知A正确。
12. 焰火与高中化学中“焰色反应”知识有关。下列有关“焰色反应”说法中正确的是( B )
A.非金属单质燃烧时火焰均为无色
B.NaCl与Na2CO3灼烧时火焰颜色相同
C.焰色反应均应透过蓝色钴玻璃观察
D.所有金属及其化合物灼烧时火焰均有颜色
解析:非金属单质燃烧时火焰可能有色,如H2燃烧时火焰为淡蓝色,而S在O2中燃烧火焰为蓝紫色,A错;焰色反应是金属元素的性质,在单质和化合物中,同种金属元素的焰色是相同的,B正确;只有观察K的焰色反应时,才需透过蓝色的钴玻璃,C错;有些金属,如铂、铁、铝、镍、钨等都没有焰色反应,D错。
二、非选择题(共52分)
13. (12分)某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,B和酸性气体D反应能生成C,A露置在空气中足够长时间也会变为C,E与D反应也能生成C,A、B都能与水反应生成E。回答下列问题:
(1)写出下列物质的化学式:A Na,B Na2O2,C Na2CO3,D CO2,E NaOH。
(2)写出下列反应的化学方程式:
①A生成B:2Na+O2Na2O2;
②B与水反应生成E:2Na2O2+2H2O===4NaOH+O2↑。
解析:根据金属单质A在空气中加热燃烧时发出黄色火焰,可以推断出A为Na,则B为Na2O2。结合Na2O2的性质,可以推断出D为CO2,C为Na2CO3,根据A、B都能与水反应生成E,可推断出E为NaOH。
14.(12分)如何除去下列物质中的杂质,请写出相应的除杂方法或试剂名称及有关反应的实验现象和化学反应方程式。
解析:用化学方法将杂质转化成易于分离的气体或者沉淀,同时不引入新的杂质。
15.(16分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做以下实验,如下图所示。
(1)写出装置Ⅰ中与盐酸发生反应的化学方程式:
①Na2CO3:Na2CO3+2HCl===2NaCl+H2O+CO2↑。
②NaHCO3:NaHCO3+HCl===NaCl+H2O+CO2↑。
③由此可知装置Ⅰ不能(填“能”或“不能”)鉴别Na2CO3和NaHCO3。
(2)装置Ⅱ能鉴别Na2CO3和NaHCO3的现象是盛NaHCO3的装置比盛Na2CO3的装置反应剧烈且反应后气球大。
(3)装置Ⅲ、Ⅳ均利用了Na2CO3和NaHCO3的热稳定性区别。有关化学方程式为2NaHCO3Na2CO3+H2O+CO2↑。
(4)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式)NaHCO3。有的同学在盛Na2CO3的导管口观察到开始加热时也有气泡产生,据此认为Na2CO3加热也分解。你认为此观点错误(填“正确”或“错误”)。分析产生此现象的原因为大试管中空气受热膨胀时逸出。
(5)除了以上方法,请你再举出一例鉴别二者的方法把二者分别配成溶液后滴加BaCl2溶液,有白色沉淀生成的为Na2CO3,无现象的为NaHCO3(其他合理答案均可)。
解析:(1)装置Ⅰ中Na2CO3和NaHCO3均能与盐酸反应产生CO2,使澄清石灰水变浑浊,所以不能鉴别二者。(2)装置Ⅱ利用NaHCO3与盐酸反应比Na2CO3快且产生的气体多进行鉴定。(3)装置Ⅲ、Ⅳ利用了NaHCO3受热分解生成CO2而Na2CO3受热不分解。(4)酒精灯火焰直接加热试管A,然后预热试管B,因此试管B中盛放NaHCO3,更能说明稳定性Na2CO3>NaHCO3。因为气体受热膨胀,所以a、b开始均能看到有气泡产生,只是a中产生的气泡不能使澄清石灰水变浑浊。
16.(12分)如图是实验室研究潜水艇中供氧体系反应机理的的装置图(夹持仪器略)。
(1)A装置为CO2的发生装置,反应的离子方程式为CaCO3+2H+===Ca2++H2O+CO2↑。
(2)B装置可除去A装置中可能挥发出的HCl,反应的离子方程式为HCO+H+===H2O+CO2↑。
(3)C装置为O2的发生装置,反应的化学方程式为2Na2O2+2CO2===2Na2CO3+O2、2Na2O2+2H2O===4NaOH+O2↑。
(4)D装置可除去C装置中未反应的CO2,反应的离子方程式为2OH-+CO2===CO+H2O。
(5)E装置为排水法收集O2的装置,检验所收集的气体为O2的方法为取出集气瓶正放于桌面上,将一根带火星的木条伸入集气瓶中,若木条复燃,证明所收集的气体为O2。
(6)C装置中固体由淡黄色完全变为白色,检验固体成分的实验方案为取少量C装置中反应后的固体溶于水,向溶液中滴入过量CaCl2溶液,若有白色沉淀生成,则证明固体中含有Na2CO3;过滤,向滤液中滴入几滴酚酞试液,若溶液变红且不褪色,则证明固体中含有NaOH。
解析:(1)实验室用稀盐酸与大理石反应制取CO2。(2)制得的CO2中混有HCl,通过饱和NaHCO3溶液除去CO2中的HCl。(3)从B装置中出来的CO2中含有水蒸气,通过C装置时CO2、H2O均能与Na2O2反应产生氧气。(4)D装置中NaOH溶液的作用是除去CO2。(5)利用带火星的木条检验氧气。(6)C装置中反应后的固体可能含有NaOH、Na2CO3,先加入过量CaCl2溶液检验并除去Na2CO3,过滤后加入酚酞试液检验NaOH。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
2-1-2 钠的几种化合物、焰色试验
一、选择题(每小题4分,共48分,每小题只有一个正确选项)
1.向含有HCO、CO、NO、Na+的溶液中加入一定量Na2O2后,下列离子的浓度减小的是( )
A.HCO B.CO C.NO D.Na+
2.下列叙述中正确的是( )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
③Na2O主要有氧化性,Na2O2主要有还原性
④Na2O2可作供氧剂,而Na2O不能
⑤Na2O2是强氧化剂,Na2O是一种碱性氧化物
A. 都正确 B. ②③④⑤ C. ②③⑤ D. ④⑤
3.有两份质量相同的NaHCO3,向第一份中加入盐酸使其充分反应;将第二份加热使其完全分解,冷却至原温度再加入相同浓度的盐酸充分反应,则它们所耗用的盐酸的体积比为( )
A. 2∶1 B. 1∶1 C. 1∶2 D. 4∶1
4.纯碱和小苏打都是白色晶体,在日常生活中都可以找到。若要在家中将它们区分开来,下面的方法中可行的是( )
A.分别放在炒锅中加热,观察是否有残留物
B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色
C.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀
D.在水杯中各盛相同质量的样品,分别加入等体积、等浓度的白醋,观察反应的剧烈程度
5.已知A是一种金属单质,B显淡黄色,相关物质的转化关系如图所示,则下列关于C的性质的叙述错误的是( )
A.易溶于水
B.与澄清石灰水反应产生白色沉淀
C.与足量盐酸反应放出气体
D.属于碱
6. 下列有关焰色反应操作的描述正确的是( )
A.取一根洁净的细铂丝,放在酒精灯上灼烧至无色,再蘸取少量NaCl溶液,进行焰色反应
B.在观察焰色反应时均要透过蓝色钴玻璃片,以便排除钠元素的黄光的干扰
C.铂丝在做完氯化钠溶液的焰色反应后,用稀硫酸洗净,再蘸取少量的K2SO4溶液,重复以上实验
D.用洁净的铂丝蘸取某溶液,放在火焰上灼烧,观察到黄色火焰,则证明该溶液中一定有Na+,没有K+
7. 下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断正确的是( )
选项 陈述Ⅰ 陈述Ⅱ 判断
A 碳酸钠可用于治疗胃酸 Na2CO3可与盐酸反应 Ⅰ对,Ⅱ对,有
B 向Na2O2的水溶液中滴入酚酞变红色 Na2O2与水反应生成氢氧化钠 Ⅰ对,Ⅱ错,无
C 金属钠具有强还原性 高压钠灯发出透光性强的黄光 Ⅰ对,Ⅱ对,有
D 过氧化钠可为航天员供氧 Na2O2能与CO2、H2O反应生成O2 Ⅰ对,Ⅱ对,有
8. 下列实验装置及操作均正确的是( )
A.图Ⅰ中A盛放碳酸氢钠,B盛放碳酸钠,可对比二者的热稳定性
B.图Ⅱ可用于从碳酸钠溶液中提取碳酸钠固体
C.图Ⅲ为探究钠与水的反应现象实验的装置
D.图Ⅳ为实验室制备碳酸钠溶液的装置(NaHCO3溶液与NaOH溶液等体积、等浓度)
9. Na2O2与足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的固体物质是( )
A.Na2O2、Na2CO3 B.Na2CO3
C.Na2CO3、NaOH D.Na2O2、NaOH
10. 将7.2 g CO和H2的混合气体与足量O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加( )
A.2.1 g B.3.6 g C.7.2 g D.无法确定
11. 观察是研究物质性质的一种基本方法。一同学将一小块金属钠露置于空气中,观察到下列现象:银白色变灰暗变白色出现液滴白色固体白色粉末,下列说法正确的是( )
A.①发生了氧化还原反应
B.②变白色是因为生成了碳酸钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化
12. 焰火与高中化学中“焰色反应”知识有关。下列有关“焰色反应”说法中正确的是( )
A.非金属单质燃烧时火焰均为无色
B.NaCl与Na2CO3灼烧时火焰颜色相同
C.焰色反应均应透过蓝色钴玻璃观察
D.所有金属及其化合物灼烧时火焰均有颜色
二、非选择题(共52分)
13. (12分)某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,B和酸性气体D反应能生成C,A露置在空气中足够长时间也会变为C,E与D反应也能生成C,A、B都能与水反应生成E。回答下列问题:
(1)写出下列物质的化学式:A ,B ,C ,D ,E 。
(2)写出下列反应的化学方程式:
①A生成B: ;
②B与水反应生成E: 。
14.(12分)如何除去下列物质中的杂质,请写出相应的除杂方法或试剂名称及有关反应的实验现象和化学反应方程式。
15.(16分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做以下实验,如下图所示。
(1)写出装置Ⅰ中与盐酸发生反应的化学方程式:
①Na2CO3: 。
②NaHCO3: 。
③由此可知装置Ⅰ (填“能”或“不能”)鉴别Na2CO3和NaHCO3。
(2)装置Ⅱ能鉴别Na2CO3和NaHCO3的现象是 。
(3)装置Ⅲ、Ⅳ均利用了Na2CO3和NaHCO3的 区别。有关化学方程式为 。
(4)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式) 。有的同学在盛Na2CO3的导管口观察到开始加热时也有气泡产生,据此认为Na2CO3加热也分解。你认为此观点 (填“正确”或“错误”)。分析产生此现象的原因为 。
(5)除了以上方法,请你再举出一例鉴别二者的方法 。
16.(12分)如图是实验室研究潜水艇中供氧体系反应机理的的装置图(夹持仪器略)。
(1)A装置为CO2的发生装置,反应的离子方程式为 。
(2)B装置可除去A装置中可能挥发出的 ,反应的离子方程式为 。
(3)C装置为O2的发生装置,反应的化学方程式为 。
(4)D装置可除去C装置中未反应的 ,反应的离子方程式为
。
(5)E装置为排水法收集O2的装置,检验所收集的气体为O2的方法为 。
(6)C装置中固体由淡黄色完全变为白色,检验固体成分的实验方案为取少量C装置中反应后的固体溶于水,向溶液中滴入过量 溶液,若有白色沉淀生成,则证明固体中含有 ;过滤,向滤液中滴入几滴酚酞试液,若 且不褪色,则证明固体中含有 。
2-1-2 钠的几种化合物、焰色试验
一、选择题(每小题4分,共48分,每小题只有一个正确选项)
1.向含有HCO、CO、NO、Na+的溶液中加入一定量Na2O2后,下列离子的浓度减小的是( A )
A.HCO B.CO C.NO D.Na+
解析:由于2Na2O2+2H2O===4NaOH+O2↑,HCO可与OH-发生反应HCO+OH-===CO+H2O,因此HCO的浓度减小。
2.下列叙述中正确的是( D )
①Na2O与Na2O2都能和水反应生成碱,它们都是碱性氧化物
②Na2O与CO2发生化合反应生成Na2CO3,Na2O2与CO2发生置换反应生成O2
③Na2O主要有氧化性,Na2O2主要有还原性
④Na2O2可作供氧剂,而Na2O不能
⑤Na2O2是强氧化剂,Na2O是一种碱性氧化物
A. 都正确 B. ②③④⑤ C. ②③⑤ D. ④⑤
解析:Na2O是碱性氧化物,但Na2O2与水反应时还生成O2,不是碱性氧化物;Na2O2与CO2的反应不符合置换反应的特点;Na2O2有强氧化性,因其中-1价O易得电子变为其稳定价态-2价,而Na2O的氧化性、还原性都很弱。
3.有两份质量相同的NaHCO3,向第一份中加入盐酸使其充分反应;将第二份加热使其完全分解,冷却至原温度再加入相同浓度的盐酸充分反应,则它们所耗用的盐酸的体积比为( B )
A. 2∶1 B. 1∶1 C. 1∶2 D. 4∶1
解析:方法一 取168 g NaHCO3,第一份:
NaHCO3+HCl===NaCl+H2O+CO2↑
84 36.5
168 g 36.5×2 g
第二份:
2NaHCO3Na2CO3+H2O+CO2↑
2×84 106
168 g 106 g
Na2CO3+2HCl2NaCl+H2O+CO2↑
106 36.5×2
106 g 36.5×2 g
通过比较耗酸量相同。
方法二 不论NaHCO3是直接与酸反应,还是受热分解后的固体再与酸反应,其中的Na+均转化为NaCl,因Na+的含量一定,则需Cl-的量一定,即需HCl的量一定,所以由守恒式可直接判断出答案。
4.纯碱和小苏打都是白色晶体,在日常生活中都可以找到。若要在家中将它们区分开来,下面的方法中可行的是( D )
A.分别放在炒锅中加热,观察是否有残留物
B.分别用干净铁丝蘸取样品在煤气炉的火焰上灼烧,观察火焰颜色
C.将样品溶解,分别加入澄清石灰水,观察是否有白色沉淀
D.在水杯中各盛相同质量的样品,分别加入等体积、等浓度的白醋,观察反应的剧烈程度
解析:Na2CO3很稳定,加热不发生分解,NaHCO3加热时分解生成碳酸钠,A错误;Na2CO3与NaHCO3进行焰色反应时,火焰均是黄色,B错误;Na2CO3与NaHCO3都能与澄清石灰水反应产生白色沉淀,C错误;相同质量的样品,分别加入等体积、等浓度的白醋,碳酸氢钠反应更剧烈,D正确。
5.已知A是一种金属单质,B显淡黄色,相关物质的转化关系如图所示,则下列关于C的性质的叙述错误的是( D )
A.易溶于水
B.与澄清石灰水反应产生白色沉淀
C.与足量盐酸反应放出气体
D.属于碱
解析:根据已知信息,可以推断出A为Na,B为Na2O2,C为Na2CO3,D为NaOH。Na2CO3属于盐,D项错误。
6. 下列有关焰色反应操作的描述正确的是( A )
A.取一根洁净的细铂丝,放在酒精灯上灼烧至无色,再蘸取少量NaCl溶液,进行焰色反应
B.在观察焰色反应时均要透过蓝色钴玻璃片,以便排除钠元素的黄光的干扰
C.铂丝在做完氯化钠溶液的焰色反应后,用稀硫酸洗净,再蘸取少量的K2SO4溶液,重复以上实验
D.用洁净的铂丝蘸取某溶液,放在火焰上灼烧,观察到黄色火焰,则证明该溶液中一定有Na+,没有K+
解析:焰色反应用稀盐酸清洗金属丝,C项错误;钾的焰色反应容易被钠的焰色反应掩盖,故应透过蓝色钴玻璃观察,B、D错误。
7. 下表中,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断正确的是( D )
选项 陈述Ⅰ 陈述Ⅱ 判断
A 碳酸钠可用于治疗胃酸 Na2CO3可与盐酸反应 Ⅰ对,Ⅱ对,有
B 向Na2O2的水溶液中滴入酚酞变红色 Na2O2与水反应生成氢氧化钠 Ⅰ对,Ⅱ错,无
C 金属钠具有强还原性 高压钠灯发出透光性强的黄光 Ⅰ对,Ⅱ对,有
D 过氧化钠可为航天员供氧 Na2O2能与CO2、H2O反应生成O2 Ⅰ对,Ⅱ对,有
解析:A项,陈述Ⅰ错误,治疗胃酸过多要用NaHCO3而不是Na2CO3;B项,陈述Ⅰ错误,酚酞在Na2O2的溶液中最终呈无色;C项,陈述Ⅰ与Ⅱ之间无因果关系。
8. 下列实验装置及操作均正确的是( D )
A.图Ⅰ中A盛放碳酸氢钠,B盛放碳酸钠,可对比二者的热稳定性
B.图Ⅱ可用于从碳酸钠溶液中提取碳酸钠固体
C.图Ⅲ为探究钠与水的反应现象实验的装置
D.图Ⅳ为实验室制备碳酸钠溶液的装置(NaHCO3溶液与NaOH溶液等体积、等浓度)
解析:应该是NaHCO3放在小试管B中,Na2CO3放在大试管A中,试管A直接加热,温度较高,试管B间接加热,温度较低,如果温度较高的不分解,而温度较低的物质分解,可判断稳定性强弱,A错误;从碳酸钠溶液中提取碳酸钠固体应该用蒸发皿,B错误;烧杯中盛水量不能超过烧杯容积的一半,否则容易发生危险,C错误;NaHCO3溶液与NaOH溶液等体积、等浓度混合,恰好生成碳酸钠和水:NaHCO3+NaOH===Na2CO3+H2O,D正确。
9. Na2O2与足量的NaHCO3混合后,在密闭容器中充分加热,排除气体物质后冷却,残留的固体物质是( B )
A.Na2O2、Na2CO3 B.Na2CO3
C.Na2CO3、NaOH D.Na2O2、NaOH
解析:NaHCO3分解生成CO2和H2O,通常CO2先与Na2O2反应,然后H2O再与Na2O2反应,否则先生成的NaOH也会与CO2发生反应,生成Na2CO3。又题中为足量的NaHCO3,故最后固体为Na2CO3。
10. 将7.2 g CO和H2的混合气体与足量O2充分燃烧后,立即通入足量的Na2O2固体中,固体的质量增加( C )
A.2.1 g B.3.6 g C.7.2 g D.无法确定
解析:题中整个过程发生四个反应。
①2H2+O22H2O
②2H2O+2Na2O2===4NaOH+O2↑
③2CO+O22CO2
④2CO2+2Na2O2===2Na2CO3+O2↑
由①、②叠加得2H2+2Na2O2===4NaOH,由③、④叠加得2CO+2Na2O2===2Na2CO3,由叠加方程式不难看出,Na2O2将全部的CO和H2吸收,因此增重的质量为CO与H2的质量之和。
11. 观察是研究物质性质的一种基本方法。一同学将一小块金属钠露置于空气中,观察到下列现象:银白色变灰暗变白色出现液滴白色固体白色粉末,下列说法正确的是( A )
A.①发生了氧化还原反应
B.②变白色是因为生成了碳酸钠
C.③是碳酸钠吸收空气中的水蒸气形成了溶液
D.④只发生物理变化
解析:钠在空气中露置,物质转化如下:NaNa2ONaOHNaOH潮解Na2CO3·10H2ONa2CO3粉末,可知A正确。
12. 焰火与高中化学中“焰色反应”知识有关。下列有关“焰色反应”说法中正确的是( B )
A.非金属单质燃烧时火焰均为无色
B.NaCl与Na2CO3灼烧时火焰颜色相同
C.焰色反应均应透过蓝色钴玻璃观察
D.所有金属及其化合物灼烧时火焰均有颜色
解析:非金属单质燃烧时火焰可能有色,如H2燃烧时火焰为淡蓝色,而S在O2中燃烧火焰为蓝紫色,A错;焰色反应是金属元素的性质,在单质和化合物中,同种金属元素的焰色是相同的,B正确;只有观察K的焰色反应时,才需透过蓝色的钴玻璃,C错;有些金属,如铂、铁、铝、镍、钨等都没有焰色反应,D错。
二、非选择题(共52分)
13. (12分)某银白色金属单质A在空气中加热燃烧时发出黄色火焰,得到淡黄色固体B,B和酸性气体D反应能生成C,A露置在空气中足够长时间也会变为C,E与D反应也能生成C,A、B都能与水反应生成E。回答下列问题:
(1)写出下列物质的化学式:A Na,B Na2O2,C Na2CO3,D CO2,E NaOH。
(2)写出下列反应的化学方程式:
①A生成B:2Na+O2Na2O2;
②B与水反应生成E:2Na2O2+2H2O===4NaOH+O2↑。
解析:根据金属单质A在空气中加热燃烧时发出黄色火焰,可以推断出A为Na,则B为Na2O2。结合Na2O2的性质,可以推断出D为CO2,C为Na2CO3,根据A、B都能与水反应生成E,可推断出E为NaOH。
14.(12分)如何除去下列物质中的杂质,请写出相应的除杂方法或试剂名称及有关反应的实验现象和化学反应方程式。
解析:用化学方法将杂质转化成易于分离的气体或者沉淀,同时不引入新的杂质。
15.(16分)某校化学课外小组为了鉴别碳酸钠和碳酸氢钠两种白色固体,用不同的方法做以下实验,如下图所示。
(1)写出装置Ⅰ中与盐酸发生反应的化学方程式:
①Na2CO3:Na2CO3+2HCl===2NaCl+H2O+CO2↑。
②NaHCO3:NaHCO3+HCl===NaCl+H2O+CO2↑。
③由此可知装置Ⅰ不能(填“能”或“不能”)鉴别Na2CO3和NaHCO3。
(2)装置Ⅱ能鉴别Na2CO3和NaHCO3的现象是盛NaHCO3的装置比盛Na2CO3的装置反应剧烈且反应后气球大。
(3)装置Ⅲ、Ⅳ均利用了Na2CO3和NaHCO3的热稳定性区别。有关化学方程式为2NaHCO3Na2CO3+H2O+CO2↑。
(4)若用实验Ⅳ验证碳酸钠和碳酸氢钠的稳定性,则试管B中装入的固体最好是(填化学式)NaHCO3。有的同学在盛Na2CO3的导管口观察到开始加热时也有气泡产生,据此认为Na2CO3加热也分解。你认为此观点错误(填“正确”或“错误”)。分析产生此现象的原因为大试管中空气受热膨胀时逸出。
(5)除了以上方法,请你再举出一例鉴别二者的方法把二者分别配成溶液后滴加BaCl2溶液,有白色沉淀生成的为Na2CO3,无现象的为NaHCO3(其他合理答案均可)。
解析:(1)装置Ⅰ中Na2CO3和NaHCO3均能与盐酸反应产生CO2,使澄清石灰水变浑浊,所以不能鉴别二者。(2)装置Ⅱ利用NaHCO3与盐酸反应比Na2CO3快且产生的气体多进行鉴定。(3)装置Ⅲ、Ⅳ利用了NaHCO3受热分解生成CO2而Na2CO3受热不分解。(4)酒精灯火焰直接加热试管A,然后预热试管B,因此试管B中盛放NaHCO3,更能说明稳定性Na2CO3>NaHCO3。因为气体受热膨胀,所以a、b开始均能看到有气泡产生,只是a中产生的气泡不能使澄清石灰水变浑浊。
16.(12分)如图是实验室研究潜水艇中供氧体系反应机理的的装置图(夹持仪器略)。
(1)A装置为CO2的发生装置,反应的离子方程式为CaCO3+2H+===Ca2++H2O+CO2↑。
(2)B装置可除去A装置中可能挥发出的HCl,反应的离子方程式为HCO+H+===H2O+CO2↑。
(3)C装置为O2的发生装置,反应的化学方程式为2Na2O2+2CO2===2Na2CO3+O2、2Na2O2+2H2O===4NaOH+O2↑。
(4)D装置可除去C装置中未反应的CO2,反应的离子方程式为2OH-+CO2===CO+H2O。
(5)E装置为排水法收集O2的装置,检验所收集的气体为O2的方法为取出集气瓶正放于桌面上,将一根带火星的木条伸入集气瓶中,若木条复燃,证明所收集的气体为O2。
(6)C装置中固体由淡黄色完全变为白色,检验固体成分的实验方案为取少量C装置中反应后的固体溶于水,向溶液中滴入过量CaCl2溶液,若有白色沉淀生成,则证明固体中含有Na2CO3;过滤,向滤液中滴入几滴酚酞试液,若溶液变红且不褪色,则证明固体中含有NaOH。
解析:(1)实验室用稀盐酸与大理石反应制取CO2。(2)制得的CO2中混有HCl,通过饱和NaHCO3溶液除去CO2中的HCl。(3)从B装置中出来的CO2中含有水蒸气,通过C装置时CO2、H2O均能与Na2O2反应产生氧气。(4)D装置中NaOH溶液的作用是除去CO2。(5)利用带火星的木条检验氧气。(6)C装置中反应后的固体可能含有NaOH、Na2CO3,先加入过量CaCl2溶液检验并除去Na2CO3,过滤后加入酚酞试液检验NaOH。
21世纪教育网 www.21cnjy.com 精品试卷·第 2 页 (共 2 页)
HYPERLINK "http://21世纪教育网(www.21cnjy.com)
" 21世纪教育网(www.21cnjy.com)
