3.2组成物质的化学元素(共2课时)【2022-2023沪教版九上化学精优课件含视频】(课件54页)
文档属性
| 名称 | 3.2组成物质的化学元素(共2课时)【2022-2023沪教版九上化学精优课件含视频】(课件54页) |

|
|
| 格式 | pptx | ||
| 文件大小 | 24.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-29 14:19:34 | ||
图片预览










文档简介
(共56张PPT)
九上化学同步精品课件
沪教版九年级上册
沪教版九上化学精品课件
3.2 组成物质的化学元素
绪言
第三章 物质构成的奥秘
(共2课时 )
学习目标
重点难点
1.认识一些常见元素,会书写它们的名称与符号;
2.知道元素符号的意义;了解元素周期表;
3.掌握有关单质、化合物及氧化物的概念;
4.了解化学元素与人体健康关系。
1.掌握单质和化合物的概念;
2.元素符号所表示的意义;
3.元素周期表的认识。
认识元素(附高清视频)
1
2
化学元素之歌(附高清视频)
3
目 录 Contents
有关元素的概念/书写/意义/分类
4
5
6
元素与原子的联系与区别/元素、原子、分子物质间的关系
元素与人体健康(附高清视频)
化学元素周期表简介
5
单质、化合物、氧化物/物质分类技巧
新课引入
认
识
元
素
不知道你是否意识到,我们每时每刻都在与化学元素打交道:比如你每天吃的钙片中钙元素;喝的水中含有氢元素、氧元素;今天就让我们一起学习一下关于这方面的知识吧!
锌
碘
想一想,以上的“钙”、“铁”、“锌”、“碘”指的是什么?
钙
铁
新课引入
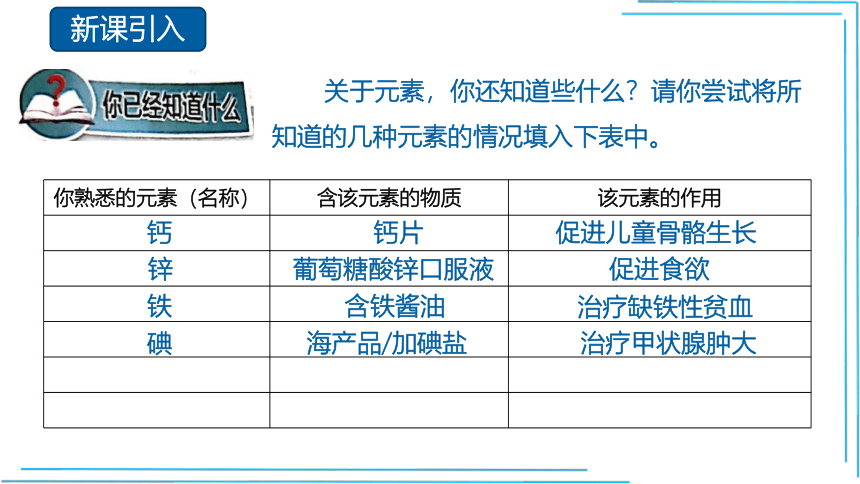
关于元素,你还知道些什么?请你尝试将所知道的几种元素的情况填入下表中。
你熟悉的元素(名称) 含该元素的物质 该元素的作用
新课引入
钙
钙片
促进儿童骨骼生长
锌
葡萄糖酸锌口服液
促进食欲
铁
含铁酱油
治疗缺铁性贫血
碘
海产品/加碘盐
治疗甲状腺肿大
一、元素与元素符号
各种原子、离子、分子构成了数以千万计的物质。我们也知道世间万物都是由元素组成的。不管是氧分子中的氧原子,还是水分子中的氧原子,都是氧元素的原子;氢气、水、酒精中含有的氢原子都是氢元素的原子;二氧化碳、一氧 化碳、碳酸钙中含有的碳原子都是碳元素的原子。
新课讲解
氧 化 汞
HgO
汞原子和氧原子
水
H2O
氢原子和氧原子
CO2
二氧化碳
碳原子和氧原子
思考:上述分子在组成上有何相同点
氧 气
O2
氧原子
它们为什么属于同类原子
新课讲解
元 素
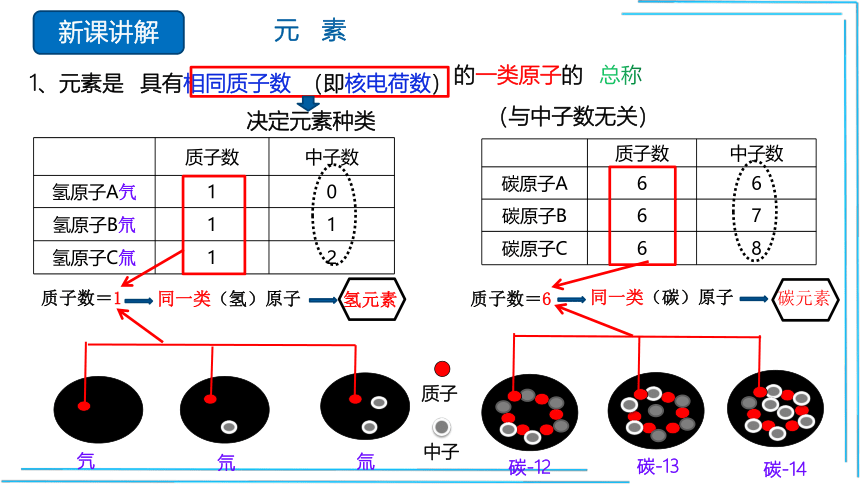
1、元素是
具有相同质子数
(即核电荷数)
的一类原子的
总称
质子数 中子数
碳原子A 6 6
碳原子B 6 7
碳原子C 6 8
碳-12
碳-14
碳-13
质子数 中子数
氢原子A氕 1 0
氢原子B氘 1 1
氢原子C氚 1 2
质子
中子
氕
氚
氘
决定元素种类
(与中子数无关)
质子数=1
同一类(氢)原子
氢元素
质子数=6
同一类(碳)原子
碳元素
新课讲解
元 素
新课讲解
(1)具有相同质子数的微粒不一定是同种元素,微粒可能是分子、原子或离子。如水分子(H2O)和氖原子(Ne)都有10个质子,但不属于同种元素。
(2)这里所说的一类原子是指质子数相同、但中子数不一定相同的原子,也就是说同种元素的原子可以是质子数相同,但中子数不同的不同种原子。如
126C、 136C、 146C都是碳原子;质子数相同的原子与对应的单核离子,如钠原子和钠离子都属于钠元素。
(3)元素是一个宏观概念,只讲种类不讲个数。
(4)物质发生化学变化时,分子的种类发生变化,原子的种类不变,元素的种类也不会改变。
归 纳 小 结
元 素
物质都是由元素组成的
氧气(O2)是由 组成的;
水(H2O)是由 和 组成的;
碳酸钙(CaCO3)是由 、 和 组成的。
氧元素
氢元素
氧元素
钙元素
碳元素
氧元素
镁元素:Na、Na+
铁元素:Fe、Fe2+、Fe3+
【易错提醒】
原子通过得失电子变为离子,其质子数不变
新课讲解
元 素
新课讲解
表3-3 部分元素的中文、拉丁文、英文名称和符号
中文名称 拉丁文 英文 元素符号
氢 Hydrogenium Hydrogen H
氧 Oxygenium Oxygen 0
碳 Carbonium Carbon C
氮 Nitrogenium Nitrogen N
铁 Ferrum Iron Fe
铜 Cuprum Copper Cu
表3-4 常见元素的名称、符号和相对原子质量
名称 符号 相对原子质量 名称 符号 相对原子质量
氢 H 1 钾 K 39
碳 C 12 钙 Ca 40
氮 N 14 锰 Mn 55
氧 0 16 铁 Fe 56
钠 Na 23 铜 Cu 64
镁 Mg 24 锌 Zn 65
铝 A1 27 银 Ag 108
硅 Si 28 锡 Sn 119
磷 P 31 碘 I 127
硫 S 32 钡 Ba 137
氯 C1 35.5 金 Au 197
新课讲解
(1)元素符号的书写
2、元素符合
(1)由首字母表示元素符号(大写)。
(2)若首字母相同,则第一个字母(大写),附加第二个字母(小写)
国际上统一采用元素拉丁文名称
O C H N S
氧 碳 氢 氮 硫
Fe Cu Al Mg Hg
铁 铜 铝 镁 汞
书写规则“一大二小”。
即第一个字母大写,第二个字母小写。
小结
新课讲解
(2)元素符号的意义
①表示一种元素
②表示该元素的一个原子
③由原子直接构成的物质,元素符号还表示一种物质
H
表示氢元素
表示一个氢原子
③一个铁原子
①铁元素
Cu
②铁这种物质
宏观
微观
指出下列元素符号所表示的意义
强调:在元素符号前面加上任何一个数字,只表示微观意义,即原子个数。
新课讲解
数字意义
元素理解
元素符号
符号意义
元素周期表
B
符号右上角数字表示一个离子所带的电荷数
C
符号右下角数字表示一个分子中原子的个数
A
符号前面数字表示微粒的个数
新课讲解
自我检查
2、用符号和数字表达含义
5个氧原子: 2个铜原子:
氮元素 : 3个磷原子:
O :
2H:
Na:
2Mg:
nS:
1、说说下列符号的意义
5O
2Cu
N
3P
氧元素或一个氧原子
2个氢原子
钠元素或一个钠原子
2个镁原子
n个硫原子
新课讲解
3.元素的分类
稀有气体元素:
钠(Na)、铁(Fe)、镁(Mg)、铝(Al)、……
金属元素:
“钅”字旁(汞除外,俗称“水银”)
非金属元素:
氢(H)、碳(C)、氧(O)、磷(P)、氯(Cl)……
①(“石”字旁)固态
②(“氵”字旁)液态
③(“气”字头)气态
碳、磷、硫、硅等
溴
氢、氧、氮、氟、氯等
氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)、氡(Rn)
新课讲解
2.元素、原子的联系与区别
联系
原子
元素
区
别
元素是同一类原子的总称,原子是构成元素的
基本单元,是个体与集体的关系
描述微观粒子的构成
描述宏观物质的组成
既讲种类,又讲个数
只讲种类,不讲个数
概念
化学变化中的最小粒子
质子数(即核电荷数)相同的一类原子的总称
新课讲解
3、物质、元素、分子、原子间的关系
原子
分子
元素
物质
宏观
微观
总称
构成
组成
构成
构成
新课讲解
化学元素之歌
新课讲解
三、元素周期表简介
1869年2月,俄国化学家门捷列夫编制了他的第一张元素周期表,表中除收入了当时已知的63种元素外,还给尚未发现的元素留下了27个空位,并大胆地预言了11种未知的新元素和它们在元素周期表的位置,同时根据它们的性质取了名字,如类铝、类硼、类硅等,后来都得到了验证。
新课讲解
仔细观察元素周期表,你能发现什么规律?
新课讲解
归纳小结
1、元素周期表共有7个横行,18个纵行。每一个横行叫做一个
周期(共7个周期),每一个纵行叫做一个族(8,9,10三个
纵行共同组成一个族)(共16个族)。
2、为了便于查找,元素周期表按元素原子核电荷数递增的顺序
给元素编了序号,叫做原子序数,原子序数与元素原子核电荷数
在数值上相同。 质子数=核外电子数=核电荷数=原子序数
新课讲解
3、排列规律:
(1)元素周期表上开头是金属元素、靠近尾部的是非金属元素结尾的是稀有气体元素用不同的颜色做了分区。说明元素之间存在着一些规律性。
(2)按照原子序数由大到小地排列;
(3)电子层数相同的排在同一个横行(同周期)
(4)最外层电子数相同的排在同一个纵行(同一族)
新课讲解
元素周期表中元素所在表格信息
氢
原子序数
相对原子质量
元素符号
元素名称
H
1
1.008
新课讲解
物质的分类
交流讨论
请比较以下三组纯净物的元素组成,各有什么特点?
第一组:氢气(H2)、氧气(O2)、氮气(N2)、铁(Fe)、碳(C)
第二组:二氧化碳( C O2)、氯化钠(Na C l)、高锰酸钾(KMnO4)
第三组:二氧化碳( C O2)、氧化铁(Fe2O3)、水(H2O)
由同种元素组成的纯净物
由两种或两种以上的元素组成的纯净物
由两种元素组成,其中一种是氧元素的化合物
第一组的特点:
第二组的特点:
第三组的特点:
单质
化合物
氧化物
新课讲解
新课讲解
单质 化合物
概念 由同种元素组成的纯净物 由不同种元素组成的纯净物
区 别 宏观组成 由同种元素组成 由不同种元素组成
微观构成 单质分子:由同种元素的原子构成 化合物分子:由不同种元素的原子或离子构成
举例 氧气(O2))、氮气 (N2) 二氧化碳(CO2)、水(H2O)、氯化钠(NaCl)
联系 二者都是纯净物,都有固定组成; 单质在一定条件下发生化合反应可以生成化合物,某些化合物在一定条件下发生分解反应可以生成单质
物质分类小技巧
1.看化学式
(1)有化学式的为纯净物,无化学式的为混合物;
(2)化学式只含有一种元素的为单质,两种及以上为化合物;
单质:O2、O3、N2、H2、Fe、Cu;化合物:SO2、CO2、NaCl、CuSO4
2.看名称
(1)名称含有“化”,为化合物。如:二氧化锰、五氧化二磷、氯化钠、二氧化碳、二氧化硫。
(2)名称含有“酸”,为化合物。如:氯酸钾、硫酸铜、高锰酸钾。
(3)“氧化*”,为氧化物。如:氧化铁、氧化铜、二氧化碳、过氧化氢。
新课讲解
(1)从宏观角度辨别物质的类别时,一定要知道每一类物质的特点,如:混合物——“多物”,纯净物——“一物”,单质——“一物一(元)素”,化合物——“一物多(元)素”,氧化物——“一物两(元)素含一氧”。
(2)从微观角度来判断物质的类别时,首先根据构成物质的分子(或
原子)种类来判断纯净物、混合物。如果物质由分子构成,只含一种分子的是纯净物,含不同种分子的是混合物,然后根据纯净物分子的构成判断单质、化合物,纯净物的分子由同种原子构成的为单质,由不同种原子构成的为化合物。同理,若物质由原子构成,只含一种原子的为单质,含不同种原子的为混合物。
新课讲解
物质分类小技巧
1.由同种元素组成的物质_________都是单质。
氧气和臭氧
2.含有氧元素的化合物_________都是氧化物。
KMnO4、KClO3
不一定
不一定
石墨、金刚石
碳元素组成
O2
O3
新课讲解
由两种元素组成的化合物,其中有一种元素是氧,这样的化合物叫做氧化物
【氧化物】
由同种元素组成的物质一定是单质吗?
交流与 讨论
新课讲解
氧气和臭氧
二、自然界中元素的存在
自然界中有千千万万种物质,这些物质主要由哪些化学元素组成 这些元素是如何分布的
自然界中元素存在
新课讲解
1. 地壳是由沙、黏土、岩石等组成的,其中含量最多的是氧元素,其他元素含量从高到低依次是硅、铝、铁、钙等。
新课讲解
2. 海洋占地球表面的71%,海水中的元素含量分布如图所示。其中含量最多的是氧,其次是氢,这两种元素约占总量的96.5%。
新课讲解
3.水占人体体重的70%左右。组成人体的元素中含量最多的是氧,其次是碳、氢、氮。这三种元素在地壳中的含量很少,但却是生命的必需元素。
新课讲解
三、元素与人体健康
人体中化学元素含量的多少直接影响人体的健康。健康的生命所必需的元素称为生命必需元素,这些元素在人体中的功能不能由别的元素来替代。大量的研究表明,人体必需的元素有20多种,除图3-23所列含量较高的元素外.还有铁(Fe)、铜(Cu)、锰(Mn)、锌(Zn)钻(Co)、碘(I)、硒(Se)等微量元素。
人体中缺少某些元素,会影响健康,甚至引起疾病。例如:缺钙有可能导致骨骼疏松、畸形,易得佝偻病;缺锌会使儿童发育停滞,智力低下。严重时会得休儒症;缺钻、铁易得贫血症;缺碘和确过量均会导致甲状腺疾病。但某些元素过量,也会导致疾病。如钙吸收过多,容易引起白内障动脉硬化等;微量的硒可以防癌,过量的硒则是致癌的因素之一。
新课讲解
新课讲解
缺少钙元素
元素与人体健康
新课讲解
缺少锌元素
新课讲解
活动与探究
请从家中找出几种零食食品、药品和保健食品。
从包装袋或说明书上了解食品,药品和保健品食品
中主要含有哪些元素。
新课讲解
典例讲解
例1.(2022年甘肃省武威市中考)每年9月20日为”全国爱牙日”。为防治龋齿在牙膏中加入的元素是( )
A.铁 B.钙
C.锌 D.氟
【答案】D
典例讲解
例2.(2022年四川省泸州市中考)“化学观念”是从化学视角对物质世界的总体认识。下列有关说法错误的是( )
A.化学物质不可能再细分
B.化学物质由元素组成
C.化学物质的性质决定用途
D.化学变化伴随能量变化
【答案】A
例3.(2022年湖南省衡阳市中考)我国著名科学家、中国科学院院士张青莲教授主持测定了铟、铱、锑、铕等近十种元素的相对原子质量,为相对原子质量测定作出了卓越贡献。关于钢元素在元素周期表中的部分信息及原了结构示意图如图所示。下列说法正确的是( )
A.铟元素属于非金属元素 B.铟元素的相对原子质量是114.8g
C.铟原子的质子数为49 D.铟的原子结构示意图中X=18
【答案】C
典例讲解
1.地壳中的各元素含量如图所示,其中区域②代表的元素是( )
A.Fe
B.O
C.Si
D.Al
C
达标检测
达标检测
2.(2022山东临沂市九年级三模)氢元素(H)与汞元素(Hg)的本质区别是( )
A.质子数不同
B.元素符号不同
C.氢元素是非金属元素,汞元素是金属元素
D.相对原子质量不同
A
3.下列有关元素的说法中正确的是( )
A.元素是具有相同质子数的粒子的总称
B.元素的原子序数与该元素原子的核电荷数相同
C.由同种元素组成的物质一定是单质
D.在物质发生化学变化时,元素种类可能会变
B
达标检测
自然界中元素的存在
元素与人体健康
4.在表示气体微粒的示意图中, 和 是两种不同的原子,以下表示单质的是( )
A B C D
B
达标检测
自然界中元素的存在
元素与人体健康
① 空气
⑤ 石灰水
混合物
判断下列哪些属于单质,哪些属于化合物:
⑴铜 ⑵氮气 ⑶氧化镁 ⑷碳酸钙 ⑸氯酸钾
⑹水 ⑺二氧化硫 ⑻氢氧化钙 ⑼高锰酸钾 ⑽氯化钠
⑾水银 ⑿氧气 ⒀氢气 ⒁镁 ⒂金刚石。
单 质:
化合物:
氧化物:
(1)(2)(11)(12)(13)(14)(15)
(3)(4)(5)(6)(7)(8)(9)(10)
(3)(6)(7)
达标检测
组成物质的化学元素
元素周期表
概念
分类
元素符号书写
元素与人类健康
结构
规律
自然界中的元素
归纳小结
1.完成配套练习册;
2.预习第3节 组成物质的组成。
作业布置
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
九上化学同步精品课件
沪教版九年级上册
沪教版九上化学精品课件
3.2 组成物质的化学元素
绪言
第三章 物质构成的奥秘
(共2课时 )
学习目标
重点难点
1.认识一些常见元素,会书写它们的名称与符号;
2.知道元素符号的意义;了解元素周期表;
3.掌握有关单质、化合物及氧化物的概念;
4.了解化学元素与人体健康关系。
1.掌握单质和化合物的概念;
2.元素符号所表示的意义;
3.元素周期表的认识。
认识元素(附高清视频)
1
2
化学元素之歌(附高清视频)
3
目 录 Contents
有关元素的概念/书写/意义/分类
4
5
6
元素与原子的联系与区别/元素、原子、分子物质间的关系
元素与人体健康(附高清视频)
化学元素周期表简介
5
单质、化合物、氧化物/物质分类技巧
新课引入
认
识
元
素
不知道你是否意识到,我们每时每刻都在与化学元素打交道:比如你每天吃的钙片中钙元素;喝的水中含有氢元素、氧元素;今天就让我们一起学习一下关于这方面的知识吧!
锌
碘
想一想,以上的“钙”、“铁”、“锌”、“碘”指的是什么?
钙
铁
新课引入
关于元素,你还知道些什么?请你尝试将所知道的几种元素的情况填入下表中。
你熟悉的元素(名称) 含该元素的物质 该元素的作用
新课引入
钙
钙片
促进儿童骨骼生长
锌
葡萄糖酸锌口服液
促进食欲
铁
含铁酱油
治疗缺铁性贫血
碘
海产品/加碘盐
治疗甲状腺肿大
一、元素与元素符号
各种原子、离子、分子构成了数以千万计的物质。我们也知道世间万物都是由元素组成的。不管是氧分子中的氧原子,还是水分子中的氧原子,都是氧元素的原子;氢气、水、酒精中含有的氢原子都是氢元素的原子;二氧化碳、一氧 化碳、碳酸钙中含有的碳原子都是碳元素的原子。
新课讲解
氧 化 汞
HgO
汞原子和氧原子
水
H2O
氢原子和氧原子
CO2
二氧化碳
碳原子和氧原子
思考:上述分子在组成上有何相同点
氧 气
O2
氧原子
它们为什么属于同类原子
新课讲解
元 素
1、元素是
具有相同质子数
(即核电荷数)
的一类原子的
总称
质子数 中子数
碳原子A 6 6
碳原子B 6 7
碳原子C 6 8
碳-12
碳-14
碳-13
质子数 中子数
氢原子A氕 1 0
氢原子B氘 1 1
氢原子C氚 1 2
质子
中子
氕
氚
氘
决定元素种类
(与中子数无关)
质子数=1
同一类(氢)原子
氢元素
质子数=6
同一类(碳)原子
碳元素
新课讲解
元 素
新课讲解
(1)具有相同质子数的微粒不一定是同种元素,微粒可能是分子、原子或离子。如水分子(H2O)和氖原子(Ne)都有10个质子,但不属于同种元素。
(2)这里所说的一类原子是指质子数相同、但中子数不一定相同的原子,也就是说同种元素的原子可以是质子数相同,但中子数不同的不同种原子。如
126C、 136C、 146C都是碳原子;质子数相同的原子与对应的单核离子,如钠原子和钠离子都属于钠元素。
(3)元素是一个宏观概念,只讲种类不讲个数。
(4)物质发生化学变化时,分子的种类发生变化,原子的种类不变,元素的种类也不会改变。
归 纳 小 结
元 素
物质都是由元素组成的
氧气(O2)是由 组成的;
水(H2O)是由 和 组成的;
碳酸钙(CaCO3)是由 、 和 组成的。
氧元素
氢元素
氧元素
钙元素
碳元素
氧元素
镁元素:Na、Na+
铁元素:Fe、Fe2+、Fe3+
【易错提醒】
原子通过得失电子变为离子,其质子数不变
新课讲解
元 素
新课讲解
表3-3 部分元素的中文、拉丁文、英文名称和符号
中文名称 拉丁文 英文 元素符号
氢 Hydrogenium Hydrogen H
氧 Oxygenium Oxygen 0
碳 Carbonium Carbon C
氮 Nitrogenium Nitrogen N
铁 Ferrum Iron Fe
铜 Cuprum Copper Cu
表3-4 常见元素的名称、符号和相对原子质量
名称 符号 相对原子质量 名称 符号 相对原子质量
氢 H 1 钾 K 39
碳 C 12 钙 Ca 40
氮 N 14 锰 Mn 55
氧 0 16 铁 Fe 56
钠 Na 23 铜 Cu 64
镁 Mg 24 锌 Zn 65
铝 A1 27 银 Ag 108
硅 Si 28 锡 Sn 119
磷 P 31 碘 I 127
硫 S 32 钡 Ba 137
氯 C1 35.5 金 Au 197
新课讲解
(1)元素符号的书写
2、元素符合
(1)由首字母表示元素符号(大写)。
(2)若首字母相同,则第一个字母(大写),附加第二个字母(小写)
国际上统一采用元素拉丁文名称
O C H N S
氧 碳 氢 氮 硫
Fe Cu Al Mg Hg
铁 铜 铝 镁 汞
书写规则“一大二小”。
即第一个字母大写,第二个字母小写。
小结
新课讲解
(2)元素符号的意义
①表示一种元素
②表示该元素的一个原子
③由原子直接构成的物质,元素符号还表示一种物质
H
表示氢元素
表示一个氢原子
③一个铁原子
①铁元素
Cu
②铁这种物质
宏观
微观
指出下列元素符号所表示的意义
强调:在元素符号前面加上任何一个数字,只表示微观意义,即原子个数。
新课讲解
数字意义
元素理解
元素符号
符号意义
元素周期表
B
符号右上角数字表示一个离子所带的电荷数
C
符号右下角数字表示一个分子中原子的个数
A
符号前面数字表示微粒的个数
新课讲解
自我检查
2、用符号和数字表达含义
5个氧原子: 2个铜原子:
氮元素 : 3个磷原子:
O :
2H:
Na:
2Mg:
nS:
1、说说下列符号的意义
5O
2Cu
N
3P
氧元素或一个氧原子
2个氢原子
钠元素或一个钠原子
2个镁原子
n个硫原子
新课讲解
3.元素的分类
稀有气体元素:
钠(Na)、铁(Fe)、镁(Mg)、铝(Al)、……
金属元素:
“钅”字旁(汞除外,俗称“水银”)
非金属元素:
氢(H)、碳(C)、氧(O)、磷(P)、氯(Cl)……
①(“石”字旁)固态
②(“氵”字旁)液态
③(“气”字头)气态
碳、磷、硫、硅等
溴
氢、氧、氮、氟、氯等
氦(He)、氖(Ne)、氩(Ar)、氪(Kr)、氙(Xe)、氡(Rn)
新课讲解
2.元素、原子的联系与区别
联系
原子
元素
区
别
元素是同一类原子的总称,原子是构成元素的
基本单元,是个体与集体的关系
描述微观粒子的构成
描述宏观物质的组成
既讲种类,又讲个数
只讲种类,不讲个数
概念
化学变化中的最小粒子
质子数(即核电荷数)相同的一类原子的总称
新课讲解
3、物质、元素、分子、原子间的关系
原子
分子
元素
物质
宏观
微观
总称
构成
组成
构成
构成
新课讲解
化学元素之歌
新课讲解
三、元素周期表简介
1869年2月,俄国化学家门捷列夫编制了他的第一张元素周期表,表中除收入了当时已知的63种元素外,还给尚未发现的元素留下了27个空位,并大胆地预言了11种未知的新元素和它们在元素周期表的位置,同时根据它们的性质取了名字,如类铝、类硼、类硅等,后来都得到了验证。
新课讲解
仔细观察元素周期表,你能发现什么规律?
新课讲解
归纳小结
1、元素周期表共有7个横行,18个纵行。每一个横行叫做一个
周期(共7个周期),每一个纵行叫做一个族(8,9,10三个
纵行共同组成一个族)(共16个族)。
2、为了便于查找,元素周期表按元素原子核电荷数递增的顺序
给元素编了序号,叫做原子序数,原子序数与元素原子核电荷数
在数值上相同。 质子数=核外电子数=核电荷数=原子序数
新课讲解
3、排列规律:
(1)元素周期表上开头是金属元素、靠近尾部的是非金属元素结尾的是稀有气体元素用不同的颜色做了分区。说明元素之间存在着一些规律性。
(2)按照原子序数由大到小地排列;
(3)电子层数相同的排在同一个横行(同周期)
(4)最外层电子数相同的排在同一个纵行(同一族)
新课讲解
元素周期表中元素所在表格信息
氢
原子序数
相对原子质量
元素符号
元素名称
H
1
1.008
新课讲解
物质的分类
交流讨论
请比较以下三组纯净物的元素组成,各有什么特点?
第一组:氢气(H2)、氧气(O2)、氮气(N2)、铁(Fe)、碳(C)
第二组:二氧化碳( C O2)、氯化钠(Na C l)、高锰酸钾(KMnO4)
第三组:二氧化碳( C O2)、氧化铁(Fe2O3)、水(H2O)
由同种元素组成的纯净物
由两种或两种以上的元素组成的纯净物
由两种元素组成,其中一种是氧元素的化合物
第一组的特点:
第二组的特点:
第三组的特点:
单质
化合物
氧化物
新课讲解
新课讲解
单质 化合物
概念 由同种元素组成的纯净物 由不同种元素组成的纯净物
区 别 宏观组成 由同种元素组成 由不同种元素组成
微观构成 单质分子:由同种元素的原子构成 化合物分子:由不同种元素的原子或离子构成
举例 氧气(O2))、氮气 (N2) 二氧化碳(CO2)、水(H2O)、氯化钠(NaCl)
联系 二者都是纯净物,都有固定组成; 单质在一定条件下发生化合反应可以生成化合物,某些化合物在一定条件下发生分解反应可以生成单质
物质分类小技巧
1.看化学式
(1)有化学式的为纯净物,无化学式的为混合物;
(2)化学式只含有一种元素的为单质,两种及以上为化合物;
单质:O2、O3、N2、H2、Fe、Cu;化合物:SO2、CO2、NaCl、CuSO4
2.看名称
(1)名称含有“化”,为化合物。如:二氧化锰、五氧化二磷、氯化钠、二氧化碳、二氧化硫。
(2)名称含有“酸”,为化合物。如:氯酸钾、硫酸铜、高锰酸钾。
(3)“氧化*”,为氧化物。如:氧化铁、氧化铜、二氧化碳、过氧化氢。
新课讲解
(1)从宏观角度辨别物质的类别时,一定要知道每一类物质的特点,如:混合物——“多物”,纯净物——“一物”,单质——“一物一(元)素”,化合物——“一物多(元)素”,氧化物——“一物两(元)素含一氧”。
(2)从微观角度来判断物质的类别时,首先根据构成物质的分子(或
原子)种类来判断纯净物、混合物。如果物质由分子构成,只含一种分子的是纯净物,含不同种分子的是混合物,然后根据纯净物分子的构成判断单质、化合物,纯净物的分子由同种原子构成的为单质,由不同种原子构成的为化合物。同理,若物质由原子构成,只含一种原子的为单质,含不同种原子的为混合物。
新课讲解
物质分类小技巧
1.由同种元素组成的物质_________都是单质。
氧气和臭氧
2.含有氧元素的化合物_________都是氧化物。
KMnO4、KClO3
不一定
不一定
石墨、金刚石
碳元素组成
O2
O3
新课讲解
由两种元素组成的化合物,其中有一种元素是氧,这样的化合物叫做氧化物
【氧化物】
由同种元素组成的物质一定是单质吗?
交流与 讨论
新课讲解
氧气和臭氧
二、自然界中元素的存在
自然界中有千千万万种物质,这些物质主要由哪些化学元素组成 这些元素是如何分布的
自然界中元素存在
新课讲解
1. 地壳是由沙、黏土、岩石等组成的,其中含量最多的是氧元素,其他元素含量从高到低依次是硅、铝、铁、钙等。
新课讲解
2. 海洋占地球表面的71%,海水中的元素含量分布如图所示。其中含量最多的是氧,其次是氢,这两种元素约占总量的96.5%。
新课讲解
3.水占人体体重的70%左右。组成人体的元素中含量最多的是氧,其次是碳、氢、氮。这三种元素在地壳中的含量很少,但却是生命的必需元素。
新课讲解
三、元素与人体健康
人体中化学元素含量的多少直接影响人体的健康。健康的生命所必需的元素称为生命必需元素,这些元素在人体中的功能不能由别的元素来替代。大量的研究表明,人体必需的元素有20多种,除图3-23所列含量较高的元素外.还有铁(Fe)、铜(Cu)、锰(Mn)、锌(Zn)钻(Co)、碘(I)、硒(Se)等微量元素。
人体中缺少某些元素,会影响健康,甚至引起疾病。例如:缺钙有可能导致骨骼疏松、畸形,易得佝偻病;缺锌会使儿童发育停滞,智力低下。严重时会得休儒症;缺钻、铁易得贫血症;缺碘和确过量均会导致甲状腺疾病。但某些元素过量,也会导致疾病。如钙吸收过多,容易引起白内障动脉硬化等;微量的硒可以防癌,过量的硒则是致癌的因素之一。
新课讲解
新课讲解
缺少钙元素
元素与人体健康
新课讲解
缺少锌元素
新课讲解
活动与探究
请从家中找出几种零食食品、药品和保健食品。
从包装袋或说明书上了解食品,药品和保健品食品
中主要含有哪些元素。
新课讲解
典例讲解
例1.(2022年甘肃省武威市中考)每年9月20日为”全国爱牙日”。为防治龋齿在牙膏中加入的元素是( )
A.铁 B.钙
C.锌 D.氟
【答案】D
典例讲解
例2.(2022年四川省泸州市中考)“化学观念”是从化学视角对物质世界的总体认识。下列有关说法错误的是( )
A.化学物质不可能再细分
B.化学物质由元素组成
C.化学物质的性质决定用途
D.化学变化伴随能量变化
【答案】A
例3.(2022年湖南省衡阳市中考)我国著名科学家、中国科学院院士张青莲教授主持测定了铟、铱、锑、铕等近十种元素的相对原子质量,为相对原子质量测定作出了卓越贡献。关于钢元素在元素周期表中的部分信息及原了结构示意图如图所示。下列说法正确的是( )
A.铟元素属于非金属元素 B.铟元素的相对原子质量是114.8g
C.铟原子的质子数为49 D.铟的原子结构示意图中X=18
【答案】C
典例讲解
1.地壳中的各元素含量如图所示,其中区域②代表的元素是( )
A.Fe
B.O
C.Si
D.Al
C
达标检测
达标检测
2.(2022山东临沂市九年级三模)氢元素(H)与汞元素(Hg)的本质区别是( )
A.质子数不同
B.元素符号不同
C.氢元素是非金属元素,汞元素是金属元素
D.相对原子质量不同
A
3.下列有关元素的说法中正确的是( )
A.元素是具有相同质子数的粒子的总称
B.元素的原子序数与该元素原子的核电荷数相同
C.由同种元素组成的物质一定是单质
D.在物质发生化学变化时,元素种类可能会变
B
达标检测
自然界中元素的存在
元素与人体健康
4.在表示气体微粒的示意图中, 和 是两种不同的原子,以下表示单质的是( )
A B C D
B
达标检测
自然界中元素的存在
元素与人体健康
① 空气
⑤ 石灰水
混合物
判断下列哪些属于单质,哪些属于化合物:
⑴铜 ⑵氮气 ⑶氧化镁 ⑷碳酸钙 ⑸氯酸钾
⑹水 ⑺二氧化硫 ⑻氢氧化钙 ⑼高锰酸钾 ⑽氯化钠
⑾水银 ⑿氧气 ⒀氢气 ⒁镁 ⒂金刚石。
单 质:
化合物:
氧化物:
(1)(2)(11)(12)(13)(14)(15)
(3)(4)(5)(6)(7)(8)(9)(10)
(3)(6)(7)
达标检测
组成物质的化学元素
元素周期表
概念
分类
元素符号书写
元素与人类健康
结构
规律
自然界中的元素
归纳小结
1.完成配套练习册;
2.预习第3节 组成物质的组成。
作业布置
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
