3.1 构成物质的基本微粒 (第4课时)【2022-2023沪教版九上化学精优课件含视频】(课件41页)
文档属性
| 名称 | 3.1 构成物质的基本微粒 (第4课时)【2022-2023沪教版九上化学精优课件含视频】(课件41页) |

|
|
| 格式 | pptx | ||
| 文件大小 | 137.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-29 14:19:34 | ||
图片预览










文档简介
(共41张PPT)
九上化学同步精品课件
沪教版九年级上册
沪教版九上化学精品课件
3.1 构成物质的基本微粒
绪言
第三章 物质构成的奥秘
(第4课时 核外电子排布及离子)
学习目标
重点、难点
1.离子与原子的区别。
2.离子形成的过程。
1.能说出原子核外电子分层排布的规律,学会原子结构的表示方法。
2.能说出离子的形成过程,知道离子也是构成物质的一种粒子。
3.了解典型元素(稀有气体、金属和非金属)原子核外电子排布的规律。
1
2
核外电子的排布规律(附高清视频)
3
4
原子结构示意图(附高清视频)
目 录 Contents
原子与离子的区别和联系
物质是由分子、原子、离子构成的
5
核外电子运动规律(附高清视频)
电子层
原子核
原子并不是一个实心的球体,原子核位于原子的中心,体积很小,原子核外有很大的空间,电子围绕原子核在这个空间里作高速运动。
新课引入
新课引入
核外电子的运动规律
1. 电子层的定义与命名
(1)核外电子的运动有自己的特点,它没有固定的轨道,但有经常出现的区域,我们称之为电子层。
(2)离核_______的电子层为第一层,次之为第二层,依次类推为三、四、五、六、七层,离核最远的也叫_________。(电子层由内到外分别用K,L,M,N,O,P,Q表示)
最近
最外层
电子层
原子核
新课讲解
核外电子的分层排布
新课引入
核外电子的分层排布规律
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
+
+
+
+
+
原子核
第一层
第二层
第三层
2. 核外电子的能量规律
电子层数 一、二、三、四、五、六、七
离核远近
能量高低
近 远
低 高
氯 原 子
核外电子的分层排布
新课讲解
3. 核外电子的排布规律(先近后远)
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
+
+
+
+
+
原子核
第一层
第二层
第三层
氯 原 子
新课讲解
第一层最多容纳2个电子,
第二层最多容纳8个电子,
最外层最多容纳8个电子,
若只有一个电子层,则不超过2个。
核外电子的分层排布
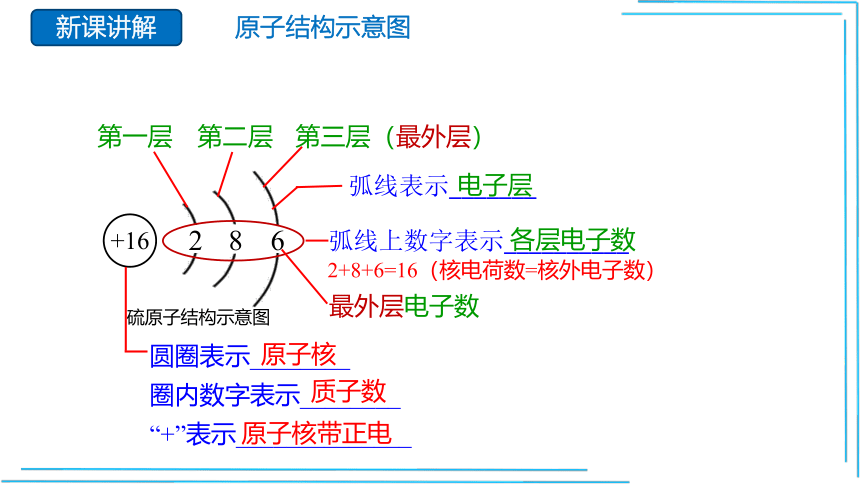
+16
2
8
6
弧线表示_______
2+8+6=16(核电荷数=核外电子数)
圆圈表示________
圈内数字表示________
“+”表示______________
弧线上数字表示__________
第一层
第二层
第三层(最外层)
电子层
各层电子数
最外层电子数
原子核
质子数
原子核带正电
硫原子结构示意图
原子结构示意图
新课讲解
1.用圆圈表示原子核
2.在圆圈内用正数表示质子数
3.用弧线表示电子层
4.在弧线上的数字表示该电子层上的电子数
+2
2
氦(He)
原子结构示意图
新课讲解
归纳小结
部分原子的原子结构示意图
新课讲解
原子的最外层电子数与其化学性质的关系
原子的分类 最外层电子数 得失电子趋势 化学性质 举例
稀有气体 原子 相对稳定结构,不易得失电子 稳定 氦、氖、氩等
金属原子 在化学反应中,易________电子 不稳定 钠、镁、铝等
非金属原子 在化学反应中,易________电子 不稳定 氧、氟、氯等
【小结归纳】
(1)原子在化学反应中得失电子的原因是原子趋于达到 ____ ____的结构。
(2)原子的化学性质取决于________________________。
8个(氦为2个)
一般少于4个
一般多于4个
失去
得到
相对稳定
原子的最外层电子数
新课讲解
新课讲解
钠与氯气反应生成氯化钠的过程
钠原子容易失去最外层一个电子,氯原子容易得到一个电子。
那么,如果一个钠原子和一个氯原子相遇,会发生什么呢?
+11
2 8 1
+17
7 8 2
钠 Na
氯 Cl
e-
+11
2 8
钠离子 Na+
+17
8 8 2
氯离子 Cl-
Na+
Cl-
钠原子的最外层有1个电子,氯原子的最外层有7个电子,当钠与氯气反应时,钠原子最外层的 1 个电子转移到氯原子的最外层上,这样两者都形成相对稳定的结构
钠原子因失去 1 个电子而带上 1 个单位的正电荷
氯原子因得到 1 个电子而带上 1 个单位的负电荷
带相反电荷的Na+ 与Cl- 相互作用就形成了NaCl(氯化钠)
新课讲解
钠与氯气反应生成氯化钠的过程
新课讲解
离 子
(1)阳离子:带正电的原子(或原子团),如Na+、NH4+计等。
(2)阴离子:带负电的原子(或原子团),如CI-、OH-等。
1.离子的概念
在化学反应中,金属原子失去最外层电子,非金属原子得到电子,从
而使参加反应的原子带上电荷。带电的原子(或原子团)叫做离子。
离子也是构成物质的一种基本粒子。
2.离子的分类
新课讲解
(1)金属原子的最外层电子数一般少于4,在化学反应里易失去电子,使得质子数大于核外电子数,所以带正电荷(电荷数=最外层电子数),形成阳离子,电子层数减少1层。
(2)非金属原子的最外层电子数一般多于4,在化学反应里易得到电子,使得质子数小于核外电子数,所以带负电荷(电荷数=8-最外层电子数),形成阴离子,电子层数不变。
3.离子的形成
新课讲解
4.离子符号的含义
表示方法:在元素符号(或原子团)的右上角标明离子所带的电荷,数字在前,正、负号在后。当离子带1个单位的正电荷或1个单位的负电荷时,“1”省略不写。如阳离子Na+、Mg2+、Al3+等;阴离子Cl-、SO42-等。
说出下列数字“2”的含义:
(1)2H (2)O2 (3)S2- (4)Mg2+
(1)2个氢原子
(2)1个氧分子是由2个氧原子构成的
(3)1个硫离子带2个单位负电荷
(4)1个镁离子带2个单位正电荷
如:Na+ (钠离子) 、 Mg2+ (镁离子) 、 Cl- (氯离子) 、 O2- (氧离子)
在元素符号的右上角标出所带的电荷数,数值在前,符号在后,1可以省略不写。
离子结构示意图
8
2
+11
8
+17
8
2
钠离子:
氯离子:
离子符号
Cl-
Na+
离子表示的意义
2Mg
表示2个镁离子
2+
表示每个镁离子带2个单位的正电荷
新课讲解
5.离子的表示方法
原子团是由两种或两种以上元素的原子,按照一定的个数比组成的原子集团,是纯净物的一部分,不是独立的物质。这样的原子集团在很多反应中作为一个整体参加反应,就像一个原子一样。原子团常命名为“某某根”。
常见的原子团离子有硫酸根离子(SO42-)、碳酸根离子(CO32-)、硝酸根离子(NO3-)、氢氧根离子(OH-)、铵根离子(NH4+)等。
新课讲解
拓展延伸
新课讲解
除分子、原子外,离子也是构成物质的一种基本粒子,如氯化钠就是由钠离子(Na+)和氯离子(CI-)构成的。离子和分子、原子一样,也具有微观粒子的基本性质。
(1)由分子构成的物质,分子保持其化学性质。如保持水的化学性质的粒子是水分子。
(2)由原子直接构成的物质,原子保持其化学性质。如金属、稀有气体的单质、金刚石等由原子直接构成,保持其化学性质的是构成它们的原子。
(3)由离子构成的物质,阴、阳离子保持其化学性质。如保持氯化钠化学性质的粒子是钠离子和氯离子。
构成物质的微粒性质
粒子种类 原子 离子 阳离子 阴离子
区 别 粒子结构
化学性质
电 性
符 号
联 系 核内质子=
核外电子数
核内电子数>
核外电数
核内电子数<
核外电子数
不一定稳定
较稳定
较稳定
不显电性
带正电
带负电
用元素符号表示:
如:S、Na……
用阳离子符号表示:
如:Na+Mg2+……
用阴离子符号表示:
如:Cl-、O2-……
原子
阳离子
失电子
得电子
失电子
得电子
阴离子
原子与离子的区别和联系
新课讲解
物质是由分子、原子、离子构成的
分子
原子
离子
构成
物
质
金属、“石”旁、稀有气体
例:铁是由________构成的
氯化钠、硫酸铜
氯化钠(NaCl)是____和____构成的
硫酸铜(CuSO4)是由____和 构成的
水和气体(稀气除外)
例:水是由________构成的
水分子
铁原子
Cu2+
SO42-
Na+
Cl-
构
成
分
为
得失电子
新课讲解
1、原子结构示意图
弧线表示________
硫原子结构示意图
圆圈表示________
圈内数字表示________
“+”表示_______________
弧线上数字表示__________
第一层
第二层
第三层(最外层)
电子层
数字6还可以表示____________
各层电子数
最外层电子数
原子核
质子数
原子核带正电
2、离子:_______的原子。带正电的是___离子,带负电的是____离子。
2Mg2+
2个镁离子
一个镁离子带两个单位的正电荷
带电
阳
阴
3.硫酸铜(CuSO4)是由____和 构成的
1.离子符号的意义
2.氯化钠(NaCl)是由__________和___________构成的(化学符号)。
Na+
Cl-
Cu2+
SO42-
归纳小结
典例精讲
例1.(2022年云南省昆明市中考)如图是某粒子结构示意图,下列有关该粒子的说法错误的是( )
A.最外层有8个电子 B.该粒子是阴离子
C.核外有3个电子层 D.核电荷数为18
典例精讲
【答案】B
【解析】A、根据原子结构示意图可知,该粒子最外层有8个电子,A 正确;B、根据原子结构示意图可知,核内质子数为18,核外电子数为2+8+8=18,即质子数=电子数,属于原子,B 错误;C、根据原子结构示意图可知,该粒子核外有3个电子层,C 正确;D、根据原子结构示意图可知,核电荷数为18,D正确。故选B。
典例精讲
例2.(2022广东广州中考)铷(Rb)原子钟被称作北斗卫星的“心脏”、下图为铷原子的结构示意图,下列说法不正确的是( )
A. 铷原子核内的质子数为37 B. 铷原子 化学变化中容易失去1个电子
C. 铷原子的核外电子分5层排布 D. 氯化铷的化学式为RbCl2
典例精讲
【答案】D
【解析】A、根据结构示意图可知,铷原子的核电荷数为37,核电荷数=核内的质子数,铷原子核内的质子数为37,故选项说法正确;B、根据结构示意图可知,铷原子的最外层电子数是1,在化学变化中容易失去1个电子,故选项说法正确;C、根据结构示意图可知,铷原子的核外有5个电子层,故选项说法正确;
D、在化学变化中铷原子容易失去1个电子形成带一个单位正电荷的铷离子,其化合价为+1价,氯化铷的化学式为RbCl,故选项说法错误。故选:D。
典例精讲
例3.(2022湖北潜江等中考)如图是三种微粒的结构示意图,下列说法正确的是( )
A. ①和②化学性质相似 B. 它们表示三种元素
C. 表示稳定结构的是②和③ D. 表示阳离子的是②
典例精讲
【答案】C
【解析】A、决定元素化学性质的原子结构为最外层电子,最外层电子数相同,化学性质相似,②与③的化学性质相似,不符合题意;B、质子数(核电荷数)相同的一类原子归为一种元素,①②为一种元素,不符合题意;C、稳定结构即最外层电子数达到8个电子(第一层 2个电子),②与③为稳定结构,符合题意;D、阳离子指的是与原子失去电子得到的带正电的离子,②为O2-,是阴离子,不符合题意;故选C。
C
2.如图是五种微粒的结构示意图,下列说法不正确的是( )
A.上述五种微粒只涉及四种元素
B.②③⑤表示的微粒性质较稳定
C.①②④属于原子,③⑤属于阴离子
D.①④对应元素组成化合物的化学式为NaF
-
达标检测
3.(2022崇州市崇庆中学实验学校一模) 下列对分子、原子、离子的认识正确的是( )
A.同种分子排列方式不同,化学性质不同
B.在干冰中,分子因相互作用而静止不动
C.同种原子按不同方式结合,可以构成不同的物质
D.原子得失电子形成离子后,原子核发生了变化
C
达标检测
4.(2022金堂县福兴镇初级中学二模)在下列示意图表示的粒子中,属于原
子的有 (填序号,下同),属于阳离子的有 ,属于阴离子的
有 ,属于同种元素的为 。
②⑤⑥
①④
③
④⑤
达标检测
5.(2021山东杜郎口中学二模)如图,A、B、C是三种粒子的结构示意图。
请回答下列问题:
(1)在A、B、C三种粒子中属于阳离子的是 ,属于阴离子的是 ,
属于原子的是 。
(2)用化学符号表示:A ,C 。
(3)A、B、C三种粒子中,不具备稳定结构的是 (填序号)。
A
C
B
Mg2+
Cl-
B
达标检测
通过本节课的学习,同学们谈谈有哪些收获?
归纳小结
1.完成配套练习册;
2.预习第2节 组成物质的化学元素;
3.书面作业:课后习题2、3。
达标检测
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
九上化学同步精品课件
沪教版九年级上册
沪教版九上化学精品课件
3.1 构成物质的基本微粒
绪言
第三章 物质构成的奥秘
(第4课时 核外电子排布及离子)
学习目标
重点、难点
1.离子与原子的区别。
2.离子形成的过程。
1.能说出原子核外电子分层排布的规律,学会原子结构的表示方法。
2.能说出离子的形成过程,知道离子也是构成物质的一种粒子。
3.了解典型元素(稀有气体、金属和非金属)原子核外电子排布的规律。
1
2
核外电子的排布规律(附高清视频)
3
4
原子结构示意图(附高清视频)
目 录 Contents
原子与离子的区别和联系
物质是由分子、原子、离子构成的
5
核外电子运动规律(附高清视频)
电子层
原子核
原子并不是一个实心的球体,原子核位于原子的中心,体积很小,原子核外有很大的空间,电子围绕原子核在这个空间里作高速运动。
新课引入
新课引入
核外电子的运动规律
1. 电子层的定义与命名
(1)核外电子的运动有自己的特点,它没有固定的轨道,但有经常出现的区域,我们称之为电子层。
(2)离核_______的电子层为第一层,次之为第二层,依次类推为三、四、五、六、七层,离核最远的也叫_________。(电子层由内到外分别用K,L,M,N,O,P,Q表示)
最近
最外层
电子层
原子核
新课讲解
核外电子的分层排布
新课引入
核外电子的分层排布规律
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
+
+
+
+
+
原子核
第一层
第二层
第三层
2. 核外电子的能量规律
电子层数 一、二、三、四、五、六、七
离核远近
能量高低
近 远
低 高
氯 原 子
核外电子的分层排布
新课讲解
3. 核外电子的排布规律(先近后远)
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
﹣
+
+
+
+
+
原子核
第一层
第二层
第三层
氯 原 子
新课讲解
第一层最多容纳2个电子,
第二层最多容纳8个电子,
最外层最多容纳8个电子,
若只有一个电子层,则不超过2个。
核外电子的分层排布
+16
2
8
6
弧线表示_______
2+8+6=16(核电荷数=核外电子数)
圆圈表示________
圈内数字表示________
“+”表示______________
弧线上数字表示__________
第一层
第二层
第三层(最外层)
电子层
各层电子数
最外层电子数
原子核
质子数
原子核带正电
硫原子结构示意图
原子结构示意图
新课讲解
1.用圆圈表示原子核
2.在圆圈内用正数表示质子数
3.用弧线表示电子层
4.在弧线上的数字表示该电子层上的电子数
+2
2
氦(He)
原子结构示意图
新课讲解
归纳小结
部分原子的原子结构示意图
新课讲解
原子的最外层电子数与其化学性质的关系
原子的分类 最外层电子数 得失电子趋势 化学性质 举例
稀有气体 原子 相对稳定结构,不易得失电子 稳定 氦、氖、氩等
金属原子 在化学反应中,易________电子 不稳定 钠、镁、铝等
非金属原子 在化学反应中,易________电子 不稳定 氧、氟、氯等
【小结归纳】
(1)原子在化学反应中得失电子的原因是原子趋于达到 ____ ____的结构。
(2)原子的化学性质取决于________________________。
8个(氦为2个)
一般少于4个
一般多于4个
失去
得到
相对稳定
原子的最外层电子数
新课讲解
新课讲解
钠与氯气反应生成氯化钠的过程
钠原子容易失去最外层一个电子,氯原子容易得到一个电子。
那么,如果一个钠原子和一个氯原子相遇,会发生什么呢?
+11
2 8 1
+17
7 8 2
钠 Na
氯 Cl
e-
+11
2 8
钠离子 Na+
+17
8 8 2
氯离子 Cl-
Na+
Cl-
钠原子的最外层有1个电子,氯原子的最外层有7个电子,当钠与氯气反应时,钠原子最外层的 1 个电子转移到氯原子的最外层上,这样两者都形成相对稳定的结构
钠原子因失去 1 个电子而带上 1 个单位的正电荷
氯原子因得到 1 个电子而带上 1 个单位的负电荷
带相反电荷的Na+ 与Cl- 相互作用就形成了NaCl(氯化钠)
新课讲解
钠与氯气反应生成氯化钠的过程
新课讲解
离 子
(1)阳离子:带正电的原子(或原子团),如Na+、NH4+计等。
(2)阴离子:带负电的原子(或原子团),如CI-、OH-等。
1.离子的概念
在化学反应中,金属原子失去最外层电子,非金属原子得到电子,从
而使参加反应的原子带上电荷。带电的原子(或原子团)叫做离子。
离子也是构成物质的一种基本粒子。
2.离子的分类
新课讲解
(1)金属原子的最外层电子数一般少于4,在化学反应里易失去电子,使得质子数大于核外电子数,所以带正电荷(电荷数=最外层电子数),形成阳离子,电子层数减少1层。
(2)非金属原子的最外层电子数一般多于4,在化学反应里易得到电子,使得质子数小于核外电子数,所以带负电荷(电荷数=8-最外层电子数),形成阴离子,电子层数不变。
3.离子的形成
新课讲解
4.离子符号的含义
表示方法:在元素符号(或原子团)的右上角标明离子所带的电荷,数字在前,正、负号在后。当离子带1个单位的正电荷或1个单位的负电荷时,“1”省略不写。如阳离子Na+、Mg2+、Al3+等;阴离子Cl-、SO42-等。
说出下列数字“2”的含义:
(1)2H (2)O2 (3)S2- (4)Mg2+
(1)2个氢原子
(2)1个氧分子是由2个氧原子构成的
(3)1个硫离子带2个单位负电荷
(4)1个镁离子带2个单位正电荷
如:Na+ (钠离子) 、 Mg2+ (镁离子) 、 Cl- (氯离子) 、 O2- (氧离子)
在元素符号的右上角标出所带的电荷数,数值在前,符号在后,1可以省略不写。
离子结构示意图
8
2
+11
8
+17
8
2
钠离子:
氯离子:
离子符号
Cl-
Na+
离子表示的意义
2Mg
表示2个镁离子
2+
表示每个镁离子带2个单位的正电荷
新课讲解
5.离子的表示方法
原子团是由两种或两种以上元素的原子,按照一定的个数比组成的原子集团,是纯净物的一部分,不是独立的物质。这样的原子集团在很多反应中作为一个整体参加反应,就像一个原子一样。原子团常命名为“某某根”。
常见的原子团离子有硫酸根离子(SO42-)、碳酸根离子(CO32-)、硝酸根离子(NO3-)、氢氧根离子(OH-)、铵根离子(NH4+)等。
新课讲解
拓展延伸
新课讲解
除分子、原子外,离子也是构成物质的一种基本粒子,如氯化钠就是由钠离子(Na+)和氯离子(CI-)构成的。离子和分子、原子一样,也具有微观粒子的基本性质。
(1)由分子构成的物质,分子保持其化学性质。如保持水的化学性质的粒子是水分子。
(2)由原子直接构成的物质,原子保持其化学性质。如金属、稀有气体的单质、金刚石等由原子直接构成,保持其化学性质的是构成它们的原子。
(3)由离子构成的物质,阴、阳离子保持其化学性质。如保持氯化钠化学性质的粒子是钠离子和氯离子。
构成物质的微粒性质
粒子种类 原子 离子 阳离子 阴离子
区 别 粒子结构
化学性质
电 性
符 号
联 系 核内质子=
核外电子数
核内电子数>
核外电数
核内电子数<
核外电子数
不一定稳定
较稳定
较稳定
不显电性
带正电
带负电
用元素符号表示:
如:S、Na……
用阳离子符号表示:
如:Na+Mg2+……
用阴离子符号表示:
如:Cl-、O2-……
原子
阳离子
失电子
得电子
失电子
得电子
阴离子
原子与离子的区别和联系
新课讲解
物质是由分子、原子、离子构成的
分子
原子
离子
构成
物
质
金属、“石”旁、稀有气体
例:铁是由________构成的
氯化钠、硫酸铜
氯化钠(NaCl)是____和____构成的
硫酸铜(CuSO4)是由____和 构成的
水和气体(稀气除外)
例:水是由________构成的
水分子
铁原子
Cu2+
SO42-
Na+
Cl-
构
成
分
为
得失电子
新课讲解
1、原子结构示意图
弧线表示________
硫原子结构示意图
圆圈表示________
圈内数字表示________
“+”表示_______________
弧线上数字表示__________
第一层
第二层
第三层(最外层)
电子层
数字6还可以表示____________
各层电子数
最外层电子数
原子核
质子数
原子核带正电
2、离子:_______的原子。带正电的是___离子,带负电的是____离子。
2Mg2+
2个镁离子
一个镁离子带两个单位的正电荷
带电
阳
阴
3.硫酸铜(CuSO4)是由____和 构成的
1.离子符号的意义
2.氯化钠(NaCl)是由__________和___________构成的(化学符号)。
Na+
Cl-
Cu2+
SO42-
归纳小结
典例精讲
例1.(2022年云南省昆明市中考)如图是某粒子结构示意图,下列有关该粒子的说法错误的是( )
A.最外层有8个电子 B.该粒子是阴离子
C.核外有3个电子层 D.核电荷数为18
典例精讲
【答案】B
【解析】A、根据原子结构示意图可知,该粒子最外层有8个电子,A 正确;B、根据原子结构示意图可知,核内质子数为18,核外电子数为2+8+8=18,即质子数=电子数,属于原子,B 错误;C、根据原子结构示意图可知,该粒子核外有3个电子层,C 正确;D、根据原子结构示意图可知,核电荷数为18,D正确。故选B。
典例精讲
例2.(2022广东广州中考)铷(Rb)原子钟被称作北斗卫星的“心脏”、下图为铷原子的结构示意图,下列说法不正确的是( )
A. 铷原子核内的质子数为37 B. 铷原子 化学变化中容易失去1个电子
C. 铷原子的核外电子分5层排布 D. 氯化铷的化学式为RbCl2
典例精讲
【答案】D
【解析】A、根据结构示意图可知,铷原子的核电荷数为37,核电荷数=核内的质子数,铷原子核内的质子数为37,故选项说法正确;B、根据结构示意图可知,铷原子的最外层电子数是1,在化学变化中容易失去1个电子,故选项说法正确;C、根据结构示意图可知,铷原子的核外有5个电子层,故选项说法正确;
D、在化学变化中铷原子容易失去1个电子形成带一个单位正电荷的铷离子,其化合价为+1价,氯化铷的化学式为RbCl,故选项说法错误。故选:D。
典例精讲
例3.(2022湖北潜江等中考)如图是三种微粒的结构示意图,下列说法正确的是( )
A. ①和②化学性质相似 B. 它们表示三种元素
C. 表示稳定结构的是②和③ D. 表示阳离子的是②
典例精讲
【答案】C
【解析】A、决定元素化学性质的原子结构为最外层电子,最外层电子数相同,化学性质相似,②与③的化学性质相似,不符合题意;B、质子数(核电荷数)相同的一类原子归为一种元素,①②为一种元素,不符合题意;C、稳定结构即最外层电子数达到8个电子(第一层 2个电子),②与③为稳定结构,符合题意;D、阳离子指的是与原子失去电子得到的带正电的离子,②为O2-,是阴离子,不符合题意;故选C。
C
2.如图是五种微粒的结构示意图,下列说法不正确的是( )
A.上述五种微粒只涉及四种元素
B.②③⑤表示的微粒性质较稳定
C.①②④属于原子,③⑤属于阴离子
D.①④对应元素组成化合物的化学式为NaF
-
达标检测
3.(2022崇州市崇庆中学实验学校一模) 下列对分子、原子、离子的认识正确的是( )
A.同种分子排列方式不同,化学性质不同
B.在干冰中,分子因相互作用而静止不动
C.同种原子按不同方式结合,可以构成不同的物质
D.原子得失电子形成离子后,原子核发生了变化
C
达标检测
4.(2022金堂县福兴镇初级中学二模)在下列示意图表示的粒子中,属于原
子的有 (填序号,下同),属于阳离子的有 ,属于阴离子的
有 ,属于同种元素的为 。
②⑤⑥
①④
③
④⑤
达标检测
5.(2021山东杜郎口中学二模)如图,A、B、C是三种粒子的结构示意图。
请回答下列问题:
(1)在A、B、C三种粒子中属于阳离子的是 ,属于阴离子的是 ,
属于原子的是 。
(2)用化学符号表示:A ,C 。
(3)A、B、C三种粒子中,不具备稳定结构的是 (填序号)。
A
C
B
Mg2+
Cl-
B
达标检测
通过本节课的学习,同学们谈谈有哪些收获?
归纳小结
1.完成配套练习册;
2.预习第2节 组成物质的化学元素;
3.书面作业:课后习题2、3。
达标检测
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
