1.3常见的酸 综合训练(含答案)
图片预览



文档简介
常见的酸综合训练
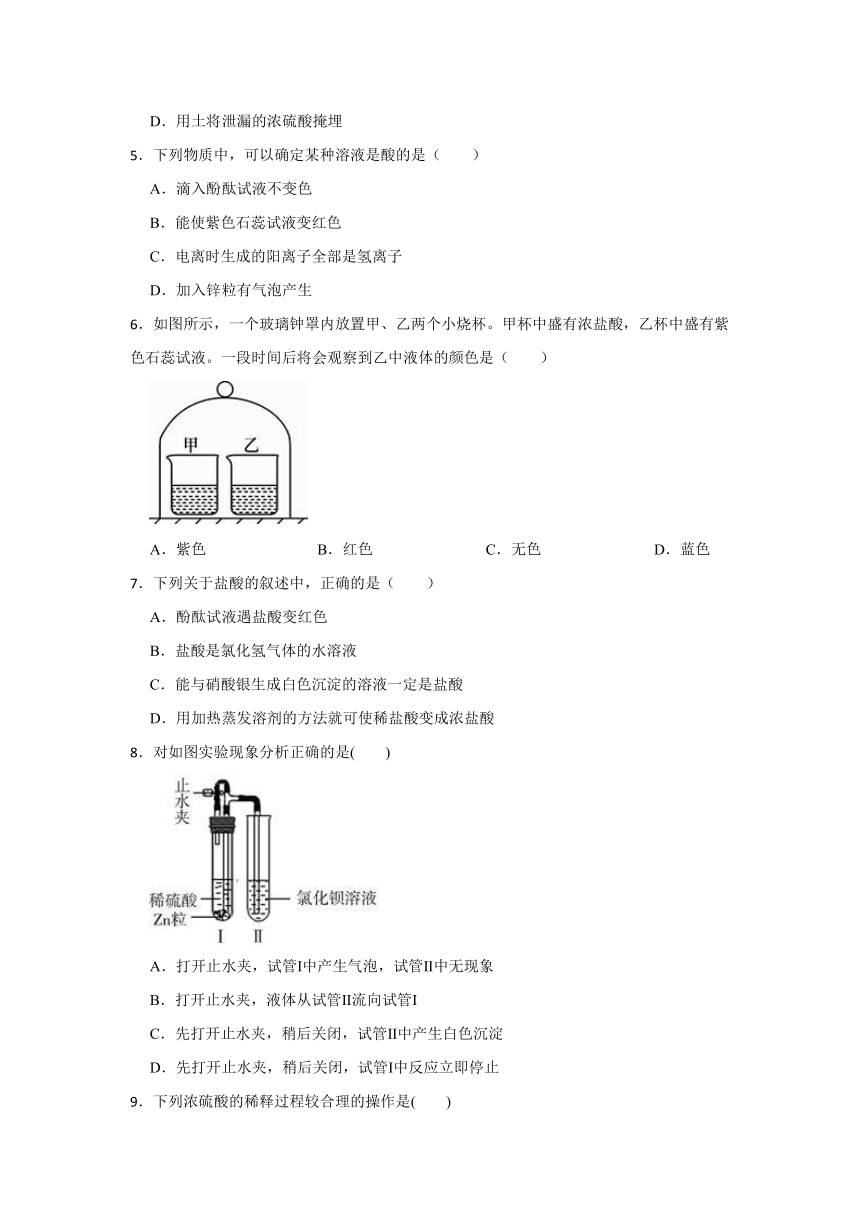
一、单选题
1.向稀硫酸中加入下列物质,溶液的 pH 没有明显变化的是( )
A.铁 B.碳酸钙 C.氯化钡 D.氢氧化钠
2.如图表示化学反应中溶液的颜色变化.下列叙述错误的是( )
A.若X 是稀硫酸,b 和d 一定是氧化物
B.若X 是稀硫酸,a 可以是紫色石蕊试液
C.若X 是稀盐酸,c 可以是单质
D.若X 是稀盐酸,d 不可能是紫色石蕊试液 图四
3.小金发现稀硫酸和氧化铜反应时,短期内观察不到明显现象。于是改进了实验(如图),很快观察到有明显现象。取反应后溶液于试管中,滴加少量NaOH溶液,无现象。下列分析不正确的是( )
A.倾倒浓硫酸时操作不规范
B.该实验不能说明一定是由于升高温度加快了反应速率
C.小金观察到的“明显现象”是:黑色固体消失,溶液呈蓝色
D.反应后烧杯中溶液的溶质是CuSO4
4.一辆满载浓硫酸的槽罐车在路上因车祸翻倒,浓硫酸大量泄漏,为了不污染旁边的水源,下列采取的措施适宜的是( )
A.用水冲洗泄漏的浓硫酸
B.将熟石灰撒在泄漏出的浓硫酸上
C.将氯化钡撒在泄漏出的浓硫酸上
D.用土将泄漏的浓硫酸掩埋
5.下列物质中,可以确定某种溶液是酸的是( )
A.滴入酚酞试液不变色
B.能使紫色石蕊试液变红色
C.电离时生成的阳离子全部是氢离子
D.加入锌粒有气泡产生
6.如图所示,一个玻璃钟罩内放置甲、乙两个小烧杯。甲杯中盛有浓盐酸,乙杯中盛有紫色石蕊试液。一段时间后将会观察到乙中液体的颜色是( )
A.紫色 B.红色 C.无色 D.蓝色
7.下列关于盐酸的叙述中,正确的是( )
A.酚酞试液遇盐酸变红色
B.盐酸是氯化氢气体的水溶液
C.能与硝酸银生成白色沉淀的溶液一定是盐酸
D.用加热蒸发溶剂的方法就可使稀盐酸变成浓盐酸
8.对如图实验现象分析正确的是( )
A.打开止水夹,试管Ⅰ中产生气泡,试管Ⅱ中无现象
B.打开止水夹,液体从试管Ⅱ流向试管Ⅰ
C.先打开止水夹,稍后关闭,试管Ⅱ中产生白色沉淀
D.先打开止水夹,稍后关闭,试管Ⅰ中反应立即停止
9.下列浓硫酸的稀释过程较合理的操作是( )
A. B.
C. D.
10.下列由实验现象得到的结论,正确的是( )
A.向某溶液中加BaCl2溶液,生成白色沉淀,说明该溶液中一定含有SO42-或CO32-
B.向某固体中加入稀盐酸,有气泡产生,说明此固体一定是金属
C.CaCO3与BaCl2能够发生复分解反应,是因为能生成沉淀
D.向某溶液中滴加无色酚酞试液,酚酞试液变红,说明该溶液显碱性
11.下列不能用来中和过多的胃酸的是( )
A.氢氧化铝 B.碳酸氢钠粉末
C.氢氧化钠 D.墨鱼骨粉
12.无色液体X是下列四种物质中的一种。将其分成等量的三份,向其中分别加入少量的石蕊试液、Fe2O3粉末、BaCl2溶液,产生的现象如下表。则Ⅹ是下列选项( )
加入的物质 石蕊试液 Fe2O3粉末 BaCl2溶液
现象 试液变红 固体逐渐溶解,溶液变黄 无明显现象
A.稀盐酸 B.稀硫酸 C.NaOH溶液 D.Na2CO3溶液
13.下列各组物质间能发生反应,且现象描述正确的是( )
A.CO2与MgCl2溶液,产生白色浑浊
B.Mg(OH)2)与稀H2SO4,没有明显现象
C.MgO与稀H2SO4,白色固体溶解
D.CuSO4溶液与MgCl2溶液,产生蓝色沉淀
14.下列物质混合,能发生反应且反应后溶液质量减少的是( )
A.铜丝与稀硫酸 B.稀硫酸与NaOH溶液
C.铁锈与稀硫酸 D.铜丝与AgNO3溶液
15.下列变化前后的数据关系不符合x>y的是( )
A.一瓶稀硫酸溶液的pH=x,将其加水稀释后溶液的pH=y
B.一瓶浓盐酸的质量为x,敞口放置一段时间后质量为y
C.一瓶浓硫酸溶质的质量分数为x,敞口放置一段时间后溶质质量分数为y
D.酒精和水混合前的体积之和为x,混合后总体积为y
二、填空题
16.某学习小组在探究酸的化学性质时,做了如图所示的两个实验:
(1)向分别装有碳酸钠和碳酸钙粉末的试管中注入一定量的稀盐酸,两支试管内均观察到的现象是 ,固体粉末全部消失,最终形成无色溶液.写出B试管中发生反应的化学方程式: .
(2)实验结束后,同学们将A、B两支试管中的废液倒入同一只洁净的烧杯中,发现烧杯中的废液变浑浊.写出该反应的化学方程式:
17.小金为验证稀硫酸的化学性质,分别将铁、氢氧化钠、氧化铜和氯化钡等固体药品加入到四支盛有稀硫酸的试管中。
(1)如图为加入某种固体药品后,溶液中主要离子种类及个数比变化的示意图(不考虑离子的大小关系),则加入的固体药品可能是 (填写序号)。
A.铁 B.氢氧化钠 C.氧化铜 D.氯化钡
(2)反应后的四支试管中有一支为无色溶液,小金只向试管中加入一种试剂就确定了溶质的成分,则加入的试剂及判断方法为 。
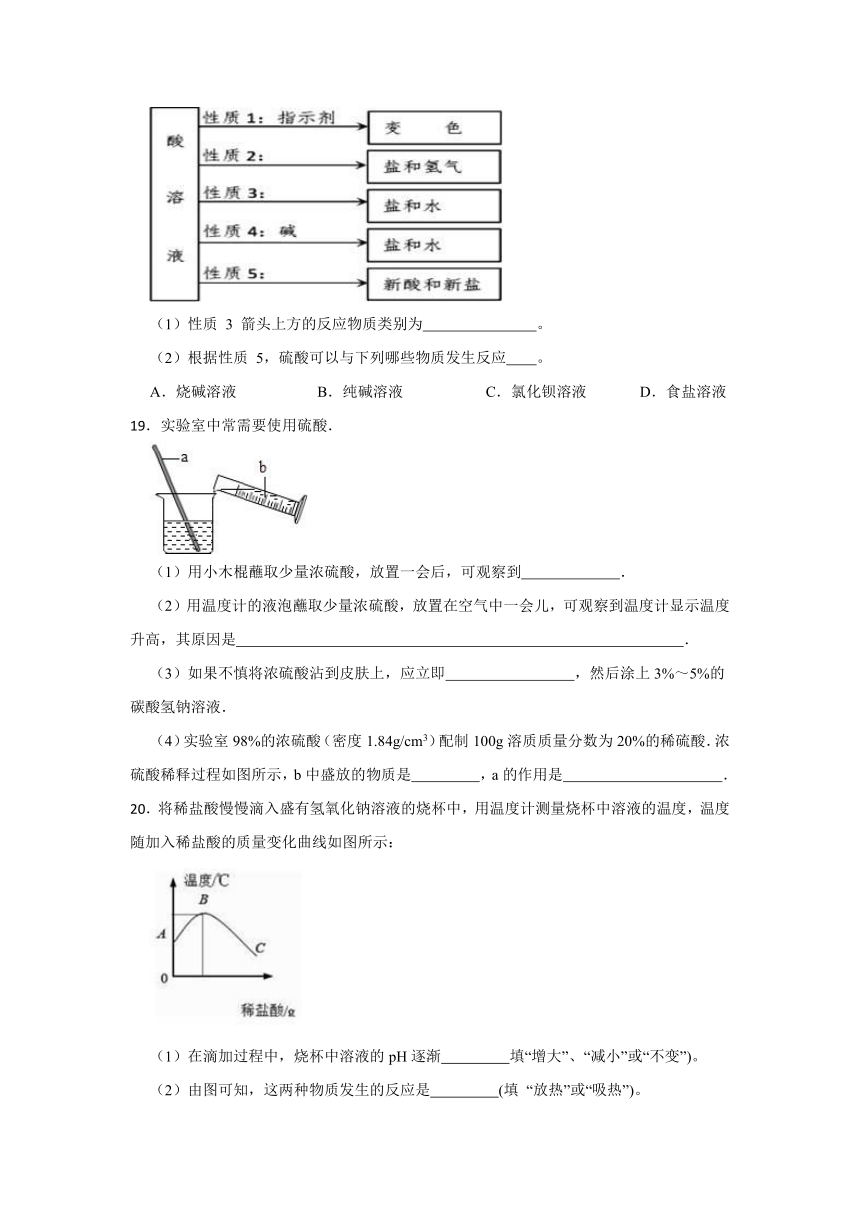
18.某同学对酸的化学性质进行了归纳,如图所示,回答下列问题。
(1)性质 3 箭头上方的反应物质类别为 。
(2)根据性质 5,硫酸可以与下列哪些物质发生反应 。
A.烧碱溶液 B.纯碱溶液 C.氯化钡溶液 D.食盐溶液
19.实验室中常需要使用硫酸.
(1)用小木棍蘸取少量浓硫酸,放置一会后,可观察到 .
(2)用温度计的液泡蘸取少量浓硫酸,放置在空气中一会儿,可观察到温度计显示温度升高,其原因是 .
(3)如果不慎将浓硫酸沾到皮肤上,应立即 ,然后涂上3%~5%的碳酸氢钠溶液.
(4)实验室98%的浓硫酸(密度1.84g/cm3)配制100g溶质质量分数为20%的稀硫酸.浓硫酸稀释过程如图所示,b中盛放的物质是 ,a的作用是 .
20.将稀盐酸慢慢滴入盛有氢氧化钠溶液的烧杯中,用温度计测量烧杯中溶液的温度,温度随加入稀盐酸的质量变化曲线如图所示:
(1)在滴加过程中,烧杯中溶液的pH逐渐 填“增大”、“减小”或“不变”)。
(2)由图可知,这两种物质发生的反应是 (填 “放热”或“吸热”)。
21.用毛笔蘸取溶质质量分数为5%的稀硫酸在竹片上画花,然后把竹片放在小火上烘干,再用水洗净,在竹片上就得到黑色或褐色的花样,一幅精美的竹片画就制成了。
(1)稀硫酸在烘干的过程中成为浓硫酸.使富含纤维素的竹片呈现黑色或褐色,这是利用了浓硫酸的 性,在这个过程中竹片发生了 变化。
(2)直接用浓硫酸在竹片上画花具有危险性,必须将浓硫酸进行稀释。在实验室把100克溶质质量分数为98%的浓硫酸稀释成5%的稀硫酸,需用量筒量取 毫升的蒸馏水,稀释时需要的仪器有烧杯和 。
22.为验证“酸的化学性质”,某班同学在实验室进行如图实验,请分析并回答相关问题:
(1)没有明显现象的试管是 。
(2)要全面验证酸的化学通性,D 试管中能与酸反应的固体单质是 (写一种即可)。
(3)实验完成后,将全部废液倒入废液缸内,测得 pH=2,则废液中所含溶质最多有 种(溶质不计指示剂与气体)。
23.盐酸和硫酸是实验室常用的试剂,也是重要的化工原料,它们既有相似之处,又有不同之点。
(1)分别打开盛浓硫酸和浓盐酸试剂瓶的瓶塞,能看到盛浓盐酸的试剂瓶口附近出现 ,说明浓盐酸有较强的 性;浓硫酸有 性,在实验室中常用作干燥剂。
(2)它们的水溶液都显 性,都能使紫色石蕊试液变为 色。
(3)它们都能与活泼金属反应。稀硫酸与铁反应的化学方程式为 。
(4)它们都能除铁锈。写出用盐酸除铁锈的化学方程式: 。
三、实验探究题
24.某班同学为验证酸的化学通性,做了五组实验.分析并回答问题:
(1)A组试管中都产生H2。若要制得较纯的H2,选稀硫酸而不选盐酸的原因是: 。
(2)B组试管中实验现象相同,该现象是 ;
(3)写出C组任一试管中发生反应的化学方程式 ;
(4)上述五组实验中没有体现酸的通性的是 (填序号)。
25.如图所示,是两种稀释浓硫酸的操作,回答下列问题:
(1)B 图中盛水仪器的名称是 。
(2)B 图锥形瓶内产生的现象是 产生这一现象的原因是 。
(3)上述两幅图中,稀释浓硫酸的操作,正确的是 (填“A”或“B”)。
(4)A 图中玻璃棒的作用是 。
(5)将生锈的铁钉放入稀硫酸中,观察到的现象是 ,过一会儿有 产生,有关的化学方程式为 (写其中一种反应即可)。
26.在做完“用稀盐酸和石灰石反应制取二氧化碳”的实验后,小金突然想到:是否可以测得实验所用的石灰石中碳酸钙的含量呢?小科又进行了 如下实验:
①将试管中反应的剩余物过滤并多次用蒸馏水洗涤,得到滤液和滤渣;②向滤渣中滴加稀盐酸,无明显的现象;③将滤渣干燥后称量,质量为0.5g;④向滤液中加入10%的Na2CO3溶液,获得了相关的数据,并绘制成如图所示的图像。
根据小科的实验过程回答下列问题。(假设石灰石中的其余杂质不与稀盐酸反应)
(1)在Na2CO3溶液加到图像中显示的A点时,溶液中所含的溶质为 。(填化学式)
(2)第②步中小金向滤渣中加入稀盐酸的目的是为了 。
(3)根据图像及相关的数据可求得石灰石中碳酸钙的质量分数为多少?
(4)第①步中如果在过滤时没有多次用蒸馏水洗涤,则测得的碳酸钙的含量将 。(填“偏大”、“偏小”或“不变”)
四、解答题
27.过期药品会对人体造成直接或潜在危害,属于有害垃圾,碳酸钙片是一种常用药,能用于补钙。
(1)为测定药片中碳酸钙的含量,小科按如图甲的实验方案,取药片和足量的稀盐酸进行实验,通过测量反应前后总质量的变化来采集实验数据。同学们认为,测得碳酸钙的质量分数会偏大,原因是 。(答出一点即可)。
(2)为减小实验误差,小科又设计了如图乙的实验方案,取药片和足量的稀盐酸进行了三次实验,采集的实验数据如表:
实验序号 1 2 3
碳酸钙片样品质量/克 3.0 3.0 3.0
反应前总质量/克 193.8 194.6 193.6
反应后总质量/克 192.6 193.6 192.5
二氧化碳质量/克
请计算该药片中碳酸钙的质量分数。
(3)碳酸钙在胃酸的作用下,能生成钙离子而被人体吸收。胃液中胃酸过多会引起人体反酸、胃痛,可以用氢氧化铝、碳酸镁治疗胃酸过多。但医生建议患有严重胃溃疡的患者最好服用氢氧化铝片,理由是 。
(4)等质量的氢氧化铝和碳酸镁,哪一物质中和的胃酸较多? (填化学式)
28.市场上常见的苏打水有苏打气泡水和无汽苏打水两种。它们的主要成分中都含有碳酸氢钠,俗称小苏打,具有以下性质。
性质一:2NaHCO3=Na2CO3+CO2↑+H20,(NaHCO3在50℃以上开始逐渐分解)
性质二:NaHCO3+HCl=NaCl+H20+CO2↑
(1)苏打气泡水中含有大量二氧化碳,瓶盖一打开就有大量气泡产生,所以叫气泡水。无汽苏打水则不含二氧化碳,但小明认为他喝人体内也会产生二氧化碳,主要是利用了碳酸氢钠的性质 (选填“一”或“二”),理由是
(2)小明查阅了相关资料想自制苏打水,于是购买了一袋小苏打,包装袋上标注的碳酸氢钠含量是99%。真的有这么高吗?小明取了10克小苏打样品放入装置,逐次加入稀硫酸进行实验,得到相关数据。请通过计算帮助小明判断包装袋上的标注是否标准。
(2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑)
序号 反应前 第1次 第2次 第3次 第4次 第5次
加入稀硫酸溶液质量/克 10 10 10 10 10
C装置中溶液总质量/克 100.0 101.1 102.2 103.3 104.4 105.0
(3)如果去掉装置B,测量结果将会 (选填“偏大”或“偏小”)。
29.鸡蛋壳的主要成分是碳酸钙。某科学兴趣小组取25g鸡蛋壳于烧杯中,缓慢加入稀盐酸(杂质不溶于水,也不与稀盐酸反应),剩余固体质量与加入稀盐酸的质量关系如图所示。请根据要求回答问题:
(1)实验时当观察到 现象时,说明鸡蛋壳已完全反应;
(2)鸡蛋壳完全反应后,求产生CO2的质量;
(3)当鸡蛋壳恰好完全反应时,求所得溶液的溶质质量分数。
参考答案
1.C
2.A
3.B
4.B
5.C
6.B
7.B
8.C
9.C
10.D
11.C
12.A
13.C
14.D
15.A
16.(1)有气泡产生;CaCO3+2HCl═CaCl2+H2O+CO2↑
(2)CaCl2+Na2CO3=CaCO3↓+2NaCl
17.(1)A;C
(2)紫色石蕊溶液,若紫色石蕊试液变红,则溶质是硫酸钠和硫酸;若石蕊溶液为紫色,则溶质是硫酸钠;若石蕊溶液是蓝色,则溶质是硫酸钠和氢氧化钠。
18.(1)金属氧化物
(2)B;C
19.(1)木棍变黑
(2)浓硫酸具有吸水性,吸收空气中的水蒸气,浓硫酸溶于水放热
(3)大量的水冲洗
(4)浓硫酸;搅拌、散热、降温
20.(1)减小
(2)放热
21.(1)脱水;化学
(2)1860;玻璃棒
22.(1)A (2)Fe (3)4
23.(1)白雾;挥发性;吸水
(2)酸;红
(3)H2SO4+Fe=FeSO4+H2↑
(4)Fe2O3+H2SO4=Fe2(SO4)3+3H2O
24.(1)盐酸具有挥发性,挥发出氯化氢气体,使制得的氢气中混有氯化氢气体
(2)红棕色固体逐渐减少,溶液变成黄色
(3)NaOH+HCl=NaCl+H2O或2NaOH+H2SO4=Na2SO4+2H2O
(4)D
25.(1)分液漏斗
(2)酸液飞溅;水滴在浓硫酸中,溶解时放出大量的热,使水立刻沸腾
(3)A
(4)搅拌
(5)铁锈逐渐溶解,溶液由无色变成棕黄色;气泡;Fe2O3+3H2SO4══Fe2(SO4)3+3H2O(或 Fe+H2SO4══FeSO4+H2↑)
26.(1)CaCl2,NaCl
(2)检验滤渣中是否有碳酸钙剩余
(3)80%
(4)偏小
27.(1)二氧化碳中混有水蒸气和氯化氢气体
(2)反应后减少质量即为产生二氧化碳质量,由三次实验可知,3.0克碳酸钙样品与盐酸反应产生二氧化碳质量为(1.2+1.0+1.1)3=1.1g,设碳酸钙质量分数为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
3.0gx 1.1g
100:44=3.0gx:1.1g
x=83.3%
(3)因为胃酸和该药作用产生CO2会刺激胃粘膜,导致胃穿孔
(4)Al(OH)3
28.(1)二;人体胃液内含有HCl溶液,且人体内温度达不到50℃
(2)C装置增重质量即为吸收二氧化碳质量,由表中数据可知,反应后产生二氧化碳质量为105.0-100.0=5.0g
设碳酸氢钠质量为x
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
168 88
x 5.0g
168:88=x:5.0g
x=9.55g
则小苏打中碳酸钠含量为95.5%,标注不准确;
(3)偏大
29.(1)鸡蛋壳表面不再产生气泡
(2)解:设产生CO2的质量为x
CaCO3+2HCl=CaCl2+ CO2↑+H2O
100 44
20g x
x=8.8g
(3)解:设所得溶液的溶质质量为y
CaCO3+2HCl= CaCl2+CO2↑+H2O
100 111
20 y
y=22.2g CaCl2%= =11.1%
一、单选题
1.向稀硫酸中加入下列物质,溶液的 pH 没有明显变化的是( )
A.铁 B.碳酸钙 C.氯化钡 D.氢氧化钠
2.如图表示化学反应中溶液的颜色变化.下列叙述错误的是( )
A.若X 是稀硫酸,b 和d 一定是氧化物
B.若X 是稀硫酸,a 可以是紫色石蕊试液
C.若X 是稀盐酸,c 可以是单质
D.若X 是稀盐酸,d 不可能是紫色石蕊试液 图四
3.小金发现稀硫酸和氧化铜反应时,短期内观察不到明显现象。于是改进了实验(如图),很快观察到有明显现象。取反应后溶液于试管中,滴加少量NaOH溶液,无现象。下列分析不正确的是( )
A.倾倒浓硫酸时操作不规范
B.该实验不能说明一定是由于升高温度加快了反应速率
C.小金观察到的“明显现象”是:黑色固体消失,溶液呈蓝色
D.反应后烧杯中溶液的溶质是CuSO4
4.一辆满载浓硫酸的槽罐车在路上因车祸翻倒,浓硫酸大量泄漏,为了不污染旁边的水源,下列采取的措施适宜的是( )
A.用水冲洗泄漏的浓硫酸
B.将熟石灰撒在泄漏出的浓硫酸上
C.将氯化钡撒在泄漏出的浓硫酸上
D.用土将泄漏的浓硫酸掩埋
5.下列物质中,可以确定某种溶液是酸的是( )
A.滴入酚酞试液不变色
B.能使紫色石蕊试液变红色
C.电离时生成的阳离子全部是氢离子
D.加入锌粒有气泡产生
6.如图所示,一个玻璃钟罩内放置甲、乙两个小烧杯。甲杯中盛有浓盐酸,乙杯中盛有紫色石蕊试液。一段时间后将会观察到乙中液体的颜色是( )
A.紫色 B.红色 C.无色 D.蓝色
7.下列关于盐酸的叙述中,正确的是( )
A.酚酞试液遇盐酸变红色
B.盐酸是氯化氢气体的水溶液
C.能与硝酸银生成白色沉淀的溶液一定是盐酸
D.用加热蒸发溶剂的方法就可使稀盐酸变成浓盐酸
8.对如图实验现象分析正确的是( )
A.打开止水夹,试管Ⅰ中产生气泡,试管Ⅱ中无现象
B.打开止水夹,液体从试管Ⅱ流向试管Ⅰ
C.先打开止水夹,稍后关闭,试管Ⅱ中产生白色沉淀
D.先打开止水夹,稍后关闭,试管Ⅰ中反应立即停止
9.下列浓硫酸的稀释过程较合理的操作是( )
A. B.
C. D.
10.下列由实验现象得到的结论,正确的是( )
A.向某溶液中加BaCl2溶液,生成白色沉淀,说明该溶液中一定含有SO42-或CO32-
B.向某固体中加入稀盐酸,有气泡产生,说明此固体一定是金属
C.CaCO3与BaCl2能够发生复分解反应,是因为能生成沉淀
D.向某溶液中滴加无色酚酞试液,酚酞试液变红,说明该溶液显碱性
11.下列不能用来中和过多的胃酸的是( )
A.氢氧化铝 B.碳酸氢钠粉末
C.氢氧化钠 D.墨鱼骨粉
12.无色液体X是下列四种物质中的一种。将其分成等量的三份,向其中分别加入少量的石蕊试液、Fe2O3粉末、BaCl2溶液,产生的现象如下表。则Ⅹ是下列选项( )
加入的物质 石蕊试液 Fe2O3粉末 BaCl2溶液
现象 试液变红 固体逐渐溶解,溶液变黄 无明显现象
A.稀盐酸 B.稀硫酸 C.NaOH溶液 D.Na2CO3溶液
13.下列各组物质间能发生反应,且现象描述正确的是( )
A.CO2与MgCl2溶液,产生白色浑浊
B.Mg(OH)2)与稀H2SO4,没有明显现象
C.MgO与稀H2SO4,白色固体溶解
D.CuSO4溶液与MgCl2溶液,产生蓝色沉淀
14.下列物质混合,能发生反应且反应后溶液质量减少的是( )
A.铜丝与稀硫酸 B.稀硫酸与NaOH溶液
C.铁锈与稀硫酸 D.铜丝与AgNO3溶液
15.下列变化前后的数据关系不符合x>y的是( )
A.一瓶稀硫酸溶液的pH=x,将其加水稀释后溶液的pH=y
B.一瓶浓盐酸的质量为x,敞口放置一段时间后质量为y
C.一瓶浓硫酸溶质的质量分数为x,敞口放置一段时间后溶质质量分数为y
D.酒精和水混合前的体积之和为x,混合后总体积为y
二、填空题
16.某学习小组在探究酸的化学性质时,做了如图所示的两个实验:
(1)向分别装有碳酸钠和碳酸钙粉末的试管中注入一定量的稀盐酸,两支试管内均观察到的现象是 ,固体粉末全部消失,最终形成无色溶液.写出B试管中发生反应的化学方程式: .
(2)实验结束后,同学们将A、B两支试管中的废液倒入同一只洁净的烧杯中,发现烧杯中的废液变浑浊.写出该反应的化学方程式:
17.小金为验证稀硫酸的化学性质,分别将铁、氢氧化钠、氧化铜和氯化钡等固体药品加入到四支盛有稀硫酸的试管中。
(1)如图为加入某种固体药品后,溶液中主要离子种类及个数比变化的示意图(不考虑离子的大小关系),则加入的固体药品可能是 (填写序号)。
A.铁 B.氢氧化钠 C.氧化铜 D.氯化钡
(2)反应后的四支试管中有一支为无色溶液,小金只向试管中加入一种试剂就确定了溶质的成分,则加入的试剂及判断方法为 。
18.某同学对酸的化学性质进行了归纳,如图所示,回答下列问题。
(1)性质 3 箭头上方的反应物质类别为 。
(2)根据性质 5,硫酸可以与下列哪些物质发生反应 。
A.烧碱溶液 B.纯碱溶液 C.氯化钡溶液 D.食盐溶液
19.实验室中常需要使用硫酸.
(1)用小木棍蘸取少量浓硫酸,放置一会后,可观察到 .
(2)用温度计的液泡蘸取少量浓硫酸,放置在空气中一会儿,可观察到温度计显示温度升高,其原因是 .
(3)如果不慎将浓硫酸沾到皮肤上,应立即 ,然后涂上3%~5%的碳酸氢钠溶液.
(4)实验室98%的浓硫酸(密度1.84g/cm3)配制100g溶质质量分数为20%的稀硫酸.浓硫酸稀释过程如图所示,b中盛放的物质是 ,a的作用是 .
20.将稀盐酸慢慢滴入盛有氢氧化钠溶液的烧杯中,用温度计测量烧杯中溶液的温度,温度随加入稀盐酸的质量变化曲线如图所示:
(1)在滴加过程中,烧杯中溶液的pH逐渐 填“增大”、“减小”或“不变”)。
(2)由图可知,这两种物质发生的反应是 (填 “放热”或“吸热”)。
21.用毛笔蘸取溶质质量分数为5%的稀硫酸在竹片上画花,然后把竹片放在小火上烘干,再用水洗净,在竹片上就得到黑色或褐色的花样,一幅精美的竹片画就制成了。
(1)稀硫酸在烘干的过程中成为浓硫酸.使富含纤维素的竹片呈现黑色或褐色,这是利用了浓硫酸的 性,在这个过程中竹片发生了 变化。
(2)直接用浓硫酸在竹片上画花具有危险性,必须将浓硫酸进行稀释。在实验室把100克溶质质量分数为98%的浓硫酸稀释成5%的稀硫酸,需用量筒量取 毫升的蒸馏水,稀释时需要的仪器有烧杯和 。
22.为验证“酸的化学性质”,某班同学在实验室进行如图实验,请分析并回答相关问题:
(1)没有明显现象的试管是 。
(2)要全面验证酸的化学通性,D 试管中能与酸反应的固体单质是 (写一种即可)。
(3)实验完成后,将全部废液倒入废液缸内,测得 pH=2,则废液中所含溶质最多有 种(溶质不计指示剂与气体)。
23.盐酸和硫酸是实验室常用的试剂,也是重要的化工原料,它们既有相似之处,又有不同之点。
(1)分别打开盛浓硫酸和浓盐酸试剂瓶的瓶塞,能看到盛浓盐酸的试剂瓶口附近出现 ,说明浓盐酸有较强的 性;浓硫酸有 性,在实验室中常用作干燥剂。
(2)它们的水溶液都显 性,都能使紫色石蕊试液变为 色。
(3)它们都能与活泼金属反应。稀硫酸与铁反应的化学方程式为 。
(4)它们都能除铁锈。写出用盐酸除铁锈的化学方程式: 。
三、实验探究题
24.某班同学为验证酸的化学通性,做了五组实验.分析并回答问题:
(1)A组试管中都产生H2。若要制得较纯的H2,选稀硫酸而不选盐酸的原因是: 。
(2)B组试管中实验现象相同,该现象是 ;
(3)写出C组任一试管中发生反应的化学方程式 ;
(4)上述五组实验中没有体现酸的通性的是 (填序号)。
25.如图所示,是两种稀释浓硫酸的操作,回答下列问题:
(1)B 图中盛水仪器的名称是 。
(2)B 图锥形瓶内产生的现象是 产生这一现象的原因是 。
(3)上述两幅图中,稀释浓硫酸的操作,正确的是 (填“A”或“B”)。
(4)A 图中玻璃棒的作用是 。
(5)将生锈的铁钉放入稀硫酸中,观察到的现象是 ,过一会儿有 产生,有关的化学方程式为 (写其中一种反应即可)。
26.在做完“用稀盐酸和石灰石反应制取二氧化碳”的实验后,小金突然想到:是否可以测得实验所用的石灰石中碳酸钙的含量呢?小科又进行了 如下实验:
①将试管中反应的剩余物过滤并多次用蒸馏水洗涤,得到滤液和滤渣;②向滤渣中滴加稀盐酸,无明显的现象;③将滤渣干燥后称量,质量为0.5g;④向滤液中加入10%的Na2CO3溶液,获得了相关的数据,并绘制成如图所示的图像。
根据小科的实验过程回答下列问题。(假设石灰石中的其余杂质不与稀盐酸反应)
(1)在Na2CO3溶液加到图像中显示的A点时,溶液中所含的溶质为 。(填化学式)
(2)第②步中小金向滤渣中加入稀盐酸的目的是为了 。
(3)根据图像及相关的数据可求得石灰石中碳酸钙的质量分数为多少?
(4)第①步中如果在过滤时没有多次用蒸馏水洗涤,则测得的碳酸钙的含量将 。(填“偏大”、“偏小”或“不变”)
四、解答题
27.过期药品会对人体造成直接或潜在危害,属于有害垃圾,碳酸钙片是一种常用药,能用于补钙。
(1)为测定药片中碳酸钙的含量,小科按如图甲的实验方案,取药片和足量的稀盐酸进行实验,通过测量反应前后总质量的变化来采集实验数据。同学们认为,测得碳酸钙的质量分数会偏大,原因是 。(答出一点即可)。
(2)为减小实验误差,小科又设计了如图乙的实验方案,取药片和足量的稀盐酸进行了三次实验,采集的实验数据如表:
实验序号 1 2 3
碳酸钙片样品质量/克 3.0 3.0 3.0
反应前总质量/克 193.8 194.6 193.6
反应后总质量/克 192.6 193.6 192.5
二氧化碳质量/克
请计算该药片中碳酸钙的质量分数。
(3)碳酸钙在胃酸的作用下,能生成钙离子而被人体吸收。胃液中胃酸过多会引起人体反酸、胃痛,可以用氢氧化铝、碳酸镁治疗胃酸过多。但医生建议患有严重胃溃疡的患者最好服用氢氧化铝片,理由是 。
(4)等质量的氢氧化铝和碳酸镁,哪一物质中和的胃酸较多? (填化学式)
28.市场上常见的苏打水有苏打气泡水和无汽苏打水两种。它们的主要成分中都含有碳酸氢钠,俗称小苏打,具有以下性质。
性质一:2NaHCO3=Na2CO3+CO2↑+H20,(NaHCO3在50℃以上开始逐渐分解)
性质二:NaHCO3+HCl=NaCl+H20+CO2↑
(1)苏打气泡水中含有大量二氧化碳,瓶盖一打开就有大量气泡产生,所以叫气泡水。无汽苏打水则不含二氧化碳,但小明认为他喝人体内也会产生二氧化碳,主要是利用了碳酸氢钠的性质 (选填“一”或“二”),理由是
(2)小明查阅了相关资料想自制苏打水,于是购买了一袋小苏打,包装袋上标注的碳酸氢钠含量是99%。真的有这么高吗?小明取了10克小苏打样品放入装置,逐次加入稀硫酸进行实验,得到相关数据。请通过计算帮助小明判断包装袋上的标注是否标准。
(2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑)
序号 反应前 第1次 第2次 第3次 第4次 第5次
加入稀硫酸溶液质量/克 10 10 10 10 10
C装置中溶液总质量/克 100.0 101.1 102.2 103.3 104.4 105.0
(3)如果去掉装置B,测量结果将会 (选填“偏大”或“偏小”)。
29.鸡蛋壳的主要成分是碳酸钙。某科学兴趣小组取25g鸡蛋壳于烧杯中,缓慢加入稀盐酸(杂质不溶于水,也不与稀盐酸反应),剩余固体质量与加入稀盐酸的质量关系如图所示。请根据要求回答问题:
(1)实验时当观察到 现象时,说明鸡蛋壳已完全反应;
(2)鸡蛋壳完全反应后,求产生CO2的质量;
(3)当鸡蛋壳恰好完全反应时,求所得溶液的溶质质量分数。
参考答案
1.C
2.A
3.B
4.B
5.C
6.B
7.B
8.C
9.C
10.D
11.C
12.A
13.C
14.D
15.A
16.(1)有气泡产生;CaCO3+2HCl═CaCl2+H2O+CO2↑
(2)CaCl2+Na2CO3=CaCO3↓+2NaCl
17.(1)A;C
(2)紫色石蕊溶液,若紫色石蕊试液变红,则溶质是硫酸钠和硫酸;若石蕊溶液为紫色,则溶质是硫酸钠;若石蕊溶液是蓝色,则溶质是硫酸钠和氢氧化钠。
18.(1)金属氧化物
(2)B;C
19.(1)木棍变黑
(2)浓硫酸具有吸水性,吸收空气中的水蒸气,浓硫酸溶于水放热
(3)大量的水冲洗
(4)浓硫酸;搅拌、散热、降温
20.(1)减小
(2)放热
21.(1)脱水;化学
(2)1860;玻璃棒
22.(1)A (2)Fe (3)4
23.(1)白雾;挥发性;吸水
(2)酸;红
(3)H2SO4+Fe=FeSO4+H2↑
(4)Fe2O3+H2SO4=Fe2(SO4)3+3H2O
24.(1)盐酸具有挥发性,挥发出氯化氢气体,使制得的氢气中混有氯化氢气体
(2)红棕色固体逐渐减少,溶液变成黄色
(3)NaOH+HCl=NaCl+H2O或2NaOH+H2SO4=Na2SO4+2H2O
(4)D
25.(1)分液漏斗
(2)酸液飞溅;水滴在浓硫酸中,溶解时放出大量的热,使水立刻沸腾
(3)A
(4)搅拌
(5)铁锈逐渐溶解,溶液由无色变成棕黄色;气泡;Fe2O3+3H2SO4══Fe2(SO4)3+3H2O(或 Fe+H2SO4══FeSO4+H2↑)
26.(1)CaCl2,NaCl
(2)检验滤渣中是否有碳酸钙剩余
(3)80%
(4)偏小
27.(1)二氧化碳中混有水蒸气和氯化氢气体
(2)反应后减少质量即为产生二氧化碳质量,由三次实验可知,3.0克碳酸钙样品与盐酸反应产生二氧化碳质量为(1.2+1.0+1.1)3=1.1g,设碳酸钙质量分数为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
3.0gx 1.1g
100:44=3.0gx:1.1g
x=83.3%
(3)因为胃酸和该药作用产生CO2会刺激胃粘膜,导致胃穿孔
(4)Al(OH)3
28.(1)二;人体胃液内含有HCl溶液,且人体内温度达不到50℃
(2)C装置增重质量即为吸收二氧化碳质量,由表中数据可知,反应后产生二氧化碳质量为105.0-100.0=5.0g
设碳酸氢钠质量为x
2NaHCO3+H2SO4=Na2SO4+2H2O+2CO2↑
168 88
x 5.0g
168:88=x:5.0g
x=9.55g
则小苏打中碳酸钠含量为95.5%,标注不准确;
(3)偏大
29.(1)鸡蛋壳表面不再产生气泡
(2)解:设产生CO2的质量为x
CaCO3+2HCl=CaCl2+ CO2↑+H2O
100 44
20g x
x=8.8g
(3)解:设所得溶液的溶质质量为y
CaCO3+2HCl= CaCl2+CO2↑+H2O
100 111
20 y
y=22.2g CaCl2%= =11.1%
同课章节目录
- 第1章 物质及其变化
- 第1节 物质的变化
- 第2节 物质的酸碱性
- 第3节 常见的酸
- 第4节 常见的碱
- 第5节 酸和碱之间发生的反应
- 第6节 几种重要的盐
- 第2章 物质转化与材料利用
- 第1节 金属材料
- 第2节 金属的化学性质
- 第3节 有机物和有机合成材料
- 第4节 物质的分类
- 第5节 物质的转化
- 第6节 材料的利用与发展
- 第3章 能量的转化与守恒
- 第1节 能量及其形式
- 第2节 机械能
- 第3节 能量转化的量度
- 第4节 简单机械
- 第5节 物体的内能
- 第6节 电能
- 第7节 核能
- 第8节 能量的转化与守恒
- 第4章 代谢与平衡
- 第1节 食物与营养
- 第2节 食物的消化与吸收
- 第3节 体内物质的运输
- 第4节 能量的获得
- 第5节 体内物质的动态平衡
- 研究性学习课题
- 一 当地酸雨情况以及对农作物和建筑物的影响
- 二 金属对社会发展的作用
- 三 寻找自行车中的杠杆
- 四 怎样防治龋齿
