化学人教版(2019)选择性必修3 1.2研究有机化合物的一般步骤和方法(共25张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 1.2研究有机化合物的一般步骤和方法(共25张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 5.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-23 22:46:47 | ||
图片预览





文档简介
(共25张PPT)
研究有机化合物的一般步骤和方法
分离、提纯
01
元素分析与相对分子质量的测定
02
分子结构的鉴定
03
CONTENTS
目 录
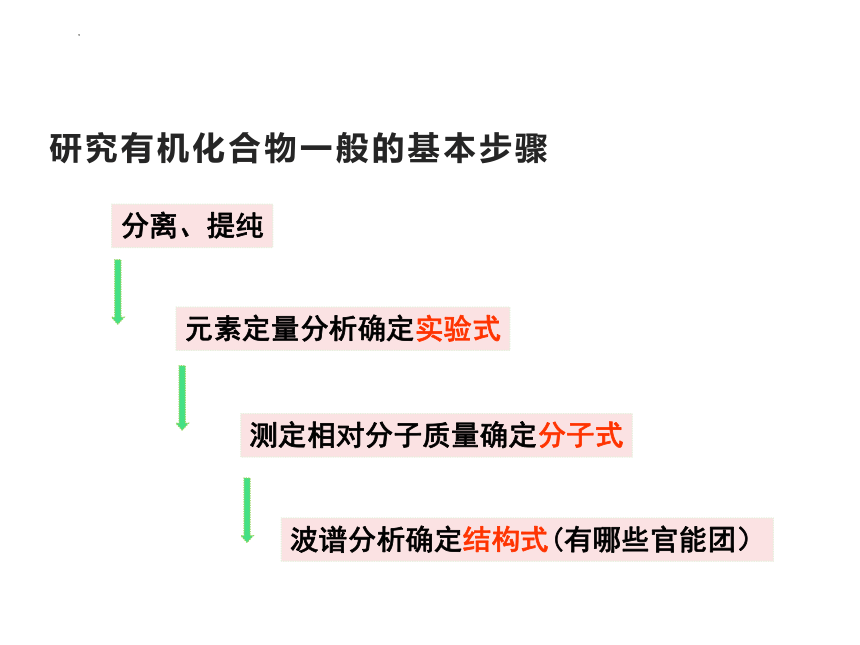
研究有机化合物一般的基本步骤
分离、提纯
元素定量分析确定实验式
测定相对分子质量确定分子式
波谱分析确定结构式(有哪些官能团)
分离、提纯
PART 01
一、分离、提纯
分离:
将混合物中的各种物质逐一分开
提纯:
将某物质中的杂质除掉的过程
原则:
最终不增加新杂质
最终尽量不减少所得物质
过程中所得物质若发生变化,易分离易复原
物理方法:
升华、液化、分液、萃取
蒸发、过滤、结晶、重结晶
蒸馏、分馏、盐析、渗析 等
3
化学方法:
沉淀法,气体转化法
4
1
2
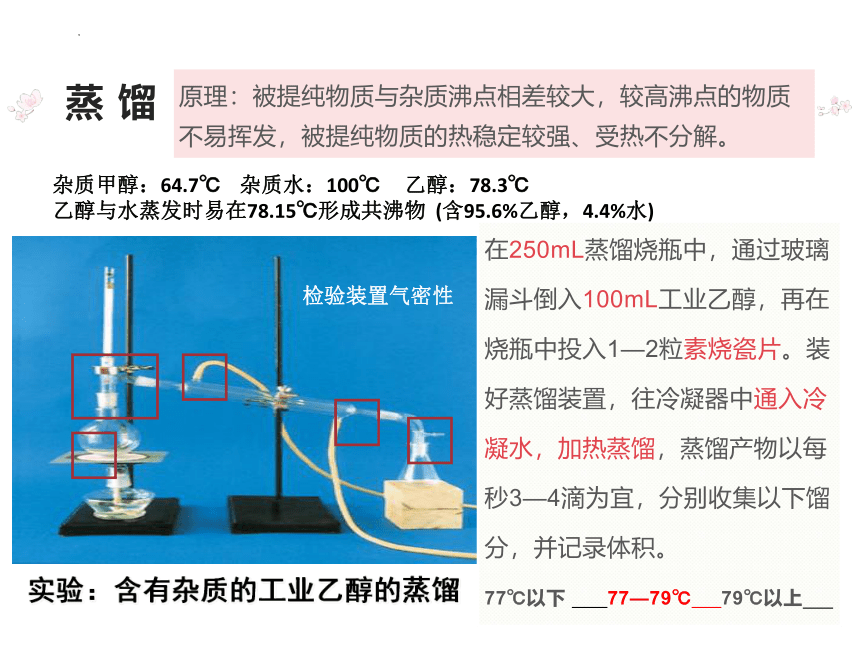
原理:被提纯物质与杂质沸点相差较大,较高沸点的物质不易挥发,被提纯物质的热稳定较强、受热不分解。
蒸 馏
实验:含有杂质的工业乙醇的蒸馏
在250mL蒸馏烧瓶中,通过玻璃
漏斗倒入100mL工业乙醇,再在
烧瓶中投入1—2粒素烧瓷片。装
好蒸馏装置,往冷凝器中通入冷
凝水,加热蒸馏,蒸馏产物以每
秒3—4滴为宜,分别收集以下馏
分,并记录体积。
77℃以下 77—79℃ 79℃以上
杂质甲醇:64.7℃ 杂质水:100℃ 乙醇:78.3℃
乙醇与水蒸发时易在78.15℃形成共沸物 (含95.6%乙醇,4.4%水)
检验装置气密性
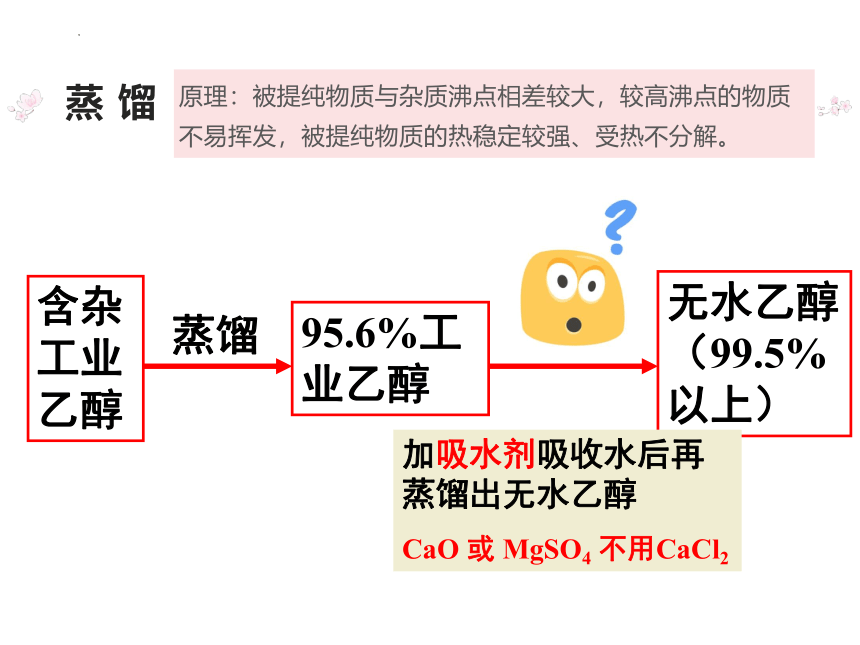
原理:被提纯物质与杂质沸点相差较大,较高沸点的物质不易挥发,被提纯物质的热稳定较强、受热不分解。
蒸 馏
含杂工业乙醇
95.6%工业乙醇
无水乙醇(99.5%以上)
蒸馏
加吸水剂吸收水后再蒸馏出无水乙醇
CaO 或 MgSO4 不用CaCl2
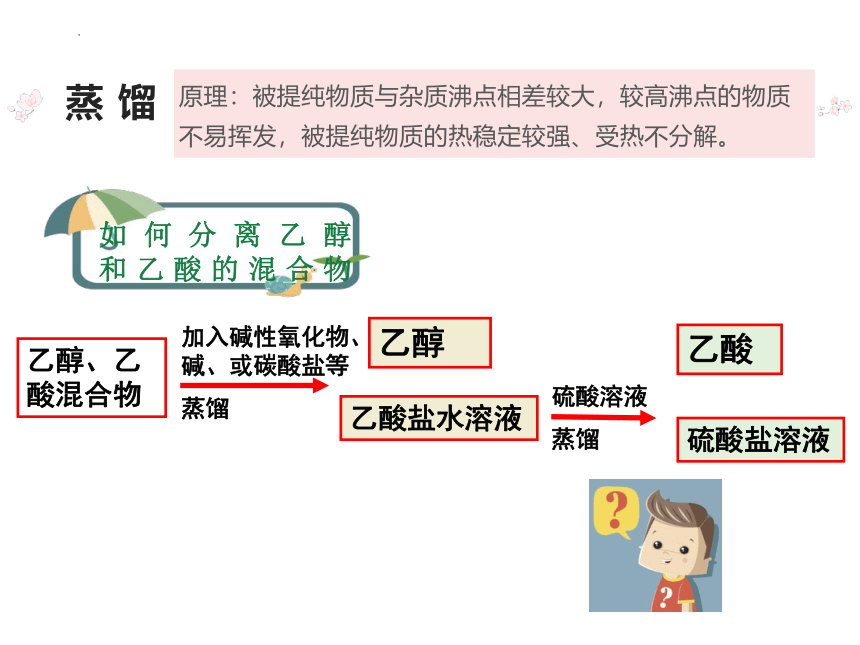
原理:被提纯物质与杂质沸点相差较大,较高沸点的物质不易挥发,被提纯物质的热稳定较强、受热不分解。
蒸 馏
如何分离乙醇
和乙酸的混合物
乙醇、乙酸混合物
乙酸盐水溶液
乙酸
加入碱性氧化物、碱、或碳酸盐等
蒸馏
硫酸溶液
蒸馏
乙醇
硫酸盐溶液
原理:重结晶是将晶体溶于溶剂或熔融以后,又重新从溶液或熔体中结晶的过程。利用被提纯物质与杂质在同一溶剂中的溶解度不同而将其杂质。
重结晶
一般步骤:溶解、蒸发(或冷却)、结晶、过滤
杂质沙子,NaCl
提纯物质:苯甲酸
NaCl
苯甲酸
1加热溶解得到苯甲酸的饱和溶液
2趁热过滤除去沙子
3冷却结晶得到苯甲酸晶体,并与NaCl分离
4过滤洗涤干燥
原理:利用物质的溶解性差异,将液体和不溶于液体的固体分离开来的一种方法。
过 滤
普通漏斗
布氏漏斗
保温漏斗
抽滤瓶
(普通)过滤
减压过滤
趁热过滤
原理:重结晶是将晶体溶于溶剂或熔融以后,又重新从溶液或熔体中结晶的过程。利用被提纯物质与杂质在同一溶剂中的溶解度不同而将其杂质。
重结晶
固体混合物
杂质:NaCl 提纯物质:KNO3
固体混合物
杂质:KNO3 提纯物质:NaCl
加热溶解得到KNO3的饱和溶液
冷却结晶
蒸发浓缩结晶
过滤洗涤干燥
加水溶解得到NaCl的饱和溶液
趁热过滤
洗涤干燥
原理:分液是把两种互不混溶的液体分离开的操作方法
分 液
原理:利用物质在两种互不相溶的溶剂中溶解度不同,使溶质物质从一种溶剂内转移到另外一种溶剂中的方法。
常见有机溶剂:乙醚、石油醚和二氯甲烷等
萃 取
(1)液—液萃取:是利用溶质在两种互不相溶的溶剂中的溶解性不同,将溶质从一种溶剂转移到另一种溶剂的过程
(2)固—液萃取:是用溶剂从固体物质中溶解某种物质的过程。(专用仪器设备)
反 萃 取
原理:萃取后加入某溶剂,将溶质从上次萃取剂中再分离出来的操作。
已知:
Cu2+(水相)+2RH(有机相) CuR(有机相)+2H+(水相)
上式反应是可逆的,在弱酸性介质中,由于反应生成的金属螯合物稳定性好,反应向右进行,即萃取反应。在强酸性介质中,上述反应向左进行,即鳌合物的金属离子将会由有机相转入水相,有机相能获得再生,这叫“反萃取”反应。
钻钼系催化剂主要用于石油炼制等工艺,从废钴钼催化剂(主要含有MnS2、CoS和Al2O3)中回收钴和钼的工艺流程如图:
(4)操作Ⅰ的名称为______。
(5)向有机相1中滴加氨水,发生的离子方程式为
_____。
(6)Co2+萃取的反应原理为,Co2+ + 2HR CoR2 + 2H+向有机相2中加入H2SO4能进行反萃取的原因是__(平衡移动解释)。
(7)水相2中的主要溶质除了,还有__(填化学式)。
(8)可用作电极,若选用电解质溶液,通电时可转化为,其电极反应式为___。
+6
SO2 MoO3
4:1
分液
已知:浸取液中的金属离子主要为、、。
(1)钼酸铵中的化合价为_____,在空气中高温焙烧
产生两种氧化物 __ (填化学式)。
(2)为了加快酸浸速率,可采取的措施为______(任写一条)。
(3)若选择两种不同萃取剂按一定比例(协萃比)协同萃取和,萃取情况如图所示,当协萃比____,更有利于的萃取。
根据Co2+ + 2HR CoR2 + 2H+可知,C(H2SO4)增大,
C(H+)增大,平衡左移
Al2(SO4)3
原理:利用吸附剂对不同有机物吸附作用的不同,分离、提纯有机物的方法。
常用的吸附剂是:碳酸钙、硅胶、氧化铝、活性炭等
色谱法
俄国植物学家茨卫特
石油醚将多种植物色素从植物中萃取后,混合液加入含CaCO3(吸附混合液,对不同的色素吸附能力不同)的柱子中,再加入冲洗剂石油醚,吸附性小的色素先取出,依次分离出不同色素。
德国化学家库恩
茨卫特的色谱实验当时并未引起人们的注意。直到25年后的1931年,德国化学家库恩在分离、提纯、确定胡萝卜素异构体和维生素的结构中,应用了色谱法,并获得1938年诺贝尔化学奖。
此后根据物质在两相(气—液、液—液等)间溶解性或吸附能力不同,分为纸上色谱法、薄层色谱法、气相色谱法、液相色谱法等
实 践 活 动
用粉笔分离菠菜叶中的色素
取5g新鲜的菠菜叶,用剪刀剪碎后放入研钵中,加入10mL无水乙醇或丙酮研磨成浆状,除去渣子,将滤液放入50mL烧杯中,再在烧杯中心垂直放置一根白粉笔。约10min后观察并记录实验现象。
元素分析与相对分子质量的测定
—— 确定有机物分子式
PART 02
通过李比希燃烧法或者现代化的元素分析仪,对元素进行定性和定量分析,从而推断出元素的种类,和每种元素的质量分数,最终得出有机物的实验室(最简式)
1、元素分析
取定量含
C H(C H O)的有机物
加氧化铜
燃烧氧化
H2O
CO2
用无水
CaCl2吸收
用KOH浓
溶液吸收
得前后质量差
得前后质量差
计算C、H含量
计算O含量
得出实验式
李比希法:
若有N元素,用燃烧法分析,生成N2
2、相对分子质量的测定——质谱法
质荷比:分子离子或碎片离子的相对质量(m)和所带电荷(e-)的比值
有机物分子
高能电子束轰击
带正电的分子离子和碎片离子
分子离子和碎片离子相对质量不同
分子失去电子
质谱图
横坐标为质荷比,最大值为分子离子的相对质量
确定分子式:有机物相对分子质量与各元素质量分数相乘,再除以各原子相对原子质量,所得数据即为分子式中各原子个数。
分 子 结 构 的 鉴 定
—— 确定有机物结构
PART 03
1、红外光谱——分子中特定化学键和官能团种类
当用红外线照射有机物时,分子中的化学健或官能团可发生振动吸收,不同的化学键或官能团吸收频率不同,在红外光谱图上将处于不同位置,从而可以获得分子中含有何种化学键或官能团的信息。
2、核磁共振氢谱——分子中等效氢种类和个数比
氢原子核具有磁性,用电磁波照射,它能通过共振吸收电磁波,发生跃迁。用核磁共振仪可以记录到有关信号,处于不同化学环境中的氢原子因产生共振时吸收的频率不同,在谱图上出现的位置也不同。且吸收峰的面积与氢原子数成正比
3、X射线衍射——键长、键角和分子的三维结构
X-射线(波长约10-8cm)与晶体中原子(或离子)间的相互作用,可以产生衍射图形。经过计算和衍射图形获得分子结构的相关信息,包括键长、键角和分子的三维结构。
一、研究有机化合物的基本步骤
分离提纯→元素定量分析以确定实验式→测定相对分子质量以确定分子式→波谱分析确定结构。
二、分离和提纯
1.蒸馏 2.重结晶 3.萃取、分液、反萃取 4.色谱法
三、元素分析与相对原子质量的测定
1.元素分析:李比希法→现代元素分析法(确定实验式)
2.相对原子质量的测定—质谱法
四、有机物分子结构的鉴定
化学方法:利用特征反应鉴定出官能团,再制备它的衍生物进一步确认。
物理方法:质谱法、红外光谱(IR)、核磁共振氢谱(H-NMR)、X-射线衍射
本节小结
研究有机化合物的一般步骤和方法
分离、提纯
01
元素分析与相对分子质量的测定
02
分子结构的鉴定
03
CONTENTS
目 录
研究有机化合物一般的基本步骤
分离、提纯
元素定量分析确定实验式
测定相对分子质量确定分子式
波谱分析确定结构式(有哪些官能团)
分离、提纯
PART 01
一、分离、提纯
分离:
将混合物中的各种物质逐一分开
提纯:
将某物质中的杂质除掉的过程
原则:
最终不增加新杂质
最终尽量不减少所得物质
过程中所得物质若发生变化,易分离易复原
物理方法:
升华、液化、分液、萃取
蒸发、过滤、结晶、重结晶
蒸馏、分馏、盐析、渗析 等
3
化学方法:
沉淀法,气体转化法
4
1
2
原理:被提纯物质与杂质沸点相差较大,较高沸点的物质不易挥发,被提纯物质的热稳定较强、受热不分解。
蒸 馏
实验:含有杂质的工业乙醇的蒸馏
在250mL蒸馏烧瓶中,通过玻璃
漏斗倒入100mL工业乙醇,再在
烧瓶中投入1—2粒素烧瓷片。装
好蒸馏装置,往冷凝器中通入冷
凝水,加热蒸馏,蒸馏产物以每
秒3—4滴为宜,分别收集以下馏
分,并记录体积。
77℃以下 77—79℃ 79℃以上
杂质甲醇:64.7℃ 杂质水:100℃ 乙醇:78.3℃
乙醇与水蒸发时易在78.15℃形成共沸物 (含95.6%乙醇,4.4%水)
检验装置气密性
原理:被提纯物质与杂质沸点相差较大,较高沸点的物质不易挥发,被提纯物质的热稳定较强、受热不分解。
蒸 馏
含杂工业乙醇
95.6%工业乙醇
无水乙醇(99.5%以上)
蒸馏
加吸水剂吸收水后再蒸馏出无水乙醇
CaO 或 MgSO4 不用CaCl2
原理:被提纯物质与杂质沸点相差较大,较高沸点的物质不易挥发,被提纯物质的热稳定较强、受热不分解。
蒸 馏
如何分离乙醇
和乙酸的混合物
乙醇、乙酸混合物
乙酸盐水溶液
乙酸
加入碱性氧化物、碱、或碳酸盐等
蒸馏
硫酸溶液
蒸馏
乙醇
硫酸盐溶液
原理:重结晶是将晶体溶于溶剂或熔融以后,又重新从溶液或熔体中结晶的过程。利用被提纯物质与杂质在同一溶剂中的溶解度不同而将其杂质。
重结晶
一般步骤:溶解、蒸发(或冷却)、结晶、过滤
杂质沙子,NaCl
提纯物质:苯甲酸
NaCl
苯甲酸
1加热溶解得到苯甲酸的饱和溶液
2趁热过滤除去沙子
3冷却结晶得到苯甲酸晶体,并与NaCl分离
4过滤洗涤干燥
原理:利用物质的溶解性差异,将液体和不溶于液体的固体分离开来的一种方法。
过 滤
普通漏斗
布氏漏斗
保温漏斗
抽滤瓶
(普通)过滤
减压过滤
趁热过滤
原理:重结晶是将晶体溶于溶剂或熔融以后,又重新从溶液或熔体中结晶的过程。利用被提纯物质与杂质在同一溶剂中的溶解度不同而将其杂质。
重结晶
固体混合物
杂质:NaCl 提纯物质:KNO3
固体混合物
杂质:KNO3 提纯物质:NaCl
加热溶解得到KNO3的饱和溶液
冷却结晶
蒸发浓缩结晶
过滤洗涤干燥
加水溶解得到NaCl的饱和溶液
趁热过滤
洗涤干燥
原理:分液是把两种互不混溶的液体分离开的操作方法
分 液
原理:利用物质在两种互不相溶的溶剂中溶解度不同,使溶质物质从一种溶剂内转移到另外一种溶剂中的方法。
常见有机溶剂:乙醚、石油醚和二氯甲烷等
萃 取
(1)液—液萃取:是利用溶质在两种互不相溶的溶剂中的溶解性不同,将溶质从一种溶剂转移到另一种溶剂的过程
(2)固—液萃取:是用溶剂从固体物质中溶解某种物质的过程。(专用仪器设备)
反 萃 取
原理:萃取后加入某溶剂,将溶质从上次萃取剂中再分离出来的操作。
已知:
Cu2+(水相)+2RH(有机相) CuR(有机相)+2H+(水相)
上式反应是可逆的,在弱酸性介质中,由于反应生成的金属螯合物稳定性好,反应向右进行,即萃取反应。在强酸性介质中,上述反应向左进行,即鳌合物的金属离子将会由有机相转入水相,有机相能获得再生,这叫“反萃取”反应。
钻钼系催化剂主要用于石油炼制等工艺,从废钴钼催化剂(主要含有MnS2、CoS和Al2O3)中回收钴和钼的工艺流程如图:
(4)操作Ⅰ的名称为______。
(5)向有机相1中滴加氨水,发生的离子方程式为
_____。
(6)Co2+萃取的反应原理为,Co2+ + 2HR CoR2 + 2H+向有机相2中加入H2SO4能进行反萃取的原因是__(平衡移动解释)。
(7)水相2中的主要溶质除了,还有__(填化学式)。
(8)可用作电极,若选用电解质溶液,通电时可转化为,其电极反应式为___。
+6
SO2 MoO3
4:1
分液
已知:浸取液中的金属离子主要为、、。
(1)钼酸铵中的化合价为_____,在空气中高温焙烧
产生两种氧化物 __ (填化学式)。
(2)为了加快酸浸速率,可采取的措施为______(任写一条)。
(3)若选择两种不同萃取剂按一定比例(协萃比)协同萃取和,萃取情况如图所示,当协萃比____,更有利于的萃取。
根据Co2+ + 2HR CoR2 + 2H+可知,C(H2SO4)增大,
C(H+)增大,平衡左移
Al2(SO4)3
原理:利用吸附剂对不同有机物吸附作用的不同,分离、提纯有机物的方法。
常用的吸附剂是:碳酸钙、硅胶、氧化铝、活性炭等
色谱法
俄国植物学家茨卫特
石油醚将多种植物色素从植物中萃取后,混合液加入含CaCO3(吸附混合液,对不同的色素吸附能力不同)的柱子中,再加入冲洗剂石油醚,吸附性小的色素先取出,依次分离出不同色素。
德国化学家库恩
茨卫特的色谱实验当时并未引起人们的注意。直到25年后的1931年,德国化学家库恩在分离、提纯、确定胡萝卜素异构体和维生素的结构中,应用了色谱法,并获得1938年诺贝尔化学奖。
此后根据物质在两相(气—液、液—液等)间溶解性或吸附能力不同,分为纸上色谱法、薄层色谱法、气相色谱法、液相色谱法等
实 践 活 动
用粉笔分离菠菜叶中的色素
取5g新鲜的菠菜叶,用剪刀剪碎后放入研钵中,加入10mL无水乙醇或丙酮研磨成浆状,除去渣子,将滤液放入50mL烧杯中,再在烧杯中心垂直放置一根白粉笔。约10min后观察并记录实验现象。
元素分析与相对分子质量的测定
—— 确定有机物分子式
PART 02
通过李比希燃烧法或者现代化的元素分析仪,对元素进行定性和定量分析,从而推断出元素的种类,和每种元素的质量分数,最终得出有机物的实验室(最简式)
1、元素分析
取定量含
C H(C H O)的有机物
加氧化铜
燃烧氧化
H2O
CO2
用无水
CaCl2吸收
用KOH浓
溶液吸收
得前后质量差
得前后质量差
计算C、H含量
计算O含量
得出实验式
李比希法:
若有N元素,用燃烧法分析,生成N2
2、相对分子质量的测定——质谱法
质荷比:分子离子或碎片离子的相对质量(m)和所带电荷(e-)的比值
有机物分子
高能电子束轰击
带正电的分子离子和碎片离子
分子离子和碎片离子相对质量不同
分子失去电子
质谱图
横坐标为质荷比,最大值为分子离子的相对质量
确定分子式:有机物相对分子质量与各元素质量分数相乘,再除以各原子相对原子质量,所得数据即为分子式中各原子个数。
分 子 结 构 的 鉴 定
—— 确定有机物结构
PART 03
1、红外光谱——分子中特定化学键和官能团种类
当用红外线照射有机物时,分子中的化学健或官能团可发生振动吸收,不同的化学键或官能团吸收频率不同,在红外光谱图上将处于不同位置,从而可以获得分子中含有何种化学键或官能团的信息。
2、核磁共振氢谱——分子中等效氢种类和个数比
氢原子核具有磁性,用电磁波照射,它能通过共振吸收电磁波,发生跃迁。用核磁共振仪可以记录到有关信号,处于不同化学环境中的氢原子因产生共振时吸收的频率不同,在谱图上出现的位置也不同。且吸收峰的面积与氢原子数成正比
3、X射线衍射——键长、键角和分子的三维结构
X-射线(波长约10-8cm)与晶体中原子(或离子)间的相互作用,可以产生衍射图形。经过计算和衍射图形获得分子结构的相关信息,包括键长、键角和分子的三维结构。
一、研究有机化合物的基本步骤
分离提纯→元素定量分析以确定实验式→测定相对分子质量以确定分子式→波谱分析确定结构。
二、分离和提纯
1.蒸馏 2.重结晶 3.萃取、分液、反萃取 4.色谱法
三、元素分析与相对原子质量的测定
1.元素分析:李比希法→现代元素分析法(确定实验式)
2.相对原子质量的测定—质谱法
四、有机物分子结构的鉴定
化学方法:利用特征反应鉴定出官能团,再制备它的衍生物进一步确认。
物理方法:质谱法、红外光谱(IR)、核磁共振氢谱(H-NMR)、X-射线衍射
本节小结
