鲁科版必修1 第三章 自然界中的元素 单元测试试卷(有解析)
文档属性
| 名称 | 鲁科版必修1 第三章 自然界中的元素 单元测试试卷(有解析) |  | |
| 格式 | zip | ||
| 文件大小 | 211.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-09-20 18:58:28 | ||
图片预览



文档简介
第3章 自然界中的元素
建议用时
实际用时
满分
实际得分
90分钟
100分
一、选择题(每小题3分,共45分)
1.下列说法从化学角度分析不正确的是( )
A.在一定条件下可将石墨转化为金刚石
B.绝大多数金属都能与硝酸反应,但不放出
氢气
C.制取镁粉时,可将镁蒸气在氮气中冷却
D.SO2能使品红溶液退色,但不能使紫色石
蕊溶液退色
2.下列有关引起环境问题的说法不正确的
是( )
A.温室效应主要与二氧化碳及烃类有关
B.光化学烟雾主要与碳的氧化物有关
C.酸雨主要与硫的氧化物排放有关
D.臭氧层空洞主要与氟利昂及氮的氧化物
有关
3.某溶液中可能含有、、。向该溶
液中加入溴水发生反应后溶液呈无色,由
此可知原溶液中( )
A.肯定不含
B.肯定不含
C.肯定含有
D.肯定不含
4.近年来,冠以“绿色”的新概念不断产生,
如绿色食品、绿色材料、绿色能源、绿色
化学等,这里的“绿色”是对人类社会可
持续发展战略的形象表述。“绿色化学”要
求从经济、环保和技术上设计可行的化学
反应。据此,由单质镁制硝酸镁的下列4
种方案中,你认为可行而且符合“绿色化
学”要求的是( )
A.MgMg(NO3)2
B.MgMgCl2Mg(OH)2
Mg(NO3)2
C.MgMgO Mg(NO3)2
D.MgMgSO4 Mg(NO3)2
5.下列反应体现了SO2的漂白性的是( )
A.SO2通入红色的酚酞溶液中,溶液由红色
变为无色
B.SO2通入品红溶液中,使品红退色
C.SO2通入酸性高锰酸钾溶液中,溶液的紫
色退去
D.SO2通入溴水中,溴水由橙色变为无色
6.下列说法中正确的是( )
A.氨能在空气中燃烧,生成N2和水
B.NO2溶于水生成HNO3,所以NO2是硝酸
的酸酐
C.所有的铵盐加热分解都能产生NH3
D.铜与浓硝酸反应时,硝酸既表现氧化性又
表现酸性
7.对于某些离子的检验及结论一定正确的
是( )
A.加入稀盐酸产生无色气体,将气体通入澄
清石灰水中,溶液变浑浊,则原溶液中
一定有
B.加入氯化钡溶液有白色沉淀产生,再加盐
酸,沉淀不消失,则原溶液中一定有
C.加入氢氧化钠溶液并加热,产生的气体能
使湿润的红色石蕊试纸变蓝,则原溶液
中一定有
D.加入碳酸钠溶液产生白色沉淀,再加盐酸,
白色沉淀消失,则原溶液中一定有
8.盐X与氢氧化钠共热,可放出无色气体Y,
Y经一系列氧化后再溶于水可得Z溶液,Y
和Z溶液反应又生成X,则X可能是下列
中的( )
A.NH4HCO3 B.NH4NO3
C.(NH4)2SO4 D.NH4Br
9.铁粉和铜粉的均匀混合物平均分成四等份,
分别加入同浓度的稀硝酸中,充分反应,
在标准状况下生成NO的体积和剩余金属
的质量如下表(设硝酸的还原产物只有
NO):
编号
①
②
③
④
稀硝酸体积/mL
100
200
300
400
剩余金属质量/g
18.0
9.6
0
0
NO体积/mL
2 240
4 480
6 720
V
经计算分析,下列推断正确的是( )
A.①中溶解了5.6 g Fe
B.硝酸的浓度为4 mol
C.②中溶解了9.6 g Cu
D.④中V=6 720
10.下列有关碳酸钠和碳酸氢钠的性质的叙述
中,错误的是( )
A.等质量的Na2CO3、NaHCO3与足量的盐
酸反应,在相同条件下Na2CO3产生CO2
的体积大
B.等物质的量的Na2CO3和NaHCO3与同
浓度的足量盐酸反应,Na2CO3所消耗盐
酸的体积是NaHCO3的两倍
C.将石灰水加入NaHCO3溶液中不会产生
沉淀,加入Na2CO3溶液中会产生沉淀
D等物质的量的NaHCO3和Na2CO3与足
量Ba(OH)2溶液反应,所得沉淀的质量
相等
11.下列关于浓硝酸和浓硫酸的叙述,正确的
是( )
A.常温下都能用铝制容器贮存
B.露置在空气中,容器内酸液的质量都
减轻
C.常温下都能与铜较快地反应
D.露置在空气中,容器内酸液的浓度都降
低
12.按下图装置持续通入X气体,并在管口P
处点燃,实验结果是澄清的石灰水变浑浊,
则X、Y可能是( )
A.H2和NaHCO3
B.CO和Na2CO3
C.CO和CuO
D.H2和Fe2O3
13.把3 mL NO2气体依次通过下列3个分别装
有足量的①饱和NaHCO3溶液,②浓硫酸,
③Na2O2固体的装置后,用排水法把残留
气体收集到集气瓶中,集气瓶内的气体应
是( )
A.1 mL NO
B.2 mL NO2和0.5 mL O2
C.2 mL O2
D.0.25 mL O2
14.把含有某一种氯化物杂质的氯化镁粉末
95 mg溶于水后,与足量的硝酸银溶液反
应,生成氯化银沉淀300 mg,则该氯化镁
粉末中的杂质可能是( )
A.氯化钠 B.氯化铝
C.氯化钾 D.氯化钙
15.甲、乙、丙三种溶液各含有一种(为
、或),向甲中加入淀粉溶液和氯
水,则溶液变为橙色,再加丙溶液,颜色
无明显变化,则甲、乙、丙溶液依次含
有( )
A.、
B.、
C.、
D.
二、非选择题(共55分)
16.Ⅰ.如下图所示,A、B、C是实验室常用的
三种制取气体的装置,提供的药品有:大
理石、浓盐酸、稀盐酸、锌粒、二氧化锰、
氯化铵、熟石灰。现欲利用这些药品分别
制取NH3、Cl2、H2、CO2四种气体,试回
答以下问题:
(1)选用装置A可制取的气体有________
_______;选用装置B可制取的气体有____
_________;通常选用装置C可制取的气体
有__________。
(2)写出利用上述有关药品制取氨气的
化学方程式:________________。若要制
得干燥的氨气,可选用下列干燥剂中的__
_____(填序号)。
a.CaCl2 b.浓硫酸
c.五氧化二磷 d.碱石灰
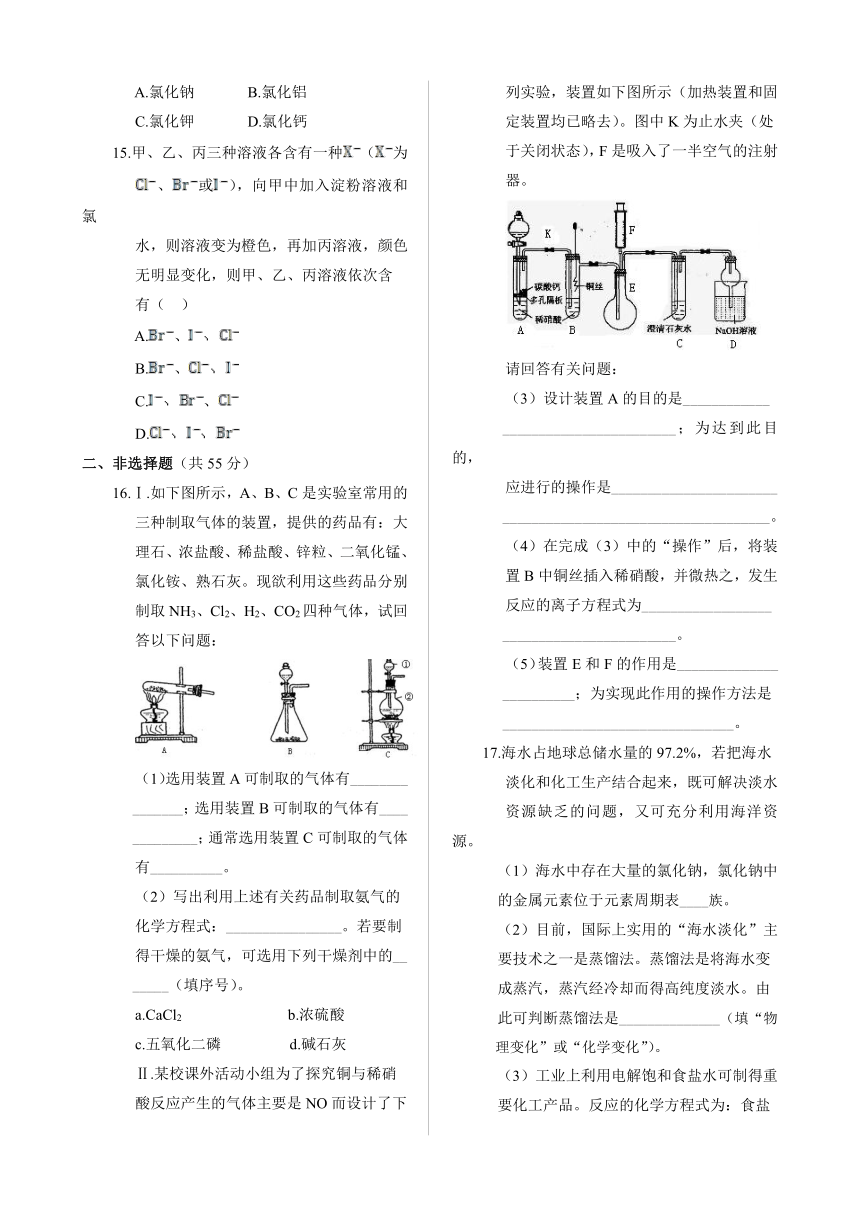
Ⅱ.某校课外活动小组为了探究铜与稀硝
酸反应产生的气体主要是NO而设计了下
列实验,装置如下图所示(加热装置和固
定装置均已略去)。图中K为止水夹(处
于关闭状态),F是吸入了一半空气的注射
器。
请回答有关问题:
(3)设计装置A的目的是____________
________________________;为达到此目的,
应进行的操作是_______________________
_____________________________________。
(4)在完成(3)中的“操作”后,将装
置B中铜丝插入稀硝酸,并微热之,发生
反应的离子方程式为__________________
________________________。
(5)装置E和F的作用是______________
__________;为实现此作用的操作方法是
________________________________。
17.海水占地球总储水量的97.2%,若把海水
淡化和化工生产结合起来,既可解决淡水
资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中
的金属元素位于元素周期表____族。
(2)目前,国际上实用的“海水淡化”主
要技术之一是蒸馏法。蒸馏法是将海水变
成蒸汽,蒸汽经冷却而得高纯度淡水。由
此可判断蒸馏法是______________(填“物
理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重
要化工产品。反应的化学方程式为:食盐
+H2ONaOH+H2↑+Cl2↑(未配平),
该反应中食盐的化学式是________;利用电
解所得气体制36.5%的浓盐酸1 000 t,最少
需消耗食盐______t。(可能需要的相对原子质
量:Na-23;Cl-35.5;H-1;O-16)
(4)近年来,有人提出了一种利用氯碱工
业产品及氯化钠循环治理含二氧化硫废气
并回收二氧化硫的方法。该方法流程如下
图所示:
请写出②④反应的化学方程式___________
__________,__________________________。
18.有三种不同质量比的氧化铜与炭粉的混合
物样品①、②、③,甲、乙、丙三位同学
各取一种样品,加强热充分反应,测定各
样品中氧化铜的量。
(1)甲取样品①加强热,若所得固体为金
属铜,将其置于足量的稀硝酸中微热,产
生1.12 L气体(标准状况下),则样品①中
氧化铜的质量为______g。
(2)乙取样品②a g加强热,生成的气体
不能使澄清的石灰水变浑浊。再将反应后
的固体与足量的稀硝酸微热,充分反应后,
有b g固体剩余,则该剩余固体的化学式为
______。样品②中氧化铜的质量为______g
(以含a、b的代数式表示)。
(3)丙称量样品③加强热后,剩余固体的
质量比原样品减少了c g,若设固体为金属
铜,则样品③中氧化铜的物质的量(n)的
取值范围为____________。
19.取一根镁条置于坩埚内点燃,得到氧化镁
和氮化镁混合物的总质量为0.470 g。冷却
后加入足量水,将反应产物加热蒸干并灼
烧,得到氧化镁的质量为0.486 g。
(1)写出镁在空气中燃烧的所有化学方
程式。
(2)写出氮化镁与水反应生成氢氧化镁
和氨的化学方程式。
(3)计算燃烧所得混合物中氮化镁的质
量分数。
20.将8.8 g FeS固体置于200 mL 2.0 mol
的足量盐酸中,以制备H2S气体。反应完
全后,溶液中H2S的浓度为0.10 mol
(假定溶液体积不变)。试计算:
(1)收集到的H2S气体的体积(标准状况
下)。
(2)溶液中的物质的量浓度。
参考答案
1.C 解析:Mg可与N2反应,故不能在N2中冷却。
2.B 解析:光化学烟雾由氮的氧化物引起。
3.A 解析:若存在,会被Br2氧化成I2,使溶液变为棕黄色,而题目说反应后溶液为无色,故一定有,一定没有,可能含有。
4.C 解析:选项C节约HNO3且污染小。
5.B 解析:选项A体现了SO2溶于水显酸性,选项C、D体现了SO2的还原性,只有选项B体现SO2的漂白性。
6.D 解析:氨不能在空气中燃烧,但可在催化剂存在下且在高温条件下被氧气氧化为NO;NO2溶于水反应时除生成HNO3外,还生成NO,因此NO2不是硝酸的酸酐,N2O5才是硝酸的酸酐;并不是所有的铵盐在受热分解时都能产生氨气;铜与浓硝酸反应时,浓硝酸一部分被还原为NO2,硝酸表现出氧化性,一部分与结合生成硝酸盐,硝酸表现出酸性。
7.C 解析:选项A不正确,加入盐酸产生的无色气体能使澄清石灰水变浑浊,可以是CO2,也可以是SO2,所以溶液中可能含有或。选项B不正确,加入BaCl2溶液产生白色沉淀,再加盐酸沉淀不消失,白色沉淀可以是BaSO4,也可以是AgCl,所以溶液中可能含有或。选项D不正确,加入Na2CO3溶液产生白色沉淀,再加入盐酸沉淀消失,沉淀可以是BaCO3、CaCO3、MgCO3等,所以此选项的说法不对。
8.B 解析:题给反应的路线为:
NH3NONO2HNO3NH4NO3。
9.B 解析:按①②③每增加100 mL硝酸,相应多产生2 240 mL气体,但多溶解的金属质量不相等。开始溶解铁为,后溶解Cu为,再后为硝酸氧化为。到③恰好金属完全溶解。3M+8+23+2NO↑+4H2O,由③得300 mL硝酸中溶质的物质的量为1.2 mol,硝酸浓度为
4 mol。
10.AC 解析:等质量的Na2CO3、NaHCO3,n(Na2CO3)11.AD 解析:常温下浓硫酸和浓硝酸都能使铝钝化,因而都能用铝制容器贮存;露置在空气中时,由于浓硝酸易挥发,导致酸液的质量减轻,浓度降低,而浓硫酸的吸水性强,导致酸液的质量增加,浓度降低;常温下浓硫酸与铜不反应,而浓硝酸可与铜较快地反应。
12.AC 解析:选项A:2NaHCO3Na2CO3+CO2↑+H2O,H2可燃;选项B:Na2CO3受热不分解,无CO2放出;选项C:CO+CuOCu+CO2,CO可燃;选项D;无CO2生成。
13.D 解析:反应过程及气体成分、体积如下所示:?
14.B 解析:95 mg MgCl2生成AgCl的质量为287 mg,而题给沉淀质量为300 mg,这表明氯化物杂质中氯的含量一定比氯化镁中氯的含量高。因含1 mol Cl元素时MgCl2中含Mg的质量为12 g,则题给各选项含1 mol Cl元素时若所含金属元素的质量小于12 g即合题意。
15.A 解析:向甲中加入淀粉溶液和氯水,溶液变为橙色,应是溴水的颜色,则甲中必含有,被Cl2置换生成了Br2,由此否定了C、D,再加丙溶液,颜色无明显变化,说明丙溶液中不含,否则加入后应被Br2所置换,生成I2,溶液应为黄褐色,与题给条件不符,则丙溶液只能含有,必在乙溶液中,因此甲、乙、丙溶液依次含有、、。
16. (1)NH3 H2、CO2 Cl2
(2)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O d
(3)利用生成的二氧化碳将整套装置内的空气赶尽,避免NO和氧气反应生成的二氧化氮对气体产物的观察产生干扰 打开止水夹K,当装置C中产白色沉淀时,再关闭止水夹K
(4)3Cu+8+23+2NO↑+4H2O
(5)验证无色气体为NO 将注射器F中的空气推入E中或将E中的无色气体吸入到注射器中
解析:Ⅰ.结合药品和装置,A可加热氯化铵和熟石灰的固体混合物制得NH3。B可用稀盐酸和锌粒制H2,也可用大量石灰石和稀盐酸制CO2。C可加热二氧化锰和浓盐酸制Cl2。干燥NH3只能用碱石灰。
Ⅱ.排尽整套装置中的空气是实验的关键。通过A中产生的CO2来排尽装置中的空气,通过C中澄清石灰水变浑浊来确认装置中空气已排尽。
17.(1)ⅠA
(2)物理变化
(3)NaCl 585
(4)NaOH+SO2NaHSO3 NaHSO3+HClNaCl+H2O+SO2↑
解析:(1)钠元素位于元素周期表ⅠA族。
(2)蒸馏过程中没有新物质生成,因此蒸馏为物理变化。
(3)经配平后的电解饱和食盐水的化学方程式为:2NaCl+2H2O2NaOH+H2↑+Cl2↑,据此可计算出结果,或者不写出化学方程式,根据Cl原子守恒,即反应前后Cl原子的物质的量不变,可知最少需消耗食盐的质量为1 000 t×36.5%÷36.5 g×58.5 g=585 t。
18.(1)6.0
(2)C
(3)l≤n≤ mol?
解析:(1)该实验中发生的反应为:3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O?
简化为如下关系:CuO~Cu~NO
所以原混合物中CuO的质量为××80 g=6.0 g。
(2)该实验中发生的反应为:?
CuO+CCu+CO↑?
3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O?
剩余的固体为C,质量为b g,所以反应中实际消耗C和CuO的总质量为(a-b) g。其中CuO的质量为×80= g。?
(3)该实验发生的反应可能为:?
CuO+CCu+CO↑ ①?
2CuO+C2Cu+CO2↑ ②?
加强热后固体质量减少了c g,说明产生了c g气体。?
如果只发生反应①,产生c g CO气体,则CuO的物质的量为 mol;?
如果只发生反应②,产生c g CO2气体,则CuO的物质的量为 mol×2= mol。?
所以,n的取值范围为: mol≤n≤ mol。
19. (1)2Mg+O2MgO,3Mg+N2Mg3N2 ,2Mg+CO22MgO+C?
(2)Mg3N2+6H2O3Mg(OH)2+2NH3↑?
(3)17%
解析:第(3)题设原混合物中Mg3N2的质量为m1,由Mg3N2生成的MgO的质量为m2,
Mg3N2 ~ 3MgO
100 120
? m1 ?m2
则m2=
依题意有(0.470 g-m1)+=0.486 g,解得m1=0.080 g。?
故燃烧所得混合物中Mg3N2的质量分数为×100%=17%。
20. (1)1.8 L
(2)c()=0.50 mol,c()=1.0 mol。?
解析:(1)求收集到的H2S气体的体积。?
? n(FeS)==0.10 mol,?
? n(HCl)=2.0 mol×0.20 L=0.40 mol,?
根据反应的离子方程式:FeS+2+H2S↑,可判断盐酸过量,计算时应以FeS的物质的量为基准。则共生成H2S 0.10 mol。?
由已知:溶液中H2S的溶解量为0.1 mol×0.20 L=0.020 mol。
? 可得收集到的H2S的物质的量为0.10 mol-0.02 mol=0.08 mol,体积为0.08 mol×22.4 L=1.8 L。? (2)求溶液中和的物质的量浓度。?
因为FeS不足,故全部溶解。?
所以n()=n(FeS)=0.10 mol。?
则:c()==0.50 mol。?
反应前:n()=2.0 mol×0.20 L=0.40 mol。?
反应中消耗 0.20 mol。?
反应后溶液中c()==1.0 mol。
建议用时
实际用时
满分
实际得分
90分钟
100分
一、选择题(每小题3分,共45分)
1.下列说法从化学角度分析不正确的是( )
A.在一定条件下可将石墨转化为金刚石
B.绝大多数金属都能与硝酸反应,但不放出
氢气
C.制取镁粉时,可将镁蒸气在氮气中冷却
D.SO2能使品红溶液退色,但不能使紫色石
蕊溶液退色
2.下列有关引起环境问题的说法不正确的
是( )
A.温室效应主要与二氧化碳及烃类有关
B.光化学烟雾主要与碳的氧化物有关
C.酸雨主要与硫的氧化物排放有关
D.臭氧层空洞主要与氟利昂及氮的氧化物
有关
3.某溶液中可能含有、、。向该溶
液中加入溴水发生反应后溶液呈无色,由
此可知原溶液中( )
A.肯定不含
B.肯定不含
C.肯定含有
D.肯定不含
4.近年来,冠以“绿色”的新概念不断产生,
如绿色食品、绿色材料、绿色能源、绿色
化学等,这里的“绿色”是对人类社会可
持续发展战略的形象表述。“绿色化学”要
求从经济、环保和技术上设计可行的化学
反应。据此,由单质镁制硝酸镁的下列4
种方案中,你认为可行而且符合“绿色化
学”要求的是( )
A.MgMg(NO3)2
B.MgMgCl2Mg(OH)2
Mg(NO3)2
C.MgMgO Mg(NO3)2
D.MgMgSO4 Mg(NO3)2
5.下列反应体现了SO2的漂白性的是( )
A.SO2通入红色的酚酞溶液中,溶液由红色
变为无色
B.SO2通入品红溶液中,使品红退色
C.SO2通入酸性高锰酸钾溶液中,溶液的紫
色退去
D.SO2通入溴水中,溴水由橙色变为无色
6.下列说法中正确的是( )
A.氨能在空气中燃烧,生成N2和水
B.NO2溶于水生成HNO3,所以NO2是硝酸
的酸酐
C.所有的铵盐加热分解都能产生NH3
D.铜与浓硝酸反应时,硝酸既表现氧化性又
表现酸性
7.对于某些离子的检验及结论一定正确的
是( )
A.加入稀盐酸产生无色气体,将气体通入澄
清石灰水中,溶液变浑浊,则原溶液中
一定有
B.加入氯化钡溶液有白色沉淀产生,再加盐
酸,沉淀不消失,则原溶液中一定有
C.加入氢氧化钠溶液并加热,产生的气体能
使湿润的红色石蕊试纸变蓝,则原溶液
中一定有
D.加入碳酸钠溶液产生白色沉淀,再加盐酸,
白色沉淀消失,则原溶液中一定有
8.盐X与氢氧化钠共热,可放出无色气体Y,
Y经一系列氧化后再溶于水可得Z溶液,Y
和Z溶液反应又生成X,则X可能是下列
中的( )
A.NH4HCO3 B.NH4NO3
C.(NH4)2SO4 D.NH4Br
9.铁粉和铜粉的均匀混合物平均分成四等份,
分别加入同浓度的稀硝酸中,充分反应,
在标准状况下生成NO的体积和剩余金属
的质量如下表(设硝酸的还原产物只有
NO):
编号
①
②
③
④
稀硝酸体积/mL
100
200
300
400
剩余金属质量/g
18.0
9.6
0
0
NO体积/mL
2 240
4 480
6 720
V
经计算分析,下列推断正确的是( )
A.①中溶解了5.6 g Fe
B.硝酸的浓度为4 mol
C.②中溶解了9.6 g Cu
D.④中V=6 720
10.下列有关碳酸钠和碳酸氢钠的性质的叙述
中,错误的是( )
A.等质量的Na2CO3、NaHCO3与足量的盐
酸反应,在相同条件下Na2CO3产生CO2
的体积大
B.等物质的量的Na2CO3和NaHCO3与同
浓度的足量盐酸反应,Na2CO3所消耗盐
酸的体积是NaHCO3的两倍
C.将石灰水加入NaHCO3溶液中不会产生
沉淀,加入Na2CO3溶液中会产生沉淀
D等物质的量的NaHCO3和Na2CO3与足
量Ba(OH)2溶液反应,所得沉淀的质量
相等
11.下列关于浓硝酸和浓硫酸的叙述,正确的
是( )
A.常温下都能用铝制容器贮存
B.露置在空气中,容器内酸液的质量都
减轻
C.常温下都能与铜较快地反应
D.露置在空气中,容器内酸液的浓度都降
低
12.按下图装置持续通入X气体,并在管口P
处点燃,实验结果是澄清的石灰水变浑浊,
则X、Y可能是( )
A.H2和NaHCO3
B.CO和Na2CO3
C.CO和CuO
D.H2和Fe2O3
13.把3 mL NO2气体依次通过下列3个分别装
有足量的①饱和NaHCO3溶液,②浓硫酸,
③Na2O2固体的装置后,用排水法把残留
气体收集到集气瓶中,集气瓶内的气体应
是( )
A.1 mL NO
B.2 mL NO2和0.5 mL O2
C.2 mL O2
D.0.25 mL O2
14.把含有某一种氯化物杂质的氯化镁粉末
95 mg溶于水后,与足量的硝酸银溶液反
应,生成氯化银沉淀300 mg,则该氯化镁
粉末中的杂质可能是( )
A.氯化钠 B.氯化铝
C.氯化钾 D.氯化钙
15.甲、乙、丙三种溶液各含有一种(为
、或),向甲中加入淀粉溶液和氯
水,则溶液变为橙色,再加丙溶液,颜色
无明显变化,则甲、乙、丙溶液依次含
有( )
A.、
B.、
C.、
D.
二、非选择题(共55分)
16.Ⅰ.如下图所示,A、B、C是实验室常用的
三种制取气体的装置,提供的药品有:大
理石、浓盐酸、稀盐酸、锌粒、二氧化锰、
氯化铵、熟石灰。现欲利用这些药品分别
制取NH3、Cl2、H2、CO2四种气体,试回
答以下问题:
(1)选用装置A可制取的气体有________
_______;选用装置B可制取的气体有____
_________;通常选用装置C可制取的气体
有__________。
(2)写出利用上述有关药品制取氨气的
化学方程式:________________。若要制
得干燥的氨气,可选用下列干燥剂中的__
_____(填序号)。
a.CaCl2 b.浓硫酸
c.五氧化二磷 d.碱石灰
Ⅱ.某校课外活动小组为了探究铜与稀硝
酸反应产生的气体主要是NO而设计了下
列实验,装置如下图所示(加热装置和固
定装置均已略去)。图中K为止水夹(处
于关闭状态),F是吸入了一半空气的注射
器。
请回答有关问题:
(3)设计装置A的目的是____________
________________________;为达到此目的,
应进行的操作是_______________________
_____________________________________。
(4)在完成(3)中的“操作”后,将装
置B中铜丝插入稀硝酸,并微热之,发生
反应的离子方程式为__________________
________________________。
(5)装置E和F的作用是______________
__________;为实现此作用的操作方法是
________________________________。
17.海水占地球总储水量的97.2%,若把海水
淡化和化工生产结合起来,既可解决淡水
资源缺乏的问题,又可充分利用海洋资源。
(1)海水中存在大量的氯化钠,氯化钠中
的金属元素位于元素周期表____族。
(2)目前,国际上实用的“海水淡化”主
要技术之一是蒸馏法。蒸馏法是将海水变
成蒸汽,蒸汽经冷却而得高纯度淡水。由
此可判断蒸馏法是______________(填“物
理变化”或“化学变化”)。
(3)工业上利用电解饱和食盐水可制得重
要化工产品。反应的化学方程式为:食盐
+H2ONaOH+H2↑+Cl2↑(未配平),
该反应中食盐的化学式是________;利用电
解所得气体制36.5%的浓盐酸1 000 t,最少
需消耗食盐______t。(可能需要的相对原子质
量:Na-23;Cl-35.5;H-1;O-16)
(4)近年来,有人提出了一种利用氯碱工
业产品及氯化钠循环治理含二氧化硫废气
并回收二氧化硫的方法。该方法流程如下
图所示:
请写出②④反应的化学方程式___________
__________,__________________________。
18.有三种不同质量比的氧化铜与炭粉的混合
物样品①、②、③,甲、乙、丙三位同学
各取一种样品,加强热充分反应,测定各
样品中氧化铜的量。
(1)甲取样品①加强热,若所得固体为金
属铜,将其置于足量的稀硝酸中微热,产
生1.12 L气体(标准状况下),则样品①中
氧化铜的质量为______g。
(2)乙取样品②a g加强热,生成的气体
不能使澄清的石灰水变浑浊。再将反应后
的固体与足量的稀硝酸微热,充分反应后,
有b g固体剩余,则该剩余固体的化学式为
______。样品②中氧化铜的质量为______g
(以含a、b的代数式表示)。
(3)丙称量样品③加强热后,剩余固体的
质量比原样品减少了c g,若设固体为金属
铜,则样品③中氧化铜的物质的量(n)的
取值范围为____________。
19.取一根镁条置于坩埚内点燃,得到氧化镁
和氮化镁混合物的总质量为0.470 g。冷却
后加入足量水,将反应产物加热蒸干并灼
烧,得到氧化镁的质量为0.486 g。
(1)写出镁在空气中燃烧的所有化学方
程式。
(2)写出氮化镁与水反应生成氢氧化镁
和氨的化学方程式。
(3)计算燃烧所得混合物中氮化镁的质
量分数。
20.将8.8 g FeS固体置于200 mL 2.0 mol
的足量盐酸中,以制备H2S气体。反应完
全后,溶液中H2S的浓度为0.10 mol
(假定溶液体积不变)。试计算:
(1)收集到的H2S气体的体积(标准状况
下)。
(2)溶液中的物质的量浓度。
参考答案
1.C 解析:Mg可与N2反应,故不能在N2中冷却。
2.B 解析:光化学烟雾由氮的氧化物引起。
3.A 解析:若存在,会被Br2氧化成I2,使溶液变为棕黄色,而题目说反应后溶液为无色,故一定有,一定没有,可能含有。
4.C 解析:选项C节约HNO3且污染小。
5.B 解析:选项A体现了SO2溶于水显酸性,选项C、D体现了SO2的还原性,只有选项B体现SO2的漂白性。
6.D 解析:氨不能在空气中燃烧,但可在催化剂存在下且在高温条件下被氧气氧化为NO;NO2溶于水反应时除生成HNO3外,还生成NO,因此NO2不是硝酸的酸酐,N2O5才是硝酸的酸酐;并不是所有的铵盐在受热分解时都能产生氨气;铜与浓硝酸反应时,浓硝酸一部分被还原为NO2,硝酸表现出氧化性,一部分与结合生成硝酸盐,硝酸表现出酸性。
7.C 解析:选项A不正确,加入盐酸产生的无色气体能使澄清石灰水变浑浊,可以是CO2,也可以是SO2,所以溶液中可能含有或。选项B不正确,加入BaCl2溶液产生白色沉淀,再加盐酸沉淀不消失,白色沉淀可以是BaSO4,也可以是AgCl,所以溶液中可能含有或。选项D不正确,加入Na2CO3溶液产生白色沉淀,再加入盐酸沉淀消失,沉淀可以是BaCO3、CaCO3、MgCO3等,所以此选项的说法不对。
8.B 解析:题给反应的路线为:
NH3NONO2HNO3NH4NO3。
9.B 解析:按①②③每增加100 mL硝酸,相应多产生2 240 mL气体,但多溶解的金属质量不相等。开始溶解铁为,后溶解Cu为,再后为硝酸氧化为。到③恰好金属完全溶解。3M+8+23+2NO↑+4H2O,由③得300 mL硝酸中溶质的物质的量为1.2 mol,硝酸浓度为
4 mol。
10.AC 解析:等质量的Na2CO3、NaHCO3,n(Na2CO3)
12.AC 解析:选项A:2NaHCO3Na2CO3+CO2↑+H2O,H2可燃;选项B:Na2CO3受热不分解,无CO2放出;选项C:CO+CuOCu+CO2,CO可燃;选项D;无CO2生成。
13.D 解析:反应过程及气体成分、体积如下所示:?
14.B 解析:95 mg MgCl2生成AgCl的质量为287 mg,而题给沉淀质量为300 mg,这表明氯化物杂质中氯的含量一定比氯化镁中氯的含量高。因含1 mol Cl元素时MgCl2中含Mg的质量为12 g,则题给各选项含1 mol Cl元素时若所含金属元素的质量小于12 g即合题意。
15.A 解析:向甲中加入淀粉溶液和氯水,溶液变为橙色,应是溴水的颜色,则甲中必含有,被Cl2置换生成了Br2,由此否定了C、D,再加丙溶液,颜色无明显变化,说明丙溶液中不含,否则加入后应被Br2所置换,生成I2,溶液应为黄褐色,与题给条件不符,则丙溶液只能含有,必在乙溶液中,因此甲、乙、丙溶液依次含有、、。
16. (1)NH3 H2、CO2 Cl2
(2)2NH4Cl+Ca(OH)2CaCl2+2NH3↑+2H2O d
(3)利用生成的二氧化碳将整套装置内的空气赶尽,避免NO和氧气反应生成的二氧化氮对气体产物的观察产生干扰 打开止水夹K,当装置C中产白色沉淀时,再关闭止水夹K
(4)3Cu+8+23+2NO↑+4H2O
(5)验证无色气体为NO 将注射器F中的空气推入E中或将E中的无色气体吸入到注射器中
解析:Ⅰ.结合药品和装置,A可加热氯化铵和熟石灰的固体混合物制得NH3。B可用稀盐酸和锌粒制H2,也可用大量石灰石和稀盐酸制CO2。C可加热二氧化锰和浓盐酸制Cl2。干燥NH3只能用碱石灰。
Ⅱ.排尽整套装置中的空气是实验的关键。通过A中产生的CO2来排尽装置中的空气,通过C中澄清石灰水变浑浊来确认装置中空气已排尽。
17.(1)ⅠA
(2)物理变化
(3)NaCl 585
(4)NaOH+SO2NaHSO3 NaHSO3+HClNaCl+H2O+SO2↑
解析:(1)钠元素位于元素周期表ⅠA族。
(2)蒸馏过程中没有新物质生成,因此蒸馏为物理变化。
(3)经配平后的电解饱和食盐水的化学方程式为:2NaCl+2H2O2NaOH+H2↑+Cl2↑,据此可计算出结果,或者不写出化学方程式,根据Cl原子守恒,即反应前后Cl原子的物质的量不变,可知最少需消耗食盐的质量为1 000 t×36.5%÷36.5 g×58.5 g=585 t。
18.(1)6.0
(2)C
(3)l≤n≤ mol?
解析:(1)该实验中发生的反应为:3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O?
简化为如下关系:CuO~Cu~NO
所以原混合物中CuO的质量为××80 g=6.0 g。
(2)该实验中发生的反应为:?
CuO+CCu+CO↑?
3Cu+8HNO3(稀)3Cu(NO3)2+2NO↑+4H2O?
剩余的固体为C,质量为b g,所以反应中实际消耗C和CuO的总质量为(a-b) g。其中CuO的质量为×80= g。?
(3)该实验发生的反应可能为:?
CuO+CCu+CO↑ ①?
2CuO+C2Cu+CO2↑ ②?
加强热后固体质量减少了c g,说明产生了c g气体。?
如果只发生反应①,产生c g CO气体,则CuO的物质的量为 mol;?
如果只发生反应②,产生c g CO2气体,则CuO的物质的量为 mol×2= mol。?
所以,n的取值范围为: mol≤n≤ mol。
19. (1)2Mg+O2MgO,3Mg+N2Mg3N2 ,2Mg+CO22MgO+C?
(2)Mg3N2+6H2O3Mg(OH)2+2NH3↑?
(3)17%
解析:第(3)题设原混合物中Mg3N2的质量为m1,由Mg3N2生成的MgO的质量为m2,
Mg3N2 ~ 3MgO
100 120
? m1 ?m2
则m2=
依题意有(0.470 g-m1)+=0.486 g,解得m1=0.080 g。?
故燃烧所得混合物中Mg3N2的质量分数为×100%=17%。
20. (1)1.8 L
(2)c()=0.50 mol,c()=1.0 mol。?
解析:(1)求收集到的H2S气体的体积。?
? n(FeS)==0.10 mol,?
? n(HCl)=2.0 mol×0.20 L=0.40 mol,?
根据反应的离子方程式:FeS+2+H2S↑,可判断盐酸过量,计算时应以FeS的物质的量为基准。则共生成H2S 0.10 mol。?
由已知:溶液中H2S的溶解量为0.1 mol×0.20 L=0.020 mol。
? 可得收集到的H2S的物质的量为0.10 mol-0.02 mol=0.08 mol,体积为0.08 mol×22.4 L=1.8 L。? (2)求溶液中和的物质的量浓度。?
因为FeS不足,故全部溶解。?
所以n()=n(FeS)=0.10 mol。?
则:c()==0.50 mol。?
反应前:n()=2.0 mol×0.20 L=0.40 mol。?
反应中消耗 0.20 mol。?
反应后溶液中c()==1.0 mol。
