化学人教版选择性必修1 2.3 化学反应的方向(共17张ppt)
文档属性
| 名称 | 化学人教版选择性必修1 2.3 化学反应的方向(共17张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-24 15:58:52 | ||
图片预览




文档简介
(共17张PPT)
第二章 化学反应速率与化学平衡
第三节 化学反应的方向
高二化学
新人教化学选择性必修一《化学反应原理》
【情境1】
假设你是一名化工厂工程师,需要把一个化学反应投入生产,针对化学反应而言,你需要考虑哪些问题?
生产的可行性问题
生产的效率问题
产率问题
水从高处向低处流
【思考】1、什么是自发过程?从能量角度分析这些自发过程过程有什么共同特点?
2、在一定的温度、压强条件下,化学反应的自发性和能量变化的关系?
热茶变凉
【情境2】
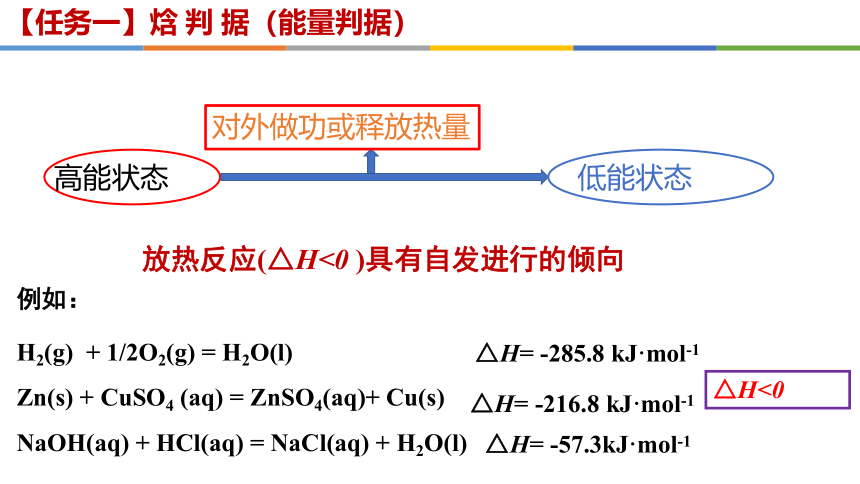
放热反应(△H<0 )具有自发进行的倾向
【任务一】焓 判 据(能量判据)
对外做功或释放热量
高能状态
低能状态
H2(g) + 1/2O2(g) = H2O(l)
Zn(s) + CuSO4 (aq) = ZnSO4(aq)+ Cu(s)
NaOH(aq) + HCl(aq) = NaCl(aq) + H2O(l)
例如:
△H<0
△H= -285.8 kJ·mol-1
△H= -216.8 kJ·mol-1
△H= -57.3kJ·mol-1
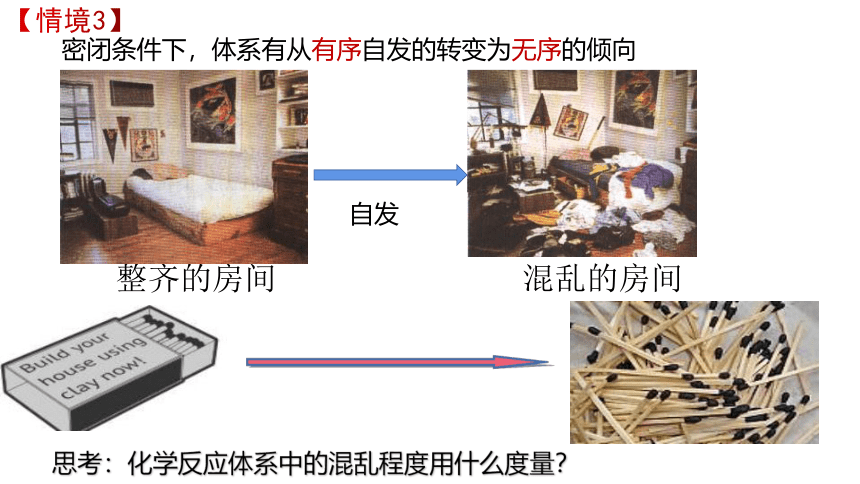
整齐的房间
混乱的房间
自发
密闭条件下,体系有从有序自发的转变为无序的倾向
【情境3】
思考:化学反应体系中的混乱程度用什么度量?
(混乱度)
衡量体系混乱程度的物理量。
体系的混乱程度越大(无序),熵越大。
符号:S
【任务二】熵 判 据(能量判据)
熵增反应(△S>0 )具有自发进行的倾向
【思考】如何判断反应中的熵变?
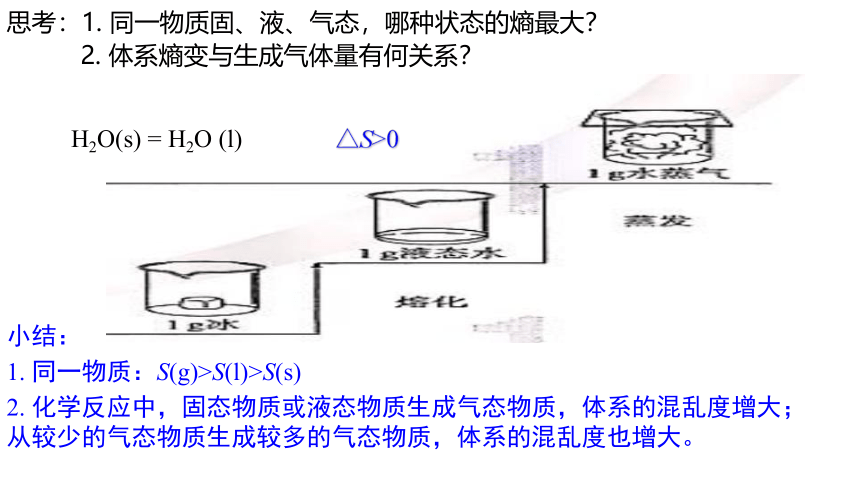
小结:
1. 同一物质:S(g)>S(l)>S(s)
2. 化学反应中,固态物质或液态物质生成气态物质,体系的混乱度增大;从较少的气态物质生成较多的气态物质,体系的混乱度也增大。
H2O(s) = H2O (l)
△S>0
思考:1. 同一物质固、液、气态,哪种状态的熵最大?
2. 体系熵变与生成气体量有何关系?
【学习评价】下列对熵变的判断不正确的是( )
A.少量的食盐溶解于水中:ΔS>0
B.炭和氧气反应生成CO(g):ΔS>0
C.气态水变成液态水:ΔS>0
D.CaCO3(s)受热分解为CaO(s)和CO2(g):ΔS>0
C
【问题讨论】(1)自发反应一定是放热反应?
(2) 熵增的化学反应都是自发反应?
2H2(g)+O2(g)= 2H2O(l)
△S<0
NH3(g)+HCl(g)= NH4Cl(s) △S<0
下列反应均可自发进行:
2N2O5(g)=4NO2(g) + O2(g) △H= +56.7kJ/mol
(NH4 ) 2CO3(s) =NH4HCO3(s)+NH3(g) △H= +74.9kJ/mol
结论:自发反应的方向与焓变和熵变有关,但都不能单独作为判断反应自发进行方向的依据。
室温 冰融化
-10 ℃ 水结冰
H2O(l) = H2O (s) △H <0 △S<0
H2O(s) = H2O (l) △H >0 △S>0
自由能ΔG=ΔH-TΔS ,化学反应总是向着自由能减小的方向进行,直到达到平衡。
当ΔG<0, 反应能自发进行;
当ΔG=0,反应处于平衡状态;
当ΔG>0, 反应不能自发进行。
【任务三】复合判据(能量判据)
H>0
S>0
H>0
S<0
H<0
S>0
H<0
S<0
△G=△H-T△S <0, 反应能自发进行
低温下自发
所有温度下都不自发
高温下自发
任意温度下都自发
NH3(g)+HCl(g)=NH4Cl(s)
CaCO3(s)=CaO(s)+CO2(g)
1..判断反应的自发性
源于实际 应用概念
汽车尾气中的主要污染物是NO和CO,它们是现代化城市中的大气污染物。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气: 2NO(g)+2CO(g)=N2(g)+2CO2(g)
你能否判断该反应在室温下能自发进行吗?
已知 298K、100kPa下,ΔH=-746.8KJ·mol -1
ΔS=-197.5J·mol-1·K-1
△G =ΔH-T ΔS
=-746.8KJ·mol-1+298K×197.5×10-3 KJ·mol-1·K-1
=-687.945 KJ.mol-1<0
可自发进行!
形成: G= H-T S这个判据指出的是在T、P一定的条件下反应自动发生的趋势,即反应发生的可能性,并不能说明反应能否实际发生和发生的速率!
工业冶钛
①TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)
ΔH= +161.9KJ/mol ΔS=-38.4 J·mol-1·K-1
②Mg+ TiCl4=Ti+ MgCl2
2. 工业上“改造”反应
2C(s,石墨)+ O2(g) = 2CO(g) △H=-110.5KJ/mol
ΔS=+89.7 J·mol-1·K-1
TiO2(s)+2Cl2(g)+2C(s,石墨)=TiCl4(l)+2CO(g)
△H=-59.2KJ/mol ΔS=+141.0 J·mol-1·K-1
教材P43
【学习评价】1、已知在100 kPa、298.15 K时石灰石分解反应:CaCO3(s)===CaO(s)+CO2(g) ΔH=+178.3 kJ·mol-1 ,ΔS=160.4 J·mol-1·K-1,则:
(1)该反应________(填“能”或“不能”)自发进行;
(2)据本题反应数据分析,温度________(填“能”或“否”)成为反应方向的决定因素;
(3)若温度能决定反应方向,则该反应自发进行的最低温度为________。
(1) G= ΔH-TΔS
=178.3 kJ·mol-1-298.15 K×160.4×10-3 kJ·mol-1·K-1=130.5 kJ·mol-1>0
能
不能
1 111.6 K
2、已知2CO(g) CO2(g)+C(s),T=980 K时,ΔH-TΔS=0。
(1)当体系温度低于980 K时,估计ΔH-TΔS________0(填“大于”“小于”或“等于”);当体系温度高于980 K时,估计ΔH-TΔS________0(填“大于”“小于”或“等于”)。
(2)在冶金工业中,以C为还原剂,温度高于980 K时的氧化产物是以________为主;温度低于980 K时的氧化产物是以________为主。
小于
大于
CO
CO2
第二章 化学反应速率与化学平衡
第三节 化学反应的方向
高二化学
新人教化学选择性必修一《化学反应原理》
【情境1】
假设你是一名化工厂工程师,需要把一个化学反应投入生产,针对化学反应而言,你需要考虑哪些问题?
生产的可行性问题
生产的效率问题
产率问题
水从高处向低处流
【思考】1、什么是自发过程?从能量角度分析这些自发过程过程有什么共同特点?
2、在一定的温度、压强条件下,化学反应的自发性和能量变化的关系?
热茶变凉
【情境2】
放热反应(△H<0 )具有自发进行的倾向
【任务一】焓 判 据(能量判据)
对外做功或释放热量
高能状态
低能状态
H2(g) + 1/2O2(g) = H2O(l)
Zn(s) + CuSO4 (aq) = ZnSO4(aq)+ Cu(s)
NaOH(aq) + HCl(aq) = NaCl(aq) + H2O(l)
例如:
△H<0
△H= -285.8 kJ·mol-1
△H= -216.8 kJ·mol-1
△H= -57.3kJ·mol-1
整齐的房间
混乱的房间
自发
密闭条件下,体系有从有序自发的转变为无序的倾向
【情境3】
思考:化学反应体系中的混乱程度用什么度量?
(混乱度)
衡量体系混乱程度的物理量。
体系的混乱程度越大(无序),熵越大。
符号:S
【任务二】熵 判 据(能量判据)
熵增反应(△S>0 )具有自发进行的倾向
【思考】如何判断反应中的熵变?
小结:
1. 同一物质:S(g)>S(l)>S(s)
2. 化学反应中,固态物质或液态物质生成气态物质,体系的混乱度增大;从较少的气态物质生成较多的气态物质,体系的混乱度也增大。
H2O(s) = H2O (l)
△S>0
思考:1. 同一物质固、液、气态,哪种状态的熵最大?
2. 体系熵变与生成气体量有何关系?
【学习评价】下列对熵变的判断不正确的是( )
A.少量的食盐溶解于水中:ΔS>0
B.炭和氧气反应生成CO(g):ΔS>0
C.气态水变成液态水:ΔS>0
D.CaCO3(s)受热分解为CaO(s)和CO2(g):ΔS>0
C
【问题讨论】(1)自发反应一定是放热反应?
(2) 熵增的化学反应都是自发反应?
2H2(g)+O2(g)= 2H2O(l)
△S<0
NH3(g)+HCl(g)= NH4Cl(s) △S<0
下列反应均可自发进行:
2N2O5(g)=4NO2(g) + O2(g) △H= +56.7kJ/mol
(NH4 ) 2CO3(s) =NH4HCO3(s)+NH3(g) △H= +74.9kJ/mol
结论:自发反应的方向与焓变和熵变有关,但都不能单独作为判断反应自发进行方向的依据。
室温 冰融化
-10 ℃ 水结冰
H2O(l) = H2O (s) △H <0 △S<0
H2O(s) = H2O (l) △H >0 △S>0
自由能ΔG=ΔH-TΔS ,化学反应总是向着自由能减小的方向进行,直到达到平衡。
当ΔG<0, 反应能自发进行;
当ΔG=0,反应处于平衡状态;
当ΔG>0, 反应不能自发进行。
【任务三】复合判据(能量判据)
H>0
S>0
H>0
S<0
H<0
S>0
H<0
S<0
△G=△H-T△S <0, 反应能自发进行
低温下自发
所有温度下都不自发
高温下自发
任意温度下都自发
NH3(g)+HCl(g)=NH4Cl(s)
CaCO3(s)=CaO(s)+CO2(g)
1..判断反应的自发性
源于实际 应用概念
汽车尾气中的主要污染物是NO和CO,它们是现代化城市中的大气污染物。为了减轻大气污染,人们提出通过以下反应来处理汽车尾气: 2NO(g)+2CO(g)=N2(g)+2CO2(g)
你能否判断该反应在室温下能自发进行吗?
已知 298K、100kPa下,ΔH=-746.8KJ·mol -1
ΔS=-197.5J·mol-1·K-1
△G =ΔH-T ΔS
=-746.8KJ·mol-1+298K×197.5×10-3 KJ·mol-1·K-1
=-687.945 KJ.mol-1<0
可自发进行!
形成: G= H-T S这个判据指出的是在T、P一定的条件下反应自动发生的趋势,即反应发生的可能性,并不能说明反应能否实际发生和发生的速率!
工业冶钛
①TiO2(s)+2Cl2(g)=TiCl4(l)+O2(g)
ΔH= +161.9KJ/mol ΔS=-38.4 J·mol-1·K-1
②Mg+ TiCl4=Ti+ MgCl2
2. 工业上“改造”反应
2C(s,石墨)+ O2(g) = 2CO(g) △H=-110.5KJ/mol
ΔS=+89.7 J·mol-1·K-1
TiO2(s)+2Cl2(g)+2C(s,石墨)=TiCl4(l)+2CO(g)
△H=-59.2KJ/mol ΔS=+141.0 J·mol-1·K-1
教材P43
【学习评价】1、已知在100 kPa、298.15 K时石灰石分解反应:CaCO3(s)===CaO(s)+CO2(g) ΔH=+178.3 kJ·mol-1 ,ΔS=160.4 J·mol-1·K-1,则:
(1)该反应________(填“能”或“不能”)自发进行;
(2)据本题反应数据分析,温度________(填“能”或“否”)成为反应方向的决定因素;
(3)若温度能决定反应方向,则该反应自发进行的最低温度为________。
(1) G= ΔH-TΔS
=178.3 kJ·mol-1-298.15 K×160.4×10-3 kJ·mol-1·K-1=130.5 kJ·mol-1>0
能
不能
1 111.6 K
2、已知2CO(g) CO2(g)+C(s),T=980 K时,ΔH-TΔS=0。
(1)当体系温度低于980 K时,估计ΔH-TΔS________0(填“大于”“小于”或“等于”);当体系温度高于980 K时,估计ΔH-TΔS________0(填“大于”“小于”或“等于”)。
(2)在冶金工业中,以C为还原剂,温度高于980 K时的氧化产物是以________为主;温度低于980 K时的氧化产物是以________为主。
小于
大于
CO
CO2
