2022-2023学年高中化学苏教版选择性必修1 课时跟踪检测(一) 化学反应的焓变 word版含解析
文档属性
| 名称 | 2022-2023学年高中化学苏教版选择性必修1 课时跟踪检测(一) 化学反应的焓变 word版含解析 |  | |
| 格式 | doc | ||
| 文件大小 | 658.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-24 20:44:04 | ||
图片预览



文档简介
课时跟踪检测(一) 化学反应的焓变
[基础巩固练]
知识点一 焓变 反应热
1.下列关于化学反应与能量变化的说法正确的是( )
A.放热反应的发生无须任何条件
B.化学键的断裂和形成与反应放热和吸热无关
C.化学反应过程都伴随着能量的变化
D.硫酸与氢氧化钠的反应是吸热反应
2.(2021·江苏南京高二检测)下列过程伴随的能量变化中,属于反应热的是( )
A.形成1 mol H—Cl键放出的能量
B.石墨转化为金刚石吸收的能量
C.1 mol O2形成2 mol O吸收的能量
D.水蒸气变成液态水放出的能量
3.(2021·江苏泰州高二月考)反应A+B―→C(ΔH<0)分两步进行:①A+B―→X(ΔH>0),②X―→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
知识点二 探究化学反应中的能量变化
4.(2021·江苏盐城高二月考)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
A.每生成2分子AB(g)吸收b kJ热量
B.该反应的反应热ΔH=(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
5.(2021·湖北荆州高二检测)已知:2H2(g)+O2(g)===2H2O(g),1 mol H2完全燃烧放出241.8 kJ热量,有关键能数据如下:
化学键 H—O O===O
键能/(kJ·mol-1) 463.4 498
则H—H键键能为( )
A.413 kJ·mol-1 B.557 kJ·mol-1
C.221.6 kJ·mol-1 D.436 kJ·mol-1
6.已知:2H2(g)+O2(g)===2H2O(g)
ΔH=-483.6 kJ·mol-1
下列有关说法不正确的是( )
A.该反应是氧化还原反应
B.破坏1 mol H—O键需要的能量是463.4 kJ
C.H2O(g)===H2(g)+O2(g) ΔH=241.8 kJ·mol-1
D.H2(g)中的H—H键比H2O(g)中的H—O键牢固
7.(2021·山东师大附中高二月考)天然气作为民生工程受到人们普遍关注。已知天然气不完全燃烧的热化学方程式为2CH4(g) +3O2(g)===2CO(g)+4H2O(g) ΔH(单位:kJ·mol-1)。且O===O键的键能为a kJ·mol-1,C—H键的键能为b kJ·mol-1,C≡O键的键能为c kJ·mol-1,O—H键的键能为d kJ·mol-1,则甲烷不完全燃烧的ΔH为( )
A.3a+8b-2c-8d B.3a+8b-2c-4d
C.2c+8d-3a-4b D.2c+8d-3a-8b
知识点三 热化学方程式
8.下列说法错误的是( )
A.热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据
B.热化学方程式中各物质化学式前的化学计量数不表示分子个数,只代表物质的量
C.同一化学反应,化学计量数不同,ΔH不同;化学计量数相同而物质的聚集状态不同,ΔH也不相同
D.化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比
9.(2021·江苏南京高二月考)已知在25 ℃、101 kPa下,1 g C8H18(辛烷)完全燃烧生成二氧化碳和液态水时放出48.4 kJ热量。表示该反应的热化学方程式正确的是( )
A.C8H18(l)+O2(g)===8CO2(g)+9H2O(g)
ΔH=-48.4 kJ·mol-1
B.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=-5 517.6 kJ·mol-1
C.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=+5 517.6 kJ·mol-1
D.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=-48.4 kJ·mol-1
10.(2021·江苏徐州高二检测)已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·mol-1。下列有关说法正确的是( )
A.在相同条件下,1 mol H2(g)与1 mol F2(g) 的能量总和大于2 mol HF(g) 的能量
B.1 mol H2(g)与1 mol F2(g) 反应生成2 mol液态HF放出的热量小于270 kJ
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用下图来表示
[素养提升练]
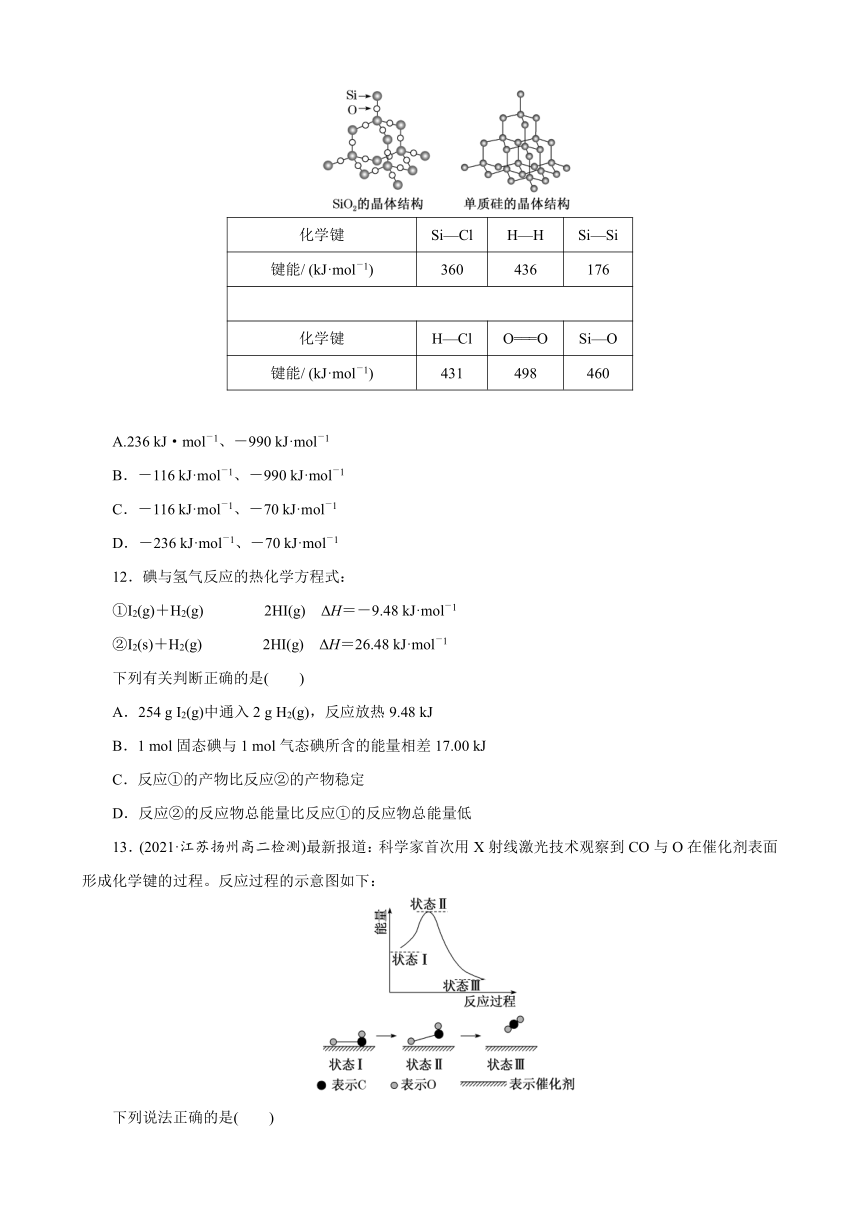
11.(2021·辽宁大连高二检测)根据表中提供的数据及相关物质结构知识可知:
反应1:SiCl4(g)+2H2(g)===Si(g)+4HCl(g) ΔH1;
反应2:Si(g)+O2(g)===SiO2(g) ΔH2。
反应1和反应2的反应热分别为( )
化学键 Si—Cl H—H Si—Si
键能/ (kJ·mol-1) 360 436 176
化学键 H—Cl O===O Si—O
键能/ (kJ·mol-1) 431 498 460
A.236 kJ·mol-1、-990 kJ·mol-1
B.-116 kJ·mol-1、-990 kJ·mol-1
C.-116 kJ·mol-1、-70 kJ·mol-1
D.-236 kJ·mol-1、-70 kJ·mol-1
12.碘与氢气反应的热化学方程式:
①I2(g)+H2(g)????2HI(g) ΔH=-9.48 kJ·mol-1
②I2(s)+H2(g)????2HI(g) ΔH=26.48 kJ·mol-1
下列有关判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应①的产物比反应②的产物稳定
D.反应②的反应物总能量比反应①的反应物总能量低
13.(2021·江苏扬州高二检测)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
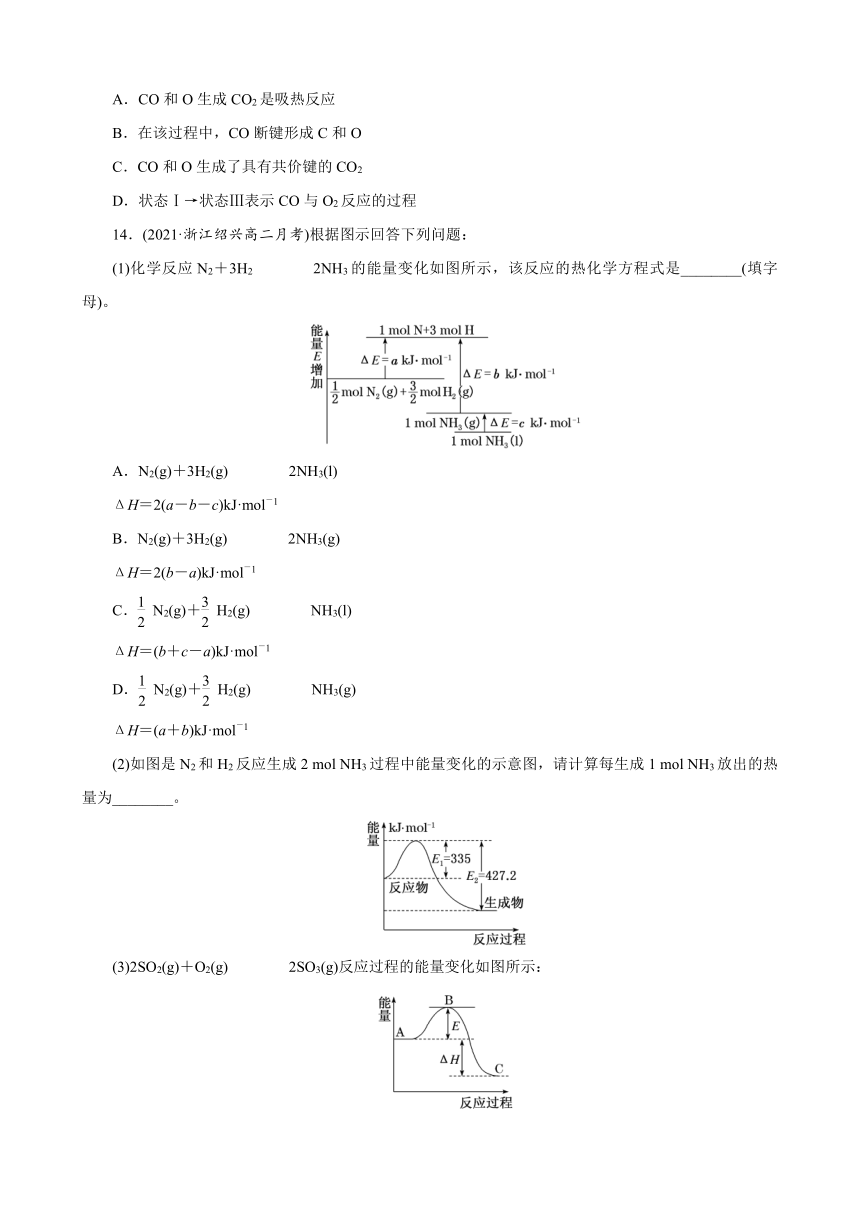
14.(2021·浙江绍兴高二月考)根据图示回答下列问题:
(1)化学反应N2+3H2????2NH3的能量变化如图所示,该反应的热化学方程式是________(填字母)。
A.N2(g)+3H2(g)????2NH3(l)
ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)????2NH3(g)
ΔH=2(b-a)kJ·mol-1
C.N2(g)+H2(g)????NH3(l)
ΔH=(b+c-a)kJ·mol-1
D.N2(g)+H2(g)????NH3(g)
ΔH=(a+b)kJ·mol-1
(2)如图是N2和H2反应生成2 mol NH3过程中能量变化的示意图,请计算每生成1 mol NH3放出的热量为________。
(3)2SO2(g)+O2(g)????2SO3(g)反应过程的能量变化如图所示:
已知1 mol SO2(g)氧化为 1 mol SO3(g)的ΔH=-99 kJ·mol-1。
①图中A、C分别表示________、________,E的大小对该反应的反应热有无影响?________________________________________________________________________。
②图中ΔH=________kJ·mol-1。
15.(2022·浙江丽水高二联考)在保温杯式量热计中(见图)将100 mL 0.500 mol·L-1CH3COOH溶液与100 mL 0.55 mol·L-1NaOH溶液混合,温度从298.2 K升高到301.2 K,醋酸钠溶液的比热容c=4.2 J·g-1·K-1,溶液的密度为1 g·cm-3(已知:反应放出的热量Q=cmΔt)。
(1)通过计算,写出CH3COOH与NaOH发生中和反应生成1 mol H2O时的反应热
ΔH_________________________________________________________。
(2)实验中NaOH溶液过量的目的是________________。
(3)CH3COOH与NaOH发生中和反应生成1 mol H2O时的反应热的文献值为-56.1 kJ·mol-1,你认为(1)中测得的热量偏小的可能原因是__________________________________
________________________________________________________________________。
(4)你认为CH3COOH与NaOH中和反应的ΔH1和HCl与NaOH中和反应的ΔH2相比,________(填“ΔH1”“ΔH2”或“一样”)大,原因是_____________________________
________________________________________________________________________。
课时跟踪检测(一) 化学反应的焓变
[基础巩固练]
知识点一 焓变 反应热
1.下列关于化学反应与能量变化的说法正确的是( )
A.放热反应的发生无须任何条件
B.化学键的断裂和形成与反应放热和吸热无关
C.化学反应过程都伴随着能量的变化
D.硫酸与氢氧化钠的反应是吸热反应
解析:C 放热反应的发生可能需要条件,如加热等,A项错误;化学键的断裂和形成与反应放热和吸热有关,B项错误;化学反应过程都伴随着能量的变化,C项正确;H2SO4与NaOH的反应是放热反应,D项错误。
2.(2021·江苏南京高二检测)下列过程伴随的能量变化中,属于反应热的是( )
A.形成1 mol H—Cl键放出的能量
B.石墨转化为金刚石吸收的能量
C.1 mol O2形成2 mol O吸收的能量
D.水蒸气变成液态水放出的能量
解析:B 化学反应的实质是旧键的断裂和新键的形成。A项,只有化学键的形成,C项只有化学键的断裂,故其能量的变化不属于反应热,A、C错误;石墨转化为金刚石既有旧键的断裂,又有新键的形成,故其能量的变化属于反应热,B正确;水蒸气变成液态水是物理变化,故其能量的变化不属于反应热,D错误。
3.(2021·江苏泰州高二月考)反应A+B―→C(ΔH<0)分两步进行:①A+B―→X(ΔH>0),②X―→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
解析:D 由A+B―→X(ΔH>0)为吸热反应,可知X的能量高于A+B的总能量,故A、C项错误;由总反应A+B―→C(ΔH<0)为放热反应,可知C的总能量小于A+B的能量,故B项错误,D项正确。
知识点二 探究化学反应中的能量变化
4.(2021·江苏盐城高二月考)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
A.每生成2分子AB(g)吸收b kJ热量
B.该反应的反应热ΔH=(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
解析:B 每生成2 mol AB(g)吸收的热量应为(a-b)kJ,故A错误;焓变=反应物的键能之和-生成物的键能之和=(a-b)kJ·mol-1,故B正确;由图像可知,反应物的总能量小于生成物的总能量,故C错误;断键应吸收能量,故D错误。
5.(2021·湖北荆州高二检测)已知:2H2(g)+O2(g)===2H2O(g),1 mol H2完全燃烧放出241.8 kJ热量,有关键能数据如下:
化学键 H—O O===O
键能/(kJ·mol-1) 463.4 498
则H—H键键能为( )
A.413 kJ·mol-1 B.557 kJ·mol-1
C.221.6 kJ·mol-1 D.436 kJ·mol-1
解析:D 设H—H键键能为x kJ·mol-1,根据反应热和键能关系可知,ΔH=反应物键能总和-生成物键能总和,即(2x+498-4×463.4) kJ·mol-1=(-241.8×2) kJ·mol-1,解得x=436。
6.已知:2H2(g)+O2(g)===2H2O(g)
ΔH=-483.6 kJ·mol-1
下列有关说法不正确的是( )
A.该反应是氧化还原反应
B.破坏1 mol H—O键需要的能量是463.4 kJ
C.H2O(g)===H2(g)+O2(g) ΔH=241.8 kJ·mol-1
D.H2(g)中的H—H键比H2O(g)中的H—O键牢固
解析:D 该反应中有元素的化合价发生改变,是氧化还原反应,A说法正确;根据旧键的断裂吸收能量,新键的形成释放能量,H—O键的键能为
=463.4 kJ·mol-1,故破坏1 mol H—O键需要的能量是463.4 kJ,B说法正确;已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则H2O(g)===H2(g)+O2(g) ΔH=241.8 kJ·mol-1,C说法正确;H2(g)中的H—H键的键能为436 kJ·mol-1,H2O(g)中的H—O键的键能为463.4 kJ·mol-1,则H2(g)中的H—H键比H2O(g)中的H—O键的稳定性差,D说法错误。
7.(2021·山东师大附中高二月考)天然气作为民生工程受到人们普遍关注。已知天然气不完全燃烧的热化学方程式为2CH4(g) +3O2(g)===2CO(g)+4H2O(g) ΔH(单位:kJ·mol-1)。且O===O键的键能为a kJ·mol-1,C—H键的键能为b kJ·mol-1,C≡O键的键能为c kJ·mol-1,O—H键的键能为d kJ·mol-1,则甲烷不完全燃烧的ΔH为( )
A.3a+8b-2c-8d B.3a+8b-2c-4d
C.2c+8d-3a-4b D.2c+8d-3a-8b
解析:A ΔH =反应物总键能之和—生成物总键能之和=3×a kJ·mol-1+8×b kJ·mol-1-(2c kJ·mol-1+8×d kJ·mol-1)= (3a+8b-2c-8d)kJ·mol-1。
知识点三 热化学方程式
8.下列说法错误的是( )
A.热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据
B.热化学方程式中各物质化学式前的化学计量数不表示分子个数,只代表物质的量
C.同一化学反应,化学计量数不同,ΔH不同;化学计量数相同而物质的聚集状态不同,ΔH也不相同
D.化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比
解析:A 热化学方程式未注明温度和压强时,ΔH表示在25 ℃、101 kPa条件下测定的数据,故A错误;热化学方程式中的化学计量数只表示反应物或生成物的物质的量,不表示微粒数,化学计量数可以用分数表示,故B正确;化学反应的焓变(ΔH)只与反应体系的始态和终态有关,而与反应的途径无关,ΔH与热化学方程式的化学计量数成正比,对于同一化学反应,当化学计量数不同时,其ΔH不同,只要热化学方程式的化学计量数一定,ΔH值一定,化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比,故C、D正确。
9.(2021·江苏南京高二月考)已知在25 ℃、101 kPa下,1 g C8H18(辛烷)完全燃烧生成二氧化碳和液态水时放出48.4 kJ热量。表示该反应的热化学方程式正确的是( )
A.C8H18(l)+O2(g)===8CO2(g)+9H2O(g)
ΔH=-48.4 kJ·mol-1
B.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=-5 517.6 kJ·mol-1
C.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=+5 517.6 kJ·mol-1
D.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=-48.4 kJ·mol-1
解析:B C8H18(辛烷)的摩尔质量为114 g·mol-1,所以1 mol C8H18(辛烷)完全燃烧生成二氧化碳和液态水时放出5 517.6 kJ热量。
10.(2021·江苏徐州高二检测)已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·mol-1。下列有关说法正确的是( )
A.在相同条件下,1 mol H2(g)与1 mol F2(g) 的能量总和大于2 mol HF(g) 的能量
B.1 mol H2(g)与1 mol F2(g) 反应生成2 mol液态HF放出的热量小于270 kJ
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用下图来表示
解析:A 该反应为放热反应,则在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和大于2 mol HF(g)的能量,故A正确;物质由气态变为液态时放出能量,则1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ,故B错误;因该反应的正反应为放热反应,所以逆反应是吸热反应,故C错误;由反应的热化学方程式可知,该反应的ΔH<0,为放热反应,说明反应物的总能量大于生成物的总能量,故D错误。
[素养提升练]
11.(2021·辽宁大连高二检测)根据表中提供的数据及相关物质结构知识可知:
反应1:SiCl4(g)+2H2(g)===Si(g)+4HCl(g) ΔH1;
反应2:Si(g)+O2(g)===SiO2(g) ΔH2。
反应1和反应2的反应热分别为( )
化学键 Si—Cl H—H Si—Si
键能/ (kJ·mol-1) 360 436 176
化学键 H—Cl O===O Si—O
键能/ (kJ·mol-1) 431 498 460
A.236 kJ·mol-1、-990 kJ·mol-1
B.-116 kJ·mol-1、-990 kJ·mol-1
C.-116 kJ·mol-1、-70 kJ·mol-1
D.-236 kJ·mol-1、-70 kJ·mol-1
解析:A 根据反应热=反应物的键能之和-生成物的键能之和,则反应1:SiCl4(g)+2H2(g)===Si(g)+4HCl(g)的ΔH=360 kJ·mol-1×4+436 kJ·mol-1×2-176 kJ·mol-1×2-431 kJ·mol-1×4=236 kJ·mol-1;反应2:Si(g)+O2(g)===SiO2(g)的ΔH=176 kJ·mol-1×2+498 kJ·mol-1-460 kJ·mol-1×4=-990 kJ·mol-1。
12.碘与氢气反应的热化学方程式:
①I2(g)+H2(g)????2HI(g) ΔH=-9.48 kJ·mol-1
②I2(s)+H2(g)????2HI(g) ΔH=26.48 kJ·mol-1
下列有关判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应①的产物比反应②的产物稳定
D.反应②的反应物总能量比反应①的反应物总能量低
解析:D A项,因为该反应是可逆反应,所以不能进行完全,放出的热量小于9.48 kJ,错误;B项,1 mol固态碘与1 mol 气态碘所含的能量相差26.48 kJ-(-9.48 kJ)=35.96 kJ,错误;C项,生成物都是气态HI,一样稳定,错误;D项,等量的同一物质,固态物质的能量比气态物质的能量低,反应②的反应物总能量比反应①的反应物总能量低,正确。
13.(2021·江苏扬州高二检测)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
解析:C 根据能量—反应过程的图像知,状态Ⅰ的能量高于状态Ⅲ的能量,故该过程是放热反应,A错误;根据状态Ⅰ、Ⅱ、Ⅲ可以看出整个过程中CO中的C和O形成的化学键没有断裂,B错误;由状态Ⅲ可知,生成物是CO2,CO2具有极性共价键,C正确;状态Ⅰ →状态Ⅲ表示CO与O反应的过程,D错误。
14.(2021·浙江绍兴高二月考)根据图示回答下列问题:
(1)化学反应N2+3H2????2NH3的能量变化如图所示,该反应的热化学方程式是________(填字母)。
A.N2(g)+3H2(g)????2NH3(l)
ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)????2NH3(g)
ΔH=2(b-a)kJ·mol-1
C.N2(g)+H2(g)????NH3(l)
ΔH=(b+c-a)kJ·mol-1
D.N2(g)+H2(g)????NH3(g)
ΔH=(a+b)kJ·mol-1
(2)如图是N2和H2反应生成2 mol NH3过程中能量变化的示意图,请计算每生成1 mol NH3放出的热量为________。
(3)2SO2(g)+O2(g)????2SO3(g)反应过程的能量变化如图所示:
已知1 mol SO2(g)氧化为 1 mol SO3(g)的ΔH=-99 kJ·mol-1。
①图中A、C分别表示________、________,E的大小对该反应的反应热有无影响?________________________________________________________________________。
②图中ΔH=________kJ·mol-1。
解析: (1)由题图可以看出, mol N2(g)和 mol H2(g)的化学键断裂吸收的能量为a kJ,形成1 mol NH3(g)放出的能量为b kJ,所以N2(g)+H2(g)????NH3(g) ΔH=(a-b)kJ·mol-1,而1 mol NH3(g)转化为1 mol NH3(l)放出的热量为c kJ,所以有N2(g)+H2(g)????NH3(l) ΔH=(a-b-c)kJ·mol-1,即N2(g)+3H2(g)????2NH3(l) ΔH=2(a-b-c)kJ·mol-1。(2)由题图可知生成2 mol NH3放出的热量为427.2 kJ-335 kJ=92.2 kJ,则生成1 mol NH3放出的热量为46.1 kJ。(3)①由图示可知,A表示反应物的总能量,C表示生成物的总能量;E值不影响A、C的能量值,故能量E的大小对该反应的反应热无影响。②ΔH对应2 mol SO2(g)转化为2 mol SO3(g)的焓变,其值为2×(-99 kJ·mol-1)=-198 kJ·mol-1。
答案:(1)A (2)46.1 kJ (3)①反应物的总能量 生成物的总能量 无影响 ②-198
15.(2022·浙江丽水高二联考)在保温杯式量热计中(见图)将100 mL 0.500 mol·L-1CH3COOH溶液与100 mL 0.55 mol·L-1NaOH溶液混合,温度从298.2 K升高到301.2 K,醋酸钠溶液的比热容c=4.2 J·g-1·K-1,溶液的密度为1 g·cm-3(已知:反应放出的热量Q=cmΔt)。
(1)通过计算,写出CH3COOH与NaOH发生中和反应生成1 mol H2O时的反应热
ΔH_________________________________________________________。
(2)实验中NaOH溶液过量的目的是________________。
(3)CH3COOH与NaOH发生中和反应生成1 mol H2O时的反应热的文献值为-56.1 kJ·mol-1,你认为(1)中测得的热量偏小的可能原因是__________________________________
________________________________________________________________________。
(4)你认为CH3COOH与NaOH中和反应的ΔH1和HCl与NaOH中和反应的ΔH2相比,________(填“ΔH1”“ΔH2”或“一样”)大,原因是_____________________________
________________________________________________________________________。
解析:(1)由题中信息可知,温度差Δt=301.2 K-298.2 K=3.0 K,Q=cmΔt=4.2 J·g-1·K-1×(100 mL×1 g·cm-3+100 mL×1 g·cm-3)×3.0 K=2 520 J=2.52 kJ,100 mL 0.500 mol·L-1 CH3COOH溶液与100 mL 0.55 mol·L-1NaOH溶液混合反应,生成0.05 mol 水,由于中和反应是放热反应,则ΔH==-=-50.4 kJ·mol-1;(2)测酸和碱中和反应的反应热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,从而减小实验误差,所以实验中NaOH过量,是为了能保证CH3COOH溶液完全被中和,从而提高实验的准确度;(3)文献值为56.1 kJ·mol-1,实际上测定数值偏低,可能原因有①量热计的保温效果不好,②酸碱溶液混合不迅速,③温度计不够精确等;(4)醋酸是弱酸,电离过程需要吸收能量,所以二者相比,HCl与NaOH的中和反应放热较多,由于ΔH为负值,则ΔH1大于ΔH2。
答案:(1)-50.4 kJ·mol-1
(2)保证醋酸完全被NaOH中和
(3)①量热计的保温效果不好,②酸碱溶液混合不迅速,③温度计不够精确等
(4) ΔH1 因CH3COOH是弱酸,电离要吸热
[基础巩固练]
知识点一 焓变 反应热
1.下列关于化学反应与能量变化的说法正确的是( )
A.放热反应的发生无须任何条件
B.化学键的断裂和形成与反应放热和吸热无关
C.化学反应过程都伴随着能量的变化
D.硫酸与氢氧化钠的反应是吸热反应
2.(2021·江苏南京高二检测)下列过程伴随的能量变化中,属于反应热的是( )
A.形成1 mol H—Cl键放出的能量
B.石墨转化为金刚石吸收的能量
C.1 mol O2形成2 mol O吸收的能量
D.水蒸气变成液态水放出的能量
3.(2021·江苏泰州高二月考)反应A+B―→C(ΔH<0)分两步进行:①A+B―→X(ΔH>0),②X―→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
知识点二 探究化学反应中的能量变化
4.(2021·江苏盐城高二月考)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
A.每生成2分子AB(g)吸收b kJ热量
B.该反应的反应热ΔH=(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
5.(2021·湖北荆州高二检测)已知:2H2(g)+O2(g)===2H2O(g),1 mol H2完全燃烧放出241.8 kJ热量,有关键能数据如下:
化学键 H—O O===O
键能/(kJ·mol-1) 463.4 498
则H—H键键能为( )
A.413 kJ·mol-1 B.557 kJ·mol-1
C.221.6 kJ·mol-1 D.436 kJ·mol-1
6.已知:2H2(g)+O2(g)===2H2O(g)
ΔH=-483.6 kJ·mol-1
下列有关说法不正确的是( )
A.该反应是氧化还原反应
B.破坏1 mol H—O键需要的能量是463.4 kJ
C.H2O(g)===H2(g)+O2(g) ΔH=241.8 kJ·mol-1
D.H2(g)中的H—H键比H2O(g)中的H—O键牢固
7.(2021·山东师大附中高二月考)天然气作为民生工程受到人们普遍关注。已知天然气不完全燃烧的热化学方程式为2CH4(g) +3O2(g)===2CO(g)+4H2O(g) ΔH(单位:kJ·mol-1)。且O===O键的键能为a kJ·mol-1,C—H键的键能为b kJ·mol-1,C≡O键的键能为c kJ·mol-1,O—H键的键能为d kJ·mol-1,则甲烷不完全燃烧的ΔH为( )
A.3a+8b-2c-8d B.3a+8b-2c-4d
C.2c+8d-3a-4b D.2c+8d-3a-8b
知识点三 热化学方程式
8.下列说法错误的是( )
A.热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据
B.热化学方程式中各物质化学式前的化学计量数不表示分子个数,只代表物质的量
C.同一化学反应,化学计量数不同,ΔH不同;化学计量数相同而物质的聚集状态不同,ΔH也不相同
D.化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比
9.(2021·江苏南京高二月考)已知在25 ℃、101 kPa下,1 g C8H18(辛烷)完全燃烧生成二氧化碳和液态水时放出48.4 kJ热量。表示该反应的热化学方程式正确的是( )
A.C8H18(l)+O2(g)===8CO2(g)+9H2O(g)
ΔH=-48.4 kJ·mol-1
B.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=-5 517.6 kJ·mol-1
C.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=+5 517.6 kJ·mol-1
D.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=-48.4 kJ·mol-1
10.(2021·江苏徐州高二检测)已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·mol-1。下列有关说法正确的是( )
A.在相同条件下,1 mol H2(g)与1 mol F2(g) 的能量总和大于2 mol HF(g) 的能量
B.1 mol H2(g)与1 mol F2(g) 反应生成2 mol液态HF放出的热量小于270 kJ
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用下图来表示
[素养提升练]
11.(2021·辽宁大连高二检测)根据表中提供的数据及相关物质结构知识可知:
反应1:SiCl4(g)+2H2(g)===Si(g)+4HCl(g) ΔH1;
反应2:Si(g)+O2(g)===SiO2(g) ΔH2。
反应1和反应2的反应热分别为( )
化学键 Si—Cl H—H Si—Si
键能/ (kJ·mol-1) 360 436 176
化学键 H—Cl O===O Si—O
键能/ (kJ·mol-1) 431 498 460
A.236 kJ·mol-1、-990 kJ·mol-1
B.-116 kJ·mol-1、-990 kJ·mol-1
C.-116 kJ·mol-1、-70 kJ·mol-1
D.-236 kJ·mol-1、-70 kJ·mol-1
12.碘与氢气反应的热化学方程式:
①I2(g)+H2(g)????2HI(g) ΔH=-9.48 kJ·mol-1
②I2(s)+H2(g)????2HI(g) ΔH=26.48 kJ·mol-1
下列有关判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应①的产物比反应②的产物稳定
D.反应②的反应物总能量比反应①的反应物总能量低
13.(2021·江苏扬州高二检测)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
14.(2021·浙江绍兴高二月考)根据图示回答下列问题:
(1)化学反应N2+3H2????2NH3的能量变化如图所示,该反应的热化学方程式是________(填字母)。
A.N2(g)+3H2(g)????2NH3(l)
ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)????2NH3(g)
ΔH=2(b-a)kJ·mol-1
C.N2(g)+H2(g)????NH3(l)
ΔH=(b+c-a)kJ·mol-1
D.N2(g)+H2(g)????NH3(g)
ΔH=(a+b)kJ·mol-1
(2)如图是N2和H2反应生成2 mol NH3过程中能量变化的示意图,请计算每生成1 mol NH3放出的热量为________。
(3)2SO2(g)+O2(g)????2SO3(g)反应过程的能量变化如图所示:
已知1 mol SO2(g)氧化为 1 mol SO3(g)的ΔH=-99 kJ·mol-1。
①图中A、C分别表示________、________,E的大小对该反应的反应热有无影响?________________________________________________________________________。
②图中ΔH=________kJ·mol-1。
15.(2022·浙江丽水高二联考)在保温杯式量热计中(见图)将100 mL 0.500 mol·L-1CH3COOH溶液与100 mL 0.55 mol·L-1NaOH溶液混合,温度从298.2 K升高到301.2 K,醋酸钠溶液的比热容c=4.2 J·g-1·K-1,溶液的密度为1 g·cm-3(已知:反应放出的热量Q=cmΔt)。
(1)通过计算,写出CH3COOH与NaOH发生中和反应生成1 mol H2O时的反应热
ΔH_________________________________________________________。
(2)实验中NaOH溶液过量的目的是________________。
(3)CH3COOH与NaOH发生中和反应生成1 mol H2O时的反应热的文献值为-56.1 kJ·mol-1,你认为(1)中测得的热量偏小的可能原因是__________________________________
________________________________________________________________________。
(4)你认为CH3COOH与NaOH中和反应的ΔH1和HCl与NaOH中和反应的ΔH2相比,________(填“ΔH1”“ΔH2”或“一样”)大,原因是_____________________________
________________________________________________________________________。
课时跟踪检测(一) 化学反应的焓变
[基础巩固练]
知识点一 焓变 反应热
1.下列关于化学反应与能量变化的说法正确的是( )
A.放热反应的发生无须任何条件
B.化学键的断裂和形成与反应放热和吸热无关
C.化学反应过程都伴随着能量的变化
D.硫酸与氢氧化钠的反应是吸热反应
解析:C 放热反应的发生可能需要条件,如加热等,A项错误;化学键的断裂和形成与反应放热和吸热有关,B项错误;化学反应过程都伴随着能量的变化,C项正确;H2SO4与NaOH的反应是放热反应,D项错误。
2.(2021·江苏南京高二检测)下列过程伴随的能量变化中,属于反应热的是( )
A.形成1 mol H—Cl键放出的能量
B.石墨转化为金刚石吸收的能量
C.1 mol O2形成2 mol O吸收的能量
D.水蒸气变成液态水放出的能量
解析:B 化学反应的实质是旧键的断裂和新键的形成。A项,只有化学键的形成,C项只有化学键的断裂,故其能量的变化不属于反应热,A、C错误;石墨转化为金刚石既有旧键的断裂,又有新键的形成,故其能量的变化属于反应热,B正确;水蒸气变成液态水是物理变化,故其能量的变化不属于反应热,D错误。
3.(2021·江苏泰州高二月考)反应A+B―→C(ΔH<0)分两步进行:①A+B―→X(ΔH>0),②X―→C(ΔH<0)。下列示意图中,能正确表示总反应过程中能量变化的是( )
解析:D 由A+B―→X(ΔH>0)为吸热反应,可知X的能量高于A+B的总能量,故A、C项错误;由总反应A+B―→C(ΔH<0)为放热反应,可知C的总能量小于A+B的能量,故B项错误,D项正确。
知识点二 探究化学反应中的能量变化
4.(2021·江苏盐城高二月考)已知化学反应A2(g)+B2(g)===2AB(g)的能量变化如图所示,判断下列叙述中正确的是( )
A.每生成2分子AB(g)吸收b kJ热量
B.该反应的反应热ΔH=(a-b)kJ·mol-1
C.该反应中反应物的总能量高于生成物的总能量
D.断裂1 mol A—A键和1 mol B—B键,放出a kJ能量
解析:B 每生成2 mol AB(g)吸收的热量应为(a-b)kJ,故A错误;焓变=反应物的键能之和-生成物的键能之和=(a-b)kJ·mol-1,故B正确;由图像可知,反应物的总能量小于生成物的总能量,故C错误;断键应吸收能量,故D错误。
5.(2021·湖北荆州高二检测)已知:2H2(g)+O2(g)===2H2O(g),1 mol H2完全燃烧放出241.8 kJ热量,有关键能数据如下:
化学键 H—O O===O
键能/(kJ·mol-1) 463.4 498
则H—H键键能为( )
A.413 kJ·mol-1 B.557 kJ·mol-1
C.221.6 kJ·mol-1 D.436 kJ·mol-1
解析:D 设H—H键键能为x kJ·mol-1,根据反应热和键能关系可知,ΔH=反应物键能总和-生成物键能总和,即(2x+498-4×463.4) kJ·mol-1=(-241.8×2) kJ·mol-1,解得x=436。
6.已知:2H2(g)+O2(g)===2H2O(g)
ΔH=-483.6 kJ·mol-1
下列有关说法不正确的是( )
A.该反应是氧化还原反应
B.破坏1 mol H—O键需要的能量是463.4 kJ
C.H2O(g)===H2(g)+O2(g) ΔH=241.8 kJ·mol-1
D.H2(g)中的H—H键比H2O(g)中的H—O键牢固
解析:D 该反应中有元素的化合价发生改变,是氧化还原反应,A说法正确;根据旧键的断裂吸收能量,新键的形成释放能量,H—O键的键能为
=463.4 kJ·mol-1,故破坏1 mol H—O键需要的能量是463.4 kJ,B说法正确;已知2H2(g)+O2(g)===2H2O(g) ΔH=-483.6 kJ·mol-1,则H2O(g)===H2(g)+O2(g) ΔH=241.8 kJ·mol-1,C说法正确;H2(g)中的H—H键的键能为436 kJ·mol-1,H2O(g)中的H—O键的键能为463.4 kJ·mol-1,则H2(g)中的H—H键比H2O(g)中的H—O键的稳定性差,D说法错误。
7.(2021·山东师大附中高二月考)天然气作为民生工程受到人们普遍关注。已知天然气不完全燃烧的热化学方程式为2CH4(g) +3O2(g)===2CO(g)+4H2O(g) ΔH(单位:kJ·mol-1)。且O===O键的键能为a kJ·mol-1,C—H键的键能为b kJ·mol-1,C≡O键的键能为c kJ·mol-1,O—H键的键能为d kJ·mol-1,则甲烷不完全燃烧的ΔH为( )
A.3a+8b-2c-8d B.3a+8b-2c-4d
C.2c+8d-3a-4b D.2c+8d-3a-8b
解析:A ΔH =反应物总键能之和—生成物总键能之和=3×a kJ·mol-1+8×b kJ·mol-1-(2c kJ·mol-1+8×d kJ·mol-1)= (3a+8b-2c-8d)kJ·mol-1。
知识点三 热化学方程式
8.下列说法错误的是( )
A.热化学方程式未注明温度和压强时,ΔH表示标准状况下的数据
B.热化学方程式中各物质化学式前的化学计量数不表示分子个数,只代表物质的量
C.同一化学反应,化学计量数不同,ΔH不同;化学计量数相同而物质的聚集状态不同,ΔH也不相同
D.化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比
解析:A 热化学方程式未注明温度和压强时,ΔH表示在25 ℃、101 kPa条件下测定的数据,故A错误;热化学方程式中的化学计量数只表示反应物或生成物的物质的量,不表示微粒数,化学计量数可以用分数表示,故B正确;化学反应的焓变(ΔH)只与反应体系的始态和终态有关,而与反应的途径无关,ΔH与热化学方程式的化学计量数成正比,对于同一化学反应,当化学计量数不同时,其ΔH不同,只要热化学方程式的化学计量数一定,ΔH值一定,化学反应过程所吸收或放出的热量与参加反应的物质的物质的量成正比,故C、D正确。
9.(2021·江苏南京高二月考)已知在25 ℃、101 kPa下,1 g C8H18(辛烷)完全燃烧生成二氧化碳和液态水时放出48.4 kJ热量。表示该反应的热化学方程式正确的是( )
A.C8H18(l)+O2(g)===8CO2(g)+9H2O(g)
ΔH=-48.4 kJ·mol-1
B.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=-5 517.6 kJ·mol-1
C.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=+5 517.6 kJ·mol-1
D.C8H18(l)+O2(g)===8CO2(g)+9H2O(l)
ΔH=-48.4 kJ·mol-1
解析:B C8H18(辛烷)的摩尔质量为114 g·mol-1,所以1 mol C8H18(辛烷)完全燃烧生成二氧化碳和液态水时放出5 517.6 kJ热量。
10.(2021·江苏徐州高二检测)已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ·mol-1。下列有关说法正确的是( )
A.在相同条件下,1 mol H2(g)与1 mol F2(g) 的能量总和大于2 mol HF(g) 的能量
B.1 mol H2(g)与1 mol F2(g) 反应生成2 mol液态HF放出的热量小于270 kJ
C.该反应的逆反应是放热反应
D.该反应过程的能量变化可用下图来表示
解析:A 该反应为放热反应,则在相同条件下,1 mol H2(g)与1 mol F2(g)的能量总和大于2 mol HF(g)的能量,故A正确;物质由气态变为液态时放出能量,则1 mol H2(g)与1 mol F2(g)反应生成2 mol液态HF放出的热量大于270 kJ,故B错误;因该反应的正反应为放热反应,所以逆反应是吸热反应,故C错误;由反应的热化学方程式可知,该反应的ΔH<0,为放热反应,说明反应物的总能量大于生成物的总能量,故D错误。
[素养提升练]
11.(2021·辽宁大连高二检测)根据表中提供的数据及相关物质结构知识可知:
反应1:SiCl4(g)+2H2(g)===Si(g)+4HCl(g) ΔH1;
反应2:Si(g)+O2(g)===SiO2(g) ΔH2。
反应1和反应2的反应热分别为( )
化学键 Si—Cl H—H Si—Si
键能/ (kJ·mol-1) 360 436 176
化学键 H—Cl O===O Si—O
键能/ (kJ·mol-1) 431 498 460
A.236 kJ·mol-1、-990 kJ·mol-1
B.-116 kJ·mol-1、-990 kJ·mol-1
C.-116 kJ·mol-1、-70 kJ·mol-1
D.-236 kJ·mol-1、-70 kJ·mol-1
解析:A 根据反应热=反应物的键能之和-生成物的键能之和,则反应1:SiCl4(g)+2H2(g)===Si(g)+4HCl(g)的ΔH=360 kJ·mol-1×4+436 kJ·mol-1×2-176 kJ·mol-1×2-431 kJ·mol-1×4=236 kJ·mol-1;反应2:Si(g)+O2(g)===SiO2(g)的ΔH=176 kJ·mol-1×2+498 kJ·mol-1-460 kJ·mol-1×4=-990 kJ·mol-1。
12.碘与氢气反应的热化学方程式:
①I2(g)+H2(g)????2HI(g) ΔH=-9.48 kJ·mol-1
②I2(s)+H2(g)????2HI(g) ΔH=26.48 kJ·mol-1
下列有关判断正确的是( )
A.254 g I2(g)中通入2 g H2(g),反应放热9.48 kJ
B.1 mol固态碘与1 mol气态碘所含的能量相差17.00 kJ
C.反应①的产物比反应②的产物稳定
D.反应②的反应物总能量比反应①的反应物总能量低
解析:D A项,因为该反应是可逆反应,所以不能进行完全,放出的热量小于9.48 kJ,错误;B项,1 mol固态碘与1 mol 气态碘所含的能量相差26.48 kJ-(-9.48 kJ)=35.96 kJ,错误;C项,生成物都是气态HI,一样稳定,错误;D项,等量的同一物质,固态物质的能量比气态物质的能量低,反应②的反应物总能量比反应①的反应物总能量低,正确。
13.(2021·江苏扬州高二检测)最新报道:科学家首次用X射线激光技术观察到CO与O在催化剂表面形成化学键的过程。反应过程的示意图如下:
下列说法正确的是( )
A.CO和O生成CO2是吸热反应
B.在该过程中,CO断键形成C和O
C.CO和O生成了具有共价键的CO2
D.状态Ⅰ→状态Ⅲ表示CO与O2反应的过程
解析:C 根据能量—反应过程的图像知,状态Ⅰ的能量高于状态Ⅲ的能量,故该过程是放热反应,A错误;根据状态Ⅰ、Ⅱ、Ⅲ可以看出整个过程中CO中的C和O形成的化学键没有断裂,B错误;由状态Ⅲ可知,生成物是CO2,CO2具有极性共价键,C正确;状态Ⅰ →状态Ⅲ表示CO与O反应的过程,D错误。
14.(2021·浙江绍兴高二月考)根据图示回答下列问题:
(1)化学反应N2+3H2????2NH3的能量变化如图所示,该反应的热化学方程式是________(填字母)。
A.N2(g)+3H2(g)????2NH3(l)
ΔH=2(a-b-c)kJ·mol-1
B.N2(g)+3H2(g)????2NH3(g)
ΔH=2(b-a)kJ·mol-1
C.N2(g)+H2(g)????NH3(l)
ΔH=(b+c-a)kJ·mol-1
D.N2(g)+H2(g)????NH3(g)
ΔH=(a+b)kJ·mol-1
(2)如图是N2和H2反应生成2 mol NH3过程中能量变化的示意图,请计算每生成1 mol NH3放出的热量为________。
(3)2SO2(g)+O2(g)????2SO3(g)反应过程的能量变化如图所示:
已知1 mol SO2(g)氧化为 1 mol SO3(g)的ΔH=-99 kJ·mol-1。
①图中A、C分别表示________、________,E的大小对该反应的反应热有无影响?________________________________________________________________________。
②图中ΔH=________kJ·mol-1。
解析: (1)由题图可以看出, mol N2(g)和 mol H2(g)的化学键断裂吸收的能量为a kJ,形成1 mol NH3(g)放出的能量为b kJ,所以N2(g)+H2(g)????NH3(g) ΔH=(a-b)kJ·mol-1,而1 mol NH3(g)转化为1 mol NH3(l)放出的热量为c kJ,所以有N2(g)+H2(g)????NH3(l) ΔH=(a-b-c)kJ·mol-1,即N2(g)+3H2(g)????2NH3(l) ΔH=2(a-b-c)kJ·mol-1。(2)由题图可知生成2 mol NH3放出的热量为427.2 kJ-335 kJ=92.2 kJ,则生成1 mol NH3放出的热量为46.1 kJ。(3)①由图示可知,A表示反应物的总能量,C表示生成物的总能量;E值不影响A、C的能量值,故能量E的大小对该反应的反应热无影响。②ΔH对应2 mol SO2(g)转化为2 mol SO3(g)的焓变,其值为2×(-99 kJ·mol-1)=-198 kJ·mol-1。
答案:(1)A (2)46.1 kJ (3)①反应物的总能量 生成物的总能量 无影响 ②-198
15.(2022·浙江丽水高二联考)在保温杯式量热计中(见图)将100 mL 0.500 mol·L-1CH3COOH溶液与100 mL 0.55 mol·L-1NaOH溶液混合,温度从298.2 K升高到301.2 K,醋酸钠溶液的比热容c=4.2 J·g-1·K-1,溶液的密度为1 g·cm-3(已知:反应放出的热量Q=cmΔt)。
(1)通过计算,写出CH3COOH与NaOH发生中和反应生成1 mol H2O时的反应热
ΔH_________________________________________________________。
(2)实验中NaOH溶液过量的目的是________________。
(3)CH3COOH与NaOH发生中和反应生成1 mol H2O时的反应热的文献值为-56.1 kJ·mol-1,你认为(1)中测得的热量偏小的可能原因是__________________________________
________________________________________________________________________。
(4)你认为CH3COOH与NaOH中和反应的ΔH1和HCl与NaOH中和反应的ΔH2相比,________(填“ΔH1”“ΔH2”或“一样”)大,原因是_____________________________
________________________________________________________________________。
解析:(1)由题中信息可知,温度差Δt=301.2 K-298.2 K=3.0 K,Q=cmΔt=4.2 J·g-1·K-1×(100 mL×1 g·cm-3+100 mL×1 g·cm-3)×3.0 K=2 520 J=2.52 kJ,100 mL 0.500 mol·L-1 CH3COOH溶液与100 mL 0.55 mol·L-1NaOH溶液混合反应,生成0.05 mol 水,由于中和反应是放热反应,则ΔH==-=-50.4 kJ·mol-1;(2)测酸和碱中和反应的反应热时,为了保证一方全部反应,往往需要另一试剂稍稍过量,从而减小实验误差,所以实验中NaOH过量,是为了能保证CH3COOH溶液完全被中和,从而提高实验的准确度;(3)文献值为56.1 kJ·mol-1,实际上测定数值偏低,可能原因有①量热计的保温效果不好,②酸碱溶液混合不迅速,③温度计不够精确等;(4)醋酸是弱酸,电离过程需要吸收能量,所以二者相比,HCl与NaOH的中和反应放热较多,由于ΔH为负值,则ΔH1大于ΔH2。
答案:(1)-50.4 kJ·mol-1
(2)保证醋酸完全被NaOH中和
(3)①量热计的保温效果不好,②酸碱溶液混合不迅速,③温度计不够精确等
(4) ΔH1 因CH3COOH是弱酸,电离要吸热
