化学人教版2019必修第一册3.2.2 铝及铝合金(共22张ppt)
文档属性
| 名称 | 化学人教版2019必修第一册3.2.2 铝及铝合金(共22张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 30.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-25 19:01:57 | ||
图片预览





文档简介
(共22张PPT)
走进奇妙的化学世界
必修第一册
第三章 铁 金属材料
第二节 金属材料
第2课时 铝及铝合金
铝和铝合金
闪耀着六射星光的天然红宝石(Al2O3中混有Cr)“罗斯利夫斯”,重138.7克拉,斯里兰卡产,世界著名珍宝。现藏于美国华盛顿斯密森博物馆。
闪耀着六射星光的天然蓝宝石(Al2O3中混有少量Ti、Fe)“亚洲之星”重330克拉,缅甸产,世界著名珍宝,现藏于美国华盛顿斯密森博物馆。
学习
目标
PART
01
PART
02
第2课时
铝及铝合金
了解金属铝的性质及铝合金的应用;
了解铝在自然界中的存在形态和在地壳中的含量;
掌握铝和氧化铝的性质,认识两性氧化物的特性。
PART
03
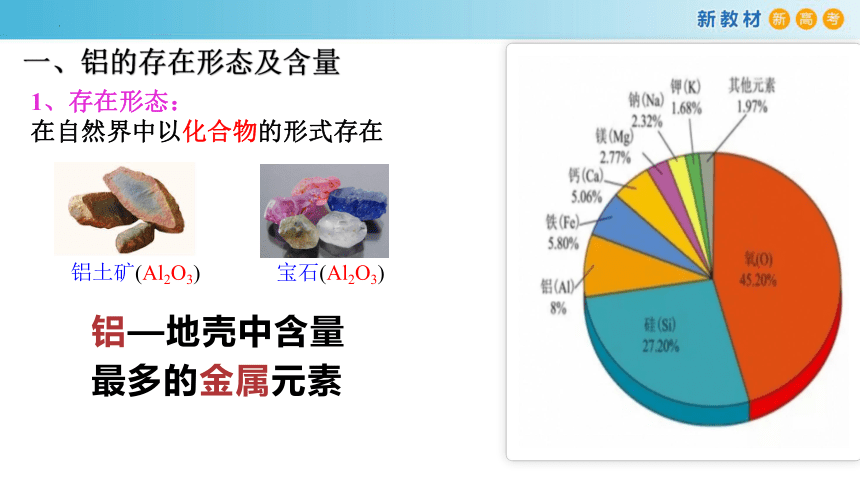
铝—地壳中含量最多的金属元素
一、铝的存在形态及含量
1、存在形态:
在自然界中以化合物的形式存在
铝土矿(Al2O3)
宝石(Al2O3)
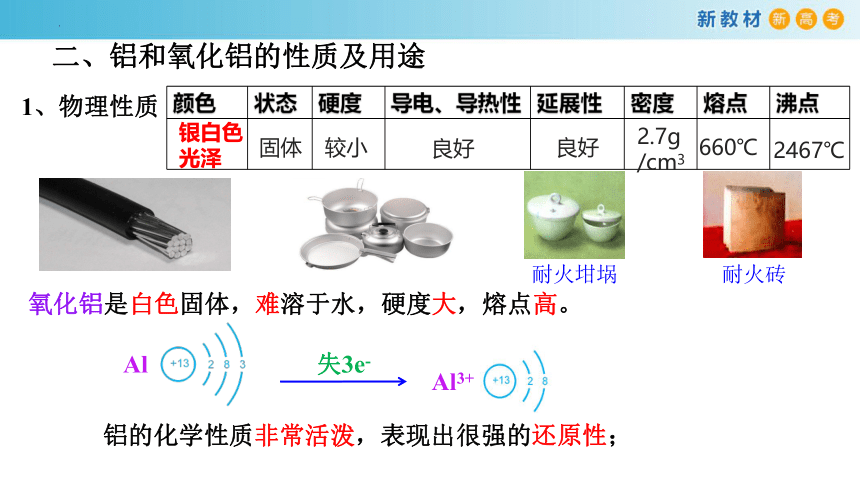
1、物理性质
二、铝和氧化铝的性质及用途
Al
失3e-
Al3+
铝的化学性质非常活泼,表现出很强的还原性;
氧化铝是白色固体,难溶于水,硬度大,熔点高。
颜色 状态 硬度 导电、导热性 延展性 密度 熔点 沸点
银白色光泽
固体
较小
良好
良好
2.7g
/cm3
660℃
2467℃
耐火坩埚
耐火砖
2、化学性质
【思考】在生活中有很多铁制品和铝制品,铁制品容易生锈,而铝制品基本不会,这是为什么呢?
铝表面会与空气中氧气生成一层致密的氧化铝薄膜,
这层膜起着保护内部金属的作用。
感受铝的氧化膜的存在
加热铝箔
实验现象:
实验结论:
铝箔熔化,表面失去光泽,熔化的铝并不滴落,好象有一层膜兜着
铝表面会与空气中氧气生成一层致密的氧化铝薄膜,氧化铝(Al2O3)的熔点很高,没有熔化,包在外面使熔化的液态铝不会滴落下来。
注意:铝箔在空气中加热不燃烧,只能熔化成液体但不滴落。
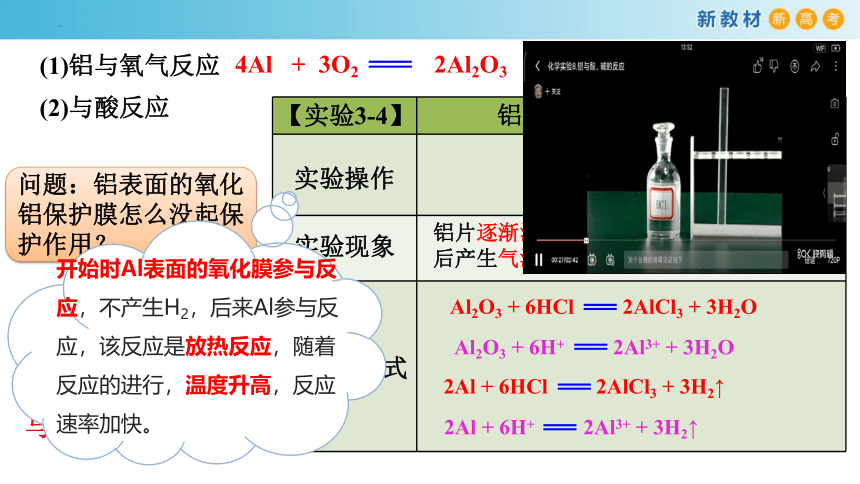
4Al + 3O2 2Al2O3
(1)铝与氧气反应
(2)与酸反应
【实验3-4】 铝片(未打磨)与盐酸反应
实验操作
实验现象
反应方程式
铝片逐渐溶解,开始没有气泡,一段时间后产生气泡,点燃产生的气体有暴鸣声。
Al2O3 + 6HCl 2AlCl3 + 3H2O
Al2O3 + 6H+ 2Al3+ + 3H2O
2Al + 6HCl 2AlCl3 + 3H2↑
2Al + 6H+ 2Al3+ + 3H2↑
问题:铝表面的氧化铝保护膜怎么没起保护作用?
氧化铝和铝均能与盐酸发生反应
开始时Al表面的氧化膜参与反应,不产生H2,后来Al参与反应,该反应是放热反应,随着反应的进行,温度升高,反应速率加快。
(3)与NaOH溶液反应
【实验3-5】在两支试管中分别加入少量的NaOH溶液,然后向其中一支试管中放入一小块铝片,向另一支试管中放入用砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片。观察现象。过一段时间后,将点燃的木条分别放在两支试管口,你观察到什么现象?
未打磨的铝片逐渐溶解,开始时没有气泡产生,一段时间后才有气泡产生,将燃着的木条放在试管口,发生爆鸣声
打磨过的铝片逐渐溶解,立即产生气泡且速率始终较快,将燃着的木条放在试管口,发生爆鸣声
上述不同的现象这说明了什么?
铝和铝表面的氧化膜(氧化铝)都能与强碱溶液反应
偏铝酸钠
①失去保护膜的铝跟水反应:
②NaOH溶液溶解Al(OH)3:
由①+②×2可得:
由以上可知:Al并不直接和NaOH溶液反应,不是两性金属
铝与NaOH溶液反应,可以认为是分两步进行的:
1、铝
2Al+6HCl=2AlCl3+3H2↑
2Al+2NaOH+2H2O=3H2↑+2NaAlO2
2、氧化铝(两性氧化物)
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+2NaOH=2NaAlO2+H2O
3、氢氧化铝(两性氢氧化物)
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
既能与酸反应生成盐和水,也能与碱反应生成盐和水,
叫做两性氧化物(或两性氢氧化物)
铝及其化合物性质小结:
Al与酸或碱和水反应生成盐和氢气
Al2O3、Al(OH)3与酸、碱反应生成盐和H2O
1.下列关于铝的说法中,正确的是( )
A.铝的化学性质不活泼
B.铝不与酸、碱反应
C.常温下铝不与氧气反应
D.铝表面容易生成一层致密的氧化铝保护膜
C
2.在空气中铝制品比铁制品耐腐蚀的原因是( )
A.铝的金属活动性比铁弱
B.铝不与氧气发生化学反应
C.铝在空气中易与氧气反应形成一层致密的氧化膜
D.铝的密度比铁的密度小
3.除去镁粉中的少量铝粉,可选用的是( )
A.稀硫酸 B.氢氧化钠溶液
C.水 D.稀盐酸
C
B
4.向某溶液中加入铝粉能放出H2,下列各组离子一定不能在该溶液中大量共存的是( )
A.Na+、Fe3+、SO42-、Cl-
B.Ba2+、Mg2+、HCO3-、NO3-
C.Na+、K+、NO3-、CO32-
D.K+、NO3-、Na+、SO42-
D
5.向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中没有发生的离子反应是 。
A.CO2+2OH-==CO32-+H2O
B.Al2O3+2OH-==2AlO2-+H2O
C.2Al+2OH-+2H2O==2AlO2-+3H2↑
D.Al3++4OH-==AlO2-+2H2O
D
6、下列既能跟盐酸反应,又能跟氢氧化钠溶液反应的物质是( )
①Al2O3 ②AlCl3 ③Al ④NaHCO3
A. ①②③ B. ①②④
C. ①③④ D. ②③④
C
7、称取两份铝粉,第一份加入足量的NaOH溶液,第二份加入足量的盐酸,若放出的氢气的体积相等
(同温同压)。则两份铝粉的质量比为( )
A. 1∶2 B. 1∶3 C. 3∶2 D. 1∶1
D
硬铝:Cu 4%、Mg 0.5%、
Mn 0.5%、Si 0.7%
特点:密度小、强度高、抗腐蚀
用途:制造飞机和宇宙飞船
铝合金
纯铝的硬度和强度都比较小
向铝中加入少量合金元素,如Cu Mg Si Mn Zn及稀土元素等
常见的铝合金
合金名称 主要性质 主要用途
镁铝合金 密度小,抗腐蚀能力强,强度和硬度都比纯铝和纯镁大 火箭、飞机、宇宙飞船、轮船等制造业
硬铝 密度小,抗腐蚀能力强,强度和硬度都比纯铝大 火箭、飞机、宇宙飞船、轮船等制造业
[日常应用]
1. 列举生活中的合金材料,并简述选择该材料时利用了该合金的哪些优异性能。
①铝合金门窗:质轻、耐腐蚀;
②易拉罐:质轻、易回收利用。
2.为什么航空工业中铝合金比铁合金应用更广泛?
铝合金比铁合金密度小且耐高温、耐腐蚀。
3.根据铝的性质分析,如何除去镁粉中的铝粉?
将样品加入足量的NaOH溶液,然后过滤、洗涤、干燥。
谢谢欣赏
走进奇妙的化学世界
必修第一册
第三章 铁 金属材料
第二节 金属材料
第2课时 铝及铝合金
铝和铝合金
闪耀着六射星光的天然红宝石(Al2O3中混有Cr)“罗斯利夫斯”,重138.7克拉,斯里兰卡产,世界著名珍宝。现藏于美国华盛顿斯密森博物馆。
闪耀着六射星光的天然蓝宝石(Al2O3中混有少量Ti、Fe)“亚洲之星”重330克拉,缅甸产,世界著名珍宝,现藏于美国华盛顿斯密森博物馆。
学习
目标
PART
01
PART
02
第2课时
铝及铝合金
了解金属铝的性质及铝合金的应用;
了解铝在自然界中的存在形态和在地壳中的含量;
掌握铝和氧化铝的性质,认识两性氧化物的特性。
PART
03
铝—地壳中含量最多的金属元素
一、铝的存在形态及含量
1、存在形态:
在自然界中以化合物的形式存在
铝土矿(Al2O3)
宝石(Al2O3)
1、物理性质
二、铝和氧化铝的性质及用途
Al
失3e-
Al3+
铝的化学性质非常活泼,表现出很强的还原性;
氧化铝是白色固体,难溶于水,硬度大,熔点高。
颜色 状态 硬度 导电、导热性 延展性 密度 熔点 沸点
银白色光泽
固体
较小
良好
良好
2.7g
/cm3
660℃
2467℃
耐火坩埚
耐火砖
2、化学性质
【思考】在生活中有很多铁制品和铝制品,铁制品容易生锈,而铝制品基本不会,这是为什么呢?
铝表面会与空气中氧气生成一层致密的氧化铝薄膜,
这层膜起着保护内部金属的作用。
感受铝的氧化膜的存在
加热铝箔
实验现象:
实验结论:
铝箔熔化,表面失去光泽,熔化的铝并不滴落,好象有一层膜兜着
铝表面会与空气中氧气生成一层致密的氧化铝薄膜,氧化铝(Al2O3)的熔点很高,没有熔化,包在外面使熔化的液态铝不会滴落下来。
注意:铝箔在空气中加热不燃烧,只能熔化成液体但不滴落。
4Al + 3O2 2Al2O3
(1)铝与氧气反应
(2)与酸反应
【实验3-4】 铝片(未打磨)与盐酸反应
实验操作
实验现象
反应方程式
铝片逐渐溶解,开始没有气泡,一段时间后产生气泡,点燃产生的气体有暴鸣声。
Al2O3 + 6HCl 2AlCl3 + 3H2O
Al2O3 + 6H+ 2Al3+ + 3H2O
2Al + 6HCl 2AlCl3 + 3H2↑
2Al + 6H+ 2Al3+ + 3H2↑
问题:铝表面的氧化铝保护膜怎么没起保护作用?
氧化铝和铝均能与盐酸发生反应
开始时Al表面的氧化膜参与反应,不产生H2,后来Al参与反应,该反应是放热反应,随着反应的进行,温度升高,反应速率加快。
(3)与NaOH溶液反应
【实验3-5】在两支试管中分别加入少量的NaOH溶液,然后向其中一支试管中放入一小块铝片,向另一支试管中放入用砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片。观察现象。过一段时间后,将点燃的木条分别放在两支试管口,你观察到什么现象?
未打磨的铝片逐渐溶解,开始时没有气泡产生,一段时间后才有气泡产生,将燃着的木条放在试管口,发生爆鸣声
打磨过的铝片逐渐溶解,立即产生气泡且速率始终较快,将燃着的木条放在试管口,发生爆鸣声
上述不同的现象这说明了什么?
铝和铝表面的氧化膜(氧化铝)都能与强碱溶液反应
偏铝酸钠
①失去保护膜的铝跟水反应:
②NaOH溶液溶解Al(OH)3:
由①+②×2可得:
由以上可知:Al并不直接和NaOH溶液反应,不是两性金属
铝与NaOH溶液反应,可以认为是分两步进行的:
1、铝
2Al+6HCl=2AlCl3+3H2↑
2Al+2NaOH+2H2O=3H2↑+2NaAlO2
2、氧化铝(两性氧化物)
Al2O3+6HCl=2AlCl3+3H2O
Al2O3+2NaOH=2NaAlO2+H2O
3、氢氧化铝(两性氢氧化物)
Al(OH)3+3HCl=AlCl3+3H2O
Al(OH)3+NaOH=NaAlO2+2H2O
既能与酸反应生成盐和水,也能与碱反应生成盐和水,
叫做两性氧化物(或两性氢氧化物)
铝及其化合物性质小结:
Al与酸或碱和水反应生成盐和氢气
Al2O3、Al(OH)3与酸、碱反应生成盐和H2O
1.下列关于铝的说法中,正确的是( )
A.铝的化学性质不活泼
B.铝不与酸、碱反应
C.常温下铝不与氧气反应
D.铝表面容易生成一层致密的氧化铝保护膜
C
2.在空气中铝制品比铁制品耐腐蚀的原因是( )
A.铝的金属活动性比铁弱
B.铝不与氧气发生化学反应
C.铝在空气中易与氧气反应形成一层致密的氧化膜
D.铝的密度比铁的密度小
3.除去镁粉中的少量铝粉,可选用的是( )
A.稀硫酸 B.氢氧化钠溶液
C.水 D.稀盐酸
C
B
4.向某溶液中加入铝粉能放出H2,下列各组离子一定不能在该溶液中大量共存的是( )
A.Na+、Fe3+、SO42-、Cl-
B.Ba2+、Mg2+、HCO3-、NO3-
C.Na+、K+、NO3-、CO32-
D.K+、NO3-、Na+、SO42-
D
5.向集满CO2的铝制易拉罐中加入过量NaOH浓溶液,立即封闭罐口,易拉罐渐渐凹瘪;再过一段时间,罐壁又重新凸起。上述实验过程中没有发生的离子反应是 。
A.CO2+2OH-==CO32-+H2O
B.Al2O3+2OH-==2AlO2-+H2O
C.2Al+2OH-+2H2O==2AlO2-+3H2↑
D.Al3++4OH-==AlO2-+2H2O
D
6、下列既能跟盐酸反应,又能跟氢氧化钠溶液反应的物质是( )
①Al2O3 ②AlCl3 ③Al ④NaHCO3
A. ①②③ B. ①②④
C. ①③④ D. ②③④
C
7、称取两份铝粉,第一份加入足量的NaOH溶液,第二份加入足量的盐酸,若放出的氢气的体积相等
(同温同压)。则两份铝粉的质量比为( )
A. 1∶2 B. 1∶3 C. 3∶2 D. 1∶1
D
硬铝:Cu 4%、Mg 0.5%、
Mn 0.5%、Si 0.7%
特点:密度小、强度高、抗腐蚀
用途:制造飞机和宇宙飞船
铝合金
纯铝的硬度和强度都比较小
向铝中加入少量合金元素,如Cu Mg Si Mn Zn及稀土元素等
常见的铝合金
合金名称 主要性质 主要用途
镁铝合金 密度小,抗腐蚀能力强,强度和硬度都比纯铝和纯镁大 火箭、飞机、宇宙飞船、轮船等制造业
硬铝 密度小,抗腐蚀能力强,强度和硬度都比纯铝大 火箭、飞机、宇宙飞船、轮船等制造业
[日常应用]
1. 列举生活中的合金材料,并简述选择该材料时利用了该合金的哪些优异性能。
①铝合金门窗:质轻、耐腐蚀;
②易拉罐:质轻、易回收利用。
2.为什么航空工业中铝合金比铁合金应用更广泛?
铝合金比铁合金密度小且耐高温、耐腐蚀。
3.根据铝的性质分析,如何除去镁粉中的铝粉?
将样品加入足量的NaOH溶液,然后过滤、洗涤、干燥。
谢谢欣赏
