[课时练习]2022-2023学年高一上学期人教版(2019)高中化学 必修一1.2.2离子反应(Word含答案)
文档属性
| 名称 | [课时练习]2022-2023学年高一上学期人教版(2019)高中化学 必修一1.2.2离子反应(Word含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 592.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-26 10:50:12 | ||
图片预览




文档简介
课时2离子反应
学校:___________姓名:___________班级:___________考号:___________
一、单选题(本大题共16小题,共16.0分)
离子反应、复分解反应、置换反应之间可用集合关系来表示,下列关系正确的是( )
A. B.
C. D.
某无色溶液既可能呈强酸性又可能呈强碱性,在该溶液中一定能大量共存的离子组是( )
A. B.
C. D.
甲、乙、丙、丁四位同学分别进行实验,测定四份不同澄清溶液的成分,记录结果如下:
甲:、、
乙:、、
丙:、、
丁:、、
其中记录结果合理的是( )
A. 甲 B. 乙 C. 丙 D. 丁
下列反应属于离子反应的是( )
A. 氢气还原氧化铜生成水和铜
B. 石灰石高温分解生成氧化钙和二氧化碳
C. 盐酸滴加到石灰石固体上
D. 实验室加热高锰酸钾制氧气
下列两种物质的溶液混合后,能发生离子反应,且溶液的总质量不会发生改变的是( )
A. 澄清石灰水和稀盐酸混合
B. 小苏打溶液和柠檬水混合制汽水
C. 人工盐含有硫酸钠、碳酸氢钠、氯化钠、硫酸钾溶液与溶液混合
D. 氯化钠溶液和蔗糖水的混合溶液可治疗腹泻
在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中共存的是( )
A. 含有大量的溶液:加入、、、
B. 滴加酚酞变红的溶液:加入、、、
C. 所含溶质为的溶液:加入、、、
D. 常温下,加入铁粉能生成的溶液:加入、、、
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A. 氢氧化铜与盐酸、氢氧化铜与硫酸
B. 氯化钡溶液与硫酸钠溶液、氢氧化钡溶液与稀硫酸
C. 碳酸钠溶液与盐酸、碳酸钙与盐酸
D. 石灰石与硝酸、石灰石与醋酸
某无色透明的溶液中含有、、、、、、、、、中的三种离子,若向其中加入石蕊溶液,溶液显蓝色,且滴入盐酸无气泡产生,则原溶液中可能存在的离子是( )
A. 、、 B. 、、
C. 、、 D. ,,
甲、乙、丙、丁四种易溶于水的物质,分别由、、、、、,、中的不同阳离子和阴离子各一种组成,将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成,则甲为( )
A. B. C. D.
下列对于某些离子的检验及结论一定正确的是( )
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有
C. 加入酸化后加入溶液产生白色沉淀,则原溶液中一定含有
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有
下列各组溶液中的反应,不管反应物量的多少,都只能用同一离子方程式来表示的是( )
A. 与 B. 与
C. 与 D. 与
下列离子方程式书写正确的是( )
A. 用醋酸除去水垢:
B. 与过量溶液反应:
C. 与稀硫酸反应:
D. 澄清石灰水与过量二氧化碳气体反应:
某固体样品中含有、和三种杂质中的一种或两种。现将样品加入足量水,样品全部溶解,再加入过量的溶液,得到沉淀。对样品所含杂质判断完全正确的是( )
A. 肯定有,可能还含有
B. 肯定有,没有
C. 肯定没有,可能有
D. 肯定没有和
滴有酚酞的溶液显红色,在该溶液中分别滴加溶液后有下列现象。下列说法不正确的是( )
序号 装置 溶液 现象
盐酸 溶液红色褪去,无沉淀,灯泡亮度没有明显变化
Ⅱ 溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化
Ⅲ 溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗
A. 实验Ⅰ中溶液红色褪去,因为发生了反应
B. 实验Ⅱ中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中存在大量的与
C. 实验Ⅲ中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应
D. 将实验Ⅱ中溶液换成溶液,现象与原实验Ⅱ中的现象相同
离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知、、的摩尔电导率分别为、、,据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
A. B.
C. D.
下列离子方程式正确的是( )
稀盐酸与铁屑反应:
碳酸镁与稀硫酸反应:
碳酸氢钙溶液中加入少量氢氧化钠溶液:
溶液中逐滴加入,溶液至刚好沉淀完全:
向溶液中滴加溶液至溶液呈中
性:
向碳酸氢铵溶液中加入足量石灰水:
A. B. C. D.
二、填空题(本大题共1小题,共1.0分)
按要求书写下列反应的离子方程式。
往澄清石灰水中通入少量二氧化碳,请写出此反应的离子方程式: 。
锌粒投入稀中,溶液里氢离子的量减少,锌离子的量增加, 填离子的量没有变化,反应的离子方程式是 。
将过量的二氧化碳气体通入烧碱溶液中,然后将反应后的溶液分成两等份,分别加入过量的硝酸、氢氧化钙溶液。
请分别写出发生反应的离子方程式:
。
。
三、实验题(本大题共1小题,共10.0分)
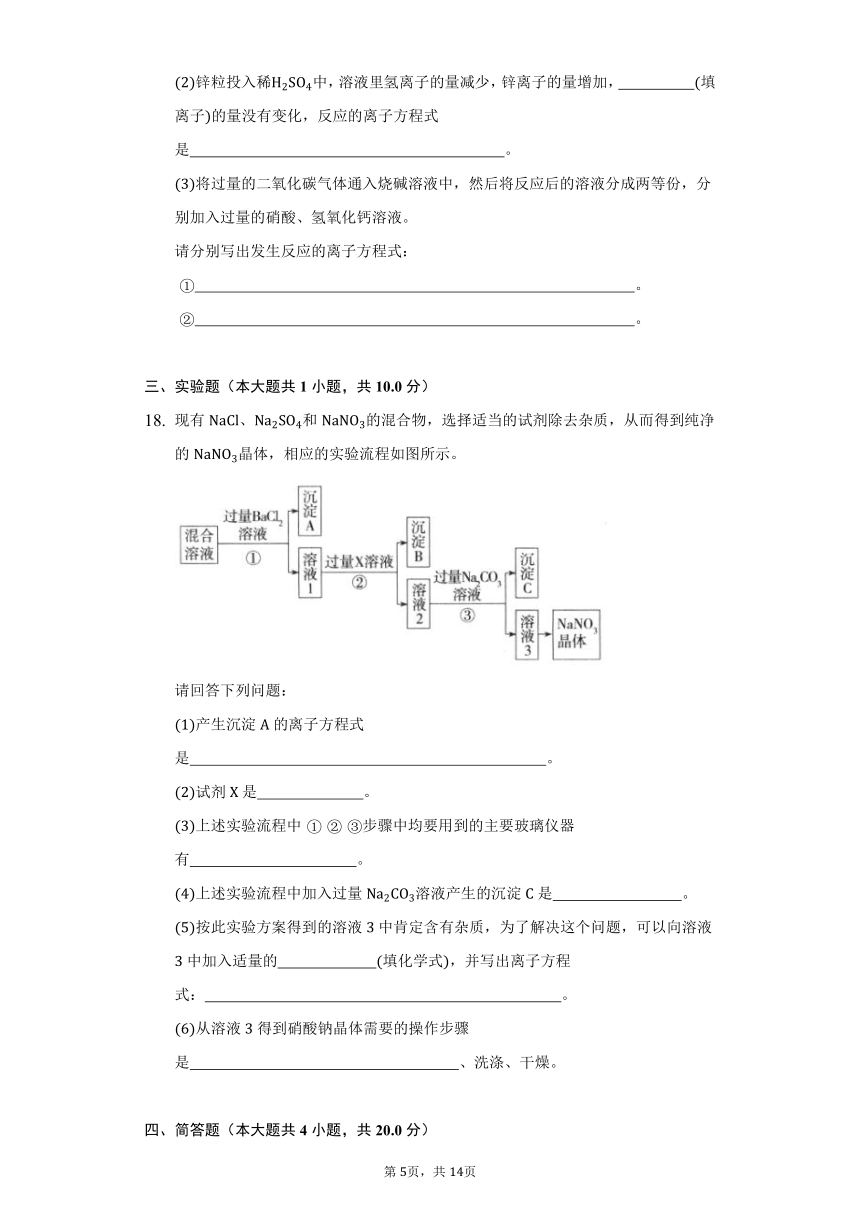
现有、和的混合物,选择适当的试剂除去杂质,从而得到纯净的晶体,相应的实验流程如图所示。
请回答下列问题:
产生沉淀的离子方程式是 。
试剂是 。
上述实验流程中步骤中均要用到的主要玻璃仪器有 。
上述实验流程中加入过量溶液产生的沉淀是 。
按此实验方案得到的溶液中肯定含有杂质,为了解决这个问题,可以向溶液中加入适量的 填化学式,并写出离子方程式: 。
从溶液得到硝酸钠晶体需要的操作步骤是 、洗涤、干燥。
四、简答题(本大题共4小题,共20.0分)
仔细分析下列实验:
A、、试管中的现象如表所示:
试管
现象 产生白色沉淀,
溶液仍为蓝色 产生蓝色沉淀,
溶液变为无色 产生蓝色沉淀,
溶液变为
无色
写出、、试管中所发生反应的离子方程式。
。
。
。
某小组在实验室探究Ba(OH)2溶液与稀盐酸反应的实质。向0.2mol Ba(OH)2溶液中滴加0.1mol盐酸,测得溶液导电率的变化如图所示,回答下列问题:
(1)Ba在水中以离子形式存在的实验证据是 。Ba的电离方程式为 。
(2)A~B段发生的离子反应是 。
(3)B点恰好完全反应,此时溶液中存在的微粒有O、 。
(4)下列化学反应的实质与Ba溶液和稀盐酸反应的实质相同的是 (填序号)。
A.Ba和
B.NaOH和
C.Ba与
甲、乙、丙、丁四种可溶性物质,均分别由、、、、、、、中的两种离子组成,四种物质中的离子各不相同,它们具有如下一些反应:
甲乙红褐色沉淀 甲丙白色甲丁白色
由上述现象可以确定的物质编号与化学式分别为 。写出相应的离子方程式: 。
将白色沉淀与盐酸混合无明显现象,则丙、丁的化学式分别是 ,写出甲与足量的丁反应的离子方程式:
与在溶液中“相遇”时会有红褐色沉淀生成并产生气泡,写出相应的离子方程式: ,当某溶液中存在时,中不可能有 。
现有失去标签的甲、乙、丙、丁四瓶溶液,溶质分别是、、、中的一种,为了鉴别它们,进行了如下实验:
甲丁溶液气体 乙丙溶液沉淀
乙丁溶液沉淀 甲乙溶液沉淀
在得到的沉淀中加入足量稀盐酸,沉淀迅速溶解,并产生无色无味的气体。
根据以上实验事实,回答下列问题:
中得到沉淀所使用的玻璃仪器有 。
乙为 填名称,下同溶液,丁为 溶液。
写出在得到的沉淀中加入足量稀盐酸时反应的离子方程式: 。
答案和解析
1.【答案】
【解析】部分置换反应、部分复分解反应属于离子反应,置换反应与复分解反应属于并列关系,无交叉,故选C。
2.【答案】
【解析】呈紫红色,项错误;溶液呈强酸性时不能大量存在,溶液呈强碱性时不能大量存在,项错误;强酸性或强碱性溶液中、、、相互不反应,均能大量共存,且溶液为无色,项正确溶液呈强酸性时不能大量存在,溶液呈强碱性时也不能大量存在,项错误。
3.【答案】
【解析】甲中会形成沉淀而不能共存,A错误;乙中会形成沉淀而不能共存,B错误;丙中会产生气体而不能共存,C错误。
4.【答案】
【解析】氢气还原氧化铜生成水和铜,没有离子参与反应,项错误;石灰石高温分解生成氧化钙和二氧化碳,没有离子参与反应,项错误;盐酸滴加到石灰石固体上,生成了氯化钙、水和二氧化碳,有离子参与反应,属于离子反应,项正确;实验室加热高锰酸钾制氧气,没有离子参与反应, 项错误。
5.【答案】
【解析】项,发生了离子反应:,生成水,溶液总质量不变,符合题意;项,与酸反应产生气体,发生了离子反应,逸出,使溶液总质量变小,不符合题意;项,与反应生成沉淀,发生了离子反应,溶液总质量变小,不符合题意;项,与蔗糖不发生反应,不符合题意。
6.【答案】
【解析】含有大量的溶液中,、、、、各离子之间不反应,能大量共存,A正确;滴加酚酞变红的溶液呈碱性,碱性条件下不能大量存在,B错误;所含溶质为的溶液中含有大量,酸性条件下不能大量存在,C错误;常温下,加入铁粉能生成的溶液呈酸性,酸性条件下不能大量存在,D错误。
7.【答案】
【解析】氢氧化铜是难溶物,要写化学式, 和硫酸都是强电解质,写成离子形式,离子方程式都是 ,故A正确;氯化钡溶液与硫酸钠溶液、氢氧化钡溶液与稀硫酸反应的离子方程式分别为:、,离子方程式不同,故B错误;碳酸钠溶液与盐酸、碳酸钙与盐酸反应的离子方程式分别为:、,离子方程式不同,故C错误;石灰石与硝酸、石灰石与醋酸反应的离子方程式分别为: 、,离子方程式不同,故D错误。
8.【答案】
【解析】无色透明的溶液中不会存在向其中加入石蕊溶液,溶液显蓝色,说明该溶液为碱性溶液,且滴入盐酸后,无气泡产生,则溶液中存在大量,不含因为阳离子、、、都与反应,则溶液中一定存在又与反应,则溶液中一定不存在因为有三种离子存在,则一定存在根据分析可以知道,溶液中一定存在的离子为,、,A正确。
9.【答案】
【解析】依题意得,四种物质两两反应形成的白色沉淀为、、,而甲溶液能够与其他各物质反应生成三种沉淀,所以甲中一定含有和,即甲为,D正确。
10.【答案】
【解析】加入稀盐酸产生无色气体,不一定有,可能为、、,A错误;加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,可能含有,不一定有,B错误;加入酸化后加入溶液,产生的白色沉淀为,则原溶液中一定含有,C正确;加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,该溶液中可能含有,不一定有,D错误。
11.【答案】
【解析】氢氧化钠少量时,与二氧化碳反应生成碳酸氢钠,氢氧化钠过量时,二者反应生成碳酸钠,不能用同一离子方程式表示,A错误;无论量的多少都只发生 ,能用同一离子方程式表示,B正确;少量时发生反应:,过量时发生,不能用同一离子方程式表示,C错误;少量时,与反应生成水、碳酸钙、碳酸氢钠,而过量时,二者反应生成碳酸钙、碳酸钠、水,产物不同,不能用同一离子方程式表示,D错误。
12.【答案】
【解析】用醋酸除去水垢,醋酸是弱酸,写化学式,离子方程式为,故A错误;与过量溶液反应生成碳酸钙和水,离子方程式为,故B错误;与稀硫酸不反应,故C错误;澄清石灰水与过量二氧化碳气体反应生成碳酸氢钙,离子方程式为,故D正确。
13.【答案】
【解析】样品加入水中,全部溶解,说明一定无硝酸钡,若样品全是,样品溶解后,加入过量的溶液,则
若样品全是,样品溶解后,加入过量的溶液,则
现得到沉淀,则样品中肯定有,可能还有,故A选项正确。
14.【答案】
【解析】与盐酸发生中和反应:,溶液碱性减弱,则实验Ⅰ中溶液红色褪去,故A正确与溶液发生反应生成硫酸钡沉淀和氢氧化钠,实验Ⅱ中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在大量的与,故B正确与溶液发生反应:,溶液碱性减弱,离子浓度减小,则实验Ⅲ中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,故C正确将实验Ⅱ中溶液换成溶液,发生反应:,有蓝色沉淀生成,溶液红色褪去,灯泡逐渐变暗,反应现象与原实验Ⅱ中的现象不同,故D错误。
15.【答案】
【解析】向澄清石灰水中通入,先发生反应: ,溶液中离子浓度降低,导电能力降低,继续通入二氧化碳,发生反应:,溶液的导电能力增强,但由于的摩尔电导率比的大,故溶液最终的导电能力低于澄清石灰水的导电能力。
16.【答案】
【解析】稀盐酸与铁屑反应生成,不正确;碳酸镁与稀硫酸反应的离子方程式为,正确;碳酸氢钙溶液中加入少量氢氧化钠溶液,发生反应的离子方程式为 ,正确;向溶液中逐滴加入溶液至刚好沉淀完全,发生反应的离子方程式为 ,正确;向溶液中滴加溶液至溶液呈中性,发生反应的离子方程式为 ,正确;向碳酸氢铵溶液中加入足量石灰水的离子方程式为 ,不正确。故选B。
17.【答案】
;
【解析】反应生成碳酸钙沉淀和水,离子方程式为 。
反应生成硫酸锌和氢气,硫酸根离子实际不参加反应,则的量不变,离子方程式为。
过量的二氧化碳气体通入烧碱溶液中反应生成碳酸氢钠,碳酸氢钠与硝酸反应生成硝酸钠、水、二氧化碳,离子方程式为;碳酸氢钠与过量的氢氧化钙反应生成碳酸钙、水、氢氧化钠,离子方程式为 。
18.【答案】
烧杯、玻璃棒和漏斗
和
;
蒸发浓缩、冷却结晶、过滤
【解析】由流程可知,混合溶液中加入过量氯化钡溶液,硫酸根离子和钡离子结合生成沉淀,则沉淀为,溶液中含氯化钠、硝酸钠、氯化钡,溶液中加入过量溶液后,氯离子和银离子结合生成沉淀,则沉淀为,溶液中含硝酸钠、硝酸银、硝酸钡,溶液中加入过量溶液后钡离子和碳酸根离子结合生成沉淀,银离子和碳酸根离子结合生成沉淀,则沉淀为碳酸钡、碳酸银的混合物,溶液中的溶质为硝酸钠和碳酸钠。
沉淀为,产生沉淀的离子方程式是
由上述分析可知,为。
流程中步均生成沉淀,需要进行过滤操作,均要用到的主要玻璃仪器有烧杯、玻璃棒和漏斗。
加入过量的溶液的目的是使溶液中的、完全沉淀,则产生的沉淀是和。
根据上述分析可知,溶液中含有、,可加适量的稀除去,发生反应的离子方程式为。
由于硝酸易挥发,所以溶液中滴加适量的稀硝酸后,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥即可得到纯净的硝酸钠。
19.【答案】
【解析】溶液和溶液混合后,和结合生成白色沉淀,和不反应,所以溶液仍然呈蓝色,向滤液中加入溶液,和反应生成蓝色沉淀。溶液和溶液混合后,和反应生成蓝色沉淀,和反应生成白色沉淀。
20.【答案】(1)A点的导电率高;Ba=+
(2)+=O
(3)、
(4)BC
【解析】溶液的导电率和离子浓度及离子所带电荷数有关。反应中和反应生成O,溶液中离子浓度减小,溶液的导电率下降;恰好完全中和后,随着盐酸的加入,溶液中离子浓度增大,溶液的导电率增大;因此可以推出B点时,Ba和HCl恰好完全反应。
(1)AB段,A点溶液的导电率高,随着加入盐酸的体积的增多,溶液的导电率减小,是因为发生反应:+=O,溶液中离子浓度减小,说明Ba在水中以离子形式存在; Ba的电离方程式为Ba=+。
(2)A∽B段Ba和HCl发生反应,离子方程式为+=O。
(3)B点Ba和HCl恰好完全反应,此时溶液中存在的微粒有O、、。
(4)Ba(OH)溶液与稀盐酸反应的实质是+=O。
A项,Ba和反应的实质是+++2=+O;B项,NaOH和反应的实质是+=O;C项,Ba与反应的实质是+=O,则B、C符合题意。
21.【答案】甲:、乙: ;
、 ;
;、
【解析】由甲能与另外两种物质反应生成白色沉淀知甲为由甲与乙反应得到红褐色沉淀知乙为另外两种物质是、。
丙、丁分别是与中的一种,、是、中的一种,由与盐酸混合后无明显现象知是,则是,故丙是、丁是。
红褐色沉淀是,无色气泡是,据此推出反应的离子方程式为。能与反应,也能与反应,故中不可能有和。
22.【答案】漏斗、烧杯、玻璃棒
硝酸钡;硫酸
【解析】乙分别与甲、丙、丁混合,均有沉淀生成,则乙为溶液,在得到的沉淀中加入足量的盐酸,沉淀迅速溶解并产生无色无味的气味,则该沉淀为,甲为溶液根据可知丁为溶液,则丙为溶液。
通过过滤分离出沉淀,所使用的玻璃仪器有漏斗、烧杯、玻璃棒。
由以上分析可知,乙是硝酸钡溶液,丁是硫酸溶液。
碳酸钡和稀盐酸反应生成氯化钡、水和二氧化碳,反应的离子方程式为。
第2页,共2页
第1页,共1页
学校:___________姓名:___________班级:___________考号:___________
一、单选题(本大题共16小题,共16.0分)
离子反应、复分解反应、置换反应之间可用集合关系来表示,下列关系正确的是( )
A. B.
C. D.
某无色溶液既可能呈强酸性又可能呈强碱性,在该溶液中一定能大量共存的离子组是( )
A. B.
C. D.
甲、乙、丙、丁四位同学分别进行实验,测定四份不同澄清溶液的成分,记录结果如下:
甲:、、
乙:、、
丙:、、
丁:、、
其中记录结果合理的是( )
A. 甲 B. 乙 C. 丙 D. 丁
下列反应属于离子反应的是( )
A. 氢气还原氧化铜生成水和铜
B. 石灰石高温分解生成氧化钙和二氧化碳
C. 盐酸滴加到石灰石固体上
D. 实验室加热高锰酸钾制氧气
下列两种物质的溶液混合后,能发生离子反应,且溶液的总质量不会发生改变的是( )
A. 澄清石灰水和稀盐酸混合
B. 小苏打溶液和柠檬水混合制汽水
C. 人工盐含有硫酸钠、碳酸氢钠、氯化钠、硫酸钾溶液与溶液混合
D. 氯化钠溶液和蔗糖水的混合溶液可治疗腹泻
在给定的四种溶液中,加入以下各种离子,各离子能在原溶液中共存的是( )
A. 含有大量的溶液:加入、、、
B. 滴加酚酞变红的溶液:加入、、、
C. 所含溶质为的溶液:加入、、、
D. 常温下,加入铁粉能生成的溶液:加入、、、
下列各组的两种物质在溶液中的反应,可用同一离子方程式表示的是( )
A. 氢氧化铜与盐酸、氢氧化铜与硫酸
B. 氯化钡溶液与硫酸钠溶液、氢氧化钡溶液与稀硫酸
C. 碳酸钠溶液与盐酸、碳酸钙与盐酸
D. 石灰石与硝酸、石灰石与醋酸
某无色透明的溶液中含有、、、、、、、、、中的三种离子,若向其中加入石蕊溶液,溶液显蓝色,且滴入盐酸无气泡产生,则原溶液中可能存在的离子是( )
A. 、、 B. 、、
C. 、、 D. ,,
甲、乙、丙、丁四种易溶于水的物质,分别由、、、、、,、中的不同阳离子和阴离子各一种组成,将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成,则甲为( )
A. B. C. D.
下列对于某些离子的检验及结论一定正确的是( )
A. 加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有
B. 加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有
C. 加入酸化后加入溶液产生白色沉淀,则原溶液中一定含有
D. 加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,一定有
下列各组溶液中的反应,不管反应物量的多少,都只能用同一离子方程式来表示的是( )
A. 与 B. 与
C. 与 D. 与
下列离子方程式书写正确的是( )
A. 用醋酸除去水垢:
B. 与过量溶液反应:
C. 与稀硫酸反应:
D. 澄清石灰水与过量二氧化碳气体反应:
某固体样品中含有、和三种杂质中的一种或两种。现将样品加入足量水,样品全部溶解,再加入过量的溶液,得到沉淀。对样品所含杂质判断完全正确的是( )
A. 肯定有,可能还含有
B. 肯定有,没有
C. 肯定没有,可能有
D. 肯定没有和
滴有酚酞的溶液显红色,在该溶液中分别滴加溶液后有下列现象。下列说法不正确的是( )
序号 装置 溶液 现象
盐酸 溶液红色褪去,无沉淀,灯泡亮度没有明显变化
Ⅱ 溶液红色不变,有白色沉淀生成,灯泡亮度没有明显变化
Ⅲ 溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗
A. 实验Ⅰ中溶液红色褪去,因为发生了反应
B. 实验Ⅱ中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中存在大量的与
C. 实验Ⅲ中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,说明发生了反应
D. 将实验Ⅱ中溶液换成溶液,现象与原实验Ⅱ中的现象相同
离子的摩尔电导率可用来衡量电解质溶液中离子导电能力的强弱,摩尔电导率越大,离子在溶液中的导电能力越强。已知、、的摩尔电导率分别为、、,据此可判断,向饱和的澄清石灰水中通入过量的二氧化碳,溶液导电能力随二氧化碳通入量的变化趋势正确的是( )
A. B.
C. D.
下列离子方程式正确的是( )
稀盐酸与铁屑反应:
碳酸镁与稀硫酸反应:
碳酸氢钙溶液中加入少量氢氧化钠溶液:
溶液中逐滴加入,溶液至刚好沉淀完全:
向溶液中滴加溶液至溶液呈中
性:
向碳酸氢铵溶液中加入足量石灰水:
A. B. C. D.
二、填空题(本大题共1小题,共1.0分)
按要求书写下列反应的离子方程式。
往澄清石灰水中通入少量二氧化碳,请写出此反应的离子方程式: 。
锌粒投入稀中,溶液里氢离子的量减少,锌离子的量增加, 填离子的量没有变化,反应的离子方程式是 。
将过量的二氧化碳气体通入烧碱溶液中,然后将反应后的溶液分成两等份,分别加入过量的硝酸、氢氧化钙溶液。
请分别写出发生反应的离子方程式:
。
。
三、实验题(本大题共1小题,共10.0分)
现有、和的混合物,选择适当的试剂除去杂质,从而得到纯净的晶体,相应的实验流程如图所示。
请回答下列问题:
产生沉淀的离子方程式是 。
试剂是 。
上述实验流程中步骤中均要用到的主要玻璃仪器有 。
上述实验流程中加入过量溶液产生的沉淀是 。
按此实验方案得到的溶液中肯定含有杂质,为了解决这个问题,可以向溶液中加入适量的 填化学式,并写出离子方程式: 。
从溶液得到硝酸钠晶体需要的操作步骤是 、洗涤、干燥。
四、简答题(本大题共4小题,共20.0分)
仔细分析下列实验:
A、、试管中的现象如表所示:
试管
现象 产生白色沉淀,
溶液仍为蓝色 产生蓝色沉淀,
溶液变为无色 产生蓝色沉淀,
溶液变为
无色
写出、、试管中所发生反应的离子方程式。
。
。
。
某小组在实验室探究Ba(OH)2溶液与稀盐酸反应的实质。向0.2mol Ba(OH)2溶液中滴加0.1mol盐酸,测得溶液导电率的变化如图所示,回答下列问题:
(1)Ba在水中以离子形式存在的实验证据是 。Ba的电离方程式为 。
(2)A~B段发生的离子反应是 。
(3)B点恰好完全反应,此时溶液中存在的微粒有O、 。
(4)下列化学反应的实质与Ba溶液和稀盐酸反应的实质相同的是 (填序号)。
A.Ba和
B.NaOH和
C.Ba与
甲、乙、丙、丁四种可溶性物质,均分别由、、、、、、、中的两种离子组成,四种物质中的离子各不相同,它们具有如下一些反应:
甲乙红褐色沉淀 甲丙白色甲丁白色
由上述现象可以确定的物质编号与化学式分别为 。写出相应的离子方程式: 。
将白色沉淀与盐酸混合无明显现象,则丙、丁的化学式分别是 ,写出甲与足量的丁反应的离子方程式:
与在溶液中“相遇”时会有红褐色沉淀生成并产生气泡,写出相应的离子方程式: ,当某溶液中存在时,中不可能有 。
现有失去标签的甲、乙、丙、丁四瓶溶液,溶质分别是、、、中的一种,为了鉴别它们,进行了如下实验:
甲丁溶液气体 乙丙溶液沉淀
乙丁溶液沉淀 甲乙溶液沉淀
在得到的沉淀中加入足量稀盐酸,沉淀迅速溶解,并产生无色无味的气体。
根据以上实验事实,回答下列问题:
中得到沉淀所使用的玻璃仪器有 。
乙为 填名称,下同溶液,丁为 溶液。
写出在得到的沉淀中加入足量稀盐酸时反应的离子方程式: 。
答案和解析
1.【答案】
【解析】部分置换反应、部分复分解反应属于离子反应,置换反应与复分解反应属于并列关系,无交叉,故选C。
2.【答案】
【解析】呈紫红色,项错误;溶液呈强酸性时不能大量存在,溶液呈强碱性时不能大量存在,项错误;强酸性或强碱性溶液中、、、相互不反应,均能大量共存,且溶液为无色,项正确溶液呈强酸性时不能大量存在,溶液呈强碱性时也不能大量存在,项错误。
3.【答案】
【解析】甲中会形成沉淀而不能共存,A错误;乙中会形成沉淀而不能共存,B错误;丙中会产生气体而不能共存,C错误。
4.【答案】
【解析】氢气还原氧化铜生成水和铜,没有离子参与反应,项错误;石灰石高温分解生成氧化钙和二氧化碳,没有离子参与反应,项错误;盐酸滴加到石灰石固体上,生成了氯化钙、水和二氧化碳,有离子参与反应,属于离子反应,项正确;实验室加热高锰酸钾制氧气,没有离子参与反应, 项错误。
5.【答案】
【解析】项,发生了离子反应:,生成水,溶液总质量不变,符合题意;项,与酸反应产生气体,发生了离子反应,逸出,使溶液总质量变小,不符合题意;项,与反应生成沉淀,发生了离子反应,溶液总质量变小,不符合题意;项,与蔗糖不发生反应,不符合题意。
6.【答案】
【解析】含有大量的溶液中,、、、、各离子之间不反应,能大量共存,A正确;滴加酚酞变红的溶液呈碱性,碱性条件下不能大量存在,B错误;所含溶质为的溶液中含有大量,酸性条件下不能大量存在,C错误;常温下,加入铁粉能生成的溶液呈酸性,酸性条件下不能大量存在,D错误。
7.【答案】
【解析】氢氧化铜是难溶物,要写化学式, 和硫酸都是强电解质,写成离子形式,离子方程式都是 ,故A正确;氯化钡溶液与硫酸钠溶液、氢氧化钡溶液与稀硫酸反应的离子方程式分别为:、,离子方程式不同,故B错误;碳酸钠溶液与盐酸、碳酸钙与盐酸反应的离子方程式分别为:、,离子方程式不同,故C错误;石灰石与硝酸、石灰石与醋酸反应的离子方程式分别为: 、,离子方程式不同,故D错误。
8.【答案】
【解析】无色透明的溶液中不会存在向其中加入石蕊溶液,溶液显蓝色,说明该溶液为碱性溶液,且滴入盐酸后,无气泡产生,则溶液中存在大量,不含因为阳离子、、、都与反应,则溶液中一定存在又与反应,则溶液中一定不存在因为有三种离子存在,则一定存在根据分析可以知道,溶液中一定存在的离子为,、,A正确。
9.【答案】
【解析】依题意得,四种物质两两反应形成的白色沉淀为、、,而甲溶液能够与其他各物质反应生成三种沉淀,所以甲中一定含有和,即甲为,D正确。
10.【答案】
【解析】加入稀盐酸产生无色气体,不一定有,可能为、、,A错误;加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,可能含有,不一定有,B错误;加入酸化后加入溶液,产生的白色沉淀为,则原溶液中一定含有,C正确;加入碳酸钠溶液产生白色沉淀,再加盐酸,白色沉淀消失,该溶液中可能含有,不一定有,D错误。
11.【答案】
【解析】氢氧化钠少量时,与二氧化碳反应生成碳酸氢钠,氢氧化钠过量时,二者反应生成碳酸钠,不能用同一离子方程式表示,A错误;无论量的多少都只发生 ,能用同一离子方程式表示,B正确;少量时发生反应:,过量时发生,不能用同一离子方程式表示,C错误;少量时,与反应生成水、碳酸钙、碳酸氢钠,而过量时,二者反应生成碳酸钙、碳酸钠、水,产物不同,不能用同一离子方程式表示,D错误。
12.【答案】
【解析】用醋酸除去水垢,醋酸是弱酸,写化学式,离子方程式为,故A错误;与过量溶液反应生成碳酸钙和水,离子方程式为,故B错误;与稀硫酸不反应,故C错误;澄清石灰水与过量二氧化碳气体反应生成碳酸氢钙,离子方程式为,故D正确。
13.【答案】
【解析】样品加入水中,全部溶解,说明一定无硝酸钡,若样品全是,样品溶解后,加入过量的溶液,则
若样品全是,样品溶解后,加入过量的溶液,则
现得到沉淀,则样品中肯定有,可能还有,故A选项正确。
14.【答案】
【解析】与盐酸发生中和反应:,溶液碱性减弱,则实验Ⅰ中溶液红色褪去,故A正确与溶液发生反应生成硫酸钡沉淀和氢氧化钠,实验Ⅱ中溶液红色不变,且灯泡亮度没有明显变化,说明溶液中依然存在大量的与,故B正确与溶液发生反应:,溶液碱性减弱,离子浓度减小,则实验Ⅲ中溶液红色褪去,有白色沉淀生成,灯泡逐渐变暗,故C正确将实验Ⅱ中溶液换成溶液,发生反应:,有蓝色沉淀生成,溶液红色褪去,灯泡逐渐变暗,反应现象与原实验Ⅱ中的现象不同,故D错误。
15.【答案】
【解析】向澄清石灰水中通入,先发生反应: ,溶液中离子浓度降低,导电能力降低,继续通入二氧化碳,发生反应:,溶液的导电能力增强,但由于的摩尔电导率比的大,故溶液最终的导电能力低于澄清石灰水的导电能力。
16.【答案】
【解析】稀盐酸与铁屑反应生成,不正确;碳酸镁与稀硫酸反应的离子方程式为,正确;碳酸氢钙溶液中加入少量氢氧化钠溶液,发生反应的离子方程式为 ,正确;向溶液中逐滴加入溶液至刚好沉淀完全,发生反应的离子方程式为 ,正确;向溶液中滴加溶液至溶液呈中性,发生反应的离子方程式为 ,正确;向碳酸氢铵溶液中加入足量石灰水的离子方程式为 ,不正确。故选B。
17.【答案】
;
【解析】反应生成碳酸钙沉淀和水,离子方程式为 。
反应生成硫酸锌和氢气,硫酸根离子实际不参加反应,则的量不变,离子方程式为。
过量的二氧化碳气体通入烧碱溶液中反应生成碳酸氢钠,碳酸氢钠与硝酸反应生成硝酸钠、水、二氧化碳,离子方程式为;碳酸氢钠与过量的氢氧化钙反应生成碳酸钙、水、氢氧化钠,离子方程式为 。
18.【答案】
烧杯、玻璃棒和漏斗
和
;
蒸发浓缩、冷却结晶、过滤
【解析】由流程可知,混合溶液中加入过量氯化钡溶液,硫酸根离子和钡离子结合生成沉淀,则沉淀为,溶液中含氯化钠、硝酸钠、氯化钡,溶液中加入过量溶液后,氯离子和银离子结合生成沉淀,则沉淀为,溶液中含硝酸钠、硝酸银、硝酸钡,溶液中加入过量溶液后钡离子和碳酸根离子结合生成沉淀,银离子和碳酸根离子结合生成沉淀,则沉淀为碳酸钡、碳酸银的混合物,溶液中的溶质为硝酸钠和碳酸钠。
沉淀为,产生沉淀的离子方程式是
由上述分析可知,为。
流程中步均生成沉淀,需要进行过滤操作,均要用到的主要玻璃仪器有烧杯、玻璃棒和漏斗。
加入过量的溶液的目的是使溶液中的、完全沉淀,则产生的沉淀是和。
根据上述分析可知,溶液中含有、,可加适量的稀除去,发生反应的离子方程式为。
由于硝酸易挥发,所以溶液中滴加适量的稀硝酸后,经蒸发浓缩、冷却结晶、过滤、洗涤、干燥即可得到纯净的硝酸钠。
19.【答案】
【解析】溶液和溶液混合后,和结合生成白色沉淀,和不反应,所以溶液仍然呈蓝色,向滤液中加入溶液,和反应生成蓝色沉淀。溶液和溶液混合后,和反应生成蓝色沉淀,和反应生成白色沉淀。
20.【答案】(1)A点的导电率高;Ba=+
(2)+=O
(3)、
(4)BC
【解析】溶液的导电率和离子浓度及离子所带电荷数有关。反应中和反应生成O,溶液中离子浓度减小,溶液的导电率下降;恰好完全中和后,随着盐酸的加入,溶液中离子浓度增大,溶液的导电率增大;因此可以推出B点时,Ba和HCl恰好完全反应。
(1)AB段,A点溶液的导电率高,随着加入盐酸的体积的增多,溶液的导电率减小,是因为发生反应:+=O,溶液中离子浓度减小,说明Ba在水中以离子形式存在; Ba的电离方程式为Ba=+。
(2)A∽B段Ba和HCl发生反应,离子方程式为+=O。
(3)B点Ba和HCl恰好完全反应,此时溶液中存在的微粒有O、、。
(4)Ba(OH)溶液与稀盐酸反应的实质是+=O。
A项,Ba和反应的实质是+++2=+O;B项,NaOH和反应的实质是+=O;C项,Ba与反应的实质是+=O,则B、C符合题意。
21.【答案】甲:、乙: ;
、 ;
;、
【解析】由甲能与另外两种物质反应生成白色沉淀知甲为由甲与乙反应得到红褐色沉淀知乙为另外两种物质是、。
丙、丁分别是与中的一种,、是、中的一种,由与盐酸混合后无明显现象知是,则是,故丙是、丁是。
红褐色沉淀是,无色气泡是,据此推出反应的离子方程式为。能与反应,也能与反应,故中不可能有和。
22.【答案】漏斗、烧杯、玻璃棒
硝酸钡;硫酸
【解析】乙分别与甲、丙、丁混合,均有沉淀生成,则乙为溶液,在得到的沉淀中加入足量的盐酸,沉淀迅速溶解并产生无色无味的气味,则该沉淀为,甲为溶液根据可知丁为溶液,则丙为溶液。
通过过滤分离出沉淀,所使用的玻璃仪器有漏斗、烧杯、玻璃棒。
由以上分析可知,乙是硝酸钡溶液,丁是硫酸溶液。
碳酸钡和稀盐酸反应生成氯化钡、水和二氧化碳,反应的离子方程式为。
第2页,共2页
第1页,共1页
