2022-2023学年高中化学苏教版选择性必修3 专题质量检测(一) 有机化学的发展及研究思路(含解析)
文档属性
| 名称 | 2022-2023学年高中化学苏教版选择性必修3 专题质量检测(一) 有机化学的发展及研究思路(含解析) |  | |
| 格式 | doc | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-26 22:50:42 | ||
图片预览


文档简介
专题质量检测(一) 有机化学的发展及研究思路
一、选择题(本题共13小题,每小题3分,共39分,每小题只有一个选项符合题意)
1.下列关于有机物的说法正确的是( )
A.有机物只能存在于动植物体内,不能通过人工的方法合成
B.有机物只含有碳、氢两种元素
C.含碳元素的化合物不一定属于有机物
D.烃是指燃烧后只生成CO2和H2O的有机物
2.首次提出了“有机化学”概念的化学家是( )
A.门捷列夫 B.维勒
C.舍勒 D.贝采利乌斯
3.某有机化合物3.2 g在氧气中充分燃烧只生成CO2和H2O,将生成物依次通入盛有浓硫酸的洗气瓶和盛有碱石灰的干燥管,实验测得装有浓硫酸的洗气瓶增重3.6 g,盛有碱石灰的干燥管增重4.4 g。则下列判断正确的是( )
A.只含碳、氢两种元素
B.肯定含有碳、氢、氧三种元素
C.肯定含有碳、氢元素,可能含有氧元素
D.根据题目条件可求出该有机物的最简式,无法求出该有机物的分子式
4.下列说法不正确的是( )
A.元素分析仪不仅可以测试试样常见的组成元素及含量,还可测定其分子的空间结构
B.用水煤气可合成液态碳氢化合物和含氧有机物
C.沼气属于绿色、可再生能源,沼气的生成属于生物质能的生物化学转化
D.通过用红外光谱图分析可以区分乙醇和乙酸乙酯
5.将2.4 g某有机物M置于密闭容器中燃烧,定性实验表明产物是CO2、CO和水蒸气。将燃烧产物依次通过浓硫酸、碱石灰和灼热的氧化铜(试剂均足量,且充分反应),测得浓硫酸增重1.44 g,碱石灰增重1.76 g,氧化铜减轻0.64 g。下列说法中正确的是( )
A.M的实验式为CH2O
B.若要得到M的分子式,还必需测得M的相对分子质量和物质的量
C.若M的相对分子质量为60,则M一定为乙酸
D.通过质谱仪可分析M中的官能团
6.某有机物由碳、氢、氧三种元素组成,其红外光谱图中有C—H键、O—H键、C—O键的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式是( )
A.CH3CH2OCH3 B.CH3CH2COOH
C.CH3CH2CH2OH D.CH3CH2CHO
7.环己醇(沸点161.0 ℃)可在浓磷酸催化下脱水制备环己烯(沸点83.0 ℃),实验过程如下:将一定量的环己醇和浓磷酸混合加热蒸馏,收集 85 ℃ 以下的蒸出液。蒸出液中加入NaCl使水层饱和,然后加入少量Na2CO3溶液,分液,向有机相加适量无水CaCl2干燥、过滤、加热蒸馏,收集82~84 ℃的馏分。下列说法中错误的是( )
A.本实验可用硫酸代替磷酸作催化剂,但使用硫酸时常常产生黑色物质
B.加入NaCl的目的是降低环己烯的溶解度,增加水层密度使有机层易于分离
C.分液时,打开活塞将有机层从分液漏斗下口放出
D.第一次蒸馏中边反应边蒸出产物,可以使反应更完全、提高转化率
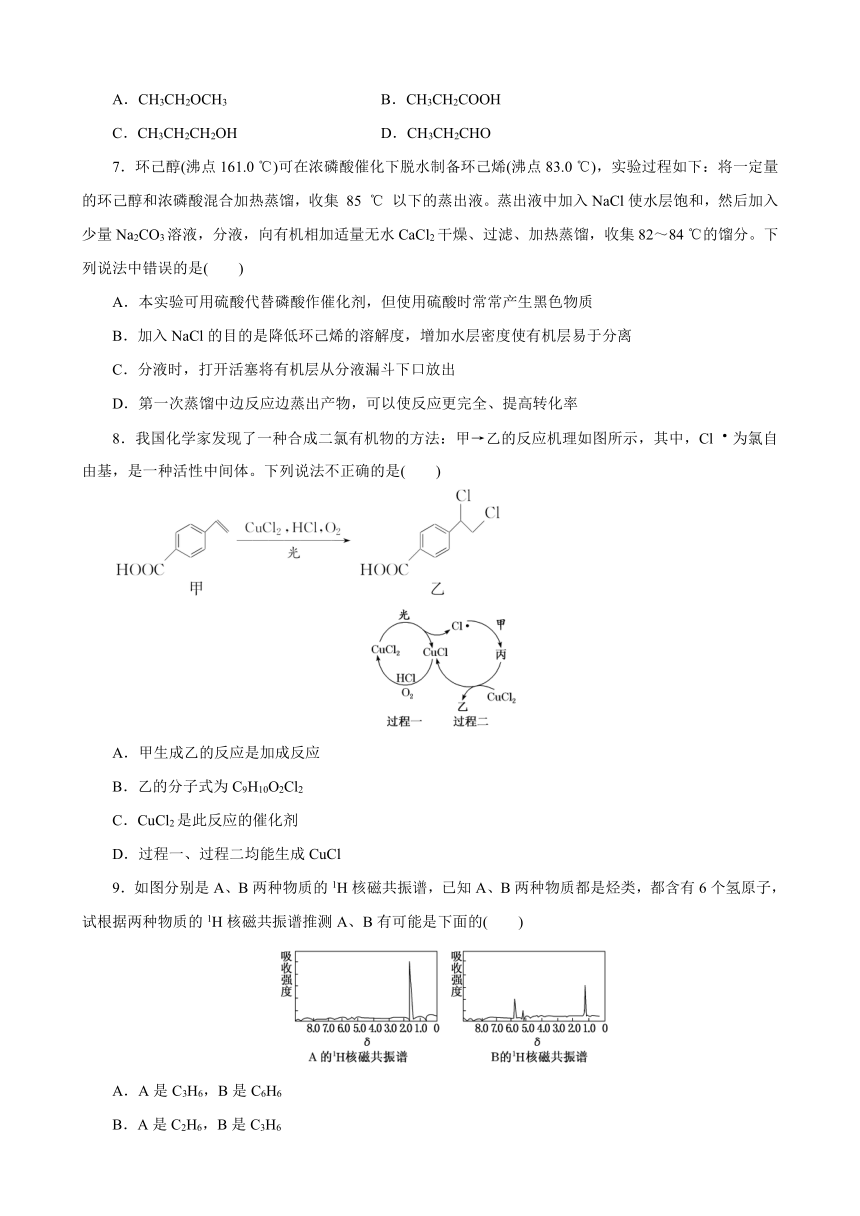
8.我国化学家发现了一种合成二氯有机物的方法:甲→乙的反应机理如图所示,其中,Cl为氯自由基,是一种活性中间体。下列说法不正确的是( )
A.甲生成乙的反应是加成反应
B.乙的分子式为C9H10O2Cl2
C.CuCl2是此反应的催化剂
D.过程一、过程二均能生成CuCl
9.如图分别是A、B两种物质的1H核磁共振谱,已知A、B两种物质都是烃类,都含有6个氢原子,试根据两种物质的1H核磁共振谱推测A、B有可能是下面的( )
A.A是C3H6,B是C6H6
B.A是C2H6,B是C3H6
C.A是C2H6,B是C6H6
D.A是C3H6,B是C2H6
10.除去下列物质中含有少量杂质(括号内为杂质)的方法不正确的是( )
A.硝基苯(苯)—蒸馏
B.乙烯(SO2)—NaOH溶液,洗气
C.苯(苯酚)—浓溴水,过滤
D.乙酸乙酯(乙酸)—饱和Na2CO3溶液,分液
11.某化合物的结构(键线式)及球棍模型如下:该有机分子的1H核磁共振谱图如下:
下列关于该有机物的叙述正确的是( )
A.该有机物不同化学环境的氢原子有7种
B.该有机物属于芳香族化合物
C.键线式中的Et代表的基团为—CH3
D.该有机物在一定条件下能完全燃烧生成CO2和H2O
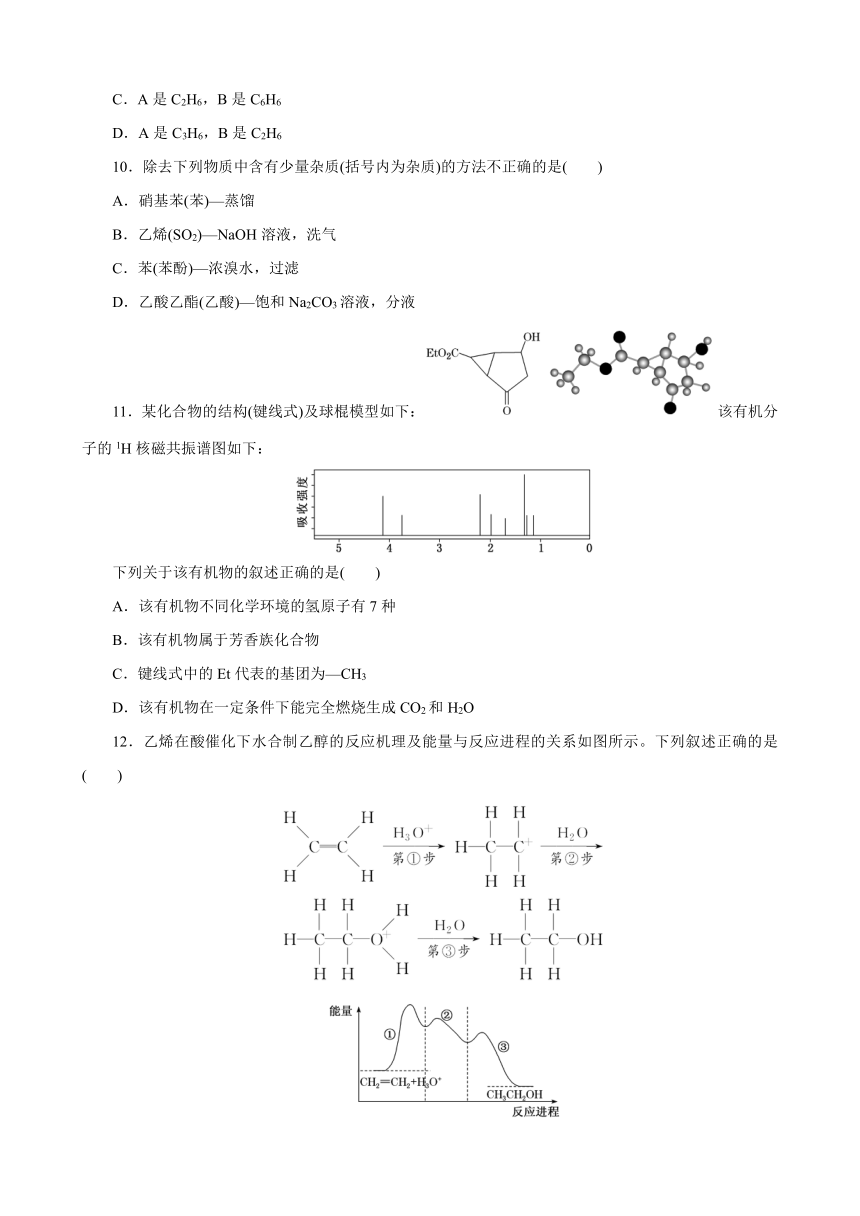
12.乙烯在酸催化下水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列叙述正确的是( )
A.总反应为放热反应故此反应不需要加热就能发生
B.①②反应属于加成反应
C.总反应速率由第③步反应决定
D.第②步反应的中间体比第①步反应的中间体稳定
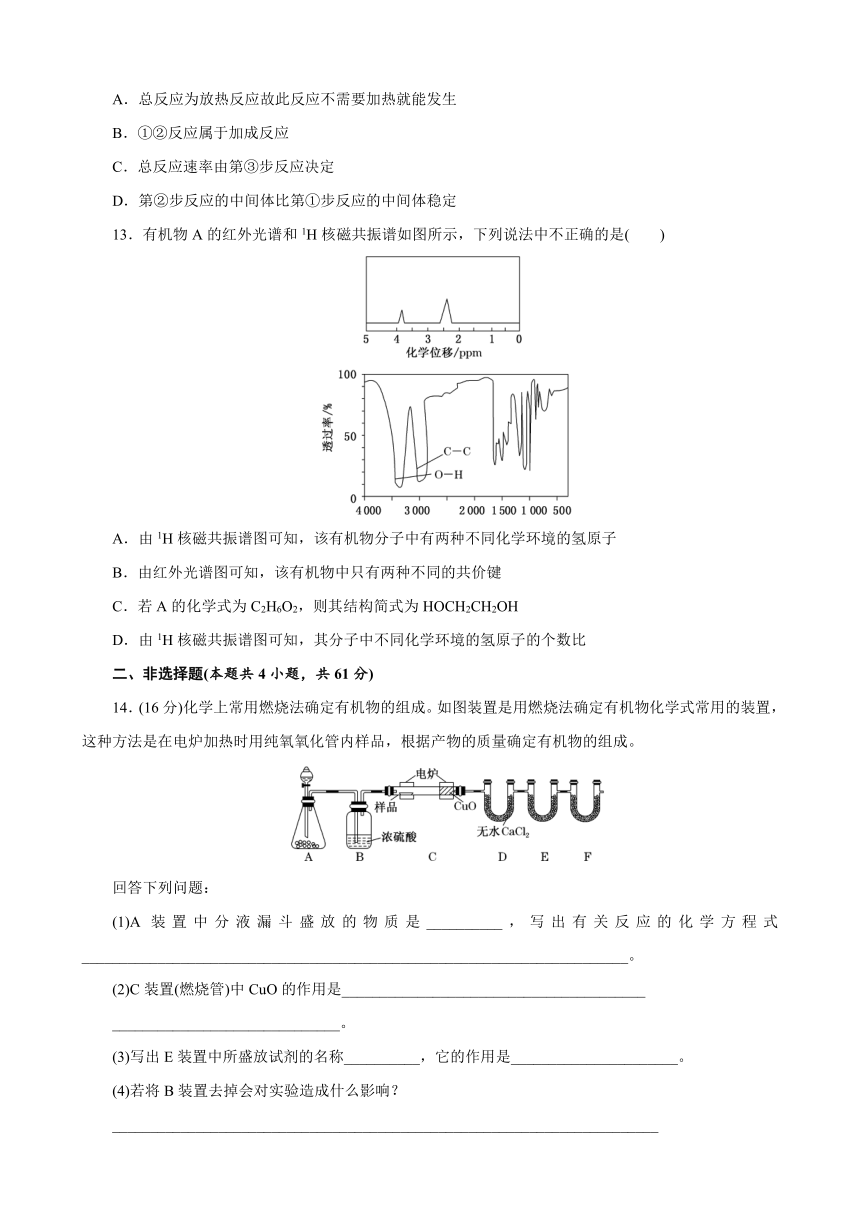
13.有机物A的红外光谱和1H核磁共振谱如图所示,下列说法中不正确的是( )
A.由1H核磁共振谱图可知,该有机物分子中有两种不同化学环境的氢原子
B.由红外光谱图可知,该有机物中只有两种不同的共价键
C.若A的化学式为C2H6O2,则其结构简式为HOCH2CH2OH
D.由1H核磁共振谱图可知,其分子中不同化学环境的氢原子的个数比
二、非选择题(本题共4小题,共61分)
14.(16分)化学上常用燃烧法确定有机物的组成。如图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
回答下列问题:
(1)A装置中分液漏斗盛放的物质是__________,写出有关反应的化学方程式________________________________________________________________________。
(2)C装置(燃烧管)中CuO的作用是________________________________________
______________________________。
(3)写出E装置中所盛放试剂的名称__________,它的作用是______________________。
(4)若将B装置去掉会对实验造成什么影响?
________________________________________________________________________
________________________________________________________________________。
(5)若准确称取1.20 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的最简式为_____________________。
(6)要确定该有机物的化学式,还需要测定____________________________________。
15.(16分)(1)某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为60%,氧的质量分数为26.7%,则其最简式为____________。若需确定其分子式,是否需要测定其相对分子质量________(填“是”或“否”)。
(2)化合物B的分子式为C8H8O2。B的1H核磁共振谱有4个峰且面积之比为1∶2∶2∶3,B分子中苯环上只有一个取代基,其红外光谱与1H核磁共振谱如图所示。则B的结构简式为____________。
(3)有机物C与乙酸无论以何种比例混合,只要总质量一定,完全燃烧后产生的水的质量也一定。若C与乙酸相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则C的结构简式为____________;若C由C、H、O、N四种元素形成的两种官能团组成,相对分子质量与乙酸相等,且分子中氢原子都不与碳原子相连,则C的结构简式为____________。
16.(14分)某有机化合物A经李比希法测得其中含碳为72.0%、含氢为6.67%,其余为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为150。
方法二:核磁共振仪测出A的1H核磁共振谱有5组峰,其面积之比为1∶2∶2∶2∶3,如下图所示。
方法三:利用红外光谱仪测得A分子的红外光谱如下图所示。
请填空:
(1)A的分子式为____________。
(2)A的分子中含一个甲基的依据是________。
a.A 的相对分子质量
b.A 的分子式
c.A的1H核磁共振谱图
d.A 分子的红外光谱图
(3)A的结构简式为_____________________________________________________。
(4)A的芳香类同分异构体有多种,其中符合下列条件:
①分子结构中只含一个官能团;
②分子结构中含有一个甲基;
③苯环上只有一个取代基。
则该类A的同分异构体共有___________种,结构简式为
________________________________________________________________________
________________________________________________________________________。
17.(15分)为测定某有机化合物A的结构,进行如下实验:
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下),则该物质的实验式是________。
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图1所示质谱图,则其相对分子质量为__________,该物质的分子式是________。
(3)1H核磁共振谱能对有机物分子中不同化学环境的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(ClCH2OCH3)有两种氢原子如图2。经测定,有机物A的1H核磁共振谱示意图如图3,则A的结构简式为__________。
专题质量检测(一) 有机化学的发展及研究思路
一、选择题(本题共13小题,每小题3分,共39分,每小题只有一个选项符合题意)
1.下列关于有机物的说法正确的是( )
A.有机物只能存在于动植物体内,不能通过人工的方法合成
B.有机物只含有碳、氢两种元素
C.含碳元素的化合物不一定属于有机物
D.烃是指燃烧后只生成CO2和H2O的有机物
解析:选C 维勒用氰酸铵为原料合成了尿素,A错误;乙醇、乙酸、葡萄糖、油脂、蛋白质等除含碳、氢元素外,还含氧等元素,B错误;CO、CO2、H2CO3、CaCO3、Ca(HCO3)2等属于无机物,C正确;烃的含氧衍生物燃烧后也只生成CO2和H2O,因此烃只能从组成元素只含碳和氢进行定义,不能从它与氧气反应所得产物进行判断,D错误。
2.首次提出了“有机化学”概念的化学家是( )
A.门捷列夫 B.维勒
C.舍勒 D.贝采利乌斯
解析:选D 门捷列夫排出了第一张元素周期表;维勒首次合成尿素;舍勒主要从事有机物的提取;提出“有机化合物”和“有机化学”概念的是瑞典化学家贝采利乌斯,故D正确。
3.某有机化合物3.2 g在氧气中充分燃烧只生成CO2和H2O,将生成物依次通入盛有浓硫酸的洗气瓶和盛有碱石灰的干燥管,实验测得装有浓硫酸的洗气瓶增重3.6 g,盛有碱石灰的干燥管增重4.4 g。则下列判断正确的是( )
A.只含碳、氢两种元素
B.肯定含有碳、氢、氧三种元素
C.肯定含有碳、氢元素,可能含有氧元素
D.根据题目条件可求出该有机物的最简式,无法求出该有机物的分子式
解析:选B 由题中信息可知,m(H2O)=3.6 g
m(CO2)=4.4 g
则m(C)=×12 g·mol-1=1.2 g
m(H)=×2×1 g·mol-1=0.4 g
所以m(C)+m(H)=1.6 g<3.2 g,故该有机物中还含有氧元素,B项正确。
4.下列说法不正确的是( )
A.元素分析仪不仅可以测试试样常见的组成元素及含量,还可测定其分子的空间结构
B.用水煤气可合成液态碳氢化合物和含氧有机物
C.沼气属于绿色、可再生能源,沼气的生成属于生物质能的生物化学转化
D.通过用红外光谱图分析可以区分乙醇和乙酸乙酯
解析:选A 元素分析仪可以测试试样常见的组成元素及含量,无法帮助人们测定其分子的空间结构,故A错误;用水煤气可合成液态碳氢化合物和含氧有机物,比如用水煤气合成辛烷(8CO+17H2C8H18+8H2O)或甲醇(CO+2H2CH3OH),故B正确;沼气主要成分为CH4,沼气的生成属于生物质能的生物化学转化,它属于绿色、可再生能源,故C正确;红外光谱图可以确定化学键和官能团,乙醇和乙酸乙酯中的化学键、官能团不同,因此可以用红外光谱图分析可以区分乙醇和乙酸乙酯,故D正确。
5.将2.4 g某有机物M置于密闭容器中燃烧,定性实验表明产物是CO2、CO和水蒸气。将燃烧产物依次通过浓硫酸、碱石灰和灼热的氧化铜(试剂均足量,且充分反应),测得浓硫酸增重1.44 g,碱石灰增重1.76 g,氧化铜减轻0.64 g。下列说法中正确的是( )
A.M的实验式为CH2O
B.若要得到M的分子式,还必需测得M的相对分子质量和物质的量
C.若M的相对分子质量为60,则M一定为乙酸
D.通过质谱仪可分析M中的官能团
解析:选A 浓硫酸增重的1.44 g为水,水的物质的量为0.06 mol。碱石灰增重的1.76 g为CO2的质量,其物质的量为0.04 mol。CuO与CO反应生成Cu与CO2,氧化铜减少的质量等于反应的CuO中O原子质量,1个CO与1个O原子结合生成CO2,O原子物质的量为0.04 mol,故CO为0.04 mol。综上可知,2.4 g有机物M中含有C原子的物质的量为0.04 mol+0.04 mol=0.08 mol,含有H原子的物质的量为0.08 mol×2=0.16 mol,则含有C、H元素的总质量为 12 g·mol-1×0.08 mol+1 g·mol-1×0.16 mol=1.12 g<2.4 g,说明M中含有O元素,其质量=2.4 g-1.12 g=1.28 g,物质的量为0.08 mol。经过计算可知,M分子中C、H、O的物质的量之比=0.08∶0.16∶0.08=1∶2∶1,则M的实验式为CH2O,A正确;已经计算出M的实验式,再测得M的相对分子质量,可推出M的分子式,B错误;若M的相对分子质量为60,设M的分子式为(CH2O)x,则30x=60,解得x=2,M的分子式为C2H4O2,M可能为乙酸或甲酸甲酯等,C错误;用质谱仪可以得到M的相对分子质量,要得到M的官能团可以使用红外光谱仪,可以确定有机物分子中含有哪些基团,从而可确定M分子中含有的官能团类型,D错误。
6.某有机物由碳、氢、氧三种元素组成,其红外光谱图中有C—H键、O—H键、C—O键的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式是( )
A.CH3CH2OCH3 B.CH3CH2COOH
C.CH3CH2CH2OH D.CH3CH2CHO
解析:选C CH3CH2COOH和CH3CH2CHO的相对分子质量不是60,B、D项错误;CH3CH2OCH3 没有O—H 键,A项错。
7.环己醇(沸点161.0 ℃)可在浓磷酸催化下脱水制备环己烯(沸点83.0 ℃),实验过程如下:将一定量的环己醇和浓磷酸混合加热蒸馏,收集 85 ℃ 以下的蒸出液。蒸出液中加入NaCl使水层饱和,然后加入少量Na2CO3溶液,分液,向有机相加适量无水CaCl2干燥、过滤、加热蒸馏,收集82~84 ℃的馏分。下列说法中错误的是( )
A.本实验可用硫酸代替磷酸作催化剂,但使用硫酸时常常产生黑色物质
B.加入NaCl的目的是降低环己烯的溶解度,增加水层密度使有机层易于分离
C.分液时,打开活塞将有机层从分液漏斗下口放出
D.第一次蒸馏中边反应边蒸出产物,可以使反应更完全、提高转化率
解析:选C 本实验可用硫酸代替磷酸作催化剂,由于浓硫酸具有脱水性,能使有机物炭化,所以使用硫酸时常常产生黑色物质,A正确;加入NaCl可以降低环己烯的溶解度,增加水层密度使有机层易于分离,类似于盐析,B正确;环己烯的密度小于水的,分液时,打开活塞将水层从分液漏斗下口放出,然后关闭活塞,将上层液体即有机层从上口倒出,C错误;第一次蒸馏中边反应边蒸出产物,降低生成物浓度,促使平衡正向进行,可以使反应更完全、提高转化率,D正确。
8.我国化学家发现了一种合成二氯有机物的方法:甲→乙的反应机理如图所示,其中,Cl为氯自由基,是一种活性中间体。下列说法不正确的是( )
A.甲生成乙的反应是加成反应
B.乙的分子式为C9H10O2Cl2
C.CuCl2是此反应的催化剂
D.过程一、过程二均能生成CuCl
据可知,CuCl2初始参与反应被消耗,而后又重新生成,所以是此反应的催化剂,C正确;过程一中CuCl2光照生成CuCl、过程二CuCl2与丙反应生成CuCl,D正确。
9.如图分别是A、B两种物质的1H核磁共振谱,已知A、B两种物质都是烃类,都含有6个氢原子,试根据两种物质的1H核磁共振谱推测A、B有可能是下面的( )
A.A是C3H6,B是C6H6
B.A是C2H6,B是C3H6
C.A是C2H6,B是C6H6
D.A是C3H6,B是C2H6
解析:选B A物质1H核磁共振谱中只给出一组峰,说明该分子中只有1种H原子,则A为乙烷(CH3CH3)或苯(C6H6),B物质1H核磁共振谱中只给出3种峰,说明该分子中只有3种H原子,则B为丙烯(CH2===CH—CH3),B项正确。
10.除去下列物质中含有少量杂质(括号内为杂质)的方法不正确的是( )
A.硝基苯(苯)—蒸馏
B.乙烯(SO2)—NaOH溶液,洗气
C.苯(苯酚)—浓溴水,过滤
D.乙酸乙酯(乙酸)—饱和Na2CO3溶液,分液
解析:选C 硝基苯与苯沸点不同,则可用蒸馏的方法分离,故A正确;乙烯不与氢氧化钠溶液反应,二氧化硫与氢氧化钠反应生成亚硫酸钠和水,可达到除杂目的,故B正确;苯酚与溴反应生成三溴苯酚,溴、三溴苯酚都溶于苯,不能得到纯净的苯,故C错误;选饱和碳酸钠溶液,分液,故D正确。
11.某化合物的结构(键线式)及球棍模型如下:
该有机分子的1H核磁共振谱图如下:
下列关于该有机物的叙述正确的是( )
A.该有机物不同化学环境的氢原子有7种
B.该有机物属于芳香族化合物
C.键线式中的Et代表的基团为—CH3
D.该有机物在一定条件下能完全燃烧生成CO2和H2O
解析:选D A项,由1H核磁共振谱图可知有8种不同化学环境的氢原子,错误;B项,由键线式可看出,该物质中无苯环,不属于芳香族化合物,错误;C项,由键线式和球棍模型对照可知Et为—CH2CH3,错误;D项,该有机物分子中含有碳、氢、氧三种元素,完全燃烧生成CO2和H2O,正确。
12.乙烯在酸催化下水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列叙述正确的是( )
A.总反应为放热反应故此反应不需要加热就能发生
B.①②反应属于加成反应
C.总反应速率由第③步反应决定
D.第②步反应的中间体比第①步反应的中间体稳定
解析:选D 根据反应物与生成物的能量关系可知,反应物的总能量比生成物的总能量高,所以该反应为放热反应,但反应条件是否需要加热与反应热无关,A错误;只有反应①存在碳碳双键生成碳碳单键,则只有反应①为加成反应,B错误;第①步反应活化能最大,故其反应速率较小,属于反应过程中的慢反应,故总反应速率由第①步反应决定,C错误;第②步反应的中间体比第①步反应的中间体能量低,能量越低越稳定,所以第②步反应的中间体较稳定,D正确。
13.有机物A的红外光谱和1H核磁共振谱如图所示,下列说法中不正确的是( )
A.由1H核磁共振谱图可知,该有机物分子中有两种不同化学环境的氢原子
B.由红外光谱图可知,该有机物中只有两种不同的共价键
C.若A的化学式为C2H6O2,则其结构简式为HOCH2CH2OH
D.由1H核磁共振谱图可知,其分子中不同化学环境的氢原子的个数比
解析:选B 1H核磁共振谱图可确定有机物分子中氢原子种类与不同化学环境的氢原子个数比,根据A的1H核磁共振谱可看出,有A的分子中有2种不同化学环境的氢原子,且氢原子的个数比为1∶2;红外光谱图可确定分子中所含的化学键,根据A的红外光谱图可知,分子中含碳碳单键和氢氧键。该有机物分子中有两种不同化学环境的氢原子,A正确;由红外光谱图可知,该有机物中含碳碳单键和氢氧键,但不符合碳四价键原则,所以不止2种化学键,B错误;若A的化学式为C2H6O2,则根据红外光谱和1H核磁共振谱可确定,该有机物为乙二醇,其结构简式为HOCH2CH2OH,C正确;1H核磁共振谱可确定氢原子种类,及其分子中不同化学环境的氢原子的个数比,D正确。
二、非选择题(本题共4小题,共61分)
14.(16分)化学上常用燃烧法确定有机物的组成。如图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
回答下列问题:
(1)A装置中分液漏斗盛放的物质是__________,写出有关反应的化学方程式________________________________________________________________________。
(2)C装置(燃烧管)中CuO的作用是________________________________________
______________________________。
(3)写出E装置中所盛放试剂的名称__________,它的作用是______________________。
(4)若将B装置去掉会对实验造成什么影响?
________________________________________________________________________
________________________________________________________________________。
(5)若准确称取1.20 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的最简式为_____________________。
(6)要确定该有机物的化学式,还需要测定____________________________________。
解析:(1)根据实验原理可知装置A是制备氧气的,根据装置的特点可知A装置中分液漏斗盛放的物质是双氧水,反应的化学方程式是2H2O22H2O+O2↑。(2)由于有机物在燃烧过程中,可能燃烧不充分,即有可能产生CO,而CO能与氧化铜反应生成铜和CO2,所以C装置(燃烧管)中CuO的作用是使有机物充分氧化生成CO2和H2O。(3)由于有机物燃烧产生CO2,所以E装置的主要作用是吸收生成的CO2,因此其中所盛放试剂是碱石灰。(4)B装置中盛有浓硫酸,其主要的作用是干燥氧气,除去水蒸气,因此如果将B装置去掉会造成测得有机物中含氢量增大,从而产生错误的结论。(5)D管中无水氯化钙用来吸收水蒸气,质量增加0.72 g,则生成的水是0.72 g,m(H)=×2×1 g·mol-1=0.08 g;E管质量增加1.76 g,即CO2是1.76 g,m(C)=×12 g·mol-1=0.48 g,所以根据质量守恒定律可知原有机物中氧元素的质量是1.20 g-0.08 g-0.48 g=0.64 g,所以原有机物中C、H、O的原子个数之比是∶∶=0.04∶0.08∶0.04=1∶2∶1,因此最简式是CH2O。(6)根据最简式要确定化学式,则还需要知道该物质的相对分子质量,所以要确定该有机物的化学式,还需要测定有机物的相对分子质量。
答案:(1)双氧水 2H2O22H2O+O2↑
(2)使有机物充分氧化生成CO2和H2O
(3)碱石灰 吸收CO2
(4)造成测得有机物中含氢量增大
(5)CH2O
(6)有机物的相对分子质量
15.(16分)(1)某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为60%,氧的质量分数为26.7%,则其最简式为____________。若需确定其分子式,是否需要测定其相对分子质量________(填“是”或“否”)。
(2)化合物B的分子式为C8H8O2。B的1H核磁共振谱有4个峰且面积之比为1∶2∶2∶3,B分子中苯环上只有一个取代基,其红外光谱与1H核磁共振谱如图所示。则B的结构简式为____________。
(3)有机物C与乙酸无论以何种比例混合,只要总质量一定,完全燃烧后产生的水的质量也一定。若C与乙酸相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则C的结构简式为____________;若C由C、H、O、N四种元素形成的两种官能团组成,相对分子质量与乙酸相等,且分子中氢原子都不与碳原子相连,则C的结构简式为____________。
解析:(1)由碳的质量分数是60%,氧的质量分数是26.7%,可知氢元素质量分数是1-60%-26.7%=13.3%,则该物质中碳、氢、氧原子个数之比=∶∶≈5∶13.3∶1.67≈3∶8∶1,所以其最简式为C3H8O,由其最简式可看出碳原子和氢原子数已经饱和,所以要确定其分子式,不需要测定其相对分子质量,故答案为C3H8O,否。(2)由分子式为C8H8O2,1H核磁共振谱有4组峰且面积之比为1∶2∶2∶3,可知氢原子数目分别为1、2、2、3,又知分子中只含一个苯环且苯环上只有一个取代基,则分子中含有一个—CH3,结合红外光谱可知侧链为—COOCH3,故B的结构简式为。(3)有机物C与乙酸无论以何种比例混合,只要总质量一定,完全燃烧后产生的水的质量也一定,则有机物C中氢元素的质量分数与乙酸中氢元素的质量分数相等,均为。若C与乙酸相对分子质量相等,既能发生银镜反应又能发生酯化反应,则C含有—CHO,结合相对分子质量可知,不可能含有—COOH,故C中还有—OH,C与乙酸互为同分异构体,分子式为C2H4O2,所以符合条件的结构简式为HOCH2CHO;已知C的相对分子质量与乙酸相等,则C的相对分子质量为60,且根据以上分析及题意可知,分子中H原子数目为4,由碳、氢、氧、氮四种元素组成,因1个C原子、O原子、N原子的相对原子质量之和加4个H原子相对原子质量=12+16+14+4=46,相对分子质量还差60-46=14,为1个N原子的相对原子质量,所以分子式为CH4ON2,又因为分子中含有两种官能团,且分子中氢原子都不与碳原子相连,可分析得出分子中含有—NH2与羰基,所以符合条件的结构简式为。
16.(14分)某有机化合物A经李比希法测得其中含碳为72.0%、含氢为6.67%,其余为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为150。
方法二:核磁共振仪测出A的1H核磁共振谱有5组峰,其面积之比为1∶2∶2∶2∶3,如下图所示。
方法三:利用红外光谱仪测得A分子的红外光谱如下图所示。
请填空:
(1)A的分子式为____________。
(2)A的分子中含一个甲基的依据是________。
a.A 的相对分子质量
b.A 的分子式
c.A的1H核磁共振谱图
d.A 分子的红外光谱图
(3)A的结构简式为_____________________________________________________。
(4)A的芳香类同分异构体有多种,其中符合下列条件:
①分子结构中只含一个官能团;
②分子结构中含有一个甲基;
③苯环上只有一个取代基。
则该类A的同分异构体共有___________种,结构简式为
________________________________________________________________________
________________________________________________________________________。
解析:(1)A的相对分子质量为150,其中含碳为72.0%、含氢为6.67%,其余全为氧,则C原子个数是=9;H原子个数是=10;含有O原子个数是=2,A的分子式为C9H10O2。
(2)A的1H核磁共振谱有5组峰,说明分子中有5种H原子,其面积之比为对应的各种H原子个数之比,由分子式可知分子中H原子总数,进而确定甲基数目,所以需要知道A的分子式及A的1H核磁共振谱图,故答案为b、c。
(3)由A分子的红外光谱知,含有C6H5C-基团,由苯环上只有一个取代基可知,苯环上的氢有三种,H原子个数分别为1个、2个、2个。由A的1H核磁共振谱可知,除苯环外,还有两种氢,且两种氢的个数分别为2个、3个,由A分子的红外光谱可知,A分子结构有碳碳单键及其他基团,所以符合条件的有机物A结构简式为。
答案:(1)C9H10O2 (2)bc
17.(15分)为测定某有机化合物A的结构,进行如下实验:
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下),则该物质的实验式是________。
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图1所示质谱图,则其相对分子质量为__________,该物质的分子式是________。
(3)1H核磁共振谱能对有机物分子中不同化学环境的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(ClCH2OCH3)有两种氢原子如图2。经测定,有机物A的1H核磁共振谱示意图如图3,则A的结构简式为__________。
解析:(1)5.4 g H2O的物质的量为=0.3 mol,则n(H)=0.6 mol,8.8 g CO2的物质的量为=0.2 mol,则n(C)=0.2 mol,6.72 L O2的物质的量为=0.3 mol,由O元素守恒可知有机物中含有n(O)=0.3 mol+0.2 mol×2-0.3 mol×2=0.1 mol,则n(C)∶n(H)∶n(O)=2∶6∶1,所以该物质的实验式为C2H6O。
(2)有机化合物的实验式为C2H6O,式量为46,由质谱图可知该物质的相对分子质量为46,则该物质的分子式为C2H6O。
(3)有机物A的1H核磁共振谱中有3组吸收峰且峰的面积比为3∶2∶1,说明有3种不同的H原子且H原子个数比为3∶2∶1,故A的结构简式为CH3CH2OH。
答案:(1)C2H6O (2)46 C2H6O (3)CH3CH2OH
一、选择题(本题共13小题,每小题3分,共39分,每小题只有一个选项符合题意)
1.下列关于有机物的说法正确的是( )
A.有机物只能存在于动植物体内,不能通过人工的方法合成
B.有机物只含有碳、氢两种元素
C.含碳元素的化合物不一定属于有机物
D.烃是指燃烧后只生成CO2和H2O的有机物
2.首次提出了“有机化学”概念的化学家是( )
A.门捷列夫 B.维勒
C.舍勒 D.贝采利乌斯
3.某有机化合物3.2 g在氧气中充分燃烧只生成CO2和H2O,将生成物依次通入盛有浓硫酸的洗气瓶和盛有碱石灰的干燥管,实验测得装有浓硫酸的洗气瓶增重3.6 g,盛有碱石灰的干燥管增重4.4 g。则下列判断正确的是( )
A.只含碳、氢两种元素
B.肯定含有碳、氢、氧三种元素
C.肯定含有碳、氢元素,可能含有氧元素
D.根据题目条件可求出该有机物的最简式,无法求出该有机物的分子式
4.下列说法不正确的是( )
A.元素分析仪不仅可以测试试样常见的组成元素及含量,还可测定其分子的空间结构
B.用水煤气可合成液态碳氢化合物和含氧有机物
C.沼气属于绿色、可再生能源,沼气的生成属于生物质能的生物化学转化
D.通过用红外光谱图分析可以区分乙醇和乙酸乙酯
5.将2.4 g某有机物M置于密闭容器中燃烧,定性实验表明产物是CO2、CO和水蒸气。将燃烧产物依次通过浓硫酸、碱石灰和灼热的氧化铜(试剂均足量,且充分反应),测得浓硫酸增重1.44 g,碱石灰增重1.76 g,氧化铜减轻0.64 g。下列说法中正确的是( )
A.M的实验式为CH2O
B.若要得到M的分子式,还必需测得M的相对分子质量和物质的量
C.若M的相对分子质量为60,则M一定为乙酸
D.通过质谱仪可分析M中的官能团
6.某有机物由碳、氢、氧三种元素组成,其红外光谱图中有C—H键、O—H键、C—O键的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式是( )
A.CH3CH2OCH3 B.CH3CH2COOH
C.CH3CH2CH2OH D.CH3CH2CHO
7.环己醇(沸点161.0 ℃)可在浓磷酸催化下脱水制备环己烯(沸点83.0 ℃),实验过程如下:将一定量的环己醇和浓磷酸混合加热蒸馏,收集 85 ℃ 以下的蒸出液。蒸出液中加入NaCl使水层饱和,然后加入少量Na2CO3溶液,分液,向有机相加适量无水CaCl2干燥、过滤、加热蒸馏,收集82~84 ℃的馏分。下列说法中错误的是( )
A.本实验可用硫酸代替磷酸作催化剂,但使用硫酸时常常产生黑色物质
B.加入NaCl的目的是降低环己烯的溶解度,增加水层密度使有机层易于分离
C.分液时,打开活塞将有机层从分液漏斗下口放出
D.第一次蒸馏中边反应边蒸出产物,可以使反应更完全、提高转化率
8.我国化学家发现了一种合成二氯有机物的方法:甲→乙的反应机理如图所示,其中,Cl为氯自由基,是一种活性中间体。下列说法不正确的是( )
A.甲生成乙的反应是加成反应
B.乙的分子式为C9H10O2Cl2
C.CuCl2是此反应的催化剂
D.过程一、过程二均能生成CuCl
9.如图分别是A、B两种物质的1H核磁共振谱,已知A、B两种物质都是烃类,都含有6个氢原子,试根据两种物质的1H核磁共振谱推测A、B有可能是下面的( )
A.A是C3H6,B是C6H6
B.A是C2H6,B是C3H6
C.A是C2H6,B是C6H6
D.A是C3H6,B是C2H6
10.除去下列物质中含有少量杂质(括号内为杂质)的方法不正确的是( )
A.硝基苯(苯)—蒸馏
B.乙烯(SO2)—NaOH溶液,洗气
C.苯(苯酚)—浓溴水,过滤
D.乙酸乙酯(乙酸)—饱和Na2CO3溶液,分液
11.某化合物的结构(键线式)及球棍模型如下:该有机分子的1H核磁共振谱图如下:
下列关于该有机物的叙述正确的是( )
A.该有机物不同化学环境的氢原子有7种
B.该有机物属于芳香族化合物
C.键线式中的Et代表的基团为—CH3
D.该有机物在一定条件下能完全燃烧生成CO2和H2O
12.乙烯在酸催化下水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列叙述正确的是( )
A.总反应为放热反应故此反应不需要加热就能发生
B.①②反应属于加成反应
C.总反应速率由第③步反应决定
D.第②步反应的中间体比第①步反应的中间体稳定
13.有机物A的红外光谱和1H核磁共振谱如图所示,下列说法中不正确的是( )
A.由1H核磁共振谱图可知,该有机物分子中有两种不同化学环境的氢原子
B.由红外光谱图可知,该有机物中只有两种不同的共价键
C.若A的化学式为C2H6O2,则其结构简式为HOCH2CH2OH
D.由1H核磁共振谱图可知,其分子中不同化学环境的氢原子的个数比
二、非选择题(本题共4小题,共61分)
14.(16分)化学上常用燃烧法确定有机物的组成。如图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
回答下列问题:
(1)A装置中分液漏斗盛放的物质是__________,写出有关反应的化学方程式________________________________________________________________________。
(2)C装置(燃烧管)中CuO的作用是________________________________________
______________________________。
(3)写出E装置中所盛放试剂的名称__________,它的作用是______________________。
(4)若将B装置去掉会对实验造成什么影响?
________________________________________________________________________
________________________________________________________________________。
(5)若准确称取1.20 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的最简式为_____________________。
(6)要确定该有机物的化学式,还需要测定____________________________________。
15.(16分)(1)某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为60%,氧的质量分数为26.7%,则其最简式为____________。若需确定其分子式,是否需要测定其相对分子质量________(填“是”或“否”)。
(2)化合物B的分子式为C8H8O2。B的1H核磁共振谱有4个峰且面积之比为1∶2∶2∶3,B分子中苯环上只有一个取代基,其红外光谱与1H核磁共振谱如图所示。则B的结构简式为____________。
(3)有机物C与乙酸无论以何种比例混合,只要总质量一定,完全燃烧后产生的水的质量也一定。若C与乙酸相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则C的结构简式为____________;若C由C、H、O、N四种元素形成的两种官能团组成,相对分子质量与乙酸相等,且分子中氢原子都不与碳原子相连,则C的结构简式为____________。
16.(14分)某有机化合物A经李比希法测得其中含碳为72.0%、含氢为6.67%,其余为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为150。
方法二:核磁共振仪测出A的1H核磁共振谱有5组峰,其面积之比为1∶2∶2∶2∶3,如下图所示。
方法三:利用红外光谱仪测得A分子的红外光谱如下图所示。
请填空:
(1)A的分子式为____________。
(2)A的分子中含一个甲基的依据是________。
a.A 的相对分子质量
b.A 的分子式
c.A的1H核磁共振谱图
d.A 分子的红外光谱图
(3)A的结构简式为_____________________________________________________。
(4)A的芳香类同分异构体有多种,其中符合下列条件:
①分子结构中只含一个官能团;
②分子结构中含有一个甲基;
③苯环上只有一个取代基。
则该类A的同分异构体共有___________种,结构简式为
________________________________________________________________________
________________________________________________________________________。
17.(15分)为测定某有机化合物A的结构,进行如下实验:
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下),则该物质的实验式是________。
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图1所示质谱图,则其相对分子质量为__________,该物质的分子式是________。
(3)1H核磁共振谱能对有机物分子中不同化学环境的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(ClCH2OCH3)有两种氢原子如图2。经测定,有机物A的1H核磁共振谱示意图如图3,则A的结构简式为__________。
专题质量检测(一) 有机化学的发展及研究思路
一、选择题(本题共13小题,每小题3分,共39分,每小题只有一个选项符合题意)
1.下列关于有机物的说法正确的是( )
A.有机物只能存在于动植物体内,不能通过人工的方法合成
B.有机物只含有碳、氢两种元素
C.含碳元素的化合物不一定属于有机物
D.烃是指燃烧后只生成CO2和H2O的有机物
解析:选C 维勒用氰酸铵为原料合成了尿素,A错误;乙醇、乙酸、葡萄糖、油脂、蛋白质等除含碳、氢元素外,还含氧等元素,B错误;CO、CO2、H2CO3、CaCO3、Ca(HCO3)2等属于无机物,C正确;烃的含氧衍生物燃烧后也只生成CO2和H2O,因此烃只能从组成元素只含碳和氢进行定义,不能从它与氧气反应所得产物进行判断,D错误。
2.首次提出了“有机化学”概念的化学家是( )
A.门捷列夫 B.维勒
C.舍勒 D.贝采利乌斯
解析:选D 门捷列夫排出了第一张元素周期表;维勒首次合成尿素;舍勒主要从事有机物的提取;提出“有机化合物”和“有机化学”概念的是瑞典化学家贝采利乌斯,故D正确。
3.某有机化合物3.2 g在氧气中充分燃烧只生成CO2和H2O,将生成物依次通入盛有浓硫酸的洗气瓶和盛有碱石灰的干燥管,实验测得装有浓硫酸的洗气瓶增重3.6 g,盛有碱石灰的干燥管增重4.4 g。则下列判断正确的是( )
A.只含碳、氢两种元素
B.肯定含有碳、氢、氧三种元素
C.肯定含有碳、氢元素,可能含有氧元素
D.根据题目条件可求出该有机物的最简式,无法求出该有机物的分子式
解析:选B 由题中信息可知,m(H2O)=3.6 g
m(CO2)=4.4 g
则m(C)=×12 g·mol-1=1.2 g
m(H)=×2×1 g·mol-1=0.4 g
所以m(C)+m(H)=1.6 g<3.2 g,故该有机物中还含有氧元素,B项正确。
4.下列说法不正确的是( )
A.元素分析仪不仅可以测试试样常见的组成元素及含量,还可测定其分子的空间结构
B.用水煤气可合成液态碳氢化合物和含氧有机物
C.沼气属于绿色、可再生能源,沼气的生成属于生物质能的生物化学转化
D.通过用红外光谱图分析可以区分乙醇和乙酸乙酯
解析:选A 元素分析仪可以测试试样常见的组成元素及含量,无法帮助人们测定其分子的空间结构,故A错误;用水煤气可合成液态碳氢化合物和含氧有机物,比如用水煤气合成辛烷(8CO+17H2C8H18+8H2O)或甲醇(CO+2H2CH3OH),故B正确;沼气主要成分为CH4,沼气的生成属于生物质能的生物化学转化,它属于绿色、可再生能源,故C正确;红外光谱图可以确定化学键和官能团,乙醇和乙酸乙酯中的化学键、官能团不同,因此可以用红外光谱图分析可以区分乙醇和乙酸乙酯,故D正确。
5.将2.4 g某有机物M置于密闭容器中燃烧,定性实验表明产物是CO2、CO和水蒸气。将燃烧产物依次通过浓硫酸、碱石灰和灼热的氧化铜(试剂均足量,且充分反应),测得浓硫酸增重1.44 g,碱石灰增重1.76 g,氧化铜减轻0.64 g。下列说法中正确的是( )
A.M的实验式为CH2O
B.若要得到M的分子式,还必需测得M的相对分子质量和物质的量
C.若M的相对分子质量为60,则M一定为乙酸
D.通过质谱仪可分析M中的官能团
解析:选A 浓硫酸增重的1.44 g为水,水的物质的量为0.06 mol。碱石灰增重的1.76 g为CO2的质量,其物质的量为0.04 mol。CuO与CO反应生成Cu与CO2,氧化铜减少的质量等于反应的CuO中O原子质量,1个CO与1个O原子结合生成CO2,O原子物质的量为0.04 mol,故CO为0.04 mol。综上可知,2.4 g有机物M中含有C原子的物质的量为0.04 mol+0.04 mol=0.08 mol,含有H原子的物质的量为0.08 mol×2=0.16 mol,则含有C、H元素的总质量为 12 g·mol-1×0.08 mol+1 g·mol-1×0.16 mol=1.12 g<2.4 g,说明M中含有O元素,其质量=2.4 g-1.12 g=1.28 g,物质的量为0.08 mol。经过计算可知,M分子中C、H、O的物质的量之比=0.08∶0.16∶0.08=1∶2∶1,则M的实验式为CH2O,A正确;已经计算出M的实验式,再测得M的相对分子质量,可推出M的分子式,B错误;若M的相对分子质量为60,设M的分子式为(CH2O)x,则30x=60,解得x=2,M的分子式为C2H4O2,M可能为乙酸或甲酸甲酯等,C错误;用质谱仪可以得到M的相对分子质量,要得到M的官能团可以使用红外光谱仪,可以确定有机物分子中含有哪些基团,从而可确定M分子中含有的官能团类型,D错误。
6.某有机物由碳、氢、氧三种元素组成,其红外光谱图中有C—H键、O—H键、C—O键的振动吸收,该有机物的相对分子质量是60,则该有机物的结构简式是( )
A.CH3CH2OCH3 B.CH3CH2COOH
C.CH3CH2CH2OH D.CH3CH2CHO
解析:选C CH3CH2COOH和CH3CH2CHO的相对分子质量不是60,B、D项错误;CH3CH2OCH3 没有O—H 键,A项错。
7.环己醇(沸点161.0 ℃)可在浓磷酸催化下脱水制备环己烯(沸点83.0 ℃),实验过程如下:将一定量的环己醇和浓磷酸混合加热蒸馏,收集 85 ℃ 以下的蒸出液。蒸出液中加入NaCl使水层饱和,然后加入少量Na2CO3溶液,分液,向有机相加适量无水CaCl2干燥、过滤、加热蒸馏,收集82~84 ℃的馏分。下列说法中错误的是( )
A.本实验可用硫酸代替磷酸作催化剂,但使用硫酸时常常产生黑色物质
B.加入NaCl的目的是降低环己烯的溶解度,增加水层密度使有机层易于分离
C.分液时,打开活塞将有机层从分液漏斗下口放出
D.第一次蒸馏中边反应边蒸出产物,可以使反应更完全、提高转化率
解析:选C 本实验可用硫酸代替磷酸作催化剂,由于浓硫酸具有脱水性,能使有机物炭化,所以使用硫酸时常常产生黑色物质,A正确;加入NaCl可以降低环己烯的溶解度,增加水层密度使有机层易于分离,类似于盐析,B正确;环己烯的密度小于水的,分液时,打开活塞将水层从分液漏斗下口放出,然后关闭活塞,将上层液体即有机层从上口倒出,C错误;第一次蒸馏中边反应边蒸出产物,降低生成物浓度,促使平衡正向进行,可以使反应更完全、提高转化率,D正确。
8.我国化学家发现了一种合成二氯有机物的方法:甲→乙的反应机理如图所示,其中,Cl为氯自由基,是一种活性中间体。下列说法不正确的是( )
A.甲生成乙的反应是加成反应
B.乙的分子式为C9H10O2Cl2
C.CuCl2是此反应的催化剂
D.过程一、过程二均能生成CuCl
据可知,CuCl2初始参与反应被消耗,而后又重新生成,所以是此反应的催化剂,C正确;过程一中CuCl2光照生成CuCl、过程二CuCl2与丙反应生成CuCl,D正确。
9.如图分别是A、B两种物质的1H核磁共振谱,已知A、B两种物质都是烃类,都含有6个氢原子,试根据两种物质的1H核磁共振谱推测A、B有可能是下面的( )
A.A是C3H6,B是C6H6
B.A是C2H6,B是C3H6
C.A是C2H6,B是C6H6
D.A是C3H6,B是C2H6
解析:选B A物质1H核磁共振谱中只给出一组峰,说明该分子中只有1种H原子,则A为乙烷(CH3CH3)或苯(C6H6),B物质1H核磁共振谱中只给出3种峰,说明该分子中只有3种H原子,则B为丙烯(CH2===CH—CH3),B项正确。
10.除去下列物质中含有少量杂质(括号内为杂质)的方法不正确的是( )
A.硝基苯(苯)—蒸馏
B.乙烯(SO2)—NaOH溶液,洗气
C.苯(苯酚)—浓溴水,过滤
D.乙酸乙酯(乙酸)—饱和Na2CO3溶液,分液
解析:选C 硝基苯与苯沸点不同,则可用蒸馏的方法分离,故A正确;乙烯不与氢氧化钠溶液反应,二氧化硫与氢氧化钠反应生成亚硫酸钠和水,可达到除杂目的,故B正确;苯酚与溴反应生成三溴苯酚,溴、三溴苯酚都溶于苯,不能得到纯净的苯,故C错误;选饱和碳酸钠溶液,分液,故D正确。
11.某化合物的结构(键线式)及球棍模型如下:
该有机分子的1H核磁共振谱图如下:
下列关于该有机物的叙述正确的是( )
A.该有机物不同化学环境的氢原子有7种
B.该有机物属于芳香族化合物
C.键线式中的Et代表的基团为—CH3
D.该有机物在一定条件下能完全燃烧生成CO2和H2O
解析:选D A项,由1H核磁共振谱图可知有8种不同化学环境的氢原子,错误;B项,由键线式可看出,该物质中无苯环,不属于芳香族化合物,错误;C项,由键线式和球棍模型对照可知Et为—CH2CH3,错误;D项,该有机物分子中含有碳、氢、氧三种元素,完全燃烧生成CO2和H2O,正确。
12.乙烯在酸催化下水合制乙醇的反应机理及能量与反应进程的关系如图所示。下列叙述正确的是( )
A.总反应为放热反应故此反应不需要加热就能发生
B.①②反应属于加成反应
C.总反应速率由第③步反应决定
D.第②步反应的中间体比第①步反应的中间体稳定
解析:选D 根据反应物与生成物的能量关系可知,反应物的总能量比生成物的总能量高,所以该反应为放热反应,但反应条件是否需要加热与反应热无关,A错误;只有反应①存在碳碳双键生成碳碳单键,则只有反应①为加成反应,B错误;第①步反应活化能最大,故其反应速率较小,属于反应过程中的慢反应,故总反应速率由第①步反应决定,C错误;第②步反应的中间体比第①步反应的中间体能量低,能量越低越稳定,所以第②步反应的中间体较稳定,D正确。
13.有机物A的红外光谱和1H核磁共振谱如图所示,下列说法中不正确的是( )
A.由1H核磁共振谱图可知,该有机物分子中有两种不同化学环境的氢原子
B.由红外光谱图可知,该有机物中只有两种不同的共价键
C.若A的化学式为C2H6O2,则其结构简式为HOCH2CH2OH
D.由1H核磁共振谱图可知,其分子中不同化学环境的氢原子的个数比
解析:选B 1H核磁共振谱图可确定有机物分子中氢原子种类与不同化学环境的氢原子个数比,根据A的1H核磁共振谱可看出,有A的分子中有2种不同化学环境的氢原子,且氢原子的个数比为1∶2;红外光谱图可确定分子中所含的化学键,根据A的红外光谱图可知,分子中含碳碳单键和氢氧键。该有机物分子中有两种不同化学环境的氢原子,A正确;由红外光谱图可知,该有机物中含碳碳单键和氢氧键,但不符合碳四价键原则,所以不止2种化学键,B错误;若A的化学式为C2H6O2,则根据红外光谱和1H核磁共振谱可确定,该有机物为乙二醇,其结构简式为HOCH2CH2OH,C正确;1H核磁共振谱可确定氢原子种类,及其分子中不同化学环境的氢原子的个数比,D正确。
二、非选择题(本题共4小题,共61分)
14.(16分)化学上常用燃烧法确定有机物的组成。如图装置是用燃烧法确定有机物化学式常用的装置,这种方法是在电炉加热时用纯氧氧化管内样品,根据产物的质量确定有机物的组成。
回答下列问题:
(1)A装置中分液漏斗盛放的物质是__________,写出有关反应的化学方程式________________________________________________________________________。
(2)C装置(燃烧管)中CuO的作用是________________________________________
______________________________。
(3)写出E装置中所盛放试剂的名称__________,它的作用是______________________。
(4)若将B装置去掉会对实验造成什么影响?
________________________________________________________________________
________________________________________________________________________。
(5)若准确称取1.20 g样品(只含C、H、O三种元素中的两种或三种),经充分燃烧后,E管质量增加1.76 g,D管质量增加0.72 g,则该有机物的最简式为_____________________。
(6)要确定该有机物的化学式,还需要测定____________________________________。
解析:(1)根据实验原理可知装置A是制备氧气的,根据装置的特点可知A装置中分液漏斗盛放的物质是双氧水,反应的化学方程式是2H2O22H2O+O2↑。(2)由于有机物在燃烧过程中,可能燃烧不充分,即有可能产生CO,而CO能与氧化铜反应生成铜和CO2,所以C装置(燃烧管)中CuO的作用是使有机物充分氧化生成CO2和H2O。(3)由于有机物燃烧产生CO2,所以E装置的主要作用是吸收生成的CO2,因此其中所盛放试剂是碱石灰。(4)B装置中盛有浓硫酸,其主要的作用是干燥氧气,除去水蒸气,因此如果将B装置去掉会造成测得有机物中含氢量增大,从而产生错误的结论。(5)D管中无水氯化钙用来吸收水蒸气,质量增加0.72 g,则生成的水是0.72 g,m(H)=×2×1 g·mol-1=0.08 g;E管质量增加1.76 g,即CO2是1.76 g,m(C)=×12 g·mol-1=0.48 g,所以根据质量守恒定律可知原有机物中氧元素的质量是1.20 g-0.08 g-0.48 g=0.64 g,所以原有机物中C、H、O的原子个数之比是∶∶=0.04∶0.08∶0.04=1∶2∶1,因此最简式是CH2O。(6)根据最简式要确定化学式,则还需要知道该物质的相对分子质量,所以要确定该有机物的化学式,还需要测定有机物的相对分子质量。
答案:(1)双氧水 2H2O22H2O+O2↑
(2)使有机物充分氧化生成CO2和H2O
(3)碱石灰 吸收CO2
(4)造成测得有机物中含氢量增大
(5)CH2O
(6)有机物的相对分子质量
15.(16分)(1)某含C、H、O三种元素的未知物A,经燃烧分析实验测定该未知物中碳的质量分数为60%,氧的质量分数为26.7%,则其最简式为____________。若需确定其分子式,是否需要测定其相对分子质量________(填“是”或“否”)。
(2)化合物B的分子式为C8H8O2。B的1H核磁共振谱有4个峰且面积之比为1∶2∶2∶3,B分子中苯环上只有一个取代基,其红外光谱与1H核磁共振谱如图所示。则B的结构简式为____________。
(3)有机物C与乙酸无论以何种比例混合,只要总质量一定,完全燃烧后产生的水的质量也一定。若C与乙酸相对分子质量相等,且既能发生银镜反应又能发生酯化反应,则C的结构简式为____________;若C由C、H、O、N四种元素形成的两种官能团组成,相对分子质量与乙酸相等,且分子中氢原子都不与碳原子相连,则C的结构简式为____________。
解析:(1)由碳的质量分数是60%,氧的质量分数是26.7%,可知氢元素质量分数是1-60%-26.7%=13.3%,则该物质中碳、氢、氧原子个数之比=∶∶≈5∶13.3∶1.67≈3∶8∶1,所以其最简式为C3H8O,由其最简式可看出碳原子和氢原子数已经饱和,所以要确定其分子式,不需要测定其相对分子质量,故答案为C3H8O,否。(2)由分子式为C8H8O2,1H核磁共振谱有4组峰且面积之比为1∶2∶2∶3,可知氢原子数目分别为1、2、2、3,又知分子中只含一个苯环且苯环上只有一个取代基,则分子中含有一个—CH3,结合红外光谱可知侧链为—COOCH3,故B的结构简式为。(3)有机物C与乙酸无论以何种比例混合,只要总质量一定,完全燃烧后产生的水的质量也一定,则有机物C中氢元素的质量分数与乙酸中氢元素的质量分数相等,均为。若C与乙酸相对分子质量相等,既能发生银镜反应又能发生酯化反应,则C含有—CHO,结合相对分子质量可知,不可能含有—COOH,故C中还有—OH,C与乙酸互为同分异构体,分子式为C2H4O2,所以符合条件的结构简式为HOCH2CHO;已知C的相对分子质量与乙酸相等,则C的相对分子质量为60,且根据以上分析及题意可知,分子中H原子数目为4,由碳、氢、氧、氮四种元素组成,因1个C原子、O原子、N原子的相对原子质量之和加4个H原子相对原子质量=12+16+14+4=46,相对分子质量还差60-46=14,为1个N原子的相对原子质量,所以分子式为CH4ON2,又因为分子中含有两种官能团,且分子中氢原子都不与碳原子相连,可分析得出分子中含有—NH2与羰基,所以符合条件的结构简式为。
16.(14分)某有机化合物A经李比希法测得其中含碳为72.0%、含氢为6.67%,其余为氧。现用下列方法测定该有机化合物的相对分子质量和分子结构。
方法一:用质谱法分析得知A的相对分子质量为150。
方法二:核磁共振仪测出A的1H核磁共振谱有5组峰,其面积之比为1∶2∶2∶2∶3,如下图所示。
方法三:利用红外光谱仪测得A分子的红外光谱如下图所示。
请填空:
(1)A的分子式为____________。
(2)A的分子中含一个甲基的依据是________。
a.A 的相对分子质量
b.A 的分子式
c.A的1H核磁共振谱图
d.A 分子的红外光谱图
(3)A的结构简式为_____________________________________________________。
(4)A的芳香类同分异构体有多种,其中符合下列条件:
①分子结构中只含一个官能团;
②分子结构中含有一个甲基;
③苯环上只有一个取代基。
则该类A的同分异构体共有___________种,结构简式为
________________________________________________________________________
________________________________________________________________________。
解析:(1)A的相对分子质量为150,其中含碳为72.0%、含氢为6.67%,其余全为氧,则C原子个数是=9;H原子个数是=10;含有O原子个数是=2,A的分子式为C9H10O2。
(2)A的1H核磁共振谱有5组峰,说明分子中有5种H原子,其面积之比为对应的各种H原子个数之比,由分子式可知分子中H原子总数,进而确定甲基数目,所以需要知道A的分子式及A的1H核磁共振谱图,故答案为b、c。
(3)由A分子的红外光谱知,含有C6H5C-基团,由苯环上只有一个取代基可知,苯环上的氢有三种,H原子个数分别为1个、2个、2个。由A的1H核磁共振谱可知,除苯环外,还有两种氢,且两种氢的个数分别为2个、3个,由A分子的红外光谱可知,A分子结构有碳碳单键及其他基团,所以符合条件的有机物A结构简式为。
答案:(1)C9H10O2 (2)bc
17.(15分)为测定某有机化合物A的结构,进行如下实验:
(1)将有机物A置于氧气流中充分燃烧,实验测得:生成5.4 g H2O和8.8 g CO2,消耗氧气6.72 L(标准状况下),则该物质的实验式是________。
(2)用质谱仪测定该有机化合物的相对分子质量,得到如图1所示质谱图,则其相对分子质量为__________,该物质的分子式是________。
(3)1H核磁共振谱能对有机物分子中不同化学环境的氢原子给出不同的峰值(信号),根据峰值(信号)可以确定分子中氢原子的种类和数目。例如:甲基氯甲基醚(ClCH2OCH3)有两种氢原子如图2。经测定,有机物A的1H核磁共振谱示意图如图3,则A的结构简式为__________。
解析:(1)5.4 g H2O的物质的量为=0.3 mol,则n(H)=0.6 mol,8.8 g CO2的物质的量为=0.2 mol,则n(C)=0.2 mol,6.72 L O2的物质的量为=0.3 mol,由O元素守恒可知有机物中含有n(O)=0.3 mol+0.2 mol×2-0.3 mol×2=0.1 mol,则n(C)∶n(H)∶n(O)=2∶6∶1,所以该物质的实验式为C2H6O。
(2)有机化合物的实验式为C2H6O,式量为46,由质谱图可知该物质的相对分子质量为46,则该物质的分子式为C2H6O。
(3)有机物A的1H核磁共振谱中有3组吸收峰且峰的面积比为3∶2∶1,说明有3种不同的H原子且H原子个数比为3∶2∶1,故A的结构简式为CH3CH2OH。
答案:(1)C2H6O (2)46 C2H6O (3)CH3CH2OH
