河南省开封市2022-2023学年高二上学期8月开学联考化学试卷(Word版含答案)
文档属性
| 名称 | 河南省开封市2022-2023学年高二上学期8月开学联考化学试卷(Word版含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 415.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
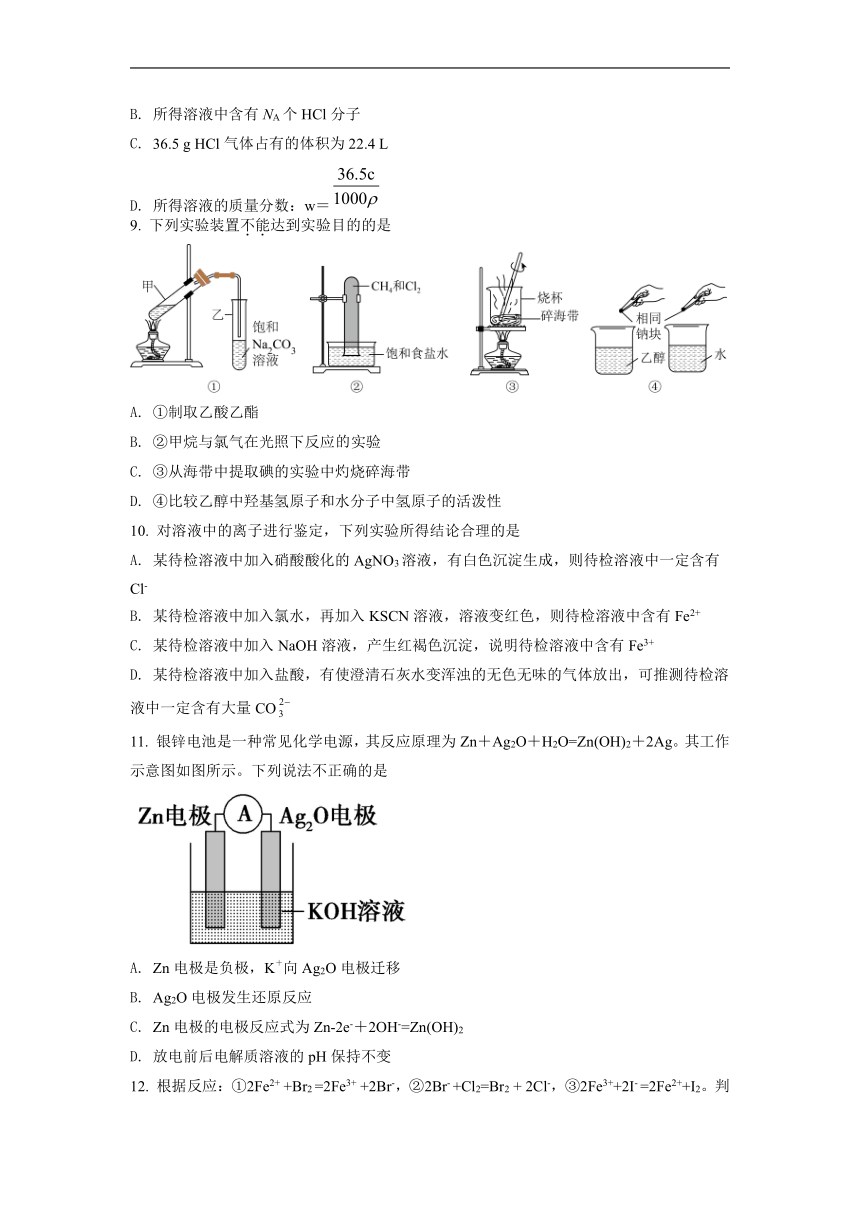
| 科目 | 化学 | ||
| 更新时间 | 2022-08-28 00:00:00 | ||
图片预览


文档简介
河南省开封市2022~2023学年高二开学联考
化学试题
注意事项:1.请在答题纸上作答,在试卷上作答无效。
2.本试卷共100分,考试时间75分钟。
可能用到的元素相对原子质量:H-1 C-12 O-16 Cu-64 Cl-35.5 Fe-56
第Ⅰ卷 (选择题,共45分)
一、选择题(本题包括15小题,每小题3分,共45分,每小题只有一个选项符合题意)
1. 2022年北京冬奥会成功举办,本届冬奥会体现了科技创新与艺术设计的完美融合。下列说法错误的是
A. 为场馆提供电能的硅太阳能电池,利用了硅的半导体性能
B. 速滑竞赛服使用了蜂窝样式的聚氨酯材料,属于合成有机高分子材料
C. 氢燃料电池车采用全新的车载光伏发电系统,体现了“绿色出行”的理念
D. 颁奖礼仪服内胆添加了第二代石墨烯发热材料,石墨烯属于新型有机高分子材料
2. 正确掌握化学用语是学好化学的基础。下列化学用语正确的是
A. 次氯酸的结构式:H-Cl-O
B. 氯离子的结构示意图:
C. 二氧化碳的空间构型为直线型
D. 硫化氢分子的电子式:
3. 下列说法正确的是
A. 工业制玻璃和陶瓷都是以石英砂为主要原料
B. SO2和Cl2混合使用有更强的漂白性
C. 浓硫酸有吸水性,所以可以干燥H2、CO、SO2等气体
D. 在实验室中,可加热NH4Cl固体制取NH3
4. 某小组拟用两种方法制备同一种金属氯化物:①用金属和氯气共热直接化合制得;②用金属和盐酸反应制得。可以成功的是
A. CuCl2 B. FeCl3 C. NaCl D. FeCl2
5. 根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 实验结论
A 向蔗糖溶液中加入稀硫酸,水浴加热,一段时间后加入新制悬浊液并加热,未出现砖红色沉淀 蔗糖未发生水解
B 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 部分Na2SO3被氧化
C 用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色 原溶液中一定有Na+,无K+
D 某溶液中加入盐酸,并将产生的气体通入澄清石灰水 澄清石灰水变浑浊,说明溶液中一定含有
A. A B. B C. C D. D
6. 某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀H2SO4,通过仪器测得混合溶液的导电能力随时间变化的曲线如图所示。下列有关说法不正确的是
A. XY段混合溶液的导电能力逐渐减弱,是因为溶液中离子数目减少
B. a时刻,混合溶液中Ba(OH)2与H2SO4恰好完全反应
C. YZ段溶液的导电能力逐渐增强,主要是由于过量的硫酸电离出的离子导电
D. 该实验发生反应的离子方程式为H+++Ba2++OH-=BaSO4↓+H2O
7. “焖子”是大连地区特色小吃之一,制作“焖子”的主要原料有:红薯淀粉、植物油、味精、糖、芝麻酱和大蒜等。下列说法正确的是
A. 葡萄糖、乳糖都属于单糖
B. 红薯淀粉水解后产物是氨基酸
C. 植物油是天然有机高分子化合物,可以使溴水褪色
D. 味精化学名称为谷氨酸钠,作为增味剂,能增加食品的鲜味
8. 36.5 g HCl溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数,则下列叙述中正确的是
A. 所得溶液的物质的量浓度为1 mol·L-1
B. 所得溶液中含有NA个HCl分子
C. 36.5 g HCl气体占有的体积为22.4 L
D. 所得溶液的质量分数:w=
9. 下列实验装置不能达到实验目的的是
A. ①制取乙酸乙酯
B. ②甲烷与氯气在光照下反应实验
C. ③从海带中提取碘的实验中灼烧碎海带
D. ④比较乙醇中羟基氢原子和水分子中氢原子的活泼性
10. 对溶液中的离子进行鉴定,下列实验所得结论合理的是
A. 某待检溶液中加入硝酸酸化的AgNO3溶液,有白色沉淀生成,则待检溶液中一定含有Cl-
B. 某待检溶液中加入氯水,再加入KSCN溶液,溶液变红色,则待检溶液中含有Fe2+
C. 某待检溶液中加入NaOH溶液,产生红褐色沉淀,说明待检溶液中含有Fe3+
D. 某待检溶液中加入盐酸,有使澄清石灰水变浑浊的无色无味的气体放出,可推测待检溶液中一定含有大量CO
11. 银锌电池是一种常见化学电源,其反应原理为Zn+Ag2O+H2O=Zn(OH)2+2Ag。其工作示意图如图所示。下列说法不正确的是
A. Zn电极是负极,K+向Ag2O电极迁移
B. Ag2O电极发生还原反应
C. Zn电极的电极反应式为Zn-2e-+2OH-=Zn(OH)2
D. 放电前后电解质溶液的pH保持不变
12. 根据反应:①2Fe2+ +Br2 =2Fe3+ +2Br-,②2Br- +Cl2=Br2 + 2Cl-,③2Fe3++2I- =2Fe2++I2。判断下列物质的氧化性由强到弱的顺序正确的是
A. Cl2>Br2>Fe3+>I2
B. Br2>Fe3+>Cl2>I2
C. Cl2>Br2>I2>Fe3+
D. I2>Fe3+> Br2>Cl2
13. 如图为合成治疗癌症用药“格列宁”的药物中间体的结构简式。下列关于该化合物说法正确的是
A. 分子式为
B. 含有4种官能团
C. 1mol该物质可以与1mol碳酸氢钠反应
D. 在一定条件下能发生氧化反应、加聚反应、酯化反应
14. 下列性质的比较,不能用元素周期律解释的是
A. 酸性:HClO4>H2SO3>H2SiO3 B. 碱性:KOH>NaOH>LiOH
C. 热稳定性:H2O>H2S>PH3 D. 非金属性:F>O>N
15. 海水开发利用的部分过程如图所示。下列说法正确的是
A. 除去粗盐中的、、、等杂质,加入试剂的顺序为溶液→NaOH溶液→溶液→过滤后加盐酸
B. 电解提取金属镁
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用将其还原吸收
第Ⅱ卷 (非选择题,共55分)
二、填空题(本题包括4小题,共55分)
16. 中国“奋斗者”号深潜器研制及海试的成功,标志着我国在钛合金材料制备方面实现了重大突破。工业上用钛矿石(主要成分:等)为原料制取钛并得到副产物绿矾(),工艺流程如下:
已知:①
②易水解,只能存在于强酸性溶液中
请回答以下问题:
(1)钛矿石在加入浓硫酸酸溶前要先粉碎,其目的是_______。
(2)加入过量铁粉的目的是_______。操作1名称为_______。
(3)固体2的主要成分是_______。
(4)在高温下,和焦炭的混合物中通入得到和一种可燃性气体,请写出反应的化学方程式_______。
(5)用过量的钠在高温条件下与反应可制得钛,写出此反应的化学方程式_______。该反应必须在高温下进行,你认为还应该控制的反应条件是_______。
17. Ⅰ.已知下列物质均由短周期元素组成,X无论是盐酸还是氢氧化钠,转化均能进行,又已知C的相对分子质量比D少16,A、B、C、D、E中均含有同一元素。
(1)当X是盐酸时则A中的阴离子的电子式_______。
(2)当X是氢氧化钠溶液时,C的化学式_______。
(3)写出A和足量氢氧化钠在加热条件下反应的化学方程式_______。
Ⅱ.金属及其化合物用途广泛,研究金属的提取、冶炼意义重大。
(4)下列各组金属,冶炼方法一定不同的是_______(填字母)。
a.Hg、Ag b.Na、Mg c.Al、Fe d.Na、Ca
(5)以铬铁矿(主要成分为FeO和,含有少量、等杂质)为主要原料生产化工原料重铬酸钠并制取铬,其主要工艺流程如下:
查阅资料得知:在碱性条件下,某些氧化剂能将氧化为。
①“操作②”是_______。
②工业上可用固体A制取粗硅,写出反应的化学方程式:_______。
③写出溶液D转化为溶液E过程中反应的离子方程式:_______。
18. 利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。
回答下列问题:
(1)X在水中的电离方程式为_______。
(2)Y可用于实验室制O2,其焰色试验为紫色,则Y的化学式为_______;Y在400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种是含氧酸盐,则生成这两种盐的物质的量之比是_______。
(3)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的_______倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(4)Cl2O熔点-116℃,沸点2℃,容易与水反应生成次氯酸,与空气混合容易爆炸。Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为________,适宜的收集方法是_______。
19. 实验室现有、、、四种溶液,装有四种溶液的试剂瓶标签不慎弄脏。现将四瓶溶液编号为A、B、C、D并进行相关实验。其中A属于盐类且能与B反应生成气体,B、C、D间反应现象的记录如下表。回答下列问题:
溶液 B C D
B - 不反应 ↓
C 不反应 - ↓
D ↓ ↓ -
(1)根据实验现象及已知条件,可推断出A、C溶液中溶质的化学式:
A:_______;C:_______;
(2)写出C和D反应的化学方程式:_______;
(3)写出B和D反应的离子方程式:_______;
(4)过量A溶液与澄清石灰水混合会产生白色沉淀,写出该反应的离子方程式:_______。
DCCCB DDDCC DADAD
16【答案】(1)增大接触面积,加速固体溶解
(2) ①. 将全部还原为 ②. 过滤
(3)
(4)
(5) ①. ②. 隔绝空气(或在惰性环境中进行)
【解析】
【分析】钛铁矿中含有FeO、TiO2、SiO2,加入浓硫酸,利用浓硫酸的强氧化性,将FeO氧化成Fe2(SO4)3,根据信息①,TiO2与硫酸反应生成TiOSO4,SiO2为不溶于水的酸性氧化物,加水、加入过量Fe,Fe将Fe3+氧化成Fe2+,然后过滤,滤渣1为SiO2和过量的铁,滤液1为FeSO4、TiOSO4,冷却,过滤,固体2为FeSO4·7H2O,滤液2为TiOSO4,据此分析;
17【答案】(1) (2)NO
(3)
(4)c (5) ①. 过滤 ②. ③. 10OH-+2Cr3++3H2O2=2+8H2O
【解析】
【分析】Ⅰ.B连续与Y反应生成D,C的相对分子质量比D少16,初步判断D比C多一个氧原子,可出推断Y为O2,由于E为酸,则D应为能转化为酸的某物质,很可能为SO3、NO2等,若D为SO3,顺推E为H2SO4,Z为H2O,逆推B为H2S,A为硫氢化物,此时X为强酸;若D为NO2,顺推E为HNO3,Z为H2O,逆推B为NH3,A为铵盐,此时X为强碱,综合而得A应为NH4HS。
Ⅱ. 铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质),加入过量稀硫酸,固体A为SiO2,溶液B中含有Cr3+、Al3+、Fe2+,在B中加入氧化剂,可生成Fe3+,调节溶液pH可除去Fe3+、Al3+,生成氢氧化铁、氢氧化铝沉淀,即固体C,溶液D含有Cr3+,在溶液D中加入H2O2和NaOH,发生氧化还原反应,溶液E含有Na2CrO4,酸化可得Na2Cr2O7,在酸性条件下电解得到铬;
18【答案】(1)HClO4
(2) ①. KClO3 ②. 1:3
(3)2 (4) ①. 2Cl2 + 2Na2CO3 + H2O = Cl2O + 2NaHCO3 + 2NaCl ②. 气体干燥后隔绝空气并将收集装置放置在冰水浴中液化收集
19【答案】(1) ①. NaHCO3 ②. BaCl2
(2)2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2
(3)Ag++Cl-=AgCl↓
(4)Ca2++2OH-+2=CaCO3↓+2H2O+
【解析】
【分析】A属于盐类且能与B反应生成气体,由题干给的物质可知A为,B为,由表可知B和D反应生成沉淀,则D为,C与D反应也生成沉淀,C为。
化学试题
注意事项:1.请在答题纸上作答,在试卷上作答无效。
2.本试卷共100分,考试时间75分钟。
可能用到的元素相对原子质量:H-1 C-12 O-16 Cu-64 Cl-35.5 Fe-56
第Ⅰ卷 (选择题,共45分)
一、选择题(本题包括15小题,每小题3分,共45分,每小题只有一个选项符合题意)
1. 2022年北京冬奥会成功举办,本届冬奥会体现了科技创新与艺术设计的完美融合。下列说法错误的是
A. 为场馆提供电能的硅太阳能电池,利用了硅的半导体性能
B. 速滑竞赛服使用了蜂窝样式的聚氨酯材料,属于合成有机高分子材料
C. 氢燃料电池车采用全新的车载光伏发电系统,体现了“绿色出行”的理念
D. 颁奖礼仪服内胆添加了第二代石墨烯发热材料,石墨烯属于新型有机高分子材料
2. 正确掌握化学用语是学好化学的基础。下列化学用语正确的是
A. 次氯酸的结构式:H-Cl-O
B. 氯离子的结构示意图:
C. 二氧化碳的空间构型为直线型
D. 硫化氢分子的电子式:
3. 下列说法正确的是
A. 工业制玻璃和陶瓷都是以石英砂为主要原料
B. SO2和Cl2混合使用有更强的漂白性
C. 浓硫酸有吸水性,所以可以干燥H2、CO、SO2等气体
D. 在实验室中,可加热NH4Cl固体制取NH3
4. 某小组拟用两种方法制备同一种金属氯化物:①用金属和氯气共热直接化合制得;②用金属和盐酸反应制得。可以成功的是
A. CuCl2 B. FeCl3 C. NaCl D. FeCl2
5. 根据下列实验操作和现象所得到的结论正确的是
选项 实验操作和现象 实验结论
A 向蔗糖溶液中加入稀硫酸,水浴加热,一段时间后加入新制悬浊液并加热,未出现砖红色沉淀 蔗糖未发生水解
B 向久置的Na2SO3溶液中加入足量BaCl2溶液,出现白色沉淀;再加入足量稀盐酸,部分沉淀溶解 部分Na2SO3被氧化
C 用洁净的铂丝蘸取溶液进行焰色反应,火焰呈黄色 原溶液中一定有Na+,无K+
D 某溶液中加入盐酸,并将产生的气体通入澄清石灰水 澄清石灰水变浑浊,说明溶液中一定含有
A. A B. B C. C D. D
6. 某兴趣小组的同学向一定体积的Ba(OH)2溶液中逐滴加入稀H2SO4,通过仪器测得混合溶液的导电能力随时间变化的曲线如图所示。下列有关说法不正确的是
A. XY段混合溶液的导电能力逐渐减弱,是因为溶液中离子数目减少
B. a时刻,混合溶液中Ba(OH)2与H2SO4恰好完全反应
C. YZ段溶液的导电能力逐渐增强,主要是由于过量的硫酸电离出的离子导电
D. 该实验发生反应的离子方程式为H+++Ba2++OH-=BaSO4↓+H2O
7. “焖子”是大连地区特色小吃之一,制作“焖子”的主要原料有:红薯淀粉、植物油、味精、糖、芝麻酱和大蒜等。下列说法正确的是
A. 葡萄糖、乳糖都属于单糖
B. 红薯淀粉水解后产物是氨基酸
C. 植物油是天然有机高分子化合物,可以使溴水褪色
D. 味精化学名称为谷氨酸钠,作为增味剂,能增加食品的鲜味
8. 36.5 g HCl溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数,则下列叙述中正确的是
A. 所得溶液的物质的量浓度为1 mol·L-1
B. 所得溶液中含有NA个HCl分子
C. 36.5 g HCl气体占有的体积为22.4 L
D. 所得溶液的质量分数:w=
9. 下列实验装置不能达到实验目的的是
A. ①制取乙酸乙酯
B. ②甲烷与氯气在光照下反应实验
C. ③从海带中提取碘的实验中灼烧碎海带
D. ④比较乙醇中羟基氢原子和水分子中氢原子的活泼性
10. 对溶液中的离子进行鉴定,下列实验所得结论合理的是
A. 某待检溶液中加入硝酸酸化的AgNO3溶液,有白色沉淀生成,则待检溶液中一定含有Cl-
B. 某待检溶液中加入氯水,再加入KSCN溶液,溶液变红色,则待检溶液中含有Fe2+
C. 某待检溶液中加入NaOH溶液,产生红褐色沉淀,说明待检溶液中含有Fe3+
D. 某待检溶液中加入盐酸,有使澄清石灰水变浑浊的无色无味的气体放出,可推测待检溶液中一定含有大量CO
11. 银锌电池是一种常见化学电源,其反应原理为Zn+Ag2O+H2O=Zn(OH)2+2Ag。其工作示意图如图所示。下列说法不正确的是
A. Zn电极是负极,K+向Ag2O电极迁移
B. Ag2O电极发生还原反应
C. Zn电极的电极反应式为Zn-2e-+2OH-=Zn(OH)2
D. 放电前后电解质溶液的pH保持不变
12. 根据反应:①2Fe2+ +Br2 =2Fe3+ +2Br-,②2Br- +Cl2=Br2 + 2Cl-,③2Fe3++2I- =2Fe2++I2。判断下列物质的氧化性由强到弱的顺序正确的是
A. Cl2>Br2>Fe3+>I2
B. Br2>Fe3+>Cl2>I2
C. Cl2>Br2>I2>Fe3+
D. I2>Fe3+> Br2>Cl2
13. 如图为合成治疗癌症用药“格列宁”的药物中间体的结构简式。下列关于该化合物说法正确的是
A. 分子式为
B. 含有4种官能团
C. 1mol该物质可以与1mol碳酸氢钠反应
D. 在一定条件下能发生氧化反应、加聚反应、酯化反应
14. 下列性质的比较,不能用元素周期律解释的是
A. 酸性:HClO4>H2SO3>H2SiO3 B. 碱性:KOH>NaOH>LiOH
C. 热稳定性:H2O>H2S>PH3 D. 非金属性:F>O>N
15. 海水开发利用的部分过程如图所示。下列说法正确的是
A. 除去粗盐中的、、、等杂质,加入试剂的顺序为溶液→NaOH溶液→溶液→过滤后加盐酸
B. 电解提取金属镁
C. 工业生产中常选用NaOH作为沉淀剂
D. 富集溴一般先用空气和水蒸气吹出单质溴,再用将其还原吸收
第Ⅱ卷 (非选择题,共55分)
二、填空题(本题包括4小题,共55分)
16. 中国“奋斗者”号深潜器研制及海试的成功,标志着我国在钛合金材料制备方面实现了重大突破。工业上用钛矿石(主要成分:等)为原料制取钛并得到副产物绿矾(),工艺流程如下:
已知:①
②易水解,只能存在于强酸性溶液中
请回答以下问题:
(1)钛矿石在加入浓硫酸酸溶前要先粉碎,其目的是_______。
(2)加入过量铁粉的目的是_______。操作1名称为_______。
(3)固体2的主要成分是_______。
(4)在高温下,和焦炭的混合物中通入得到和一种可燃性气体,请写出反应的化学方程式_______。
(5)用过量的钠在高温条件下与反应可制得钛,写出此反应的化学方程式_______。该反应必须在高温下进行,你认为还应该控制的反应条件是_______。
17. Ⅰ.已知下列物质均由短周期元素组成,X无论是盐酸还是氢氧化钠,转化均能进行,又已知C的相对分子质量比D少16,A、B、C、D、E中均含有同一元素。
(1)当X是盐酸时则A中的阴离子的电子式_______。
(2)当X是氢氧化钠溶液时,C的化学式_______。
(3)写出A和足量氢氧化钠在加热条件下反应的化学方程式_______。
Ⅱ.金属及其化合物用途广泛,研究金属的提取、冶炼意义重大。
(4)下列各组金属,冶炼方法一定不同的是_______(填字母)。
a.Hg、Ag b.Na、Mg c.Al、Fe d.Na、Ca
(5)以铬铁矿(主要成分为FeO和,含有少量、等杂质)为主要原料生产化工原料重铬酸钠并制取铬,其主要工艺流程如下:
查阅资料得知:在碱性条件下,某些氧化剂能将氧化为。
①“操作②”是_______。
②工业上可用固体A制取粗硅,写出反应的化学方程式:_______。
③写出溶液D转化为溶液E过程中反应的离子方程式:_______。
18. 利用“价类二维图”研究物质的性质是化学研究的重要手段。如图是氯元素的化合价与部分物质类别的对应关系。
回答下列问题:
(1)X在水中的电离方程式为_______。
(2)Y可用于实验室制O2,其焰色试验为紫色,则Y的化学式为_______;Y在400℃时分解只生成两种盐,其中一种是无氧酸盐,另一种是含氧酸盐,则生成这两种盐的物质的量之比是_______。
(3)NaClO2具有很强的氧化性,常用作消毒剂,其消毒效率是Z的_______倍(还原产物都为Cl-,消毒效率以单位物质的量得到的电子数表示)。
(4)Cl2O熔点-116℃,沸点2℃,容易与水反应生成次氯酸,与空气混合容易爆炸。Cl2O可用潮湿的Z与Na2CO3反应制取,同时生成NaHCO3,反应中Z既体现氧化性,又体现还原性,该反应的化学方程式为________,适宜的收集方法是_______。
19. 实验室现有、、、四种溶液,装有四种溶液的试剂瓶标签不慎弄脏。现将四瓶溶液编号为A、B、C、D并进行相关实验。其中A属于盐类且能与B反应生成气体,B、C、D间反应现象的记录如下表。回答下列问题:
溶液 B C D
B - 不反应 ↓
C 不反应 - ↓
D ↓ ↓ -
(1)根据实验现象及已知条件,可推断出A、C溶液中溶质的化学式:
A:_______;C:_______;
(2)写出C和D反应的化学方程式:_______;
(3)写出B和D反应的离子方程式:_______;
(4)过量A溶液与澄清石灰水混合会产生白色沉淀,写出该反应的离子方程式:_______。
DCCCB DDDCC DADAD
16【答案】(1)增大接触面积,加速固体溶解
(2) ①. 将全部还原为 ②. 过滤
(3)
(4)
(5) ①. ②. 隔绝空气(或在惰性环境中进行)
【解析】
【分析】钛铁矿中含有FeO、TiO2、SiO2,加入浓硫酸,利用浓硫酸的强氧化性,将FeO氧化成Fe2(SO4)3,根据信息①,TiO2与硫酸反应生成TiOSO4,SiO2为不溶于水的酸性氧化物,加水、加入过量Fe,Fe将Fe3+氧化成Fe2+,然后过滤,滤渣1为SiO2和过量的铁,滤液1为FeSO4、TiOSO4,冷却,过滤,固体2为FeSO4·7H2O,滤液2为TiOSO4,据此分析;
17【答案】(1) (2)NO
(3)
(4)c (5) ①. 过滤 ②. ③. 10OH-+2Cr3++3H2O2=2+8H2O
【解析】
【分析】Ⅰ.B连续与Y反应生成D,C的相对分子质量比D少16,初步判断D比C多一个氧原子,可出推断Y为O2,由于E为酸,则D应为能转化为酸的某物质,很可能为SO3、NO2等,若D为SO3,顺推E为H2SO4,Z为H2O,逆推B为H2S,A为硫氢化物,此时X为强酸;若D为NO2,顺推E为HNO3,Z为H2O,逆推B为NH3,A为铵盐,此时X为强碱,综合而得A应为NH4HS。
Ⅱ. 铬铁矿(主要成分为FeO和Cr2O3,含有Al2O3、SiO2等杂质),加入过量稀硫酸,固体A为SiO2,溶液B中含有Cr3+、Al3+、Fe2+,在B中加入氧化剂,可生成Fe3+,调节溶液pH可除去Fe3+、Al3+,生成氢氧化铁、氢氧化铝沉淀,即固体C,溶液D含有Cr3+,在溶液D中加入H2O2和NaOH,发生氧化还原反应,溶液E含有Na2CrO4,酸化可得Na2Cr2O7,在酸性条件下电解得到铬;
18【答案】(1)HClO4
(2) ①. KClO3 ②. 1:3
(3)2 (4) ①. 2Cl2 + 2Na2CO3 + H2O = Cl2O + 2NaHCO3 + 2NaCl ②. 气体干燥后隔绝空气并将收集装置放置在冰水浴中液化收集
19【答案】(1) ①. NaHCO3 ②. BaCl2
(2)2AgNO3+BaCl2=2AgCl↓+Ba(NO3)2
(3)Ag++Cl-=AgCl↓
(4)Ca2++2OH-+2=CaCO3↓+2H2O+
【解析】
【分析】A属于盐类且能与B反应生成气体,由题干给的物质可知A为,B为,由表可知B和D反应生成沉淀,则D为,C与D反应也生成沉淀,C为。
同课章节目录
