河南省开封市杞县官庄乡联合中学2022-2023学年高三上学期8月开学考试化学试卷(Word版含答案)
文档属性
| 名称 | 河南省开封市杞县官庄乡联合中学2022-2023学年高三上学期8月开学考试化学试卷(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 715.1KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-28 10:00:30 | ||
图片预览



文档简介
杞县官庄乡联合中学2022-2023学年高三上学期8月开学考试
化学试卷
注意事项
1.全卷满分100分。考试用时90分钟。
2.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Si 28 P 31 S 32 K 39 Fe 56 Cu 64 Zn 65。
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一个是符合题目要求的)
1.2021年诺贝尔化学奖颁给了“在不对称催化方面”做出贡献的两位科学家,脯氨酸()是不对称有机催化剂中的一种。下列关于脯氨酸分子的说法错误的是( )
A.该分子为极性分子
B.分子中所有原子可能共面
C.分子中存在手性碳原子
D.可形成分子内氢键
2. 下列物质的用途中,不正确的是
A. 醋酸可除水垢 B. 乙烯可用于催熟果实
C. 丙三醇可用于配制化妆品 D. 油脂在酸性条件下水解用于制作肥皂
3.磷酸铁锂(LiFePO4)电极材料主要用于各种锂离子电池。下列说法错误的是( )
A.Li位于周期表s区
B.基态Fe2+的价层电子排布式为3d5
C.基态P原子的未成对电子数为3
D.基态O原子核外电子占据的最高能级的电子云轮廓图为哑铃形
4.下列叙述正确的是( )
A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B.CC14是非极性分子,分子中C原子处在4个C1原子所组成的正方形的中心
C.H2O是极性分子,分子中O原子处在2个H原子所连成的直线的中央
D.CO2是非极性分子,分子中C原子处在2个O原子所连成的直线的中央
5.防晒霜之所以能有效减轻紫外光对人体的伤害,是因为它所含的有效成分的分子中含有π键,π键的电子可在吸收紫外光后被激发,从而阻挡部分紫外光对皮肤的伤害。下列物质中没有防晒效果的是( )
A.氨基苯甲酸() B.羟基丙酮()
C.肉桂酸() D.乙醇()
6. 氢氰酸(HCN)作为一种重要的精细化工原料,随着医药、染料和农药等相关行业的发展,其下游产品的研究和生产取得了较快的进展。HCN分子中所有原子都通过化学键而达到稳定结构,则下列有关HCN的说法中正确的是
A. 结构式: B. 电子式:
C. 中心原子是杂化 D. 1个分子中含有4个σ键
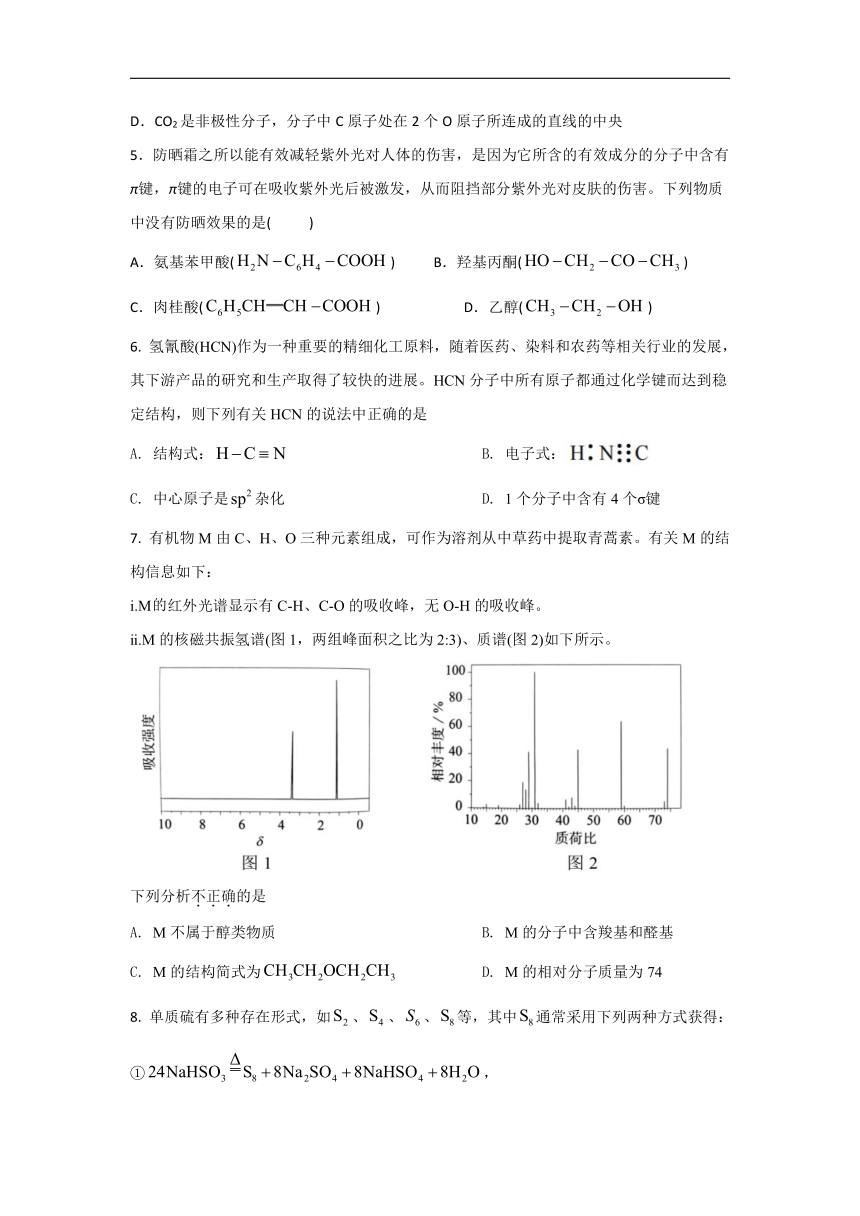
7. 有机物M由C、H、O三种元素组成,可作为溶剂从中草药中提取青蒿素。有关M的结构信息如下:
ⅰ.M红外光谱显示有C-H、C-O的吸收峰,无O-H的吸收峰。
ⅱ.M的核磁共振氢谱(图1,两组峰面积之比为2:3)、质谱(图2)如下所示。
下列分析不正确的是
A. M不属于醇类物质 B. M的分子中含羧基和醛基
C. M的结构简式为 D. M的相对分子质量为74
8. 单质硫有多种存在形式,如、、、等,其中通常采用下列两种方式获得:①,②(浓)。下列说法正确的是
A. 、、、互为同位素
B. 反应①中每生成1 mol ,有16 mol电子发生转移
C. 反应②为还原产物
D. 还原性:
9. 从粗铜精炼的阳极泥(主要成分为Cu、Ag、C、Au)中回收贵金属Au与Ag的工艺流程如图所示。已知氧化性:。下列说法错误的是
A. 滤渣Ⅰ通过灼烧可获得较纯净的Au
B. “酸浸”时通入可减少污染
C. “转化”时反应的离子方程式为
D. 粗银可通过酸浸、过滤、洗涤、干燥获得熔点和硬度更高的纯银
10.下列叙述中正确的是( )
A.乙硫醇(CH3CH2SH)沸点高于乙醇(CH3CH2OH),因为前者相对分子质 量大
B.[Cu(NH3)4]SO4·H2O中含离子键、极性共价键、配位键
C.原子的电子云轮廓图中小点表示核外电子在此处出现过一次
D.电负性越大的元素,第一电离能也越大
11.维通氟橡胶的耐高温和耐化学性能是闻名的,它可用于飞机结构密封件、电气涂层和护套、海绵衬垫等。其结构简式为:,则合成它的单体为
A. B.
C. 和 D. CH2=CF2和CF2=CF-CF3
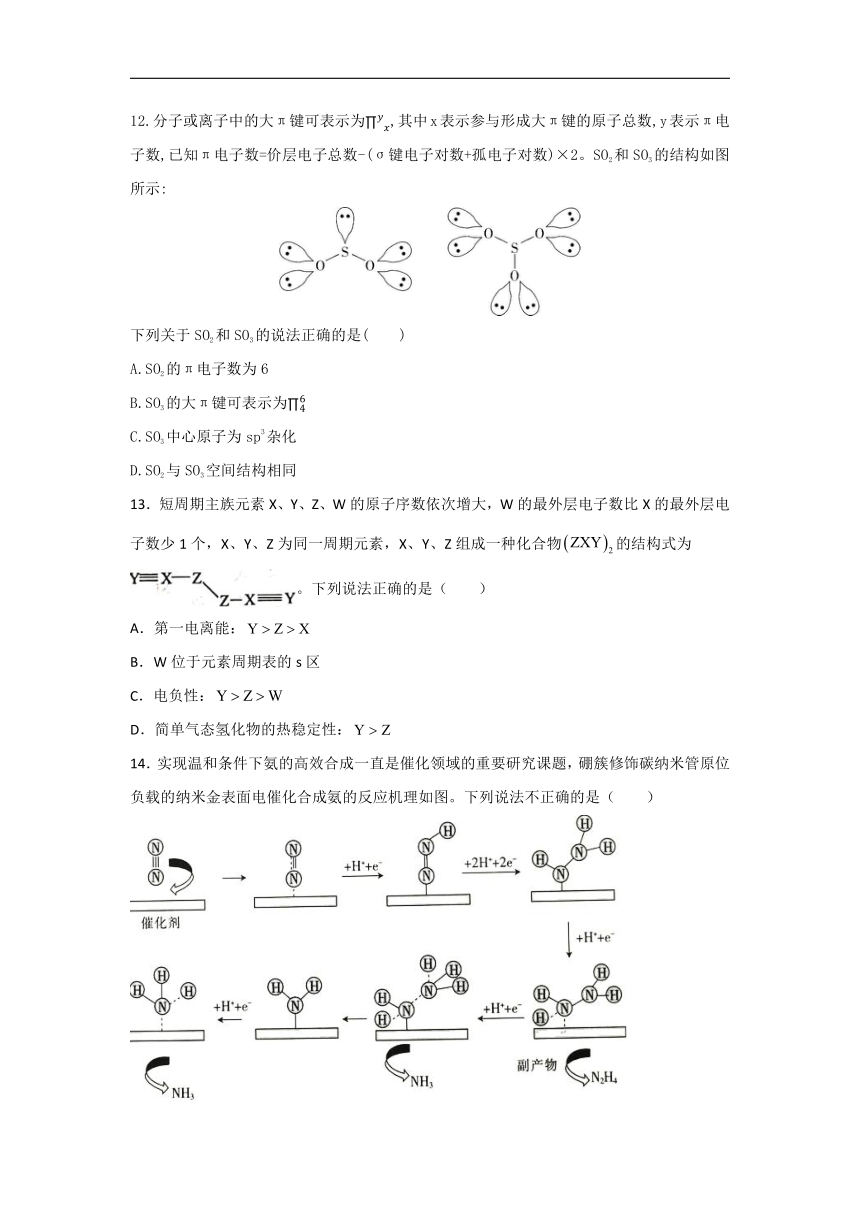
12.分子或离子中的大π键可表示为,其中x表示参与形成大π键的原子总数,y表示π电子数,已知π电子数=价层电子总数-(σ键电子对数+孤电子对数)×2。SO2和SO3的结构如图所示:
下列关于SO2和SO3的说法正确的是( )
A.SO2的π电子数为6
B.SO3的大π键可表示为
C.SO3中心原子为sp3杂化
D.SO2与SO3空间结构相同
13.短周期主族元素X、Y、Z、W的原子序数依次增大,W的最外层电子数比X的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物的结构式为。下列说法正确的是( )
A.第一电离能:
B.W位于元素周期表的s区
C.电负性:
D.简单气态氢化物的热稳定性:
14.实现温和条件下氨的高效合成一直是催化领域的重要研究课题,硼簇修饰碳纳米管原位负载的纳米金表面电催化合成氨的反应机理如图。下列说法不正确的是( )
A.上述转化过程中涉及非极性键的断裂和极性键的生成
B.生成的电极总反应式为
C.使用纳米金作催化剂可以降低反应的活化能,从而提高化学反应速率
D.当标准状况下22.4L发生反应时,可得到2mol
15.氧氟沙星的结构简式如图所示,它对革兰氏阴性菌具有强大的杀菌作用,如大肠杆菌、枸橼酸杆菌、志贺杆菌、肺炎克雷伯菌等。下列有关说法正确的是
A. 氧氟沙星不能使溴水溶液褪色 B. 氧氟沙星能与碳酸氢钠溶液反应
C. 氧氟沙星分子中含有4种含氧官能团 D. 1mol氧氟沙星最多可与6mol加成
二、非选择题(本题共5小题,共55分)
16.(10分)我国复旦大学魏大程团队开发的一种共形六方氮化硼修饰技术,可直接在二氧化硅表面生长高质量六方氮化硼薄膜。
(1)下列N原子的电子排布图表示的状态中,能量最高的是 (填字母)。
A. B.
C. D.
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有 种。
(3)Na与N形成的NaN3可用于汽车的安全气囊中,其中阴离子的空间结构为 ,Na在空气中燃烧发出黄色火焰,这种黄色焰色用光谱仪摄取的光谱为 (填“发射”或“吸收”)光谱。
(4)已知NH3分子的键角约为107°,而同主族磷的氢化物PH3分子的键角约为94°,试用价层电子对互斥模型解释NH3的键角比PH3的键角大的原因: 。
(5)BH3·NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,B与N之间形成配位键,氮原子提供 ,在BH3·NH3中B原子的杂化方式为 。
17.(14分)已知500mL待测液中除含有0.3mol·L-1的Na+外,还可能含有下列离子中的一种成几种:K+、NH、Mg2+、Ba2+、Al3+、Cl—、Br—、CO、HCO、SO。现进行如下实验操作(每次实验所加试剂均过量):
(1)由白色沉淀B可确定待测液中含有的离子是____。
(2)检验气体B常用的简便方法是____,若在标准状态下,用一充满气体B的圆底烧瓶做喷泉实验,实验完毕后,圆底烧瓶中充入水的体积为其容积的,则所得溶液的物质的量浓度是____mol·L-1(假设溶液不扩散,保留2位有效数字)。
(3)由沉淀D和沉淀E可以判断待测液中一定含有____离子,据此可以排除的离子是____。
(4)某同学分析白色沉淀C后,认为待测液一定不含____。
(5)综合分析,待测液中K+的最小浓度为____。
18. 分子结构修饰在药物设计与合成中有广泛的应用。
(1)有机物A()是一种医药中间体。A属于_______(填物质类别)。
(2)研究发现,在A中取代基的对位上引入“”,其抗炎活性更好。基于此,科研人员合成了具有抗炎、镇痛、解热作用的药物——布洛芬。
①B的结构简式是_______。
②D与布洛芬的相对分子质量相差_______。
③口服布洛芬对胃、肠道有刺激。用对布洛芬进行成酯修饰,能有效改善这种状况,二者发生酯化反应的化学方程式是_______。
(3)如果对布洛芬既进行成酯修饰,又将其转变为高分子,则不仅增加它的治疗效果,还能降低毒性。科研人员对布洛芬的分子结构修饰如下:
(有机物Q)
①分析Q的结构,使其发生加聚反应的官能团是_______。
②从反应类型的角度说明布洛芬与Q的性质差异:_______(答出两点即可)。
(4)Y是制备有机物Q的物质之一,其合成路线如下:
①试剂a是_______。
②E→F的反应方程式是_______。
可用酰胺类物质继续修饰有机物Q,得到性能更优异的药物。
19. 中科院物理所的孟庆波研究团队,利用三芐基氧化膦(TBPO)和双功能材料异丁基二硫代氨基甲酸异丁胺(iBA-iBDTC)作为钙钛矿()添加剂,显著提升了电池效率、界面稳定性和电池器件稳定性。
(1)基态钛原子价电子轨道表示式为_______。钙与钛同周期,均为金属晶体,二者的熔沸点如表所示,Ti的熔沸点高于Ca的原因是_______。
物质
熔点/℃ 839 1660
沸点/℃ 1484 3287
(2)三芐基氧化膦的结构为,基态磷原子核外电子具有的能量有_______种。与氧同周期的主族元素中,第一电离能大于氧的元素有_______种。
(3)异丁基二硫代氨基甲酸异丁胺中含有C、N、O、S、H元素,其中C、N、S三种元的简单氢化物中,属于非极性分子的是_______(填化学式,下同),键角从大到小的顺序为_______,它们的中心原子的杂化方式均为_______。
(4)氮能形成共价晶体氮化硼、氮化铝等,其中氮化铝的晶胞结构如图所示:
其中A、B两个原子的坐标参数分别为(0,0,0)、(,,0),则C原子的坐标参数为_______。若N和Al的原子半径分别为a pm和b pm,且Al与最近的N原子相切,则晶胞的空间利用率为_______(列出计算式即可,不必化简)。
20.
苯甲酸甲酯常用于配制香水香精和人造精油,也可用作有机合成中间体、溶剂、食品保鲜剂等。用如图所示装置制取少量苯甲酸甲酯。请回答下列问题:
相关物质的物理性质见下表:
苯甲酸 甲醇 苯甲酸甲酯
相对分子质量 122 32 136
熔点/℃ 122 -93.9 -12.3
沸点/℃ 249 65 199.6
沸石密度/() 1.2659 0.792 1.0888
水溶性 微溶 易溶 难溶
I.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2 g苯甲酸和13 g甲醇,再小心加入2 mL浓硫酸,混匀后,投入几粒沸石,小心加热65 min,获得苯甲酸甲酯粗产品。
(1)仪器甲的名称是_______;加入沸石的作用是_______;如果在实验过程中发现忘记加沸石,接下来的操作是_______。
(2)写出该实验中制取苯甲酸甲酯的化学方程式_______。
(3)该实验中使用过量的甲醇,其目的是_______。
II.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制:
(4)第一次蒸馏时,温度应控制_______℃左右;操作a名称是_______。
(5)用饱和Na2CO3溶液洗涤的目的是_______。
(6)实验制得的苯甲酸甲酯精制品质量为10.2 g,则苯甲酸甲酯的产率为_______。
BDBDD ABDDB DBADB
16.答案 (除注明外,每空1分)
(1)D
(2)3
(3)直线形(2分) 发射
(4)N的原子半径比P小、电负性比P大,使得NH3分子中共用电子对之间的距离比PH3分子中近、斥力大(2分)
(5)孤电子对 sp3(2分)
17、(14分,每空2分)
(1) HCO (2) 用湿润的红色石蕊试纸检验,试纸变蓝证明有氨气 0.045
(3) CO、SO Mg2+、Ba2+、Al3+ (4) Br— (5) 0.3mol·L-1
【18题答案】
【答案】(1)芳香烃 (2) ①. ②. 28 ③. + +H2O
(3) ①. 碳碳双键 ②. Q能够发生水解反应、消去反应、加聚反应:布洛芬能发生中和反应
(4) ①. NaOH水溶液 ②.
【答案】(1) ①. ②. 二者均为金属晶体,但是Ti的原子半径小,价电子数多,所以金属键更强,熔沸点更高(合理即可)
(2) ①. 5 ②. 2
(3) ①. ②. ③.
(4) ①. (,,) ②.
20.【答案】(1) ①. 球形冷凝管 ②. 防止暴沸 ③. 停止加热,待冷却后加入沸石
(2)+CH3OH+H2O
(3)提高苯甲酸的转化率和苯甲酸甲酯的产率
(4) ①. 65 ②. 分液
(5)洗去苯甲酸甲酯中的苯甲酸和硫酸
(6)75%
化学试卷
注意事项
1.全卷满分100分。考试用时90分钟。
2.可能用到的相对原子质量:H 1 C 12 N 14 O 16 Na 23 Mg 24 Si 28 P 31 S 32 K 39 Fe 56 Cu 64 Zn 65。
一、选择题(本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一个是符合题目要求的)
1.2021年诺贝尔化学奖颁给了“在不对称催化方面”做出贡献的两位科学家,脯氨酸()是不对称有机催化剂中的一种。下列关于脯氨酸分子的说法错误的是( )
A.该分子为极性分子
B.分子中所有原子可能共面
C.分子中存在手性碳原子
D.可形成分子内氢键
2. 下列物质的用途中,不正确的是
A. 醋酸可除水垢 B. 乙烯可用于催熟果实
C. 丙三醇可用于配制化妆品 D. 油脂在酸性条件下水解用于制作肥皂
3.磷酸铁锂(LiFePO4)电极材料主要用于各种锂离子电池。下列说法错误的是( )
A.Li位于周期表s区
B.基态Fe2+的价层电子排布式为3d5
C.基态P原子的未成对电子数为3
D.基态O原子核外电子占据的最高能级的电子云轮廓图为哑铃形
4.下列叙述正确的是( )
A.NH3是极性分子,分子中N原子处在3个H原子所组成的三角形的中心
B.CC14是非极性分子,分子中C原子处在4个C1原子所组成的正方形的中心
C.H2O是极性分子,分子中O原子处在2个H原子所连成的直线的中央
D.CO2是非极性分子,分子中C原子处在2个O原子所连成的直线的中央
5.防晒霜之所以能有效减轻紫外光对人体的伤害,是因为它所含的有效成分的分子中含有π键,π键的电子可在吸收紫外光后被激发,从而阻挡部分紫外光对皮肤的伤害。下列物质中没有防晒效果的是( )
A.氨基苯甲酸() B.羟基丙酮()
C.肉桂酸() D.乙醇()
6. 氢氰酸(HCN)作为一种重要的精细化工原料,随着医药、染料和农药等相关行业的发展,其下游产品的研究和生产取得了较快的进展。HCN分子中所有原子都通过化学键而达到稳定结构,则下列有关HCN的说法中正确的是
A. 结构式: B. 电子式:
C. 中心原子是杂化 D. 1个分子中含有4个σ键
7. 有机物M由C、H、O三种元素组成,可作为溶剂从中草药中提取青蒿素。有关M的结构信息如下:
ⅰ.M红外光谱显示有C-H、C-O的吸收峰,无O-H的吸收峰。
ⅱ.M的核磁共振氢谱(图1,两组峰面积之比为2:3)、质谱(图2)如下所示。
下列分析不正确的是
A. M不属于醇类物质 B. M的分子中含羧基和醛基
C. M的结构简式为 D. M的相对分子质量为74
8. 单质硫有多种存在形式,如、、、等,其中通常采用下列两种方式获得:①,②(浓)。下列说法正确的是
A. 、、、互为同位素
B. 反应①中每生成1 mol ,有16 mol电子发生转移
C. 反应②为还原产物
D. 还原性:
9. 从粗铜精炼的阳极泥(主要成分为Cu、Ag、C、Au)中回收贵金属Au与Ag的工艺流程如图所示。已知氧化性:。下列说法错误的是
A. 滤渣Ⅰ通过灼烧可获得较纯净的Au
B. “酸浸”时通入可减少污染
C. “转化”时反应的离子方程式为
D. 粗银可通过酸浸、过滤、洗涤、干燥获得熔点和硬度更高的纯银
10.下列叙述中正确的是( )
A.乙硫醇(CH3CH2SH)沸点高于乙醇(CH3CH2OH),因为前者相对分子质 量大
B.[Cu(NH3)4]SO4·H2O中含离子键、极性共价键、配位键
C.原子的电子云轮廓图中小点表示核外电子在此处出现过一次
D.电负性越大的元素,第一电离能也越大
11.维通氟橡胶的耐高温和耐化学性能是闻名的,它可用于飞机结构密封件、电气涂层和护套、海绵衬垫等。其结构简式为:,则合成它的单体为
A. B.
C. 和 D. CH2=CF2和CF2=CF-CF3
12.分子或离子中的大π键可表示为,其中x表示参与形成大π键的原子总数,y表示π电子数,已知π电子数=价层电子总数-(σ键电子对数+孤电子对数)×2。SO2和SO3的结构如图所示:
下列关于SO2和SO3的说法正确的是( )
A.SO2的π电子数为6
B.SO3的大π键可表示为
C.SO3中心原子为sp3杂化
D.SO2与SO3空间结构相同
13.短周期主族元素X、Y、Z、W的原子序数依次增大,W的最外层电子数比X的最外层电子数少1个,X、Y、Z为同一周期元素,X、Y、Z组成一种化合物的结构式为。下列说法正确的是( )
A.第一电离能:
B.W位于元素周期表的s区
C.电负性:
D.简单气态氢化物的热稳定性:
14.实现温和条件下氨的高效合成一直是催化领域的重要研究课题,硼簇修饰碳纳米管原位负载的纳米金表面电催化合成氨的反应机理如图。下列说法不正确的是( )
A.上述转化过程中涉及非极性键的断裂和极性键的生成
B.生成的电极总反应式为
C.使用纳米金作催化剂可以降低反应的活化能,从而提高化学反应速率
D.当标准状况下22.4L发生反应时,可得到2mol
15.氧氟沙星的结构简式如图所示,它对革兰氏阴性菌具有强大的杀菌作用,如大肠杆菌、枸橼酸杆菌、志贺杆菌、肺炎克雷伯菌等。下列有关说法正确的是
A. 氧氟沙星不能使溴水溶液褪色 B. 氧氟沙星能与碳酸氢钠溶液反应
C. 氧氟沙星分子中含有4种含氧官能团 D. 1mol氧氟沙星最多可与6mol加成
二、非选择题(本题共5小题,共55分)
16.(10分)我国复旦大学魏大程团队开发的一种共形六方氮化硼修饰技术,可直接在二氧化硅表面生长高质量六方氮化硼薄膜。
(1)下列N原子的电子排布图表示的状态中,能量最高的是 (填字母)。
A. B.
C. D.
(2)第二周期主族元素中,按第一电离能大小排序,第一电离能在B和N之间的元素有 种。
(3)Na与N形成的NaN3可用于汽车的安全气囊中,其中阴离子的空间结构为 ,Na在空气中燃烧发出黄色火焰,这种黄色焰色用光谱仪摄取的光谱为 (填“发射”或“吸收”)光谱。
(4)已知NH3分子的键角约为107°,而同主族磷的氢化物PH3分子的键角约为94°,试用价层电子对互斥模型解释NH3的键角比PH3的键角大的原因: 。
(5)BH3·NH3是一种有效、安全的固体储氢材料,可由BH3与NH3反应生成,B与N之间形成配位键,氮原子提供 ,在BH3·NH3中B原子的杂化方式为 。
17.(14分)已知500mL待测液中除含有0.3mol·L-1的Na+外,还可能含有下列离子中的一种成几种:K+、NH、Mg2+、Ba2+、Al3+、Cl—、Br—、CO、HCO、SO。现进行如下实验操作(每次实验所加试剂均过量):
(1)由白色沉淀B可确定待测液中含有的离子是____。
(2)检验气体B常用的简便方法是____,若在标准状态下,用一充满气体B的圆底烧瓶做喷泉实验,实验完毕后,圆底烧瓶中充入水的体积为其容积的,则所得溶液的物质的量浓度是____mol·L-1(假设溶液不扩散,保留2位有效数字)。
(3)由沉淀D和沉淀E可以判断待测液中一定含有____离子,据此可以排除的离子是____。
(4)某同学分析白色沉淀C后,认为待测液一定不含____。
(5)综合分析,待测液中K+的最小浓度为____。
18. 分子结构修饰在药物设计与合成中有广泛的应用。
(1)有机物A()是一种医药中间体。A属于_______(填物质类别)。
(2)研究发现,在A中取代基的对位上引入“”,其抗炎活性更好。基于此,科研人员合成了具有抗炎、镇痛、解热作用的药物——布洛芬。
①B的结构简式是_______。
②D与布洛芬的相对分子质量相差_______。
③口服布洛芬对胃、肠道有刺激。用对布洛芬进行成酯修饰,能有效改善这种状况,二者发生酯化反应的化学方程式是_______。
(3)如果对布洛芬既进行成酯修饰,又将其转变为高分子,则不仅增加它的治疗效果,还能降低毒性。科研人员对布洛芬的分子结构修饰如下:
(有机物Q)
①分析Q的结构,使其发生加聚反应的官能团是_______。
②从反应类型的角度说明布洛芬与Q的性质差异:_______(答出两点即可)。
(4)Y是制备有机物Q的物质之一,其合成路线如下:
①试剂a是_______。
②E→F的反应方程式是_______。
可用酰胺类物质继续修饰有机物Q,得到性能更优异的药物。
19. 中科院物理所的孟庆波研究团队,利用三芐基氧化膦(TBPO)和双功能材料异丁基二硫代氨基甲酸异丁胺(iBA-iBDTC)作为钙钛矿()添加剂,显著提升了电池效率、界面稳定性和电池器件稳定性。
(1)基态钛原子价电子轨道表示式为_______。钙与钛同周期,均为金属晶体,二者的熔沸点如表所示,Ti的熔沸点高于Ca的原因是_______。
物质
熔点/℃ 839 1660
沸点/℃ 1484 3287
(2)三芐基氧化膦的结构为,基态磷原子核外电子具有的能量有_______种。与氧同周期的主族元素中,第一电离能大于氧的元素有_______种。
(3)异丁基二硫代氨基甲酸异丁胺中含有C、N、O、S、H元素,其中C、N、S三种元的简单氢化物中,属于非极性分子的是_______(填化学式,下同),键角从大到小的顺序为_______,它们的中心原子的杂化方式均为_______。
(4)氮能形成共价晶体氮化硼、氮化铝等,其中氮化铝的晶胞结构如图所示:
其中A、B两个原子的坐标参数分别为(0,0,0)、(,,0),则C原子的坐标参数为_______。若N和Al的原子半径分别为a pm和b pm,且Al与最近的N原子相切,则晶胞的空间利用率为_______(列出计算式即可,不必化简)。
20.
苯甲酸甲酯常用于配制香水香精和人造精油,也可用作有机合成中间体、溶剂、食品保鲜剂等。用如图所示装置制取少量苯甲酸甲酯。请回答下列问题:
相关物质的物理性质见下表:
苯甲酸 甲醇 苯甲酸甲酯
相对分子质量 122 32 136
熔点/℃ 122 -93.9 -12.3
沸点/℃ 249 65 199.6
沸石密度/() 1.2659 0.792 1.0888
水溶性 微溶 易溶 难溶
I.合成苯甲酸甲酯粗产品
在圆底烧瓶中加入12.2 g苯甲酸和13 g甲醇,再小心加入2 mL浓硫酸,混匀后,投入几粒沸石,小心加热65 min,获得苯甲酸甲酯粗产品。
(1)仪器甲的名称是_______;加入沸石的作用是_______;如果在实验过程中发现忘记加沸石,接下来的操作是_______。
(2)写出该实验中制取苯甲酸甲酯的化学方程式_______。
(3)该实验中使用过量的甲醇,其目的是_______。
II.粗产品的精制
苯甲酸甲酯粗产品中往往含有少量甲醇、硫酸、苯甲酸和水等,现拟用下列流程进行精制:
(4)第一次蒸馏时,温度应控制_______℃左右;操作a名称是_______。
(5)用饱和Na2CO3溶液洗涤的目的是_______。
(6)实验制得的苯甲酸甲酯精制品质量为10.2 g,则苯甲酸甲酯的产率为_______。
BDBDD ABDDB DBADB
16.答案 (除注明外,每空1分)
(1)D
(2)3
(3)直线形(2分) 发射
(4)N的原子半径比P小、电负性比P大,使得NH3分子中共用电子对之间的距离比PH3分子中近、斥力大(2分)
(5)孤电子对 sp3(2分)
17、(14分,每空2分)
(1) HCO (2) 用湿润的红色石蕊试纸检验,试纸变蓝证明有氨气 0.045
(3) CO、SO Mg2+、Ba2+、Al3+ (4) Br— (5) 0.3mol·L-1
【18题答案】
【答案】(1)芳香烃 (2) ①. ②. 28 ③. + +H2O
(3) ①. 碳碳双键 ②. Q能够发生水解反应、消去反应、加聚反应:布洛芬能发生中和反应
(4) ①. NaOH水溶液 ②.
【答案】(1) ①. ②. 二者均为金属晶体,但是Ti的原子半径小,价电子数多,所以金属键更强,熔沸点更高(合理即可)
(2) ①. 5 ②. 2
(3) ①. ②. ③.
(4) ①. (,,) ②.
20.【答案】(1) ①. 球形冷凝管 ②. 防止暴沸 ③. 停止加热,待冷却后加入沸石
(2)+CH3OH+H2O
(3)提高苯甲酸的转化率和苯甲酸甲酯的产率
(4) ①. 65 ②. 分液
(5)洗去苯甲酸甲酯中的苯甲酸和硫酸
(6)75%
同课章节目录
