化学人教版(2019)选择性必修1 2.1.3活化能(共21张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修1 2.1.3活化能(共21张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 2.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-28 16:50:06 | ||
图片预览





文档简介
(共21张PPT)
第二章 化学反应速率与化学平衡
第一节 化学反应速率
第3课时 活化能
2 mol H2和1 mol O2混合于一个洁净的容器内,已知常温常压下,每个氢分子和氧分子自身或它们之间每秒钟平均碰撞2.355×1010次,如果每一次碰撞都能够引发反应,试想会有什么样的现象?
如果每一次碰撞都能引发反应,整个容器中的H2和O2将在极短的时间内全部变成H2O。
极短时间内
然而事实并非如此,为什么呢?
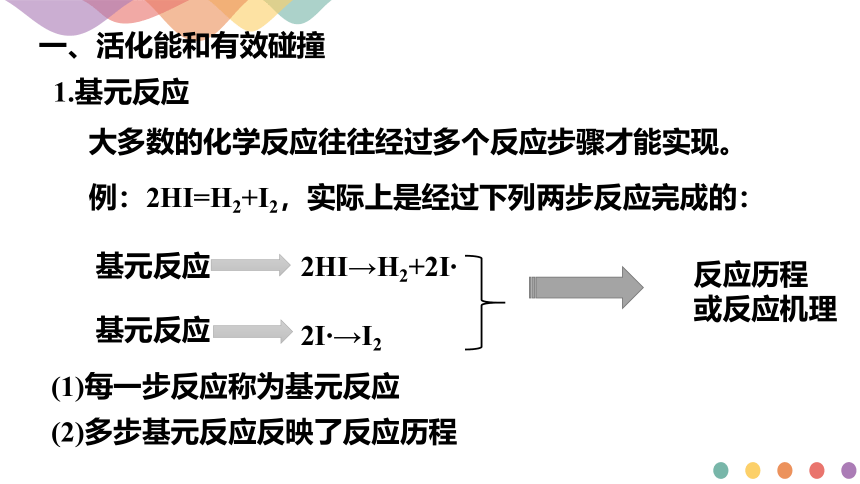
大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。
要发生反应,对于碰撞也是有要求的。
2HI→H2+2I
2I →I2
例:2HI=H2+I2,实际上是经过下列两步反应完成的:
基元反应
基元反应
反应历程
或反应机理
(1)每一步反应称为基元反应
(2)多步基元反应反映了反应历程
一、活化能和有效碰撞
1.基元反应
大多数的化学反应往往经过多个反应步骤才能实现。
(3)决定速率的步骤是最慢的一个基元反应
(4)基元反应发生的先决条件是反应物的分子必须发生碰撞
如:总反应:H2O2 + 2H+ +2Br-=Br2 + 2H2O
第一步:H2O2+H++Br-→HOBr+H2O (慢反应)
第二步:HOBr+Br-+H+ →Br2+H2O (快反应)
HBrO:中间产物或中间体
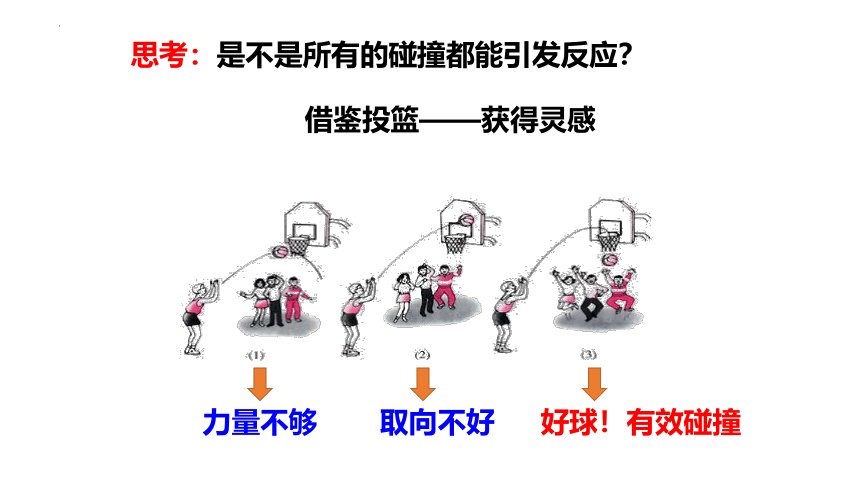
思考:是不是所有的碰撞都能引发反应?
力量不够
取向不好
好球!有效碰撞
借鉴投篮——获得灵感
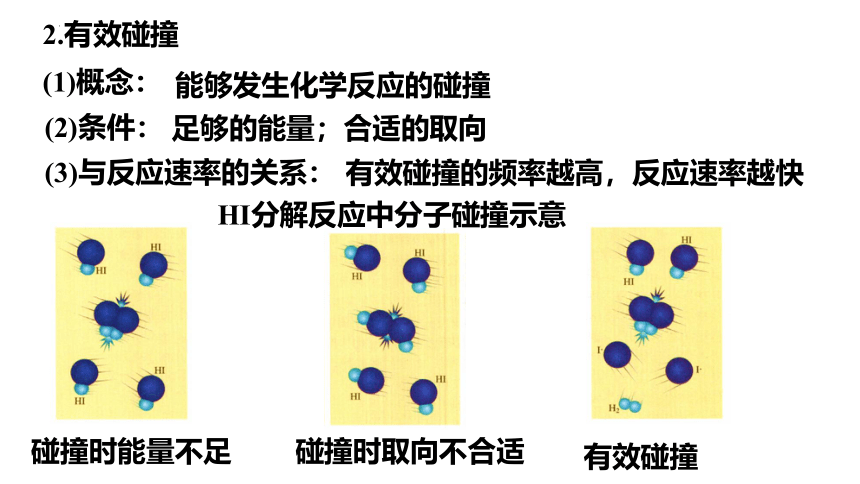
HI分解反应中分子碰撞示意
2.有效碰撞
碰撞时能量不足
碰撞时取向不合适
有效碰撞
能够发生化学反应的碰撞
足够的能量;合适的取向
有效碰撞的频率越高,反应速率越快
(1)概念:
(2)条件:
(3)与反应速率的关系:
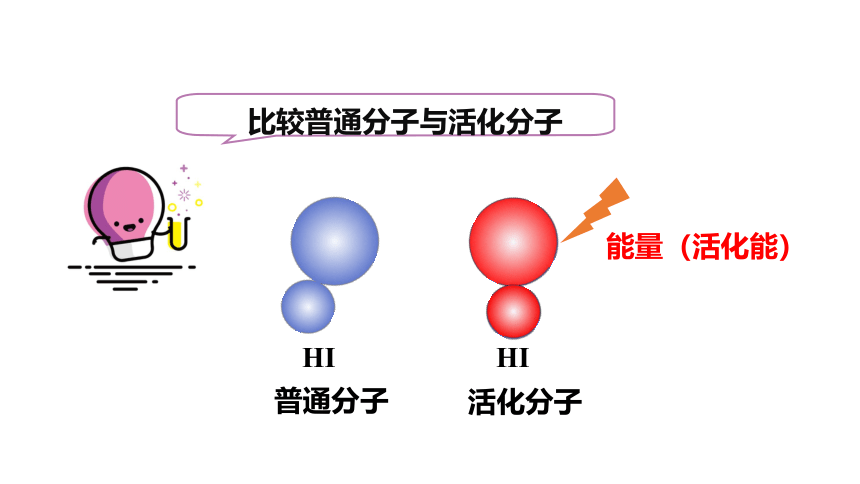
3.活化分子:
具有足够能量,能够发生有效碰撞的分子
注意:
(1)发生有效碰撞的分子一定是活化分子;
(2)活化分子的碰撞不一定是有效碰撞(由于取向问题)
(3)其他条件不变时,同一反应活化分子在反应物中所占的百分数是一定的。
(4)有效碰撞的次数与单位体积内活化分子数有关。
HI
HI
能量(活化能)
普通分子
活化分子
比较普通分子与活化分子
4.活化能
活化分子具有的平均能量与反应物分子具有的平均能量之差
活化能(正反应的活化能)
活化分子变成生成物分子放出的能量(逆反应活化能)
反应热(ΔH)
E1:
E2:
E1﹣E2:
注意:
(1)活化能越小,普通分子就越容易变成活化分子。
(2)活化能和反应速率的关系:
活化能越低,单位体积内活化分子数越多,单位时间内有效碰撞的次数就越多,化学反应速率越快。
活化分子百分数 =
活化分子数
反应物分子数
×100%
(3)活化分子百分数的判断
新物质
一个反应经历的过程:
普通
分子
活化能
活化
分子
合理取向
的碰撞
有效
碰撞
能量
学习小结
影响 外因 单位体积内 有效碰撞 次数 化学反应速率
分子总数 活化分子数 活化分子百分数
增大浓度
增加
增加
增加
加快
不变
二、用有效碰撞理论解释外界条件对化学反应速率的影响
1.浓度的影响
注意:对于固体或纯液体,反应速率与接触面积有关
1.将盐酸滴到碳酸钠粉末上,能使反应的最初速率加快的是( )
A.盐酸浓度增加一倍,用量减至1/2
B.盐酸浓度不变,使用量增大一倍
C.增大Na2CO3粉末的量
2.用铁片与稀硫酸反应制取H2时,下列措施不能使H2生成速率加大的是( )
A.加热
B.不用稀硫酸,改用98%的浓硫酸
C.滴加少量CuSO4溶液
D.不用铁片,改用铁粉
A
B
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数
增大压强
增加
增加
增加
加快
不变
2.压强的影响
对气体来说,增大压强即增加反应物的浓度
3.反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大
AC
影响 外因 分子总数 活化分子数 活化分子百分数 有效碰撞次数 化学反应速率
升高温度
不变
增加
增加
加快
增加
3.温度的影响
次要原因:
温度升高,分子运动速度加快,碰撞次数增多,反应速率增大。
影响 外因 分子总数 活化分子数 活化分子百分数 有效碰撞次数 化学反应速率
催化剂
不变
增加
增加
加快
增加
4.催化剂的影响
催化剂改变反应的路径,降低反应的活化能,但反应热没变。
4.参照反应Br2 + H2 → HBr 的能量对反应历程的示意图,下列叙述中正确的( )
A. 正反应为放热反应
B. 加入催化剂,该化学反应的反应热不改变
C. 正反应为放热反应
D. 加入催化剂可增大正反应速率,降低逆反应速率
B
能量kJ/mol
反应历程
Br2 + H2
HBr
E1
E2
5.①增大反应物的浓度使反应速率加快的主要原因( )
②对于气体参与体系增大压强使反应速率加快的主要原因是( )
③升高温度使反应速率加快的主要原因是( )
④使用催化剂使反应速率加快的主要原因是( )
A.活化分子百分数不变,但提高单位体积内活化分子的总数
B.增大分子的运动速率而使有效碰撞增加
C.升高反应物分子的能量,使活化分子的百分数增加
D.降低反应所需的能量,使活化分子百分数增加
A
A
C
D
学习小结
用有效碰撞理论解释外界条件对化学反应速率的影响
第二章 化学反应速率与化学平衡
第一节 化学反应速率
第3课时 活化能
2 mol H2和1 mol O2混合于一个洁净的容器内,已知常温常压下,每个氢分子和氧分子自身或它们之间每秒钟平均碰撞2.355×1010次,如果每一次碰撞都能够引发反应,试想会有什么样的现象?
如果每一次碰撞都能引发反应,整个容器中的H2和O2将在极短的时间内全部变成H2O。
极短时间内
然而事实并非如此,为什么呢?
大多数化学反应并不是经过简单碰撞就能完成的,而往往经过多个反应步骤才能实现。
要发生反应,对于碰撞也是有要求的。
2HI→H2+2I
2I →I2
例:2HI=H2+I2,实际上是经过下列两步反应完成的:
基元反应
基元反应
反应历程
或反应机理
(1)每一步反应称为基元反应
(2)多步基元反应反映了反应历程
一、活化能和有效碰撞
1.基元反应
大多数的化学反应往往经过多个反应步骤才能实现。
(3)决定速率的步骤是最慢的一个基元反应
(4)基元反应发生的先决条件是反应物的分子必须发生碰撞
如:总反应:H2O2 + 2H+ +2Br-=Br2 + 2H2O
第一步:H2O2+H++Br-→HOBr+H2O (慢反应)
第二步:HOBr+Br-+H+ →Br2+H2O (快反应)
HBrO:中间产物或中间体
思考:是不是所有的碰撞都能引发反应?
力量不够
取向不好
好球!有效碰撞
借鉴投篮——获得灵感
HI分解反应中分子碰撞示意
2.有效碰撞
碰撞时能量不足
碰撞时取向不合适
有效碰撞
能够发生化学反应的碰撞
足够的能量;合适的取向
有效碰撞的频率越高,反应速率越快
(1)概念:
(2)条件:
(3)与反应速率的关系:
3.活化分子:
具有足够能量,能够发生有效碰撞的分子
注意:
(1)发生有效碰撞的分子一定是活化分子;
(2)活化分子的碰撞不一定是有效碰撞(由于取向问题)
(3)其他条件不变时,同一反应活化分子在反应物中所占的百分数是一定的。
(4)有效碰撞的次数与单位体积内活化分子数有关。
HI
HI
能量(活化能)
普通分子
活化分子
比较普通分子与活化分子
4.活化能
活化分子具有的平均能量与反应物分子具有的平均能量之差
活化能(正反应的活化能)
活化分子变成生成物分子放出的能量(逆反应活化能)
反应热(ΔH)
E1:
E2:
E1﹣E2:
注意:
(1)活化能越小,普通分子就越容易变成活化分子。
(2)活化能和反应速率的关系:
活化能越低,单位体积内活化分子数越多,单位时间内有效碰撞的次数就越多,化学反应速率越快。
活化分子百分数 =
活化分子数
反应物分子数
×100%
(3)活化分子百分数的判断
新物质
一个反应经历的过程:
普通
分子
活化能
活化
分子
合理取向
的碰撞
有效
碰撞
能量
学习小结
影响 外因 单位体积内 有效碰撞 次数 化学反应速率
分子总数 活化分子数 活化分子百分数
增大浓度
增加
增加
增加
加快
不变
二、用有效碰撞理论解释外界条件对化学反应速率的影响
1.浓度的影响
注意:对于固体或纯液体,反应速率与接触面积有关
1.将盐酸滴到碳酸钠粉末上,能使反应的最初速率加快的是( )
A.盐酸浓度增加一倍,用量减至1/2
B.盐酸浓度不变,使用量增大一倍
C.增大Na2CO3粉末的量
2.用铁片与稀硫酸反应制取H2时,下列措施不能使H2生成速率加大的是( )
A.加热
B.不用稀硫酸,改用98%的浓硫酸
C.滴加少量CuSO4溶液
D.不用铁片,改用铁粉
A
B
影响 外因 单位体积内 有效碰撞次数 化学反应速率
分子总数 活化分子数 活化分子百分数
增大压强
增加
增加
增加
加快
不变
2.压强的影响
对气体来说,增大压强即增加反应物的浓度
3.反应C(s)+H2O(g) CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
A.增加C的量
B.将容器的体积缩小一半
C.保持体积不变,充入N2使体系压强增大
D.保持压强不变,充入N2使容器体积变大
AC
影响 外因 分子总数 活化分子数 活化分子百分数 有效碰撞次数 化学反应速率
升高温度
不变
增加
增加
加快
增加
3.温度的影响
次要原因:
温度升高,分子运动速度加快,碰撞次数增多,反应速率增大。
影响 外因 分子总数 活化分子数 活化分子百分数 有效碰撞次数 化学反应速率
催化剂
不变
增加
增加
加快
增加
4.催化剂的影响
催化剂改变反应的路径,降低反应的活化能,但反应热没变。
4.参照反应Br2 + H2 → HBr 的能量对反应历程的示意图,下列叙述中正确的( )
A. 正反应为放热反应
B. 加入催化剂,该化学反应的反应热不改变
C. 正反应为放热反应
D. 加入催化剂可增大正反应速率,降低逆反应速率
B
能量kJ/mol
反应历程
Br2 + H2
HBr
E1
E2
5.①增大反应物的浓度使反应速率加快的主要原因( )
②对于气体参与体系增大压强使反应速率加快的主要原因是( )
③升高温度使反应速率加快的主要原因是( )
④使用催化剂使反应速率加快的主要原因是( )
A.活化分子百分数不变,但提高单位体积内活化分子的总数
B.增大分子的运动速率而使有效碰撞增加
C.升高反应物分子的能量,使活化分子的百分数增加
D.降低反应所需的能量,使活化分子百分数增加
A
A
C
D
学习小结
用有效碰撞理论解释外界条件对化学反应速率的影响
