安徽省无为襄安高级中学2022-2023学年高二上学期8月开学考试化学试卷(Word版含答案)
文档属性
| 名称 | 安徽省无为襄安高级中学2022-2023学年高二上学期8月开学考试化学试卷(Word版含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 327.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-29 00:00:00 | ||
图片预览




文档简介
无为襄安高级中学2022-2023学年高二上学期8月开学考试
化学试卷
本试卷满分100分,考试时间75分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在本试卷和答题卡上。
2.答题时用0.5黑色中性笔将答案写在答题卡上,未在试卷答题卡上作答的试卷一律无效。
3.考试结束后,上交答题卡。
可能用到的相对原子质量:H-1,O-16,C-12,N-14,Ca-40,Cu-64
第Ⅰ卷 选择题(共44分)
选择题 (本题共14题,每题只有1个符合题意的正确选项,共28分)
化学与我们人类生活密切相关,下列有关说法正确的是( )
A “温室效应”“酸雨”的形成都与氮氧化合物有关
B 选用不含氮、磷的洗涤剂防止蓝藻污染
C “煤的干馏”和“石油的分馏”都是通过化学变化对资源进行整合利用
D 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
下列有关说法不正确的是( )
2022年北京冬奥会吉祥物“冰墩墩”使用的聚乙烯属于高分子材料
用体积分数为75%的酒精可以使蛋白质发生凝固变性
可以用纯碱溶液洗涤餐具上的油污
用米汤(含淀粉)可以检验食盐中的碘元素
3、据报道,科学家通过对稻壳进行控制性焚烧热解,从中提取到一种叫作生物质纳米结构二氧化硅的超高活性材料。下列关于二氧化硅的说法中正确的是( )
A.二氧化硅溶于水显酸性,所以二氧化硅属于酸性氧化物
B.将二氧化碳通入硅酸钠溶液可以得到硅酸
C.因为高温时二氧化硅能与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强
D.二氧化硅是酸性氧化物,它不溶于任何酸
4、某有机物的结构简式如图,下列关于该有机物的说法正确的是:( )
A.该有机物能发生取代反应、加成反应、氧化反应和加聚反应
B.1 mol该有机物能与3 mol Na发生反应
C.分子中含有两种官能团
D.该有机物中六元环上的一氯代物为2种
5、 NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.标准状况下,11.2 L苯中含有分子的数目为0.5NA
B . 1molC5H12分子中共价键总数为17NA
C.1 mol甲基(-14CD3)所含的中子数和电子数分别为11NA、9NA
1 mol乙酸(忽略挥发损失)与足量的C2HOH在浓硫酸作用下加热,充分反应可生成NA个CH3CO18OC2H5分子
6.化学反应H2(g)+Cl2(g)===2HCl(g)的能量变化如图所示,则下列说法中正确的是( )
A.该反应是吸热反应,吸收的热量为(y-x)kJ
B.断裂1 mol H—H键和1 mol Cl—Cl键时能放出x kJ的能量
C.断裂2 mol H—Cl键时需要吸收y kJ的能量
D.2 mol HCl(g)的总能量高于1 mol H2(g)和1 mol Cl2(g)的总能量
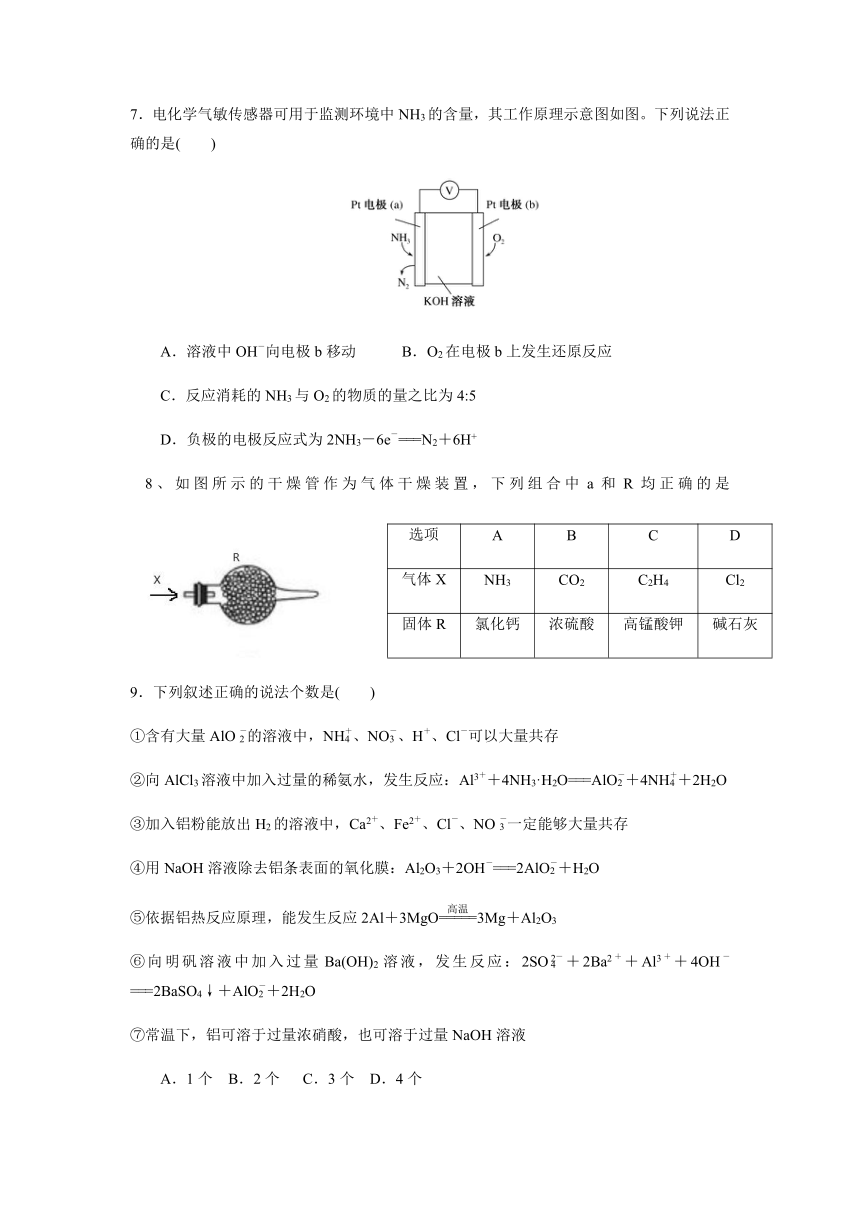
7.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图。下列说法正确的是( )
溶液中OH-向电极b移动 B.O2在电极b上发生还原反应
C.反应消耗的NH3与O2的物质的量之比为4:5
D.负极的电极反应式为2NH3-6e-===N2+6H+
选项 A B C D
气体X NH3 CO2 C2H4 Cl2
固体R 氯化钙 浓硫酸 高锰酸钾 碱石灰
8、如图所示的干燥管作为气体干燥装置,下列组合中a和R均正确的是
9.下列叙述正确的说法个数是( )
①含有大量AlO的溶液中,NH、NO、H+、Cl-可以大量共存
②向AlCl3溶液中加入过量的稀氨水,发生反应:Al3++4NH3·H2O===AlO+4NH+2H2O
③加入铝粉能放出H2的溶液中,Ca2+、Fe2+、Cl-、NO一定能够大量共存
④用NaOH溶液除去铝条表面的氧化膜:Al2O3+2OH-===2AlO+H2O
⑤依据铝热反应原理,能发生反应2Al+3MgO3Mg+Al2O3
⑥向明矾溶液中加入过量Ba(OH)2溶液,发生反应:2SO+2Ba2++Al3++4OH-===2BaSO4↓+AlO+2H2O
⑦常温下,铝可溶于过量浓硝酸,也可溶于过量NaOH溶液
A.1个 B.2个 C.3个 D.4个
10.在一定温度下的恒容密闭容器中,当下列物理量不再发生变化时,表明反应A(s)+3B(g)2C(g)+D(g)已达平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④气体的总物质的量 ⑤混合气体的平均相对分子质量
A.①③⑤ B.①④⑤ C. ②③④ D.②③⑤
11、下列气体的制备和性质实验中,由现象得出的结论不正确的是( )
选项 试剂 试纸或试液 现象 结论
A 浓氨水、生石灰 蓝色石蕊试纸 变红 NH3为碱性气体
B 浓盐酸、浓硫酸 pH试纸 变红 HCl为酸性气体
C 浓盐酸、高锰酸钾 淀粉碘化钾试液 变蓝 Cl2具有氧化性
D 亚硫酸钠、硫酸 品红试液 褪色 SO2具有漂白性
12、已知:三元轴烯(a)、四元轴烯(b)、五元轴烯(c)的最简式都与苯相同,下列说法不正确的是( )
A.三种物质都能发生加成反应 B.a、b分子中所有原子都在同一平面上
C.a与互为同分异构体D.a、b的一氯代物均只有一种,c的一氯代物有三种
13.海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示。下列说法错误的是( )
A.试剂1可以选用石灰乳
B.从苦卤中提取Br2的反应的离子方程式为2Br-+Cl2===2Cl-+Br2
C.若将粗盐中的氯化钠进行分离和提纯,用到过滤和蒸发操作
D.工业上冶炼金属镁,可将Mg(OH)2转化成MgO,再电解熔融MgO制备金属镁
14、将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1的稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
选择题 (本题共4题,每题有1-2个符合题意的正确选项,选项完全正确得4分,有2个正确选项少选得2分,错选得0分,共16分)
15、随着原子序数的递增,八种短周期元素(x~h)原子半径的相对大小、最高正价或最低负价的变化如下图所示。下列说法错误的是( )
A.h形成的酸比y形成的酸的酸性强,由此可以推出非金属性:h>y
B.d元素常见离子的半径大于f元素常见离子的半径
C.x、z元素只能组成ZX3共价化合物,其电子式可以表示为
D.g的最高价氧化物对应的水化物可以和f的单质、氧化物和氢氧化物反应
16、食品、大气、工业尾气中SO2均需严格检测或转化吸收,下列有关SO2的检测或吸收方法正确的是( )
A.滴定法:用酸性KMnO4溶液滴定葡萄酒试样以测定葡萄酒中SO2的浓度
B.沉淀法:用Ba(OH)2溶液沉淀SO2,然后将沉淀在空气中洗涤、过滤、干燥、称重以测定大气中SO2的浓度
C.氨酸法:用氨水吸收尾气中的SO2后再将吸收液与硫酸反应,将富集后的SO2循环使用
D.石灰—石膏法:常温下用石灰石吸收尾气中的SO2得到CaSO3,再经氧化可用于生产石膏
17、从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4,下列说法正确的是 ( )
A . FeS2既是氧化剂又是还原剂
B Cu2S既是氧化产物又是还原产物
C 5molFeS2发生反应,有14mol电子转移
D 产物中的SO42-离子有一部分是氧化产物
18.可逆反应mA(g)+nB(g)pC(g)+qD(g)的v t图像如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v t图像如图乙所示。
①a1=a2 ②a1t2 ⑥t1=t2
⑦两图中阴影部分面积相等 ⑧图乙中阴影部分面积更大
以上所述正确的为( )
②④⑤⑦ B.②④⑥⑧ C.②③⑤⑦ D.②③⑥⑧
第Ⅱ卷 填空题(共56分)
19.(每空2分,共14分)大气中的部分碘源于O3对海水中I-的氧化。某科学小组进行O3与含I-溶液反应相关研究。
(1)O3将I-氧化生成I2的过程由3步反应组成:
①I-(aq)+O3(g)===IO-(aq)+O2(g)
②IO-(aq)+H+(aq)HOI(aq)
③HOI(aq)+I-(aq)+H+(aq)I2(aq)+H2O(l) 写出O3氧化I-生成I2的化学方程式
_______________________________________________________________。
(2)O3在水中易分解,在一定条件下,O3的浓度减少一半时所需的时间(t)如下表所示。已知:O3的起始浓度为0.021 6 mol·L-1。
pH t/min T/℃ 3.0 4.0 5.0 6.0
20 301 231 169 58
30 158 108 48 15
50 31 35 15 7
①在30 ℃、pH=4.0条件下,O3的分解速率为________ mol·L-1·min-1。
②pH增大能加速O3分解,表明对O3分解起催化作用的是________。
③根据表中数据,推测O3在下列条件下分解速率依次增大的顺序为________(填字母代号)。 a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0
(3)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。
①放电过程中,Cl-向________填(“负极”或“正极”)移动。
②正极电极方程式为______________________________________________。
③电路中每转移0.3 mol电子,理论上会消耗_______g Ca。
(每空2分,共14分)NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为
_____________________________________________________________________
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的原因是(写化学方程式)_____________________________________________________。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始时,可以在U形管右端观察到无色的NO气体。长玻璃管的作用是________________________________________________________________________。
(4)假设实验中12.8 g Cu全部溶解,需要通入标准状况下________L O2才能使NO全部溶于水。
(5)用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”“乙”“丙”或“丁”),理由是
________________________________________________________________________
________________________________________________________________________。
甲:铜硝酸铜 乙:铜硝酸铜
丙:铜氯化铜硝酸铜
丁:铜氧化铜硝酸铜
21. (共14分) 燃烧法可测定有机化合物的组成。某同学把4.48 L(标况下)某有机物蒸气在O2中充分燃烧后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8 mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
实验结束后发现无水CuSO4变蓝,干燥管和洗气瓶共增重18 g,澄清石灰水变浑浊后又恰好变澄清。请根据实验回答下列问题:
(1) O2要过量的原因是:________。
(2) 若该有机物只含C、H两种元素,且不含任何官能团,也不含脂环,则该有机物的分子式为________,它可能属于________(填序号)。
A.烷烃 B.苯的同系物 C.芳香烃 D.烃的衍生物
该物质可能的结构简式为________。(4分)
(3) 若在上述有机物分子组成的基础上多含有一个氧原子,且能与氧气反应生成醛,写出这种新的有机物的结构简式____________和与氧气反应生成醛的化学方程式________________________________ 。
22.(14分)如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
装置A中盛放70%硫酸的实验仪器名称为_______________,写出装置A中发生的化学方程式___________________________________________________________。(共3分)
B中试剂X是________,装置D中盛放NaOH溶液的作用是_________________________________。(共3分)
(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的方法是__________________________________________________,并写出SO2与Na2O2反应的化学方程式_________________________________________________。
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,能说明I-还原性弱于SO2的现象为______________________________________________________________________;
发生反应的离子方程式是______________________________________________________。
第Ⅰ卷 选择题答题卡
题号 1 2 3 4 5 6 7
选项
题号 8 9 10 11 12 13 14
选项
题号 15 16 17 18
选项
参考答案
第Ⅰ卷 选择题
题号 1 2 3 4 5 6 7
选项 B D B A C C B
题号 8 9 10 11 12 13 14
选项 B B B A D D C
题号 15 16 17 18
选项 AC CD AD C
(1)2I-+2H++O3 = I2+ O2+H2O (2)①1×10-4 mol·L-1·min-1。②OH-③bac
①负极②PbSO4+2Li++2e-=Li2SO4+Pb ③6.0
20.(1)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O (2)2NO+O2=2NO2
(3)接收被气体压出U形管的液体,防止稀硝酸溢出 (4)2.24L
(5)丁 制取相同质量的硝酸铜丁消耗的硝酸的量最少且不产生污染气体。
21.(1)保证有机物充分反应
(2)
略
22(1)分液漏斗,Na2SO3+H2SO4(70%)=Na2SO4+SO2↑+H2O
浓硫酸,吸收剩余SO2气体,防止污染
(3)用带火星的木条防止D试管口,SO2+Na2O2=Na2SO4
(4)E中溶液蓝色褪去 SO2+I2+2H2O=2I-+SO42-+4H+
化学试卷
本试卷满分100分,考试时间75分钟。
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在本试卷和答题卡上。
2.答题时用0.5黑色中性笔将答案写在答题卡上,未在试卷答题卡上作答的试卷一律无效。
3.考试结束后,上交答题卡。
可能用到的相对原子质量:H-1,O-16,C-12,N-14,Ca-40,Cu-64
第Ⅰ卷 选择题(共44分)
选择题 (本题共14题,每题只有1个符合题意的正确选项,共28分)
化学与我们人类生活密切相关,下列有关说法正确的是( )
A “温室效应”“酸雨”的形成都与氮氧化合物有关
B 选用不含氮、磷的洗涤剂防止蓝藻污染
C “煤的干馏”和“石油的分馏”都是通过化学变化对资源进行整合利用
D 高纯度的硅单质广泛用于制作光导纤维,光导纤维遇强碱会“断路”
下列有关说法不正确的是( )
2022年北京冬奥会吉祥物“冰墩墩”使用的聚乙烯属于高分子材料
用体积分数为75%的酒精可以使蛋白质发生凝固变性
可以用纯碱溶液洗涤餐具上的油污
用米汤(含淀粉)可以检验食盐中的碘元素
3、据报道,科学家通过对稻壳进行控制性焚烧热解,从中提取到一种叫作生物质纳米结构二氧化硅的超高活性材料。下列关于二氧化硅的说法中正确的是( )
A.二氧化硅溶于水显酸性,所以二氧化硅属于酸性氧化物
B.将二氧化碳通入硅酸钠溶液可以得到硅酸
C.因为高温时二氧化硅能与碳酸钠反应放出二氧化碳,所以硅酸的酸性比碳酸强
D.二氧化硅是酸性氧化物,它不溶于任何酸
4、某有机物的结构简式如图,下列关于该有机物的说法正确的是:( )
A.该有机物能发生取代反应、加成反应、氧化反应和加聚反应
B.1 mol该有机物能与3 mol Na发生反应
C.分子中含有两种官能团
D.该有机物中六元环上的一氯代物为2种
5、 NA表示阿伏加德罗常数,下列叙述中正确的是 ( )
A.标准状况下,11.2 L苯中含有分子的数目为0.5NA
B . 1molC5H12分子中共价键总数为17NA
C.1 mol甲基(-14CD3)所含的中子数和电子数分别为11NA、9NA
1 mol乙酸(忽略挥发损失)与足量的C2HOH在浓硫酸作用下加热,充分反应可生成NA个CH3CO18OC2H5分子
6.化学反应H2(g)+Cl2(g)===2HCl(g)的能量变化如图所示,则下列说法中正确的是( )
A.该反应是吸热反应,吸收的热量为(y-x)kJ
B.断裂1 mol H—H键和1 mol Cl—Cl键时能放出x kJ的能量
C.断裂2 mol H—Cl键时需要吸收y kJ的能量
D.2 mol HCl(g)的总能量高于1 mol H2(g)和1 mol Cl2(g)的总能量
7.电化学气敏传感器可用于监测环境中NH3的含量,其工作原理示意图如图。下列说法正确的是( )
溶液中OH-向电极b移动 B.O2在电极b上发生还原反应
C.反应消耗的NH3与O2的物质的量之比为4:5
D.负极的电极反应式为2NH3-6e-===N2+6H+
选项 A B C D
气体X NH3 CO2 C2H4 Cl2
固体R 氯化钙 浓硫酸 高锰酸钾 碱石灰
8、如图所示的干燥管作为气体干燥装置,下列组合中a和R均正确的是
9.下列叙述正确的说法个数是( )
①含有大量AlO的溶液中,NH、NO、H+、Cl-可以大量共存
②向AlCl3溶液中加入过量的稀氨水,发生反应:Al3++4NH3·H2O===AlO+4NH+2H2O
③加入铝粉能放出H2的溶液中,Ca2+、Fe2+、Cl-、NO一定能够大量共存
④用NaOH溶液除去铝条表面的氧化膜:Al2O3+2OH-===2AlO+H2O
⑤依据铝热反应原理,能发生反应2Al+3MgO3Mg+Al2O3
⑥向明矾溶液中加入过量Ba(OH)2溶液,发生反应:2SO+2Ba2++Al3++4OH-===2BaSO4↓+AlO+2H2O
⑦常温下,铝可溶于过量浓硝酸,也可溶于过量NaOH溶液
A.1个 B.2个 C.3个 D.4个
10.在一定温度下的恒容密闭容器中,当下列物理量不再发生变化时,表明反应A(s)+3B(g)2C(g)+D(g)已达平衡状态的是( )
①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度
④气体的总物质的量 ⑤混合气体的平均相对分子质量
A.①③⑤ B.①④⑤ C. ②③④ D.②③⑤
11、下列气体的制备和性质实验中,由现象得出的结论不正确的是( )
选项 试剂 试纸或试液 现象 结论
A 浓氨水、生石灰 蓝色石蕊试纸 变红 NH3为碱性气体
B 浓盐酸、浓硫酸 pH试纸 变红 HCl为酸性气体
C 浓盐酸、高锰酸钾 淀粉碘化钾试液 变蓝 Cl2具有氧化性
D 亚硫酸钠、硫酸 品红试液 褪色 SO2具有漂白性
12、已知:三元轴烯(a)、四元轴烯(b)、五元轴烯(c)的最简式都与苯相同,下列说法不正确的是( )
A.三种物质都能发生加成反应 B.a、b分子中所有原子都在同一平面上
C.a与互为同分异构体D.a、b的一氯代物均只有一种,c的一氯代物有三种
13.海洋约占地球表面积的71%,对其进行开发利用的部分流程如图所示。下列说法错误的是( )
A.试剂1可以选用石灰乳
B.从苦卤中提取Br2的反应的离子方程式为2Br-+Cl2===2Cl-+Br2
C.若将粗盐中的氯化钠进行分离和提纯,用到过滤和蒸发操作
D.工业上冶炼金属镁,可将Mg(OH)2转化成MgO,再电解熔融MgO制备金属镁
14、将0.4 g NaOH和1.06 g Na2CO3混合并配成溶液,向溶液中滴加0.1 mol·L-1的稀盐酸。下列图像能正确表示加入盐酸的体积和生成CO2的物质的量的关系的是( )
选择题 (本题共4题,每题有1-2个符合题意的正确选项,选项完全正确得4分,有2个正确选项少选得2分,错选得0分,共16分)
15、随着原子序数的递增,八种短周期元素(x~h)原子半径的相对大小、最高正价或最低负价的变化如下图所示。下列说法错误的是( )
A.h形成的酸比y形成的酸的酸性强,由此可以推出非金属性:h>y
B.d元素常见离子的半径大于f元素常见离子的半径
C.x、z元素只能组成ZX3共价化合物,其电子式可以表示为
D.g的最高价氧化物对应的水化物可以和f的单质、氧化物和氢氧化物反应
16、食品、大气、工业尾气中SO2均需严格检测或转化吸收,下列有关SO2的检测或吸收方法正确的是( )
A.滴定法:用酸性KMnO4溶液滴定葡萄酒试样以测定葡萄酒中SO2的浓度
B.沉淀法:用Ba(OH)2溶液沉淀SO2,然后将沉淀在空气中洗涤、过滤、干燥、称重以测定大气中SO2的浓度
C.氨酸法:用氨水吸收尾气中的SO2后再将吸收液与硫酸反应,将富集后的SO2循环使用
D.石灰—石膏法:常温下用石灰石吸收尾气中的SO2得到CaSO3,再经氧化可用于生产石膏
17、从矿物学资料查得,一定条件下自然界存在如下反应:
14CuSO4+5FeS2+12H2O═7Cu2S+5FeSO4+12H2SO4,下列说法正确的是 ( )
A . FeS2既是氧化剂又是还原剂
B Cu2S既是氧化产物又是还原产物
C 5molFeS2发生反应,有14mol电子转移
D 产物中的SO42-离子有一部分是氧化产物
18.可逆反应mA(g)+nB(g)pC(g)+qD(g)的v t图像如图甲所示,若其他条件都不变,只是在反应前加入合适的催化剂,则其v t图像如图乙所示。
①a1=a2 ②a1
⑦两图中阴影部分面积相等 ⑧图乙中阴影部分面积更大
以上所述正确的为( )
②④⑤⑦ B.②④⑥⑧ C.②③⑤⑦ D.②③⑥⑧
第Ⅱ卷 填空题(共56分)
19.(每空2分,共14分)大气中的部分碘源于O3对海水中I-的氧化。某科学小组进行O3与含I-溶液反应相关研究。
(1)O3将I-氧化生成I2的过程由3步反应组成:
①I-(aq)+O3(g)===IO-(aq)+O2(g)
②IO-(aq)+H+(aq)HOI(aq)
③HOI(aq)+I-(aq)+H+(aq)I2(aq)+H2O(l) 写出O3氧化I-生成I2的化学方程式
_______________________________________________________________。
(2)O3在水中易分解,在一定条件下,O3的浓度减少一半时所需的时间(t)如下表所示。已知:O3的起始浓度为0.021 6 mol·L-1。
pH t/min T/℃ 3.0 4.0 5.0 6.0
20 301 231 169 58
30 158 108 48 15
50 31 35 15 7
①在30 ℃、pH=4.0条件下,O3的分解速率为________ mol·L-1·min-1。
②pH增大能加速O3分解,表明对O3分解起催化作用的是________。
③根据表中数据,推测O3在下列条件下分解速率依次增大的顺序为________(填字母代号)。 a.40 ℃、pH=3.0 b.10 ℃、pH=4.0 c.30 ℃、pH=7.0
(3)PbSO4热激活电池可用作火箭、导弹的工作电源。基本结构如图所示,其中作为电解质的无水LiCl-KCl混合物受热熔融后,电池即可瞬间输出电能。该电池总反应为PbSO4+2LiCl+Ca===CaCl2+Li2SO4+Pb。
①放电过程中,Cl-向________填(“负极”或“正极”)移动。
②正极电极方程式为______________________________________________。
③电路中每转移0.3 mol电子,理论上会消耗_______g Ca。
(每空2分,共14分)NO很容易与许多分子迅速发生反应,科学家发现在生物体中不断地产生NO,用于在细胞和细胞间传递信息;NO还参与心血管系统、免疫系统以及中枢和外围神经系统的调控。
(1)实验室用金属铜和稀硝酸制取NO的离子方程式为
_____________________________________________________________________
(2)NO是有毒气体,某学生为防止污染,用分液漏斗和烧杯装配了一套简易的、能随开随用、随关随停的NO气体发生装置,如图甲所示。
打开分液漏斗的活塞使反应进行,在分液漏斗中实际看到的气体是红棕色的原因是(写化学方程式)_____________________________________________________。
(3)为证明铜丝与稀硝酸反应生成的确实是NO,某学生另设计了一套如图乙所示的装置制取NO。反应开始时,可以在U形管右端观察到无色的NO气体。长玻璃管的作用是________________________________________________________________________。
(4)假设实验中12.8 g Cu全部溶解,需要通入标准状况下________L O2才能使NO全部溶于水。
(5)用金属铜制取硝酸铜,从节约原料和防止环境污染的角度考虑,下列4种方法中最好的是________(填“甲”“乙”“丙”或“丁”),理由是
________________________________________________________________________
________________________________________________________________________。
甲:铜硝酸铜 乙:铜硝酸铜
丙:铜氯化铜硝酸铜
丁:铜氧化铜硝酸铜
21. (共14分) 燃烧法可测定有机化合物的组成。某同学把4.48 L(标况下)某有机物蒸气在O2中充分燃烧后让产物依次通过装有无水CuSO4的干燥管、盛有浓H2SO4的洗气瓶和盛有含0.8 mol Ca(OH)2的澄清石灰水的烧杯,如图所示:
实验结束后发现无水CuSO4变蓝,干燥管和洗气瓶共增重18 g,澄清石灰水变浑浊后又恰好变澄清。请根据实验回答下列问题:
(1) O2要过量的原因是:________。
(2) 若该有机物只含C、H两种元素,且不含任何官能团,也不含脂环,则该有机物的分子式为________,它可能属于________(填序号)。
A.烷烃 B.苯的同系物 C.芳香烃 D.烃的衍生物
该物质可能的结构简式为________。(4分)
(3) 若在上述有机物分子组成的基础上多含有一个氧原子,且能与氧气反应生成醛,写出这种新的有机物的结构简式____________和与氧气反应生成醛的化学方程式________________________________ 。
22.(14分)如图是在实验室进行二氧化硫制备与性质实验的组合装置,部分固定装置未画出。
装置A中盛放70%硫酸的实验仪器名称为_______________,写出装置A中发生的化学方程式___________________________________________________________。(共3分)
B中试剂X是________,装置D中盛放NaOH溶液的作用是_________________________________。(共3分)
(3)关闭弹簧夹2,打开弹簧夹1,注入硫酸至浸没三颈烧瓶中固体,检验SO2与Na2O2反应是否有氧气生成的方法是__________________________________________________,并写出SO2与Na2O2反应的化学方程式_________________________________________________。
(4)关闭弹簧夹1后,打开弹簧夹2,残余气体进入E、F中,能说明I-还原性弱于SO2的现象为______________________________________________________________________;
发生反应的离子方程式是______________________________________________________。
第Ⅰ卷 选择题答题卡
题号 1 2 3 4 5 6 7
选项
题号 8 9 10 11 12 13 14
选项
题号 15 16 17 18
选项
参考答案
第Ⅰ卷 选择题
题号 1 2 3 4 5 6 7
选项 B D B A C C B
题号 8 9 10 11 12 13 14
选项 B B B A D D C
题号 15 16 17 18
选项 AC CD AD C
(1)2I-+2H++O3 = I2+ O2+H2O (2)①1×10-4 mol·L-1·min-1。②OH-③bac
①负极②PbSO4+2Li++2e-=Li2SO4+Pb ③6.0
20.(1)3Cu+8H++2NO3-=3Cu2++2NO↑+4H2O (2)2NO+O2=2NO2
(3)接收被气体压出U形管的液体,防止稀硝酸溢出 (4)2.24L
(5)丁 制取相同质量的硝酸铜丁消耗的硝酸的量最少且不产生污染气体。
21.(1)保证有机物充分反应
(2)
略
22(1)分液漏斗,Na2SO3+H2SO4(70%)=Na2SO4+SO2↑+H2O
浓硫酸,吸收剩余SO2气体,防止污染
(3)用带火星的木条防止D试管口,SO2+Na2O2=Na2SO4
(4)E中溶液蓝色褪去 SO2+I2+2H2O=2I-+SO42-+4H+
同课章节目录
