黑龙江省黑河市第九中学2022-2023学年高三上学期8月底开学考试化学试题(Word版含答案)
文档属性
| 名称 | 黑龙江省黑河市第九中学2022-2023学年高三上学期8月底开学考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 256.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-30 15:31:50 | ||
图片预览


文档简介
黑河市第九中学2022-2023学年高三上学期8月底开学考试
化 学 试 题
考试范围:必修1前3章;考试时间:45分钟;考试时间:45分钟;命题人:栾厚福
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Si-28 Cl-35.5 Fe-56 Cu-64
第I卷(选择题,60分)
一、选择题(本题包括10道题,每题6分,只有1个合理答案。)
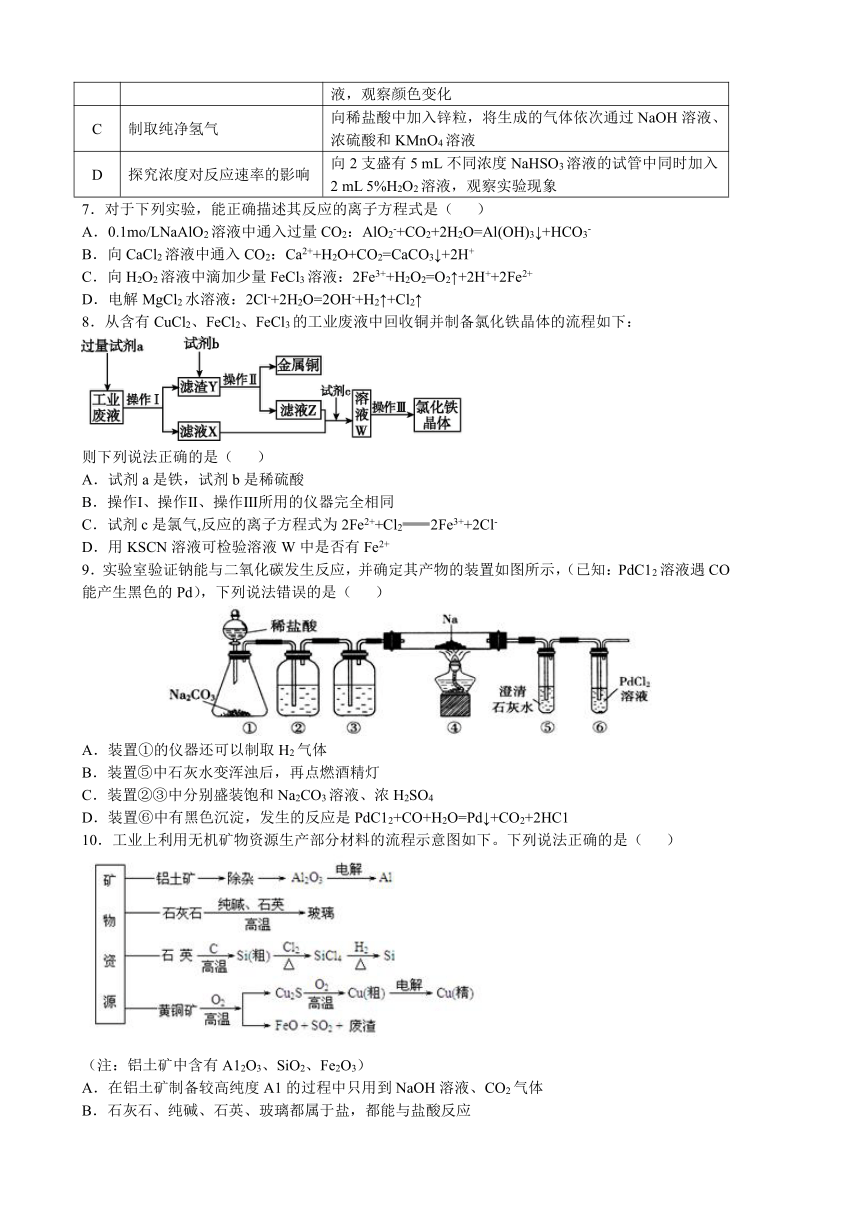
1.分类思想是研究化学的常用方法,下列分类叙述正确的是( )
A.既有单质参加又有单质生成的反应一定是氧化还原反应
B.淀粉、纤维素、油脂均属于天然高分子
C.根据丁达尔现象可以将分散系分为溶液、胶体和浊液
D.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
2.完成下列实验所选择的装置或仪器都正确的是( )
A B C D
实验 分离植物油和氯化钠溶液 除去氯化钠晶体中混有的氯化钾晶体 分离CCl4中的Br2 除去CO2气体中的HCl气体
装置 或仪器
3.第二架国产大型客机C919将在本月底实现首飞。C919机身部分采用第三代新型铝锂合金材料。下列关于铝锂合金的认识不正确的是( )
A.铝锂合金密度较小,强度较大,硬度大于纯铝,熔点低于锂单质
B.改变原料的配比,可以制得性能不同的铝锂合金
C.铝锂合金具有金属光泽,可导电导热
D.铝锂合金的性质与各成分金属的性质完全相同
4.设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A.22.0g T2O中含有的中子数为10NA
B.一定条件下,6.4g铜与过量的硫反应,转移电子数目为0.2NA
C.在标准状况下,2.8g N2和2.24L CO所含电子数均为1.4NA
D.标准状况下,22.4L CH2Cl2中含C-H键数为2NA
5.钯的化合物PdCl2通过化学反应可用来检测有毒气体CO,该反应的反应物与生成物有CO、Pd、H2O、HCl、PdCl2和一种未知物质X。下列说法错误的是( )
A.未知物质X为CO2,属于氧化产物
B.每转移1 mol e-时,生成2 mol X
C.反应中PdCl2作氧化剂,被还原
D.还原性:CO>Pd
6.下列实验过程可以达到实验目的的是( )
编号 实验目的 实验过程
A 配制0.4000 mol·L 1的NaOH溶液 称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,立即转移至250 mL容量瓶中定容
B 探究维生素C的还原性 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
C 制取纯净氢气 向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和KMnO4溶液
D 探究浓度对反应速率的影响 向2支盛有5 mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5%H2O2溶液,观察实验现象
7.对于下列实验,能正确描述其反应的离子方程式是( )
A.0.1mo/LNaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
B.向CaCl2溶液中通入CO2:Ca2++H2O+CO2=CaCO3↓+2H+
C.向H2O2溶液中滴加少量FeCl3溶液:2Fe3++H2O2=O2↑+2H++2Fe2+
D.电解MgCl2水溶液:2Cl-+2H2O=2OH-+H2↑+Cl2↑
8.从含有CuCl2、FeCl2、FeCl3的工业废液中回收铜并制备氯化铁晶体的流程如下:
则下列说法正确的是( )
A.试剂a是铁,试剂b是稀硫酸
B.操作Ⅰ、操作Ⅱ、操作Ⅲ所用的仪器完全相同
C.试剂c是氯气,反应的离子方程式为2Fe2++Cl22Fe3++2Cl-
D.用KSCN溶液可检验溶液W中是否有Fe2+
9.实验室验证钠能与二氧化碳发生反应,并确定其产物的装置如图所示,(已知:PdC12溶液遇CO能产生黑色的Pd),下列说法错误的是( )
A.装置①的仪器还可以制取H2气体
B.装置⑤中石灰水变浑浊后,再点燃酒精灯
C.装置②③中分别盛装饱和Na2CO3溶液、浓H2SO4
D.装置⑥中有黑色沉淀,发生的反应是PdC12+CO+H2O=Pd↓+CO2+2HC1
10.工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法正确的是( )
(注:铝土矿中含有A12O3、SiO2、Fe2O3)
A.在铝土矿制备较高纯度A1的过程中只用到NaOH溶液、CO2气体
B.石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C.在制粗硅时,氧化剂与还原剂的物质的量之比为1∶2
D.黄铜矿(CuFeS2)与O2反应产生的Cu2S、SO2均只是还原产物
选择题答案栏
题号 1 2 3 4 5 6 7 8 9 10
答案
第II卷(非选择题,40分)
二、非选择题(本题包括3道题,共计40分。)
11.(12分)高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用KMnO4固体来配制240 mL 0.1 mol L-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、__________。
②配制过程中玻璃棒所起的作用是_________。
③下列操作对实验结果的影响偏小的是______(填序号)。
a.加水定容时俯视刻度线
b.容量瓶内壁附有水珠而未干燥处理
c.若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶
d. 颠倒摇匀后发现凹液面低于刻度线又加水补上
(2)用上述酸性KMnO4溶液来制备氯气。
2KMnO4 +16HCl(浓)=2KCl + 2MnCl2 +5Cl2↑+8H2O
①反应中的氧化剂是_______,氧化产物是_________,HCl表现______性和_______性。
②若有73gHCl被氧化,则该反应转移的电子数目为___________。
12.(14分)某化学兴趣小组的同学进行三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O分解的实验探究。经小组讨论,他们设计了如下装置进行实验。烧瓶B中盛有饱和NH4Cl和饱和NaNO2混合液(常用于实验室制N2),干燥管C1中装有碱石灰。
(1)B中发生反应的化学方程式为______________________________________。
(2)C2的作用是_________________,C3中盛装的试剂是___________________。
(3)若实验中观察到E1、E4中的澄清石灰水均变浑浊,则E3中的现象是___________________,证明气体产物是___________________。
(4)实验装置中有2个酒精灯,先点燃A1,一段时间后,熄灭A1,关闭活塞a,再点燃A2,待D中的样品充分反应后,再次打开活塞a,点燃A1,则第二次点燃A1的理由是_________________
_______________________________________。
(5)该小组同学查阅资料后推知, D中固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。实验测得C2、C3共增重5.4g;将D中固体生成物溶于水,测得最后残余固体的质量为6.88g。通过计算,固体产物中铁元素的存在形式为______(需表示出产物的物质的量)。
若要通过实验研究上述结论,除3%H2O2、蒸馏水外,还需要下列试剂中的___________。
A.1.0 mol·L-1HNO3 B.1.0 mol·L-1盐酸 C.1.0 mol·L-1NaOH溶液
D.0.1 mol·L-1KI溶液 E.0.1 mol·L-1CuSO4溶液 F.20%KSCN溶液。
13.(14分)在Na+浓度为0.5 mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子。
阳离子 K+ Ag+ Mg2+ Ba2+
阴离子 NO3- CO32- SiO32- SO42-
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
序号 实验内容 实验结果
Ⅰ 向该溶液中加入足量稀盐酸 产生白色沉淀并放出标准状况下0.56 L气体
Ⅱ 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 固体质量为2.4 g
Ⅲ 向Ⅱ的滤液中滴加BaCl2溶液 无明显现象
请回答下列问题。
(1)实验Ⅰ能确定一定不存在的离子是___________________________。
(2)实验Ⅰ中生成沉淀的离子方程式为___________________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)_______________。
阴离子 NO3- CO32- SiO32- SO42-
c/(mol·L-1)
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由:_______________。
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 D A D C B B A C C C
11.250mL容量瓶 搅拌加速溶解、引流 cd KMnO4 Cl2 酸性 还原性 2NA
12.NH4Cl+NaNO2 ==N2↑+NaCl+2H2O 检验水蒸气 P2O5或CaCl2 溶液褪色(或变浅) CO2和CO 第二次点燃 A1,是利用生成的氮气将装置中残余的气体吹到后续装置,使其充分吸收 0.02mol Fe、0.08mol FeO BEF
13.Ag+、Mg2+、Ba2+、SO42- SiO32-+2H+=H2SiO3↓
阴离子 NO3- CO32- SiO32- SO42-
c/mol L-1 ? 0.25 0.4 0
存在,c(K+)最小值为0.8mol/L
化 学 试 题
考试范围:必修1前3章;考试时间:45分钟;考试时间:45分钟;命题人:栾厚福
可能用到的相对原子质量:H-1 C-12 N-14 O-16 Na-23 Si-28 Cl-35.5 Fe-56 Cu-64
第I卷(选择题,60分)
一、选择题(本题包括10道题,每题6分,只有1个合理答案。)
1.分类思想是研究化学的常用方法,下列分类叙述正确的是( )
A.既有单质参加又有单质生成的反应一定是氧化还原反应
B.淀粉、纤维素、油脂均属于天然高分子
C.根据丁达尔现象可以将分散系分为溶液、胶体和浊液
D.碱性氧化物一定是金属氧化物,金属氧化物不一定是碱性氧化物
2.完成下列实验所选择的装置或仪器都正确的是( )
A B C D
实验 分离植物油和氯化钠溶液 除去氯化钠晶体中混有的氯化钾晶体 分离CCl4中的Br2 除去CO2气体中的HCl气体
装置 或仪器
3.第二架国产大型客机C919将在本月底实现首飞。C919机身部分采用第三代新型铝锂合金材料。下列关于铝锂合金的认识不正确的是( )
A.铝锂合金密度较小,强度较大,硬度大于纯铝,熔点低于锂单质
B.改变原料的配比,可以制得性能不同的铝锂合金
C.铝锂合金具有金属光泽,可导电导热
D.铝锂合金的性质与各成分金属的性质完全相同
4.设NA代表阿伏加德罗常数的数值,下列说法正确的是( )
A.22.0g T2O中含有的中子数为10NA
B.一定条件下,6.4g铜与过量的硫反应,转移电子数目为0.2NA
C.在标准状况下,2.8g N2和2.24L CO所含电子数均为1.4NA
D.标准状况下,22.4L CH2Cl2中含C-H键数为2NA
5.钯的化合物PdCl2通过化学反应可用来检测有毒气体CO,该反应的反应物与生成物有CO、Pd、H2O、HCl、PdCl2和一种未知物质X。下列说法错误的是( )
A.未知物质X为CO2,属于氧化产物
B.每转移1 mol e-时,生成2 mol X
C.反应中PdCl2作氧化剂,被还原
D.还原性:CO>Pd
6.下列实验过程可以达到实验目的的是( )
编号 实验目的 实验过程
A 配制0.4000 mol·L 1的NaOH溶液 称取4.0 g固体NaOH于烧杯中,加入少量蒸馏水溶解,立即转移至250 mL容量瓶中定容
B 探究维生素C的还原性 向盛有2 mL黄色氯化铁溶液的试管中滴加浓的维生素C溶液,观察颜色变化
C 制取纯净氢气 向稀盐酸中加入锌粒,将生成的气体依次通过NaOH溶液、浓硫酸和KMnO4溶液
D 探究浓度对反应速率的影响 向2支盛有5 mL不同浓度NaHSO3溶液的试管中同时加入2 mL 5%H2O2溶液,观察实验现象
7.对于下列实验,能正确描述其反应的离子方程式是( )
A.0.1mo/LNaAlO2溶液中通入过量CO2:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3-
B.向CaCl2溶液中通入CO2:Ca2++H2O+CO2=CaCO3↓+2H+
C.向H2O2溶液中滴加少量FeCl3溶液:2Fe3++H2O2=O2↑+2H++2Fe2+
D.电解MgCl2水溶液:2Cl-+2H2O=2OH-+H2↑+Cl2↑
8.从含有CuCl2、FeCl2、FeCl3的工业废液中回收铜并制备氯化铁晶体的流程如下:
则下列说法正确的是( )
A.试剂a是铁,试剂b是稀硫酸
B.操作Ⅰ、操作Ⅱ、操作Ⅲ所用的仪器完全相同
C.试剂c是氯气,反应的离子方程式为2Fe2++Cl22Fe3++2Cl-
D.用KSCN溶液可检验溶液W中是否有Fe2+
9.实验室验证钠能与二氧化碳发生反应,并确定其产物的装置如图所示,(已知:PdC12溶液遇CO能产生黑色的Pd),下列说法错误的是( )
A.装置①的仪器还可以制取H2气体
B.装置⑤中石灰水变浑浊后,再点燃酒精灯
C.装置②③中分别盛装饱和Na2CO3溶液、浓H2SO4
D.装置⑥中有黑色沉淀,发生的反应是PdC12+CO+H2O=Pd↓+CO2+2HC1
10.工业上利用无机矿物资源生产部分材料的流程示意图如下。下列说法正确的是( )
(注:铝土矿中含有A12O3、SiO2、Fe2O3)
A.在铝土矿制备较高纯度A1的过程中只用到NaOH溶液、CO2气体
B.石灰石、纯碱、石英、玻璃都属于盐,都能与盐酸反应
C.在制粗硅时,氧化剂与还原剂的物质的量之比为1∶2
D.黄铜矿(CuFeS2)与O2反应产生的Cu2S、SO2均只是还原产物
选择题答案栏
题号 1 2 3 4 5 6 7 8 9 10
答案
第II卷(非选择题,40分)
二、非选择题(本题包括3道题,共计40分。)
11.(12分)高锰酸钾溶液常用于物质的定性检验与定量分析。
(1)实验室里欲用KMnO4固体来配制240 mL 0.1 mol L-1的KMnO4酸性溶液。
①需用的仪器有天平、药匙、烧杯、玻璃棒、量筒、胶头滴管、__________。
②配制过程中玻璃棒所起的作用是_________。
③下列操作对实验结果的影响偏小的是______(填序号)。
a.加水定容时俯视刻度线
b.容量瓶内壁附有水珠而未干燥处理
c.若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶
d. 颠倒摇匀后发现凹液面低于刻度线又加水补上
(2)用上述酸性KMnO4溶液来制备氯气。
2KMnO4 +16HCl(浓)=2KCl + 2MnCl2 +5Cl2↑+8H2O
①反应中的氧化剂是_______,氧化产物是_________,HCl表现______性和_______性。
②若有73gHCl被氧化,则该反应转移的电子数目为___________。
12.(14分)某化学兴趣小组的同学进行三草酸合铁酸钾晶体K3[Fe(C2O4)3]·3H2O分解的实验探究。经小组讨论,他们设计了如下装置进行实验。烧瓶B中盛有饱和NH4Cl和饱和NaNO2混合液(常用于实验室制N2),干燥管C1中装有碱石灰。
(1)B中发生反应的化学方程式为______________________________________。
(2)C2的作用是_________________,C3中盛装的试剂是___________________。
(3)若实验中观察到E1、E4中的澄清石灰水均变浑浊,则E3中的现象是___________________,证明气体产物是___________________。
(4)实验装置中有2个酒精灯,先点燃A1,一段时间后,熄灭A1,关闭活塞a,再点燃A2,待D中的样品充分反应后,再次打开活塞a,点燃A1,则第二次点燃A1的理由是_________________
_______________________________________。
(5)该小组同学查阅资料后推知, D中固体产物中,铁元素不可能以三价形式存在,而盐只有K2CO3。实验测得C2、C3共增重5.4g;将D中固体生成物溶于水,测得最后残余固体的质量为6.88g。通过计算,固体产物中铁元素的存在形式为______(需表示出产物的物质的量)。
若要通过实验研究上述结论,除3%H2O2、蒸馏水外,还需要下列试剂中的___________。
A.1.0 mol·L-1HNO3 B.1.0 mol·L-1盐酸 C.1.0 mol·L-1NaOH溶液
D.0.1 mol·L-1KI溶液 E.0.1 mol·L-1CuSO4溶液 F.20%KSCN溶液。
13.(14分)在Na+浓度为0.5 mol·L-1的某澄清溶液中,还可能含有下表中的若干种离子。
阳离子 K+ Ag+ Mg2+ Ba2+
阴离子 NO3- CO32- SiO32- SO42-
现取该溶液100 mL进行如下实验(气体体积均在标准状况下测定)。
序号 实验内容 实验结果
Ⅰ 向该溶液中加入足量稀盐酸 产生白色沉淀并放出标准状况下0.56 L气体
Ⅱ 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 固体质量为2.4 g
Ⅲ 向Ⅱ的滤液中滴加BaCl2溶液 无明显现象
请回答下列问题。
(1)实验Ⅰ能确定一定不存在的离子是___________________________。
(2)实验Ⅰ中生成沉淀的离子方程式为___________________________。
(3)通过实验Ⅰ、Ⅱ、Ⅲ和必要计算,填写下表中阴离子的浓度(能计算出的,填写计算结果,一定不存在的离子填“0”,不能确定是否存在的离子填“?”)_______________。
阴离子 NO3- CO32- SiO32- SO42-
c/(mol·L-1)
(4)判断K+是否存在,若存在,求出其最小浓度,若不存在说明理由:_______________。
参考答案
题号 1 2 3 4 5 6 7 8 9 10
答案 D A D C B B A C C C
11.250mL容量瓶 搅拌加速溶解、引流 cd KMnO4 Cl2 酸性 还原性 2NA
12.NH4Cl+NaNO2 ==N2↑+NaCl+2H2O 检验水蒸气 P2O5或CaCl2 溶液褪色(或变浅) CO2和CO 第二次点燃 A1,是利用生成的氮气将装置中残余的气体吹到后续装置,使其充分吸收 0.02mol Fe、0.08mol FeO BEF
13.Ag+、Mg2+、Ba2+、SO42- SiO32-+2H+=H2SiO3↓
阴离子 NO3- CO32- SiO32- SO42-
c/mol L-1 ? 0.25 0.4 0
存在,c(K+)最小值为0.8mol/L
同课章节目录
