人教版化学九年级上册 第三单元 课题2 原子的结构 课件(共36张PPT)
文档属性
| 名称 | 人教版化学九年级上册 第三单元 课题2 原子的结构 课件(共36张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 921.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-30 07:50:45 | ||
图片预览









文档简介
(共36张PPT)
在化学变化中分子可以再分,而原子不能再分。
那么,如果用其他方法或在其他变化中原子能不能再分呢 原子究竟是不是简单而不可分割的实心球体呢?
你能猜想原子的内部结构吗?
一、原子的构成
原子结构的发现历程
1 公元前5世纪,希腊哲学家德谟克利特等人认为 :万物是由大量的不可分割的微粒构成的,即原子。
19世纪初,英国科学家道尔顿提出
近代原子学说,他认为原子是微小
的不可分割的实心球体。
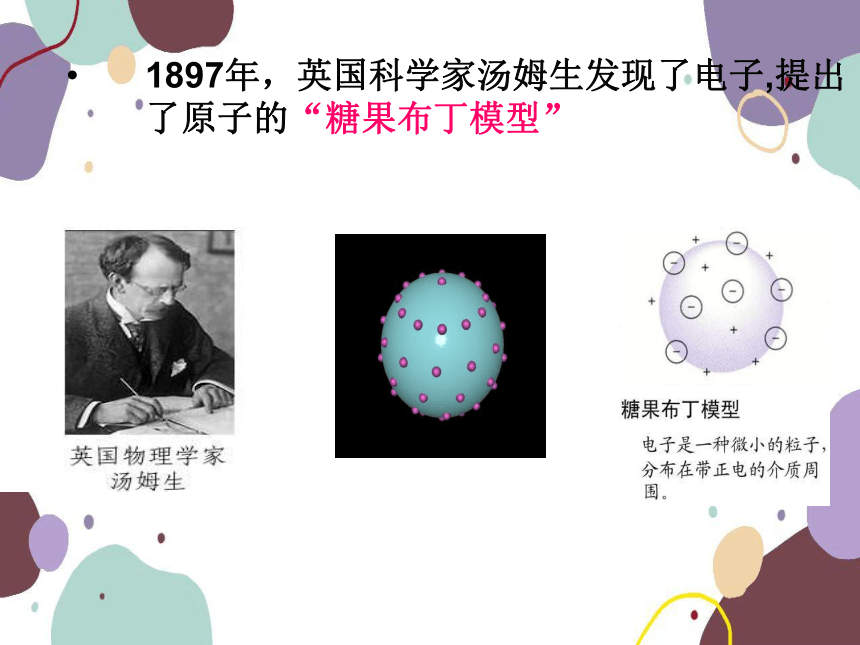
1897年,英国科学家汤姆生发现了电子,提出了原子的“糖果布丁模型”
4、卢瑟福原子行星模型
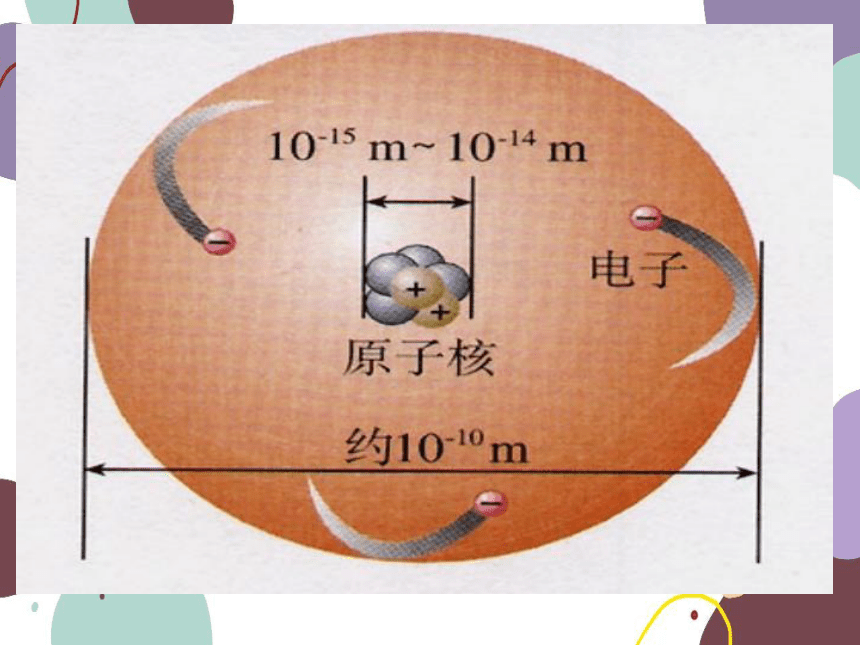
1911年,卢瑟福提出了原子结构的“核式模型”:
每个原子中心有一个极小的原子核,几乎集中了原子的全部质量并带有Z个单位正电荷,核外有Z个电子绕核旋转,电子绕核如同行星绕日运行,因此这一模型也被称为“行星式模型”。后来由于对原子光谱的深入研究和量子力学的出现,才逐步形成了现代原子结构理论。
波尔模型
在卢瑟福模型的基础上,他提出了电子在核外的量子化轨道,指出电子在一些特定的可能轨道上绕核作圆周运动。
解决了原子结构的稳定性问题,描绘出了完整而令人信服的原子结构学说。
质子和中子的发现
卢瑟福是一位永不满足的探险家。在提出原子模型之后,他用a粒子轰击氮原子时,意外地发现一种带正电的粒子,计算它的质量正好等于氢原子核并命名为质子。从这个实验中得知,质子是构成原子核的一类“砖”。根据计算,发现原子核还应该有另外一种微粒存在。并且,这种微粒不带电,它几乎和质子一样重,和质子结合共同形成原子核。”
1921年,美国的一位化学家威廉·哈金斯把这个粒子取名为中子。
卢瑟福的这个见解遭到许多科学家的反对。他们认为,既然质子是带正电的,如果还有一个不带电的粒子,它们是不能和睦相处的。再说,原子核那么小,它们俩能在这微小的空间里结合在一起吗?
要想让科学界承认原子核由质子和中子构成,必须从实验中找到它。
后来,经过很多科学家,包括居里夫人的女儿女婿约里奥·居里夫妇的不懈努力,终于于1930年中子的存在得到了科学界的认可,此发现获得了到了1935年诺贝尔奖。
原子
原子核
核外电子
质子
中子
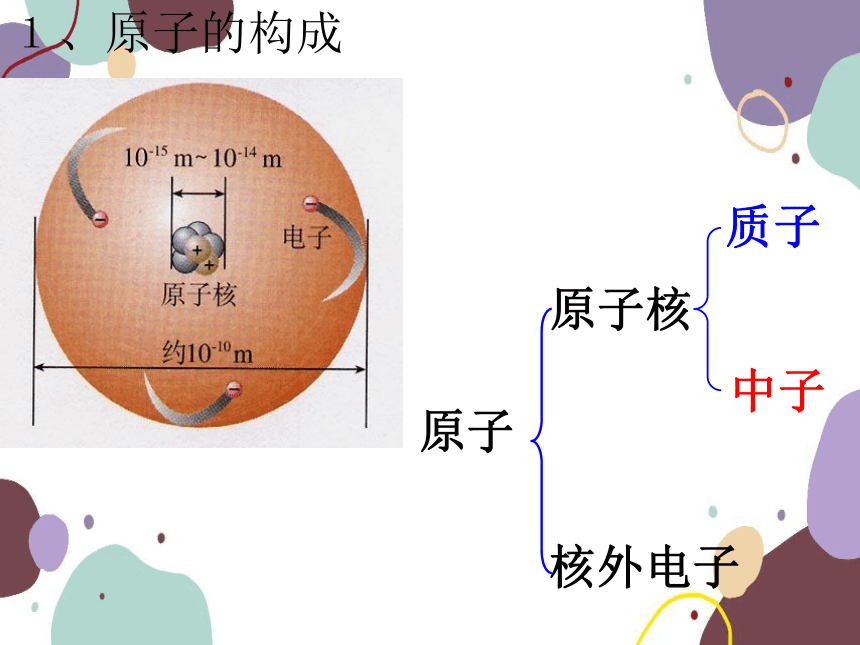
1、原子的构成
1.原子是由居于原子中心的带正电的原子核和核外带负电的电子构成.
2.原子核是由质子和中子构成的.
3.构成原子的粒子有三种:质子、中子、电子。
归纳
讨论:
1 质子、中子、电子的电性和电量怎样?
1个质子带一个单位正
电荷;
1个电子带一个单位负电荷。
中子不带电;
原子核带正电
原子核所带的正电荷数目叫做 核电荷数
核电荷数=质子数
1)原子由哪两部分构成?
2)原子核由什么构成?
3)构成原子核的粒子有哪些?
原子核和核外电子
质子和中子
质子 中子 电子
质子 中子 电子的电性和电量如何?
质子:带正电 一个质子带一个单位正电荷
中子:不显电性
电子:带负电 一个电子带一个单位负电荷
什么叫核电荷数?
原子核所带的正电荷数目
核电荷数与质子数的关系是?
核电荷数=质子数
体积很小
原子中质子数,电子数有何关系?
核电荷数 质子数 核外电子数
氢 1 1 1
碳 6 6 6
氧 8 8 8
钠 11 11 11
铁 26 26 26
核外电子数=质子数
=核电荷数
探究:
铁、铝等金属都是原子直接构成的,原子中存在带电荷的粒子(质子和电子),原子是否显电性?
原子不显电性
思考:原子不显电性的原因?
质子数 = 电子数
每个电子和质子所带电量相同,电性相反
正电荷总数 = 负电荷总数
所以,原子对外不显电性
一种氧原子是由8个质子,8个中子和8个核外电子构成的。
因为中子不带电,质子和电子数量相等,
所带电荷相反,所以,整个氧原子不显电性。
2.原子中质子数、电子数、中子数有何关系 举例说明.
原子种类 原子核 核外电子数
核电荷数 质子数 中子数
氢 1 1 0 1
碳 6 6 6 6
氧 8 8 8 8
钠 11 11 12 11
铁 26 26 30 26
1)核外电子数=质子数(核电荷数)
2)质子数不一定等于中子数,原子中不一定含有中子
不同类的原子,核内的质子数不同,核外的电子数也不同。
3.不同类的原子内部结构有什么不同
举例说明.
同类的原子,核内的质子数相同,核外的电子数也相同。
构成原子的必要粒子是质子和电子,决定原子种类的是核内质子数,它必不可少。
原子很小,一个原子跟一个乒乓球体积之比,相当于乒乓球跟地球之比。
如果把原子比作一个庞大的体育场,
而原子核只相当于一只蚂蚁。
因此,原子里有很大的空间,电子就在这个空间里作高速的运动。
请看课件。
课本上有句话:“原子很小” ,“原子里有很大的空间”。你认为这两句话矛盾吗?说明理由。
不矛盾
“原子很小”是从宏观的角度分析微观粒子(原子)的体积;
“原子里有很大的空间”是针对原子核与原子的相对大小而言的,原子核的半径比原子小得多,原子核的半径约为原子半径的十万分之一,因此,相对来说,原子里有很大的空间。
微粒质量
质子:1.6726× 10-27 Kg
中子:1.6749 ×10-27Kg
电子:9.109×10-31kg
电子的质量约为质子质量的1/1836
原子的质量主要集中在原子核上.
电子的质量比质子和中子小得多,可以忽略不计
小明同学,你多大了
我出生5475天了.
小李同学,你多大了
我出生5840天.
5475天÷365天=15
5840天÷365天=16
原子很小,但也有一定的质量.不同的原子质量不同.
一个氢原子的质量为 1.674×10-27kg
一个碳原子的质量为 1.993×10-26kg
一个氧原子的质量为 2.657×10-26kg
一个铁原子的质量为 9.288×10-26kg
这样小的数字,书写、记忆、和使用都很不方便。
科学家想到选择一种原子的质量作为比较的标准来衡量
其他原子的质量。也就是说,不直接用原子的实际质量,
而采用以一种原子的质量作为比较的标准,得到其他原子跟它的比。
经过研究和实践,国际上一致同意以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量.(符号为Ar)
某种原子的质量(Kg)
相对原子质量(Ar) =—————————
碳原子的质量× (Kg)
原子的实际质量与相对原子质量成正比
1
12
2.657×10-26kg
Ar(O)=———————————≈16
1.993×10-26kg×
1
12
所以,氧元素的相对原子质量为16.
一个氧原子的质量 2.657×10-26kg
一个碳原子的质量 1.993×10-26kg
已知1个碳原子质量为nkg,1个A原子的质量为mkg,则A原子的相对原子质量可表示为:
思考
该原子的相对原子质量=
该原子的质量
碳原子的质量×
mkg
nkg ×
1
12
=
=12m/n
1
12
氢原子核内有1个电子,氧原子核内有8个电子,氢,氧两种原子的本质不同是( )
A.核内质子数目 B.核内中子数目
C.核外电子数目 D.相对原子质量
在化学变化中分子可以再分,而原子不能再分。
那么,如果用其他方法或在其他变化中原子能不能再分呢 原子究竟是不是简单而不可分割的实心球体呢?
你能猜想原子的内部结构吗?
一、原子的构成
原子结构的发现历程
1 公元前5世纪,希腊哲学家德谟克利特等人认为 :万物是由大量的不可分割的微粒构成的,即原子。
19世纪初,英国科学家道尔顿提出
近代原子学说,他认为原子是微小
的不可分割的实心球体。
1897年,英国科学家汤姆生发现了电子,提出了原子的“糖果布丁模型”
4、卢瑟福原子行星模型
1911年,卢瑟福提出了原子结构的“核式模型”:
每个原子中心有一个极小的原子核,几乎集中了原子的全部质量并带有Z个单位正电荷,核外有Z个电子绕核旋转,电子绕核如同行星绕日运行,因此这一模型也被称为“行星式模型”。后来由于对原子光谱的深入研究和量子力学的出现,才逐步形成了现代原子结构理论。
波尔模型
在卢瑟福模型的基础上,他提出了电子在核外的量子化轨道,指出电子在一些特定的可能轨道上绕核作圆周运动。
解决了原子结构的稳定性问题,描绘出了完整而令人信服的原子结构学说。
质子和中子的发现
卢瑟福是一位永不满足的探险家。在提出原子模型之后,他用a粒子轰击氮原子时,意外地发现一种带正电的粒子,计算它的质量正好等于氢原子核并命名为质子。从这个实验中得知,质子是构成原子核的一类“砖”。根据计算,发现原子核还应该有另外一种微粒存在。并且,这种微粒不带电,它几乎和质子一样重,和质子结合共同形成原子核。”
1921年,美国的一位化学家威廉·哈金斯把这个粒子取名为中子。
卢瑟福的这个见解遭到许多科学家的反对。他们认为,既然质子是带正电的,如果还有一个不带电的粒子,它们是不能和睦相处的。再说,原子核那么小,它们俩能在这微小的空间里结合在一起吗?
要想让科学界承认原子核由质子和中子构成,必须从实验中找到它。
后来,经过很多科学家,包括居里夫人的女儿女婿约里奥·居里夫妇的不懈努力,终于于1930年中子的存在得到了科学界的认可,此发现获得了到了1935年诺贝尔奖。
原子
原子核
核外电子
质子
中子
1、原子的构成
1.原子是由居于原子中心的带正电的原子核和核外带负电的电子构成.
2.原子核是由质子和中子构成的.
3.构成原子的粒子有三种:质子、中子、电子。
归纳
讨论:
1 质子、中子、电子的电性和电量怎样?
1个质子带一个单位正
电荷;
1个电子带一个单位负电荷。
中子不带电;
原子核带正电
原子核所带的正电荷数目叫做 核电荷数
核电荷数=质子数
1)原子由哪两部分构成?
2)原子核由什么构成?
3)构成原子核的粒子有哪些?
原子核和核外电子
质子和中子
质子 中子 电子
质子 中子 电子的电性和电量如何?
质子:带正电 一个质子带一个单位正电荷
中子:不显电性
电子:带负电 一个电子带一个单位负电荷
什么叫核电荷数?
原子核所带的正电荷数目
核电荷数与质子数的关系是?
核电荷数=质子数
体积很小
原子中质子数,电子数有何关系?
核电荷数 质子数 核外电子数
氢 1 1 1
碳 6 6 6
氧 8 8 8
钠 11 11 11
铁 26 26 26
核外电子数=质子数
=核电荷数
探究:
铁、铝等金属都是原子直接构成的,原子中存在带电荷的粒子(质子和电子),原子是否显电性?
原子不显电性
思考:原子不显电性的原因?
质子数 = 电子数
每个电子和质子所带电量相同,电性相反
正电荷总数 = 负电荷总数
所以,原子对外不显电性
一种氧原子是由8个质子,8个中子和8个核外电子构成的。
因为中子不带电,质子和电子数量相等,
所带电荷相反,所以,整个氧原子不显电性。
2.原子中质子数、电子数、中子数有何关系 举例说明.
原子种类 原子核 核外电子数
核电荷数 质子数 中子数
氢 1 1 0 1
碳 6 6 6 6
氧 8 8 8 8
钠 11 11 12 11
铁 26 26 30 26
1)核外电子数=质子数(核电荷数)
2)质子数不一定等于中子数,原子中不一定含有中子
不同类的原子,核内的质子数不同,核外的电子数也不同。
3.不同类的原子内部结构有什么不同
举例说明.
同类的原子,核内的质子数相同,核外的电子数也相同。
构成原子的必要粒子是质子和电子,决定原子种类的是核内质子数,它必不可少。
原子很小,一个原子跟一个乒乓球体积之比,相当于乒乓球跟地球之比。
如果把原子比作一个庞大的体育场,
而原子核只相当于一只蚂蚁。
因此,原子里有很大的空间,电子就在这个空间里作高速的运动。
请看课件。
课本上有句话:“原子很小” ,“原子里有很大的空间”。你认为这两句话矛盾吗?说明理由。
不矛盾
“原子很小”是从宏观的角度分析微观粒子(原子)的体积;
“原子里有很大的空间”是针对原子核与原子的相对大小而言的,原子核的半径比原子小得多,原子核的半径约为原子半径的十万分之一,因此,相对来说,原子里有很大的空间。
微粒质量
质子:1.6726× 10-27 Kg
中子:1.6749 ×10-27Kg
电子:9.109×10-31kg
电子的质量约为质子质量的1/1836
原子的质量主要集中在原子核上.
电子的质量比质子和中子小得多,可以忽略不计
小明同学,你多大了
我出生5475天了.
小李同学,你多大了
我出生5840天.
5475天÷365天=15
5840天÷365天=16
原子很小,但也有一定的质量.不同的原子质量不同.
一个氢原子的质量为 1.674×10-27kg
一个碳原子的质量为 1.993×10-26kg
一个氧原子的质量为 2.657×10-26kg
一个铁原子的质量为 9.288×10-26kg
这样小的数字,书写、记忆、和使用都很不方便。
科学家想到选择一种原子的质量作为比较的标准来衡量
其他原子的质量。也就是说,不直接用原子的实际质量,
而采用以一种原子的质量作为比较的标准,得到其他原子跟它的比。
经过研究和实践,国际上一致同意以一种碳原子质量的1/12为标准,其他原子的质量跟它相比较所得到的比,作为这种原子的相对原子质量.(符号为Ar)
某种原子的质量(Kg)
相对原子质量(Ar) =—————————
碳原子的质量× (Kg)
原子的实际质量与相对原子质量成正比
1
12
2.657×10-26kg
Ar(O)=———————————≈16
1.993×10-26kg×
1
12
所以,氧元素的相对原子质量为16.
一个氧原子的质量 2.657×10-26kg
一个碳原子的质量 1.993×10-26kg
已知1个碳原子质量为nkg,1个A原子的质量为mkg,则A原子的相对原子质量可表示为:
思考
该原子的相对原子质量=
该原子的质量
碳原子的质量×
mkg
nkg ×
1
12
=
=12m/n
1
12
氢原子核内有1个电子,氧原子核内有8个电子,氢,氧两种原子的本质不同是( )
A.核内质子数目 B.核内中子数目
C.核外电子数目 D.相对原子质量
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
