山东省菏泽市成武县中2022-2023学年高二上学期8月暑假开学质量检测化学试卷(Word版含答案)
文档属性
| 名称 | 山东省菏泽市成武县中2022-2023学年高二上学期8月暑假开学质量检测化学试卷(Word版含答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 454.7KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-30 00:00:00 | ||
图片预览




文档简介
成武县中2022-2023学年高二上学期8月暑假开学质量检测
化学试题
本试卷满分为100分,考试用时90分钟。
注意事项:
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效.保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量:
H 1 C 12 N 14 O 16 Na 23 Al27 S 32 Cl35.5 Cu 64 Zn 65
一、选择题:每小题2分,共30分。每小题只有一个选项符合题意。
1.2020年11月24日凌晨,嫦娥5号在长征5号火箭巨大的推力下,启程前往月球,经20多天旅程后带着月壤返回,这是中国航天“探月工程”向世界展示出“中国力量”。下列相关说法正确的是 ( )
A.“嫦娥5号”使用的太阳能电池和锂离子电池均是将化学能转化为电能的装置
B.“返回器减速伞”用的材料——高强度锦纶纤维,属于天然高分子材料
C.月壤中含有珍贵的3He,它与4He互为同素异形体
D.长征5号火箭采用“液氢液氧”作为推进剂,“液氢”属于绿色环保燃料
2.下列关于化学观或化学研究方法的叙述中,错误的是( )
A.在化工生产中应遵循“绿色化学”的思想
B.在过渡元素中寻找优良的催化剂
C.利用金属与稀盐酸反应的快慢可以判断金属的活动性
D.根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4
3.元素在周期表中的位置反映了原子结构和元素的性质。下列说法正确的是 ( )
A.ⅠA族的元素称为碱金属元素
B.第2周期元素的最高化合价依次递增,并等于它所处的主族序数
C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数一定相同
4.下列结论错误的是( )
①微粒半径:K+>Al3+>S2->Cl- ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si
⑦金属性:BeA.只有① B.①③ C.②④⑤⑥⑦ D.①③⑤
5.下列说法正确的是( )
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以增大生成氢气的速率
B.100 mL 2 mol·L-1盐酸与锌片反应,加入适量的氯化钠溶液,反应速率不变
C.二氧化硫的催化氧化是一个放热反应,升高温度,反应速率降低
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,使用催化剂可以增大反应速率
6.一定温度下,在容积恒定的密闭容器中,进行反应A(s)+2B(g)C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量
④B的物质的量浓度
A.①④ B.②③ C.②③④ D.只有④
7.铝—海水—空气电池在航海中得到广泛的应用,其以海水作为电解液,电池的电极反应式分别为Al-3e-===Al3+,O2+2H2O+4e-===4OH-,下列说法正确的是( )
A.该电池的正极是铝,发生氧化反应
B.电池工作时,电子通过外电路从负极流向正极,再从电解质溶液流回负极
C.该电池的正极反应物是氧气
D.该电池实现了将电能转化为化学能
8.下列叙述正确的是( )
A.乙醇俗名酒精,不能使酸性高锰酸钾溶液褪色
B.油脂在酸性或碱性条件下水解都可得到甘油和高级脂肪酸
C.石油裂化的目的是提高轻质燃料油的质量和产量
D.煤中含有的苯、甲苯、二甲苯等有机物,可通过煤的干馏来获得
9.下列关于有机化合物的认识不正确的是( )
A.油脂在空气中完全燃烧转化为水和二氧化碳
B.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C.在水溶液里,乙酸分子中的—CH3可以电离出H+
D.在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
10.某有机物其结构简式如图,关于该有机物,下列叙述不正确的是 ( )
A.能使酸性KMnO4溶液、溴水褪色,原理相同
B.1 mol该有机物能与H2发生反应,消耗4 mol H2
C.一定条件下,能发生加聚反应
D.该有机物苯环上的一个H被取代,有3种同分异构体
11.已知:lgC(s)燃烧生成一氧化碳放出9.2kJ的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述正确的是 ( )
A.碳[C(s)]的燃烧热ΔH为-110.4kJ mol-1
B.1molCuO分解生成Cu2O放出73kJ的热量
C.反应2Cu2O(s)+O2(g)=4CuO(s)的ΔH为348kJ·mol-1
D.足量炭粉与CuO反应生成Cu2O的热化学方程式为: C(s)+2CuO(s)=Cu2O(s)+CO(g) ΔH=+35.6kJ mol-1
12.已知断裂1 mol N≡N键吸收能量为945.6 kJ,形成1 mol H—N键放出能量为391 kJ,若1 mol N2和3 mol H2完全反应:N2+3H2===2NH3,放出的能量为92.4 kJ,则断裂1 mol H—H键吸收的能量是( )
A.436 kJ B.433.6 kJ C.463 kJ D.869 kJ
13.下列描述的化学反应状态,不一定是平衡状态的是( )
A.H2(g)+Br2(g)2HBr(g) 恒温、 恒容下,反应体系中气体的颜色保持不变
B.2NO2(g)N2O4(g) 恒温、恒容下,反应体系中气体的压强保持不变
C.CaCO3(s)CO2(g)+ CaO(s) 恒温、恒容下,反应体系气体的密度保持不变
D.3H2(g)+N2(g)2NH3(g) 反应体系中H2与N2的物质的量之比保持3:1
14.下列各项叙述正确的是( )
A.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
B.价电子排布式为5s25p1的元素位于第五周期第ⅠA 族,是s区元素
C.所有原子任一电子层的s电子云轮廓图都是球形,但球的半径大小不同
D.p轨道电子能量一定高于s轨道电子能量
15.由多元素组成的化合物Fe-Sm-As-F-O,是我国科学家近年来发现的一种重要的铁系超导材料。下列说法正确的是( )
A.O的价电子排布式为1s22s22p4
B.Fe3+的价电子轨道表示式违背了泡利不相容原理
C.N、As同主族,第一电离能N<As
D.电负性F>O>As
二、本题共5小题,每小题4分,共20分。每小题有1个或2个选项符合题意
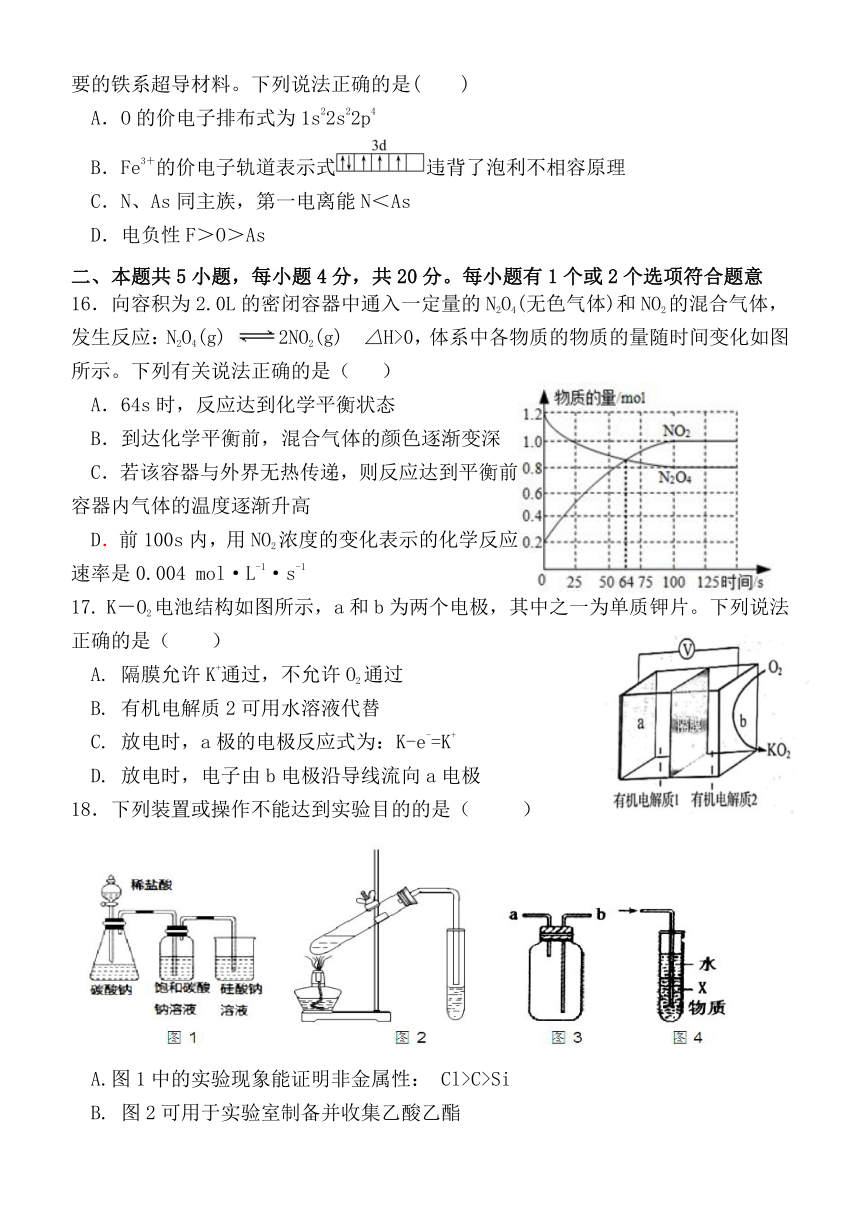
16.向容积为2.0L的密闭容器中通入一定量的N2O4(无色气体)和NO2的混合气体,发生反应:N2O4(g) 2NO2(g) △H>0,体系中各物质的物质的量随时间变化如图所示。下列有关说法正确的是( )
A.64s时,反应达到化学平衡状态
B.到达化学平衡前,混合气体的颜色逐渐变深
C.若该容器与外界无热传递,则反应达到平衡前容器内气体的温度逐渐升高
D.前100s内,用NO2浓度的变化表示的化学反应速率是0.004 mol·L-1·s-1
17. K-O2电池结构如图所示,a和b为两个电极,其中之一为单质钾片。下列说法正确的是( )
A. 隔膜允许K+通过,不允许O2通过
B. 有机电解质2可用水溶液代替
C. 放电时,a极的电极反应式为:K-e-=K+
D. 放电时,电子由b电极沿导线流向a电极
18.下列装置或操作不能达到实验目的的是( )
A.图1中的实验现象能证明非金属性: Cl>C>Si
B. 图2可用于实验室制备并收集乙酸乙酯
C. 图3中,气体从a口进入时,可用于收集H2、CH4、NH3等气体
D. 图4中X若为CCl4,可用于吸收NH3或HCl
19. “践行双碳目标,助力绿色冬奥”,2022年北京冬奥会使用近700余辆搭载国家电投氢能公司全自主研发“氢腾”燃料电池系统的宇通氢能大巴。某种氢燃料电池的内部结构如图所示,下列说法正确的是( )
A.电子流向为:从电极a经电解质溶液到电极b
B.b极为正极,电极反应式为O2+4e-+2H2O=4OH-
C.负极每消耗2.24LH2,转移2mol电子
D.装置工作一段时间后,电解质溶液的pH增大
20.下列说法正确的是( )
A.轨道表示式能反映钠原子轨道的能级差别和电子的自旋状态
B.金属Cr基态原子的核外电子排布式为1s22s22p63s23p63d44s2
C.基态原子的p能级上半充满的元素一定位于p区
D.X、Y元素同周期且电负性X>Y,则第一电离能:X>Y
三、非选择题:本题共5小题,共60分。
A 2p能级电子半充满
B 与A同周期,且原子核外有2个未成对电子
C 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子
D 其基态原子价电子排布式为msnmpn+2
E 前四周期元素中,E元素基态原子未成对电子数最多
F 基态F+各能级电子全充满
21.(14分)前四周期元素A、B、C、D、E、F原子序数依次增大,其相关性质如表所示:
请根据以上情况,回答下列问题:
(1)E元素基态原子的电子排布式为________________,写出F元素基态原子的价电子排布式________________。
(2)B和C可形成一种同时含有共价键和离子键的化合物,写出此化合物的电子式___。
(3)A、B、C、D四种元素第一电离能由大到小的顺序为_______________(用元素符号表示)。B、C、D三种元素的简单离子的半径由大到小的顺序为_________________(用离子符号表示)。
(4)写出一个化学方程式证明元素B和D的非金属性强弱___________________。
(5)许多金属盐都可以发生焰色反应,如元素C,其原因是________________。
22.(1)图1是高铁电池的模拟实验装置,放电时电池反应为
3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH
①该电池放电时正极的电极反应式为____ _____。
②盐桥中含有饱和KCl溶液,此盐桥中氯离子向______移动(填“左”或“右”)。
③如图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有___________________。
(2)某同学在研究如图所示的原电池装置时,测得Zn电极质量减轻6.5 g,Cu电极质量增加4.8 g。通过导线的电子数与反应转移电子总数的比值定义为电池的能量转换效率,则该实验中电池的能量转换效率为______。
(3)熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:
负极反应式:2CO+2 4e ═4CO2
正极反应式____________;
23.Ⅰ.乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。
碱性乙醇燃料电池 酸性乙醇燃料电池 熔融盐乙醇燃料电池
(1)三种乙醇燃料电池中正极反应物均为________。
(2)碱性乙醇燃料电池中,电极a上发生的电极反应式为___________________
(3)酸性乙醇燃料电池中,电极b上发生的电极反应式为_________ ___,通过质子交换膜的离子是________。
(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极________(填“a”或“b”)移动,电极b上发生的电极反应式为_________ ___。
Ⅱ.肼(N2H4) 双氧水燃料电池由于其较高的能量密度而广受关注,其工作原理如图所示。则电池正极反应式为_____________,电池工作过程中,A极区溶液的pH________(填“增大”“减小”或“不变”)。
24.有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某同学设计了如图所示装置进行实验(加热仪器、夹持仪器已略去)。
已知:乙醇的沸点为78℃,易溶于水;乙醛的沸点为20.8℃,易溶于水。
回答下列问题:
(1)乙醇催化氧化的化学方程式是 _。
(2)实验时上述装置需要加热,其中应该首先加热的是___________(填字母),为使装置A中的乙醇形成稳定的蒸气,适宜的加热方法是___________。
(3)装置D的作用是 _。
(4)若试管E中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有___________(填化学式),要除去该物质,可向混合液中加入___________。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
25.工业生产中,海水提取溴常用空气吹出法。某化学实验小组设计了如下实验装置(夹持装置略去)模拟该法从浓缩的海水中提取溴。
已知:Br2的沸点为58.78 ℃,密度为3.119 g·cm-3,微溶于水,有毒。
(1)实验步骤如下:
①关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
②关闭活塞a、c,打开活塞b、d,向A中鼓入足量热空气;
③关闭活塞b,打开活塞a,再通过A向B中通入足量Cl2;
④取B中所得溶液进行蒸馏,收集液溴。
(2)步骤①A中主要反应的离子方程式为_________________________。
(3)X试剂可以是_____(填序号),步骤②B中X试剂与Br2发生反应的离子方程式为______________________。
a.H2O b.饱和食盐水 c.饱和Na2SO3溶液
(4)该实验中尾气处理所用的试剂可以为__________________。
(5)蒸馏时,除酒精灯、石棉网、铁架台外,还应该选择仪器________(填序号)。蒸馏操作中应控制温度为________。
化学答案
1--5 .D D D B D 6---10 .A C C C A 11---15.D A D C D
16---20. BD、AC、A、D、AC、
21.(14分)(1) 1s22s22p63s23p63d54s1(或[Ar]3d54s1) 3d104s1
(2) (3)N>O>S>Na S2->O2->Na+
(4)2H2S+O2===2S↓+2H2O
(5)激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量
22.(8分)
(1)+4H2O+3e =Fe(OH)3+5OH- ; 右 ; 使用时间长、工作电压稳定;
(2) 75% (3) O2+2CO2+4e =2
23.(12分)Ⅰ.(1)氧气
(2)C2H5OH+16OH--12e-===2CO32-+11H2O
(3)O2+4H++4e-===2H2O 、H+
(4)a ;O2+2CO2+4e-===2CO32- ;
Ⅱ.H2O2+2e-===2OH- ;减小
24.(8分)(1).
(2) B ;水浴加热
(3) 防止外界的水蒸气进入C装置
(4) ; c
25.(8分) (2) Cl2+2Br-===Br2+2Cl-
(3) c ;Br2+SO+H2O===SO+2Br-+2H+
(4) NaOH溶液
(5)①③⑤⑥⑦ ; 59℃(58.78 ℃~60 ℃之间均可)
化学试题
本试卷满分为100分,考试用时90分钟。
注意事项:
1.答题前,考生先将自己的姓名、考生号、座号填写在相应位置,认真核对条形码上的姓名、考生号和座号,并将条形码粘贴在指定位置上。
2.选择题答案必须使用2B铅笔(按填涂样例)正确填涂;非选择题答案必须使用0.5毫米黑色签字笔书写,字体工整、笔迹清楚。
3.请按照题号在各题目的答题区域内作答,超出答题区域书写的答案无效;在草稿纸、试题卷上答题无效.保持卡面清洁,不折叠、不破损。
可能用到的相对原子质量:
H 1 C 12 N 14 O 16 Na 23 Al27 S 32 Cl35.5 Cu 64 Zn 65
一、选择题:每小题2分,共30分。每小题只有一个选项符合题意。
1.2020年11月24日凌晨,嫦娥5号在长征5号火箭巨大的推力下,启程前往月球,经20多天旅程后带着月壤返回,这是中国航天“探月工程”向世界展示出“中国力量”。下列相关说法正确的是 ( )
A.“嫦娥5号”使用的太阳能电池和锂离子电池均是将化学能转化为电能的装置
B.“返回器减速伞”用的材料——高强度锦纶纤维,属于天然高分子材料
C.月壤中含有珍贵的3He,它与4He互为同素异形体
D.长征5号火箭采用“液氢液氧”作为推进剂,“液氢”属于绿色环保燃料
2.下列关于化学观或化学研究方法的叙述中,错误的是( )
A.在化工生产中应遵循“绿色化学”的思想
B.在过渡元素中寻找优良的催化剂
C.利用金属与稀盐酸反应的快慢可以判断金属的活动性
D.根据元素周期律,由HClO4可以类推出氟元素也存在最高价氧化物的水化物HFO4
3.元素在周期表中的位置反映了原子结构和元素的性质。下列说法正确的是 ( )
A.ⅠA族的元素称为碱金属元素
B.第2周期元素的最高化合价依次递增,并等于它所处的主族序数
C.短周期元素形成离子后,最外层电子都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数一定相同
4.下列结论错误的是( )
①微粒半径:K+>Al3+>S2->Cl- ②氢化物的稳定性:HF>HCl>H2S>PH3>SiH4
③离子的还原性:S2->Cl->Br->I- ④氧化性:Cl2>S>Se>Te
⑤酸性:H2SO4>H3PO4>H2CO3>HClO ⑥非金属性:O>N>P>Si
⑦金属性:Be
5.下列说法正确的是( )
A.用铁片和稀硫酸反应制取氢气时,改用98%的浓硫酸可以增大生成氢气的速率
B.100 mL 2 mol·L-1盐酸与锌片反应,加入适量的氯化钠溶液,反应速率不变
C.二氧化硫的催化氧化是一个放热反应,升高温度,反应速率降低
D.汽车尾气中的NO和CO可以缓慢反应生成N2和CO2,使用催化剂可以增大反应速率
6.一定温度下,在容积恒定的密闭容器中,进行反应A(s)+2B(g)C(g)+D(g),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量
④B的物质的量浓度
A.①④ B.②③ C.②③④ D.只有④
7.铝—海水—空气电池在航海中得到广泛的应用,其以海水作为电解液,电池的电极反应式分别为Al-3e-===Al3+,O2+2H2O+4e-===4OH-,下列说法正确的是( )
A.该电池的正极是铝,发生氧化反应
B.电池工作时,电子通过外电路从负极流向正极,再从电解质溶液流回负极
C.该电池的正极反应物是氧气
D.该电池实现了将电能转化为化学能
8.下列叙述正确的是( )
A.乙醇俗名酒精,不能使酸性高锰酸钾溶液褪色
B.油脂在酸性或碱性条件下水解都可得到甘油和高级脂肪酸
C.石油裂化的目的是提高轻质燃料油的质量和产量
D.煤中含有的苯、甲苯、二甲苯等有机物,可通过煤的干馏来获得
9.下列关于有机化合物的认识不正确的是( )
A.油脂在空气中完全燃烧转化为水和二氧化碳
B.蔗糖、麦芽糖的分子式都是C12H22O11,二者互为同分异构体
C.在水溶液里,乙酸分子中的—CH3可以电离出H+
D.在浓硫酸存在下,苯与浓硝酸共热生成硝基苯的反应属于取代反应
10.某有机物其结构简式如图,关于该有机物,下列叙述不正确的是 ( )
A.能使酸性KMnO4溶液、溴水褪色,原理相同
B.1 mol该有机物能与H2发生反应,消耗4 mol H2
C.一定条件下,能发生加聚反应
D.该有机物苯环上的一个H被取代,有3种同分异构体
11.已知:lgC(s)燃烧生成一氧化碳放出9.2kJ的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述正确的是 ( )
A.碳[C(s)]的燃烧热ΔH为-110.4kJ mol-1
B.1molCuO分解生成Cu2O放出73kJ的热量
C.反应2Cu2O(s)+O2(g)=4CuO(s)的ΔH为348kJ·mol-1
D.足量炭粉与CuO反应生成Cu2O的热化学方程式为: C(s)+2CuO(s)=Cu2O(s)+CO(g) ΔH=+35.6kJ mol-1
12.已知断裂1 mol N≡N键吸收能量为945.6 kJ,形成1 mol H—N键放出能量为391 kJ,若1 mol N2和3 mol H2完全反应:N2+3H2===2NH3,放出的能量为92.4 kJ,则断裂1 mol H—H键吸收的能量是( )
A.436 kJ B.433.6 kJ C.463 kJ D.869 kJ
13.下列描述的化学反应状态,不一定是平衡状态的是( )
A.H2(g)+Br2(g)2HBr(g) 恒温、 恒容下,反应体系中气体的颜色保持不变
B.2NO2(g)N2O4(g) 恒温、恒容下,反应体系中气体的压强保持不变
C.CaCO3(s)CO2(g)+ CaO(s) 恒温、恒容下,反应体系气体的密度保持不变
D.3H2(g)+N2(g)2NH3(g) 反应体系中H2与N2的物质的量之比保持3:1
14.下列各项叙述正确的是( )
A.镁原子由1s22s22p63s2→1s22s22p63p2时,原子释放能量,由基态转化成激发态
B.价电子排布式为5s25p1的元素位于第五周期第ⅠA 族,是s区元素
C.所有原子任一电子层的s电子云轮廓图都是球形,但球的半径大小不同
D.p轨道电子能量一定高于s轨道电子能量
15.由多元素组成的化合物Fe-Sm-As-F-O,是我国科学家近年来发现的一种重要的铁系超导材料。下列说法正确的是( )
A.O的价电子排布式为1s22s22p4
B.Fe3+的价电子轨道表示式违背了泡利不相容原理
C.N、As同主族,第一电离能N<As
D.电负性F>O>As
二、本题共5小题,每小题4分,共20分。每小题有1个或2个选项符合题意
16.向容积为2.0L的密闭容器中通入一定量的N2O4(无色气体)和NO2的混合气体,发生反应:N2O4(g) 2NO2(g) △H>0,体系中各物质的物质的量随时间变化如图所示。下列有关说法正确的是( )
A.64s时,反应达到化学平衡状态
B.到达化学平衡前,混合气体的颜色逐渐变深
C.若该容器与外界无热传递,则反应达到平衡前容器内气体的温度逐渐升高
D.前100s内,用NO2浓度的变化表示的化学反应速率是0.004 mol·L-1·s-1
17. K-O2电池结构如图所示,a和b为两个电极,其中之一为单质钾片。下列说法正确的是( )
A. 隔膜允许K+通过,不允许O2通过
B. 有机电解质2可用水溶液代替
C. 放电时,a极的电极反应式为:K-e-=K+
D. 放电时,电子由b电极沿导线流向a电极
18.下列装置或操作不能达到实验目的的是( )
A.图1中的实验现象能证明非金属性: Cl>C>Si
B. 图2可用于实验室制备并收集乙酸乙酯
C. 图3中,气体从a口进入时,可用于收集H2、CH4、NH3等气体
D. 图4中X若为CCl4,可用于吸收NH3或HCl
19. “践行双碳目标,助力绿色冬奥”,2022年北京冬奥会使用近700余辆搭载国家电投氢能公司全自主研发“氢腾”燃料电池系统的宇通氢能大巴。某种氢燃料电池的内部结构如图所示,下列说法正确的是( )
A.电子流向为:从电极a经电解质溶液到电极b
B.b极为正极,电极反应式为O2+4e-+2H2O=4OH-
C.负极每消耗2.24LH2,转移2mol电子
D.装置工作一段时间后,电解质溶液的pH增大
20.下列说法正确的是( )
A.轨道表示式能反映钠原子轨道的能级差别和电子的自旋状态
B.金属Cr基态原子的核外电子排布式为1s22s22p63s23p63d44s2
C.基态原子的p能级上半充满的元素一定位于p区
D.X、Y元素同周期且电负性X>Y,则第一电离能:X>Y
三、非选择题:本题共5小题,共60分。
A 2p能级电子半充满
B 与A同周期,且原子核外有2个未成对电子
C 基态原子核外有6个原子轨道排有电子,且只有1个未成对电子
D 其基态原子价电子排布式为msnmpn+2
E 前四周期元素中,E元素基态原子未成对电子数最多
F 基态F+各能级电子全充满
21.(14分)前四周期元素A、B、C、D、E、F原子序数依次增大,其相关性质如表所示:
请根据以上情况,回答下列问题:
(1)E元素基态原子的电子排布式为________________,写出F元素基态原子的价电子排布式________________。
(2)B和C可形成一种同时含有共价键和离子键的化合物,写出此化合物的电子式___。
(3)A、B、C、D四种元素第一电离能由大到小的顺序为_______________(用元素符号表示)。B、C、D三种元素的简单离子的半径由大到小的顺序为_________________(用离子符号表示)。
(4)写出一个化学方程式证明元素B和D的非金属性强弱___________________。
(5)许多金属盐都可以发生焰色反应,如元素C,其原因是________________。
22.(1)图1是高铁电池的模拟实验装置,放电时电池反应为
3Zn+2K2FeO4+8H2O=3Zn(OH)2+2Fe(OH)3+4KOH
①该电池放电时正极的电极反应式为____ _____。
②盐桥中含有饱和KCl溶液,此盐桥中氯离子向______移动(填“左”或“右”)。
③如图2为高铁电池和常用的高能碱性电池的放电曲线,由此可得出高铁电池的优点有___________________。
(2)某同学在研究如图所示的原电池装置时,测得Zn电极质量减轻6.5 g,Cu电极质量增加4.8 g。通过导线的电子数与反应转移电子总数的比值定义为电池的能量转换效率,则该实验中电池的能量转换效率为______。
(3)熔融盐燃料电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极燃气,制得在650℃下工作的燃料电池,完成有关的电池反应式:
负极反应式:2CO+2 4e ═4CO2
正极反应式____________;
23.Ⅰ.乙醇燃料电池(DEFC)具有很多优点,引起了人们的研究兴趣。现有以下三种乙醇燃料电池。
碱性乙醇燃料电池 酸性乙醇燃料电池 熔融盐乙醇燃料电池
(1)三种乙醇燃料电池中正极反应物均为________。
(2)碱性乙醇燃料电池中,电极a上发生的电极反应式为___________________
(3)酸性乙醇燃料电池中,电极b上发生的电极反应式为_________ ___,通过质子交换膜的离子是________。
(4)熔融盐乙醇燃料电池中若选择熔融碳酸钾为介质,电池工作时,CO32-向电极________(填“a”或“b”)移动,电极b上发生的电极反应式为_________ ___。
Ⅱ.肼(N2H4) 双氧水燃料电池由于其较高的能量密度而广受关注,其工作原理如图所示。则电池正极反应式为_____________,电池工作过程中,A极区溶液的pH________(填“增大”“减小”或“不变”)。
24.有关催化剂的催化机理等问题可以从“乙醇催化氧化实验”得到一些认识,某同学设计了如图所示装置进行实验(加热仪器、夹持仪器已略去)。
已知:乙醇的沸点为78℃,易溶于水;乙醛的沸点为20.8℃,易溶于水。
回答下列问题:
(1)乙醇催化氧化的化学方程式是 _。
(2)实验时上述装置需要加热,其中应该首先加热的是___________(填字母),为使装置A中的乙醇形成稳定的蒸气,适宜的加热方法是___________。
(3)装置D的作用是 _。
(4)若试管E中收集到的液体用紫色石蕊试纸检验,试纸显红色,说明液体中还含有___________(填化学式),要除去该物质,可向混合液中加入___________。
a.氯化钠溶液 b.苯 c.碳酸氢钠溶液 d.四氯化碳
25.工业生产中,海水提取溴常用空气吹出法。某化学实验小组设计了如下实验装置(夹持装置略去)模拟该法从浓缩的海水中提取溴。
已知:Br2的沸点为58.78 ℃,密度为3.119 g·cm-3,微溶于水,有毒。
(1)实验步骤如下:
①关闭活塞b、d,打开活塞a、c,向A中缓慢通入Cl2至反应结束;
②关闭活塞a、c,打开活塞b、d,向A中鼓入足量热空气;
③关闭活塞b,打开活塞a,再通过A向B中通入足量Cl2;
④取B中所得溶液进行蒸馏,收集液溴。
(2)步骤①A中主要反应的离子方程式为_________________________。
(3)X试剂可以是_____(填序号),步骤②B中X试剂与Br2发生反应的离子方程式为______________________。
a.H2O b.饱和食盐水 c.饱和Na2SO3溶液
(4)该实验中尾气处理所用的试剂可以为__________________。
(5)蒸馏时,除酒精灯、石棉网、铁架台外,还应该选择仪器________(填序号)。蒸馏操作中应控制温度为________。
化学答案
1--5 .D D D B D 6---10 .A C C C A 11---15.D A D C D
16---20. BD、AC、A、D、AC、
21.(14分)(1) 1s22s22p63s23p63d54s1(或[Ar]3d54s1) 3d104s1
(2) (3)N>O>S>Na S2->O2->Na+
(4)2H2S+O2===2S↓+2H2O
(5)激发态的电子从能量较高的轨道跃迁到能量较低的轨道时,以一定波长(可见光区域)光的形式释放能量
22.(8分)
(1)+4H2O+3e =Fe(OH)3+5OH- ; 右 ; 使用时间长、工作电压稳定;
(2) 75% (3) O2+2CO2+4e =2
23.(12分)Ⅰ.(1)氧气
(2)C2H5OH+16OH--12e-===2CO32-+11H2O
(3)O2+4H++4e-===2H2O 、H+
(4)a ;O2+2CO2+4e-===2CO32- ;
Ⅱ.H2O2+2e-===2OH- ;减小
24.(8分)(1).
(2) B ;水浴加热
(3) 防止外界的水蒸气进入C装置
(4) ; c
25.(8分) (2) Cl2+2Br-===Br2+2Cl-
(3) c ;Br2+SO+H2O===SO+2Br-+2H+
(4) NaOH溶液
(5)①③⑤⑥⑦ ; 59℃(58.78 ℃~60 ℃之间均可)
同课章节目录
