河南省洛阳市洛宁县2022-2023学年高三上学期8月开学考试化学试卷(Word版含解析)
文档属性
| 名称 | 河南省洛阳市洛宁县2022-2023学年高三上学期8月开学考试化学试卷(Word版含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 286.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-30 15:47:46 | ||
图片预览




文档简介
洛宁县2022-2023学年高三上学期8月开学考试
化学
(考试时间:90分钟试卷满分:100分)
注意事项:
1.答卷前,考生务必将自己的姓名、考生号、考场号和座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂 黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在 答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.可能用到的相对原子质量:H I C12 0 16 Na23 S32 Fe56 Cu64
第I卷(选择题共42分)
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
1.在香港回归祖国二十五周年之际,筹备多年的香港故宫文化博物馆在7月2日正式对公众开放,本次香港故宫文化博物馆开幕展览中,将有许多珍贵文物分批展出,绝大部分为首次在港展出。下列几件展品中,其中主要成分为硅酸盐的是
A. 定窑白釉孩儿枕 B.填漆戗金炕桌 C.金錾云龙纹执壶 D.朱碧山银槎
2.下列有关硝酸的说法正确的是
A.实验室的浓硝酸通常呈黄色是因为含有少量 Fe3+
B.用蘸有浓氨水的玻璃棒靠近浓硝酸,有白烟产生
C.常温下用铁制容器运输浓硝酸是因为铁与浓硝酸不反应
D. Cu与浓硝酸反应生成N02,与稀硝酸反应生成NO,故稀硝酸的氧化性强于浓硝酸
3.有机物Q是一种具有解热镇痛及抗生素作用的药物的主要成分,其结构简式如图所示,下列关于该有机物的说法正确的是
A. 属于芳香烃
B. 与乙酸互为同系物
C. 苯环上的一氯取代物只有一种
D. 能发生氧化反应和取代反应
4. 金属单质及其化合物在日常生产和生活中有广泛的应用,其中涉及的化学知识错误的是
A.利用稀硝酸和KSCN溶液检验菠菜中的铁元素
B.向月饼包装袋中加入铁粉防止月饼氧化变质
C.苛性钠能与盐酸反应,故可用作治疗胃酸过多的一种药剂
D.铜盐能杀死某些细菌,并能抑制藻类生长,因此游泳馆常用硫酸铜作池水消毒剂
5.下列离子方程式书写正确的是
A. 铝片与 NaOH 溶液反应:2Al+20H-+2H2O=2Al〇2-+3H2↑
B. 用稀盐酸处理铜器表面的铜镑:Cu0+2H+=Cu2++H20
C. 向Na2S203溶液中加人足量稀硝酸:S2O32-+2H+=S↓+S02↑+H20
D. 向 Mg(OH)2 悬浊液中加人 FeCl3 溶液:30H-+Fe3+=Fe(OH)3 ↓
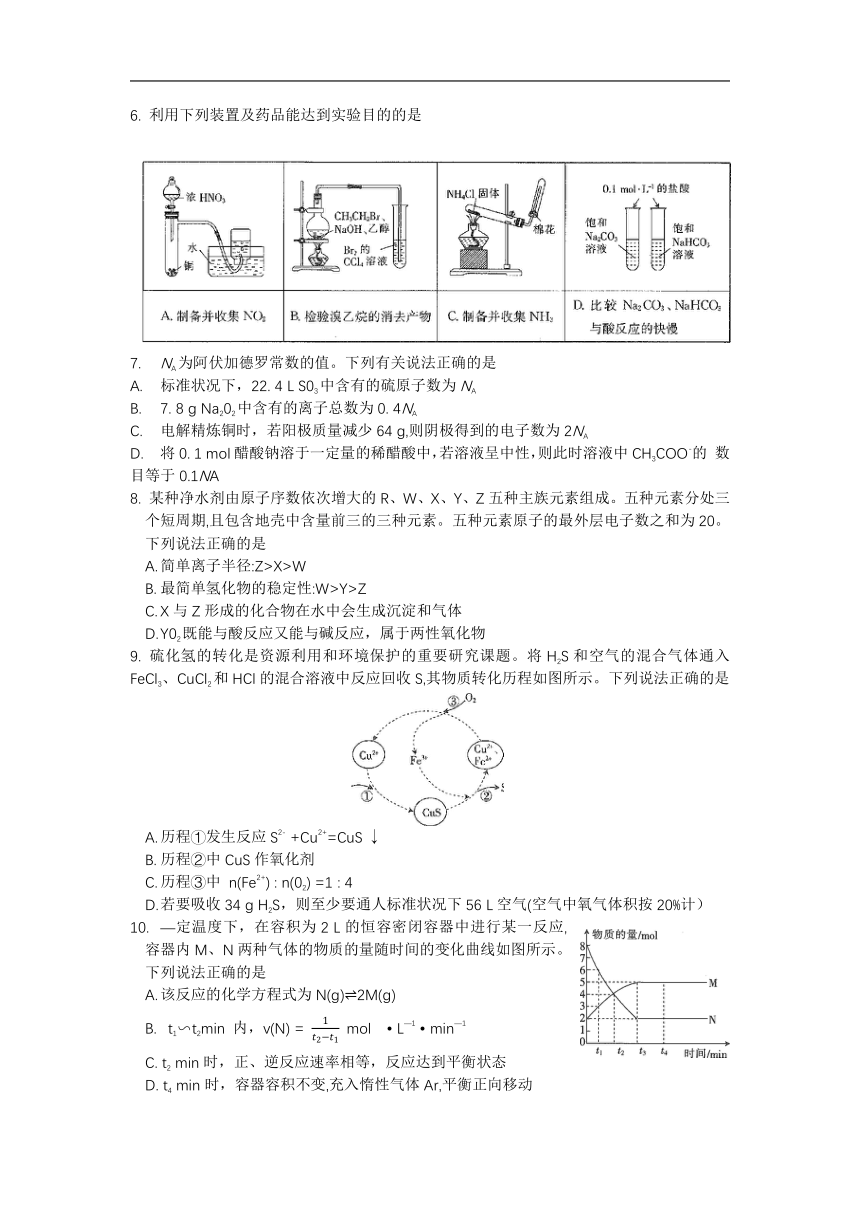
6. 利用下列装置及药品能达到实验目的的是
7. NA为阿伏加德罗常数的值。下列有关说法正确的是
A. 标准状况下,22. 4 L S03中含有的硫原子数为NA
B. 7. 8 g Na202中含有的离子总数为0. 4NA
C. 电解精炼铜时,若阳极质量减少64 g,则阴极得到的电子数为2NA
D. 将0. 1 mol醋酸钠溶于一定量的稀醋酸中,若溶液呈中性,则此时溶液中CH3COO-的 数目等于0.1NA
8. 某种净水剂由原子序数依次增大的R、W、X、Y、Z五种主族元素组成。五种元素分处三个短周期,且包含地壳中含量前三的三种元素。五种元素原子的最外层电子数之和为20。下列说法正确的是
A. 简单离子半径:Z>X>W
B. 最简单氢化物的稳定性:W>Y>Z
C. X与Z形成的化合物在水中会生成沉淀和气体
D. Y02既能与酸反应又能与碱反应,属于两性氧化物
9. 硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入 FeCl3、CuCl2和HCl的混合溶液中反应回收S,其物质转化历程如图所示。下列说法正确的是
A. 历程①发生反应S2- +Cu2+=CuS ↓
B. 历程②中CuS作氧化剂
C. 历程③中 n(Fe2+) : n(02) =1 : 4
D. 若要吸收34 g H2S,则至少要通人标准状况下56 L空气(空气中氧气体积按20%计)
10. —定温度下,在容积为2 L的恒容密闭容器中进行某一反应,容器内M、N两种气体的物质的量随时间的变化曲线如图所示。下列说法正确的是
A. 该反应的化学方程式为N(g)2M(g)
B. t1∽t2min 内,v(N) = mol L—1 min—1
C. t2 min时,正、逆反应速率相等,反应达到平衡状态
D. t4 min时,容器容积不变,充入惰性气体Ar,平衡正向移动
11. 某化学兴趣小组用废弃易拉罐(含有Al和少量Fe、Mg杂质)制备明矶的流程如图所示:
下列说法正确的是
A. 为尽量少引入杂质,NaOH溶液应改用KOH溶液或氨水
B. 生成“沉淀”的离子方程式为 Al02-+NH4++2H20=Al(〇H)3 ↓ +NH3 H20
C. 整个流程中有3处涉及过滤
D. “操作a”为蒸发结晶
12. 下列实验不能达到预期实验目的的是
选项 实验 实验目的
A 室温下,用pH计测定浓度均为0. 1 mol L-1的NaHC03溶液 和CH3COONa溶液的pH 比较H2C03和CH3COOH的酸性强弱
B 向盛有1 mL 0. 2 mol L-1 NaOH溶液的试管中滴加2滴 0.1 mol L-1的MgCl2溶液,产生白色沉淀后,再滴加2滴 0. 1 mol L-1的FeCl2溶液,又产生红褐色沉淀 验证该温度下Ksp[Mg(OH)2]> Ksp[Fe(OH)3]
C 用铁片、铜片、稀硫酸等组成原电池 比较铁、铜的金属性强弱
D 室温下,分别向2支试管中加人相同体积、相同浓度的Na2S203 溶液,再分别加人相同体积、不同浓度的稀硫酸 研究浓度对反应速率的影响
13. 超纯水微细电解加工是在常规电解加工原理的基础上,利用超纯水作电解液,并采用阳离子交换膜促进水解离来提高超纯水中OH-的浓度,使电解电流密度达到足够蚀刻材料的一种新型电解加工工艺。铜的微细电解加工如图,所用的阳离子交换膜为RS03H,RS03H自身 能解离成固定基团RSO3-和自由离子H+。下列说法错误的是
A. M为电源的正极
B. 辅助电极上有气泡产生
C. 工件电极上的电极反应式为Cu—2e—+20H-=Cu(OH)2
D. 阳离子交换膜向上的面上发生的反应为RSO3-+H2O=RSO3H+〇H—
14. 用一定浓度的H2S04溶液分别滴定体积均为20. 00 mL、浓度均为0.100 mol L-1的
Ba(OH)2、NaOH和NH3 H2O三种溶液,滴定过程中三种溶液的电导率如图所示。(已
知:溶液电导率越大,导电能力越强)下列说法错误的是
A. 曲线①②③分别代表Ba(OH)2、NaOH和NH3 H2〇
B. H2S04的浓度为0. 100mol L-1
C. a、b、c、d四点中,d点水的电离程度最小
D. d点对应的溶液中粒子浓度大小关系:c(NH4+ ) +c(H+)= c(S〇42-)+c(OH-)
第II卷(非选择题共58分)
二、必考题:本题共3小题,共43分。
15. (15分)草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐均易溶于水,而其钙盐难溶于水。草酸晶体(H2C204 2H20)无色,熔点为101 °C,易溶于水,受热易脱水、升华,175 °C时分解。某兴趣小组用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。
实验步骤如下:
糖化:先将淀粉水解为葡萄糖;
② 氧化:在淀粉水解液中加人混酸(质量之比为3: 2的65%HN03与98%H2S04的混合 物),在55 60 °C下发生反应;
③ 反应后溶液经冷却、减压过滤,即得草酸晶体(H2C204 2H20)粗产品。
(1) 装混酸的仪器名称为_________ ,冷凝管进水的接口为_______ (填“a”或“b”)。
(2) 步骤①中判断淀粉水解是否完全的操作为___________ 。
(3) 步骤②中,配制混酸的方法是____________ ;氧化时可通过_______ (填操作)控制反应温度不超过60 °C,控温的作用是___________ 。
(4) 反应结束后测得B的烧杯中NaN〇3与NaN02的物质的量之比为1 : 9,则葡萄糖(C6 H1206)被氧化为草酸(不考虑其他的副反应)的化学方程式为______________________ 。
(5) 称取8. 0 g草酸晶体粗产品,配成100 mL溶液。取25. 00 mL于锥形瓶中,加入适量硫酸,用0 200 mol L-1的KMn04标准液滴定,杂质不参与反应,数据记录如表所示,则滴定时发生反应的离子方程式为______________________;该草酸晶体(H2C204 2H2〇)的纯度为__
____ %.
起始滴定管的读数/mL 实验结束滴定管的读数/mL
第一次 0. 10 22.35
箄二次 1. 50 22. 10
第三次 0. 80 22.95
11. (13分)苯胺是一种无色油状液体,加热至370 °C会分解,微溶于水,易溶于有机溶剂,能被二氧化锰氧化成对苯酿。一种用苯胺还原软锰矿(主要成分是 Mn〇2,含Si〇2、Fe203、Al203等杂质)制备MnS〇4 H20的工艺流程如图。
溶液中金属离子开始沉淀和完全沉淀时的pH如下表所示:
回答下列问题:
(1) 还原酸浸前将软猛矿粉碎的目的是___________ ,为达到该目的在加入苯胺和稀硫酸后
常采取的操作为______________ 。
(2) 沉淀1的主要成分为__________ (填化学式),写出还原酸浸时主要发生反应的化学方程
式:___________________________ 。
(3) 根据上表数据,Ksp[Mn(OH)2]、Ksp[Fe(OH)3]、Ksp[AKOH)3]由大到小的顺序为__________
_______ 。调pH步骤中应控制的pH范围是_____ ______ 。
⑷MnS04溶液结晶温度越低,MnS04所带结晶水就越多,在9 °C时,可结晶出MnS04 7H20, 在26 °C时,可结晶出MnS04 4H2O,在100 °C左右时,可结晶出MnS04 H20,则从操作A所得的溶液中获得MnS04 H20晶体需要进行的操作是______________________________.洗涤、干燥。从制取的产品中,称取一定质量的MnS04 H20样品用BaCl2标准溶液滴定(操作过程产生的误差很小,可忽略),计算所得样品的质量分数大于100%,可能的原因是_____
________________ 。
17。(15分)尿素[CO(NH3)2]是首个由无机物人工合成的有机物。
(1) 在尿素合成塔中发生的反应可表示为2NH3 (g) +C02 (g) NH2COONH4 (l) C0(NH2)2(s)+H20(g);已知第一步反应为快速反应,119. 2 kJ ﹒ mol-1,第二步 反应为慢速反应, = + 15. 5 kJ ﹒ mol-1则 2NH3(g) + C02(g)#C0(NH2)2(s) +
H20(g) = ___________ kJ ﹒ mol-1,下列图像能表示尿素合成塔中发生反应的能量变化历程的是__________ (填标号)。
(2) T°C,在2 L的密闭容器中,通入2 mol NH3和1 mol C〇2,保持体积不变,发生反应 2NH3(g) +C02(g)CO(NH2)2 (s) + H2〇(g),10 min 时反应刚好达到平衡,测得起始压强为平衡时压强的1. 5倍,则:
① NH3的平衡转化率为__________ 。
② 能说明上述反应达到平衡状态的是____________ (填标号)。
A. n(C02) : n(NH3)=1 : 2
B. 混合气体的密度不再发生变化
C. 单位时间内消耗2 mol NH3,同时生成1 mol H2〇
D. C02的体积分数在混合气体中保持不变
③ 若10 min时保持温度和压强不变,再向容器中同时充人0. 5 mol C02(g)和0. 5 mol
H2 0(g),则此时平衡_________ (填“正向移动”、“逆向移动”或“不移动”).
(3) 一定温度下,某恒容密闭容器中发生反应2NH3 (g) +C02 (g)#CO(NH2)2 (s) +H20(g),若原料气中,测得m与C02的平衡转化率(a)的关系如图所示:
① 若平衡时A点容器内总压强为0.5 MPa,则上述反应的平衡常数Kp=_____(MPa) —2。(用平衡分压代替平衡浓度计算,分压=总压X物质的量分数)
② 若平衡时A、B对应容器的压强相等,则A、B对应的容器中,起始时投入氨气的物质
的量之比 nA(NH3) : nB(NH3)=_____________ 。
⑷用惰性电极电解尿素[CO(NH2)2]W碱性溶液可制取氢气,装置如图所示。则B为直流电源的_____极,写出该装置阳极的电极反应式:_________________ 。
三、选考题:共15分,请考生从18、19题中任选一题作答,如果多做,则按所做的第一题计分。
18. (15分)(物质结构与性质)科幻电影《阿凡达》中外星人流的是蓝色的血液,其实血液的颜色 主要是由血蛋白中含有的金属元素决定的,如含铁元素的为常见红色血液、含铜元素的为蓝 色血液、含钒元素的为绿色血液等,铜、铁、钒在科学研究和工农业生产中有许多用途。回答下列问题:
(1) 基态V的核外电子排布式为_______ ;基态Cu、Fe、V的核外未成对电子数之比为____
__________.
(2) 在高温下CuO能分解生成Cu20,试从原子结构角度解释其原因:____________________ 。
(3) 70 °C时,Cu(〇H)2会与甘氨酸(H2NCH2CO〇H)反应生成甘氨酸铜,其结构如图所示:
要确定甘氨酸铜是晶体还是非晶体,最科学的方法是________________ 。
②甘氨酸铜中H、C、N、0四种元素的电负性从大到小的顺序为________________ (填
元素符号),由这四种元素中的某几种元素形成的微粒中,VSEPR模型为平面三角形的是
________________(填化学式,填一种即可)。
③已知图中两种甘氨酸铜的其中一种不溶于水,另一种能溶于水,依据相似相容原理判断,能溶于水的是_____________ (填物质名称)。
④ 顺式一甘氨酸合铜中,Cu的配位数为_____ ,以sp3杂化的原子有____ (填元素符号)。
(4)铁与硫能形成多种化合物,某种化合物的晶胞结构如图所示。该化合物的化学式是____
______ ;若该晶胞边长为a nm,NA为阿伏加德罗常数的值,则该晶体的密度为___________
g cm-3。
19. (15分)(有机化学基础)化合物G是一些三唑类药物的重要中间体,其某种合成路线如图所示:
回答下列问题:
(1) A的名称为________ 。
(2) E中含氧官能团的名称是______ ;E→F的反应类型是_______ 。
(3) D的结构简式为_______________ 。
(4) A→B的化学方程式为________________________ 。
(5) 芳香族化合物M是D的同分异构体,符合下列条件的M的结构有_____ 种;其中核磁共振氢谱图中峰面积比是6 :6:3 : 1的结构简式为___________________ 。
①分子中除苯环不含其他的环
(6) 请设计以和CH3CO〇OH为原料制备的合成路线(无机试剂和溶剂任选)。
高三化学考试参考答案
1.A【解析】本题主要考查化学与生活,侧重考查学生对基础知识的认知能力。定窑白釉孩儿枕为瓷器,主要成分为硅酸盐,A项符合题意;填漆戗金炕桌主体材质为木材,B项不符合题意;金錾云龙纹执壶的材质为 金,C项不符合题意;朱碧山银槎是元代的银器,其材质为银,D项不符合题意。
2.B【解析】本题主要考查硝酸的有关性质,侧重考查学生的知识记忆能力。实验室的浓硝酸通常呈黄色是因为浓硝酸不稳定,易分解生成N02,N02溶于浓硝酸使浓硝酸呈黄色,A项错误;浓氨水和浓硝酸都具有挥 发性,用蘸有浓氨水的玻璃棒靠近浓硝酸时,挥发出的氨气与硝酸蒸气反应生成硝酸铵,会有白烟产生,B项 正确;常温下铁在浓硝酸中发生钝化,生成的致密氧化膜阻碍反应的进行,C项错误;浓硝酸的氧化性强于稀 硝酸,D项错误。
3. D【解析】本题主要考查有机物Q的结构与性质,侧重考查学生的知识迁移能力。该有机物结构中含有氧原子,不属于芳香烃,属于芳香族化合物,A项错误;该有机物属于芳香羧酸,与乙酸结构不相似,不互为同系物,B项错误;苯环上有两种等效氢原子,故苯环上的一氯取代物有两种,C项错误。
4.C【解析】本题主要考查金属化合物的性质,侧重考查学生对知识的理解能力。苛性钠是强碱,不能用于治疗胃酸过多,一般用碳酸氢钠治疗胃酸过多,C项错误。
5. A【解析】本题主要考查离子方程式的书写,侧重考查学生对基础知识的理解能力。铜锈的主要成分为碱式碳酸铜,B项错误;稀硝酸有强氧化性,会将Na2S203氧化成硫酸钠,C项错误;Mg(OH)2是弱碱且难溶于 水,不能拆分,D项错误。
6. B【解析】本题主要考查化学实验,侧重考查学生的实验能力。)02能与水发生反应,A项不符合题意;冷却后的氨气与氯化氢能再次化合生成氯化铵,C项不符合题意;碳酸钠与碳酸氢钠的溶解度不同,没有控制 唯一变量,且Na2C03溶液中无明显现象,D项不符合题意。
7. D【解析】本题主要考查阿伏加德罗常数,侧重考查学生的分析和计算能力。标准状况下,S03非气体,A项 错误;7. 8gNa202中含有的离子总数为0. 3NA , B项错误;粗铜中含许多杂质,减少的64g不全是铜,C项错误。
8. C【解析】本题主要考查元素周期律,侧重考查学生对知识的综合运用能力。五种元素分处三个短周期,且原子序数依次增大,则R为H;五种元素包含地壳中含量前三的元素0、S、Al,五种元素原子最外层电子数之和为20,则另一种元素为S,故W为0,X为Al,Y为S,Z为S。电子层结构相同的离子,原子序数越大,半径越小,所以Al3+<02-,A项错误;非金属性:0>S>Si,所以最简单氢化物的稳定性:H20>H2S> SiH4,B项错误;Si02只能与氢氟酸反应,与其他酸均不反应,属于酸性氧化物,D项错误。
9. D【解析】本题主要考查化学反应历程,侧重考查学生的模型认知和证据推理能力。根据图示可知历程①是 CA+与H( S气体发生复分解反应产生CuS黑色沉淀和H> , A项错误;在历程②中,CuS与Fe3+发生氧化还 原反应,生成S、Cu2+、Fe2+ , CuS作还原剂,B项错误;在历程③中,Fe2+与02发生氧化还原反应,产生Fe3+、 H20,根据氧化还原反应过程中电子转移守恒可知,n(Fe2+) : n(02)=4 : 1,C项错误。
10. B【解析】本题主要考查化学反应速率与平衡,侧重考查学生的分析和运用能力。达到平衡时,N减少 8mo1—2mol=6mol , M增加5mo1—2mol=3mol ,由此可知该反应的化学方程式为2N(g)M(g) , A项错误;t1 t2 min 内,N 减少 6mo1 — 4mol=2mol,容器容积为 2L,v(N) = mol L—1 min—1 ,B 项正确;t2 min时,M和N的物质的量仍然在变化,正、逆反应速率不相等,反应没有达到平衡状态,C项错误; 容器容积不变,充入惰性气体Ar、M、N的浓度不变,正、逆反应速率不变,平衡不移动,D项错误。
11. C【解析】本题主要考查明矾的制备流程,侧重考查学生分析和解决问题的能力。氨水不能溶解Al, A项 错误;生成“沉淀”的离子方程式为Al02-+HC03-+H20=Al(0H)3 ↓ +C032-, B项错误;明矶是带结晶水的晶体,“操作a”应为蒸发浓缩、冷却结晶、过滤、洗涤、干燥等,D项错误。
12. B【解析】本题主要考查化学实验,侧重考查学生的证据推理能力。Na0H过量,再滴加FeCl3溶液后,FeCl3与NaOH直接反应生成Fe(OH) 3,不能说明Ksp [Mg(OH)2,>KSP[Fe(OH) 3,B项符合题意。
13. D【解析】本题主要考查电化学,侧重考查学生的知识迁移能力。在电解加工中,加工工件作阳极,电极反 应式为Cu—2e-+2OH-=Cu(OH)2,故M为电源的正极,A项、C项均正确;辅助电极为阴极,电极反应 式为2H++2e- =H2 ↑ ,B项正确;超纯水中H+向辅助电极移动,OH-向工件电极移动,阳离子交换膜向下的面上发生的反应式为RSO3-+H2ORSO3H+OH- ,D项错误。
14.D【解析】本题主要考查电解质溶液中的离子平衡,侧重考查学生的综合运用能力。三种碱浓度都是 0. 100mol L-1 ,Ba(OH)2是二元强碱,NaOH是一元强碱,它们均完全电离,而NH3 H2O是一元弱碱, 在溶液中存在电离平衡,因此离子浓度:Ba(OH)2>NaOH>NH3 H2O,曲线①②③分别代表Ba(OH)2、 NaOH和NH3 H2O,A项正确;c点表示的是硫酸与Ba(OH)2恰好完全反应,反应为H2SO4+Ba(OH)2 =BaSO4↓+2H2O,由于二者消耗的体积相同,二者反应的物质的量之比是1 : 1,所以H2SO4的浓度与 Ba(OH)2相同,均为0. 100 mol L-1 ,B项正确;a点时NH3 H2O恰好被中和得到(NH4)2SO4溶液,该盐是强酸弱碱盐,水解使溶液显酸性,水的电离受到促进作用,b点时NaOH恰好被中和得到Na2SO4溶液,该盐是强酸强碱盐,不水解,水的电离不受影响,c点时H2SO4恰好被完全中和产生BaSO4,BaSO4是强酸强碱盐,不水解,溶液显中性,水的电离也不受影响,d点是H2SO4、(NH4)2SO4等浓度的混合溶液,过量的酸电离产生H+ ,使水的电离平衡受到抑制作用,所以a、b、c、d四点中,水的电离程度a点最大,d点最小,C项正确;根据电荷守恒可知溶液中离子浓度关系为c(NH4+)十c(H+) = 2c(SO42-)十c(OH-),D项错误。
15. (1)分液漏斗(1分);a(1分)
(2)取少量水解液于一洁净试管中,滴人几滴碘水,观察溶液是否变蓝(2分)
(3)先将硝酸加入烧杯中,然后加人浓硫酸,边加边搅拌(2分)水浴加热(1分)减少硝酸的挥发或分解(或防止有机物脱水炭化或其他合理答案,2分)
(4)C6H12O6 十 10HNO3 =3H2C2O4 + 6NO2 ↑+4NO ↑十8H2O(2 分)
(5)5H2C2O4 + 2MnO4—十6H+=2Mn2++10CO2 ↑十8H2O(2 分);69. 93(2 分)
【解析】本题主要考查草酸的制备实验,考查学生的实验能力和计算能力。
(3)浓硫酸与硝酸混合时,相当于稀释浓硫酸,会放出大量热,故需先将硝酸加人烧杯中,然后加入浓硫酸,边加边搅拌。
(4)依据反应 2NaOH + 2NO2=NaNO3+NaNO2+H2O和反应 2NaOH + NO2+NO= 2NaNO2 +H2O,当产物NaNO3与NaNO2的物质的量之比为1 : 9时,参与反应的NO2和
NO的物质的量之比为 3 : 2,故葡萄糖(C6H12O6)被氧化的化学方程式为C6H12O6+10HNO3 =3H2C2O4+6NO2 ↑+NO↑+ 8H2O。
(5)依据数据,第一次消耗KMnO4标准液22. 25 mL,第二次消耗KMnO4标准液20. 60 mL,第三次消耗 KMnO4标准液22. 15mL。第二次为无效数据,故本次实验平均消耗KMnO4标准液22. 20 mL,则该草酸晶体(H2C2O4 2H2O)的纯度为X100% = 69. 93%。
16. ⑴增大接触面积,加快酸浸速率(1分)搅拌(1分)
(3)Ksp[Mn(OH)2]>Ksp[Al(OH)3]>Ksp[Fe(OH)3](2 分)4. 7(1 分)8. 1(分)
(4)蒸发结晶、趁热过滤(分)样品失去部分结晶水(或样品中混有硫酸盐杂质,2分)
【解析】本题主要考查制备MnSO4 ﹒H2O的工艺流程,考查学生的推理与综合运用能力。
(1)粉碎能增大表面积,从而加快酸浸速率,由于苯胺微溶于水,故需搅拌使反应物充分接触。
⑶依据Ksp的定义以及表中数据,依次可算出Ksp [Mn(OH)2] = 0. 01X (108.1-14)2 = 10-13.8、 Ksp[Fe(OH)3] = 0. 01 X(102.2—14 )3 =10—37.4、Ksp[Al(OH)3] =0. 01 X(103.7—14 )3 = 10—32.9。
17. (1) -103. 7(1 分);C(1 分)
(2) ①50%(2 分)
②BD(2分)
③逆向移动(分)
(3) ①9(2 分)
② 11 : 10(2 分)
(4)负(1分)CO(NH2)2 —6e-+8OH-=N2 ↑十CO32-+6H2O(2 分)
【解析】本题主要考查化学反应原理,考查学生的分析与计算能力。
(2)①设平衡时,CO2转化了 a mol,据此列三段式:
2NH3(g)+ CO2(g)CO(NH2)2(s)+H2O(g) 气体总物质的量
起始/mol 2 1 0 3
转化/mol 2a a a
平衡/mol 2-2a 1-a a 3 -2a
起始压强为平衡时压强的1. 5倍,依据pV=nRT,则起始时气体物质的量为平衡时的1. 5倍,即3 —2a = 2,a = 0. 5,故氨气的平衡转化率为50%。
10 min时反应刚好达到平衡时,K= = 4,同时充入0. 5mol CO2(g)和0. 5mol H2O(g)后,依据pv=nRT,容器的体积由原来的2 L变为3 L,此时Q= = 9>K=4,平衡将逆向移动。
⑶设A点对应体系起始时NH3为3x mol,CO2为xmol, B点对应体系起始时NH3为2y mol,CO2为 y mol,据此列三段式:
2NH3 (g) +CO2 (g)CO(NH2) ( s) + H2O(g)气体总物质的量
A点对应体系 起始 /mol 3x x 0
转化 /mol x 0. 5x 0.5x
平衡/mol 2x 0. 5x 0.5x 3x
B 点对应体系 起始/mol 2y y 0
转化 /mol 0.8y 0. 4y 0.4y
平衡/mol 1.2y 0. 6y 0.4y 2. 2y
①A点容器内总压强为0. 5 MPa,则Kp= = 9 (MPa)-2。
②平衡时,A、B对应的容器压强相等,依据pV=nRT,则3x=2. 2:y,nA(NH3) : nB(NH3) = 11 : 10。
18. (1)[Ar]3d34s2 (或 1s22s22p63s23p63d34s2,1 分)1:4 : 3(1 分)
(2) Cu+的最高能级为3d9 ,而Cu+的最高能级为3d10,结构上全充满的3d10更稳定(2分)
(3) ①进行X—射线衍射实验(1分)
② O>N>C>H(2分);HCHO (或其他合理答案,1分)
③ 顺式一甘氨酸合铜(1分)
④ 4(1分);C、O、N(2分,少写一种扣1分,扣完为止)
(4) FeS2( 1 分); ( 2 分)
【解析】本题主要考查物质结构与性质,考查学生的计算和综合运用能力。
(3)②中心原子以sp2杂化的四原子微粒的VSEPR模型一般为平面三角形,符合条件的微粒有HCHO、 C032-、NO3- 等。
③水为极性溶剂,顺式一甘氨酸合铜的极性更强,因此能溶于水的是顺式一甘氨酸合铜。
⑷依据均摊原则,晶胞中Fe的数目为8 + 6 + = 4,S的数目为122+12 = 8,故该化合物的化学式为FeS2;该晶体的密度为 (g cm 3)。
19. (1)氯苯(1分)
(2)羰基(或酮羰基)、硝基(2分)氧化反应(1分)
【解析】本题主要考查有机合成路线,考查学生的推理和综合运用能力。
(5)M的分子式为C12H16ON2,依据条件可推知,苯环上的6个取代基有两种组合:①-N=N-CH3-CH0和4个-CH3 ;②-N=N-CH3、-OH、-CH=CH2和3个-CH3。若为①组合,则有3种位置异构,若为②组合,则有10种位置异构,故符合条件的M共有13种结构。
化学
(考试时间:90分钟试卷满分:100分)
注意事项:
1.答卷前,考生务必将自己的姓名、考生号、考场号和座位号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡上对应题目的答案标号涂 黑。如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在 答题卡上。写在本试卷上无效。
3.考试结束后,将本试卷和答题卡一并交回。
4.可能用到的相对原子质量:H I C12 0 16 Na23 S32 Fe56 Cu64
第I卷(选择题共42分)
一、选择题:本题共14小题,每小题3分,共42分。每小题只有一个选项符合题目要求。
1.在香港回归祖国二十五周年之际,筹备多年的香港故宫文化博物馆在7月2日正式对公众开放,本次香港故宫文化博物馆开幕展览中,将有许多珍贵文物分批展出,绝大部分为首次在港展出。下列几件展品中,其中主要成分为硅酸盐的是
A. 定窑白釉孩儿枕 B.填漆戗金炕桌 C.金錾云龙纹执壶 D.朱碧山银槎
2.下列有关硝酸的说法正确的是
A.实验室的浓硝酸通常呈黄色是因为含有少量 Fe3+
B.用蘸有浓氨水的玻璃棒靠近浓硝酸,有白烟产生
C.常温下用铁制容器运输浓硝酸是因为铁与浓硝酸不反应
D. Cu与浓硝酸反应生成N02,与稀硝酸反应生成NO,故稀硝酸的氧化性强于浓硝酸
3.有机物Q是一种具有解热镇痛及抗生素作用的药物的主要成分,其结构简式如图所示,下列关于该有机物的说法正确的是
A. 属于芳香烃
B. 与乙酸互为同系物
C. 苯环上的一氯取代物只有一种
D. 能发生氧化反应和取代反应
4. 金属单质及其化合物在日常生产和生活中有广泛的应用,其中涉及的化学知识错误的是
A.利用稀硝酸和KSCN溶液检验菠菜中的铁元素
B.向月饼包装袋中加入铁粉防止月饼氧化变质
C.苛性钠能与盐酸反应,故可用作治疗胃酸过多的一种药剂
D.铜盐能杀死某些细菌,并能抑制藻类生长,因此游泳馆常用硫酸铜作池水消毒剂
5.下列离子方程式书写正确的是
A. 铝片与 NaOH 溶液反应:2Al+20H-+2H2O=2Al〇2-+3H2↑
B. 用稀盐酸处理铜器表面的铜镑:Cu0+2H+=Cu2++H20
C. 向Na2S203溶液中加人足量稀硝酸:S2O32-+2H+=S↓+S02↑+H20
D. 向 Mg(OH)2 悬浊液中加人 FeCl3 溶液:30H-+Fe3+=Fe(OH)3 ↓
6. 利用下列装置及药品能达到实验目的的是
7. NA为阿伏加德罗常数的值。下列有关说法正确的是
A. 标准状况下,22. 4 L S03中含有的硫原子数为NA
B. 7. 8 g Na202中含有的离子总数为0. 4NA
C. 电解精炼铜时,若阳极质量减少64 g,则阴极得到的电子数为2NA
D. 将0. 1 mol醋酸钠溶于一定量的稀醋酸中,若溶液呈中性,则此时溶液中CH3COO-的 数目等于0.1NA
8. 某种净水剂由原子序数依次增大的R、W、X、Y、Z五种主族元素组成。五种元素分处三个短周期,且包含地壳中含量前三的三种元素。五种元素原子的最外层电子数之和为20。下列说法正确的是
A. 简单离子半径:Z>X>W
B. 最简单氢化物的稳定性:W>Y>Z
C. X与Z形成的化合物在水中会生成沉淀和气体
D. Y02既能与酸反应又能与碱反应,属于两性氧化物
9. 硫化氢的转化是资源利用和环境保护的重要研究课题。将H2S和空气的混合气体通入 FeCl3、CuCl2和HCl的混合溶液中反应回收S,其物质转化历程如图所示。下列说法正确的是
A. 历程①发生反应S2- +Cu2+=CuS ↓
B. 历程②中CuS作氧化剂
C. 历程③中 n(Fe2+) : n(02) =1 : 4
D. 若要吸收34 g H2S,则至少要通人标准状况下56 L空气(空气中氧气体积按20%计)
10. —定温度下,在容积为2 L的恒容密闭容器中进行某一反应,容器内M、N两种气体的物质的量随时间的变化曲线如图所示。下列说法正确的是
A. 该反应的化学方程式为N(g)2M(g)
B. t1∽t2min 内,v(N) = mol L—1 min—1
C. t2 min时,正、逆反应速率相等,反应达到平衡状态
D. t4 min时,容器容积不变,充入惰性气体Ar,平衡正向移动
11. 某化学兴趣小组用废弃易拉罐(含有Al和少量Fe、Mg杂质)制备明矶的流程如图所示:
下列说法正确的是
A. 为尽量少引入杂质,NaOH溶液应改用KOH溶液或氨水
B. 生成“沉淀”的离子方程式为 Al02-+NH4++2H20=Al(〇H)3 ↓ +NH3 H20
C. 整个流程中有3处涉及过滤
D. “操作a”为蒸发结晶
12. 下列实验不能达到预期实验目的的是
选项 实验 实验目的
A 室温下,用pH计测定浓度均为0. 1 mol L-1的NaHC03溶液 和CH3COONa溶液的pH 比较H2C03和CH3COOH的酸性强弱
B 向盛有1 mL 0. 2 mol L-1 NaOH溶液的试管中滴加2滴 0.1 mol L-1的MgCl2溶液,产生白色沉淀后,再滴加2滴 0. 1 mol L-1的FeCl2溶液,又产生红褐色沉淀 验证该温度下Ksp[Mg(OH)2]> Ksp[Fe(OH)3]
C 用铁片、铜片、稀硫酸等组成原电池 比较铁、铜的金属性强弱
D 室温下,分别向2支试管中加人相同体积、相同浓度的Na2S203 溶液,再分别加人相同体积、不同浓度的稀硫酸 研究浓度对反应速率的影响
13. 超纯水微细电解加工是在常规电解加工原理的基础上,利用超纯水作电解液,并采用阳离子交换膜促进水解离来提高超纯水中OH-的浓度,使电解电流密度达到足够蚀刻材料的一种新型电解加工工艺。铜的微细电解加工如图,所用的阳离子交换膜为RS03H,RS03H自身 能解离成固定基团RSO3-和自由离子H+。下列说法错误的是
A. M为电源的正极
B. 辅助电极上有气泡产生
C. 工件电极上的电极反应式为Cu—2e—+20H-=Cu(OH)2
D. 阳离子交换膜向上的面上发生的反应为RSO3-+H2O=RSO3H+〇H—
14. 用一定浓度的H2S04溶液分别滴定体积均为20. 00 mL、浓度均为0.100 mol L-1的
Ba(OH)2、NaOH和NH3 H2O三种溶液,滴定过程中三种溶液的电导率如图所示。(已
知:溶液电导率越大,导电能力越强)下列说法错误的是
A. 曲线①②③分别代表Ba(OH)2、NaOH和NH3 H2〇
B. H2S04的浓度为0. 100mol L-1
C. a、b、c、d四点中,d点水的电离程度最小
D. d点对应的溶液中粒子浓度大小关系:c(NH4+ ) +c(H+)= c(S〇42-)+c(OH-)
第II卷(非选择题共58分)
二、必考题:本题共3小题,共43分。
15. (15分)草酸(乙二酸)存在于自然界的植物中,草酸的钠盐和钾盐均易溶于水,而其钙盐难溶于水。草酸晶体(H2C204 2H20)无色,熔点为101 °C,易溶于水,受热易脱水、升华,175 °C时分解。某兴趣小组用硝酸氧化法制备草酸晶体并测定其纯度,制备装置如图所示(加热、固定等装置略去)。
实验步骤如下:
糖化:先将淀粉水解为葡萄糖;
② 氧化:在淀粉水解液中加人混酸(质量之比为3: 2的65%HN03与98%H2S04的混合 物),在55 60 °C下发生反应;
③ 反应后溶液经冷却、减压过滤,即得草酸晶体(H2C204 2H20)粗产品。
(1) 装混酸的仪器名称为_________ ,冷凝管进水的接口为_______ (填“a”或“b”)。
(2) 步骤①中判断淀粉水解是否完全的操作为___________ 。
(3) 步骤②中,配制混酸的方法是____________ ;氧化时可通过_______ (填操作)控制反应温度不超过60 °C,控温的作用是___________ 。
(4) 反应结束后测得B的烧杯中NaN〇3与NaN02的物质的量之比为1 : 9,则葡萄糖(C6 H1206)被氧化为草酸(不考虑其他的副反应)的化学方程式为______________________ 。
(5) 称取8. 0 g草酸晶体粗产品,配成100 mL溶液。取25. 00 mL于锥形瓶中,加入适量硫酸,用0 200 mol L-1的KMn04标准液滴定,杂质不参与反应,数据记录如表所示,则滴定时发生反应的离子方程式为______________________;该草酸晶体(H2C204 2H2〇)的纯度为__
____ %.
起始滴定管的读数/mL 实验结束滴定管的读数/mL
第一次 0. 10 22.35
箄二次 1. 50 22. 10
第三次 0. 80 22.95
11. (13分)苯胺是一种无色油状液体,加热至370 °C会分解,微溶于水,易溶于有机溶剂,能被二氧化锰氧化成对苯酿。一种用苯胺还原软锰矿(主要成分是 Mn〇2,含Si〇2、Fe203、Al203等杂质)制备MnS〇4 H20的工艺流程如图。
溶液中金属离子开始沉淀和完全沉淀时的pH如下表所示:
回答下列问题:
(1) 还原酸浸前将软猛矿粉碎的目的是___________ ,为达到该目的在加入苯胺和稀硫酸后
常采取的操作为______________ 。
(2) 沉淀1的主要成分为__________ (填化学式),写出还原酸浸时主要发生反应的化学方程
式:___________________________ 。
(3) 根据上表数据,Ksp[Mn(OH)2]、Ksp[Fe(OH)3]、Ksp[AKOH)3]由大到小的顺序为__________
_______ 。调pH步骤中应控制的pH范围是_____ ______ 。
⑷MnS04溶液结晶温度越低,MnS04所带结晶水就越多,在9 °C时,可结晶出MnS04 7H20, 在26 °C时,可结晶出MnS04 4H2O,在100 °C左右时,可结晶出MnS04 H20,则从操作A所得的溶液中获得MnS04 H20晶体需要进行的操作是______________________________.洗涤、干燥。从制取的产品中,称取一定质量的MnS04 H20样品用BaCl2标准溶液滴定(操作过程产生的误差很小,可忽略),计算所得样品的质量分数大于100%,可能的原因是_____
________________ 。
17。(15分)尿素[CO(NH3)2]是首个由无机物人工合成的有机物。
(1) 在尿素合成塔中发生的反应可表示为2NH3 (g) +C02 (g) NH2COONH4 (l) C0(NH2)2(s)+H20(g);已知第一步反应为快速反应,119. 2 kJ ﹒ mol-1,第二步 反应为慢速反应, = + 15. 5 kJ ﹒ mol-1则 2NH3(g) + C02(g)#C0(NH2)2(s) +
H20(g) = ___________ kJ ﹒ mol-1,下列图像能表示尿素合成塔中发生反应的能量变化历程的是__________ (填标号)。
(2) T°C,在2 L的密闭容器中,通入2 mol NH3和1 mol C〇2,保持体积不变,发生反应 2NH3(g) +C02(g)CO(NH2)2 (s) + H2〇(g),10 min 时反应刚好达到平衡,测得起始压强为平衡时压强的1. 5倍,则:
① NH3的平衡转化率为__________ 。
② 能说明上述反应达到平衡状态的是____________ (填标号)。
A. n(C02) : n(NH3)=1 : 2
B. 混合气体的密度不再发生变化
C. 单位时间内消耗2 mol NH3,同时生成1 mol H2〇
D. C02的体积分数在混合气体中保持不变
③ 若10 min时保持温度和压强不变,再向容器中同时充人0. 5 mol C02(g)和0. 5 mol
H2 0(g),则此时平衡_________ (填“正向移动”、“逆向移动”或“不移动”).
(3) 一定温度下,某恒容密闭容器中发生反应2NH3 (g) +C02 (g)#CO(NH2)2 (s) +H20(g),若原料气中,测得m与C02的平衡转化率(a)的关系如图所示:
① 若平衡时A点容器内总压强为0.5 MPa,则上述反应的平衡常数Kp=_____(MPa) —2。(用平衡分压代替平衡浓度计算,分压=总压X物质的量分数)
② 若平衡时A、B对应容器的压强相等,则A、B对应的容器中,起始时投入氨气的物质
的量之比 nA(NH3) : nB(NH3)=_____________ 。
⑷用惰性电极电解尿素[CO(NH2)2]W碱性溶液可制取氢气,装置如图所示。则B为直流电源的_____极,写出该装置阳极的电极反应式:_________________ 。
三、选考题:共15分,请考生从18、19题中任选一题作答,如果多做,则按所做的第一题计分。
18. (15分)(物质结构与性质)科幻电影《阿凡达》中外星人流的是蓝色的血液,其实血液的颜色 主要是由血蛋白中含有的金属元素决定的,如含铁元素的为常见红色血液、含铜元素的为蓝 色血液、含钒元素的为绿色血液等,铜、铁、钒在科学研究和工农业生产中有许多用途。回答下列问题:
(1) 基态V的核外电子排布式为_______ ;基态Cu、Fe、V的核外未成对电子数之比为____
__________.
(2) 在高温下CuO能分解生成Cu20,试从原子结构角度解释其原因:____________________ 。
(3) 70 °C时,Cu(〇H)2会与甘氨酸(H2NCH2CO〇H)反应生成甘氨酸铜,其结构如图所示:
要确定甘氨酸铜是晶体还是非晶体,最科学的方法是________________ 。
②甘氨酸铜中H、C、N、0四种元素的电负性从大到小的顺序为________________ (填
元素符号),由这四种元素中的某几种元素形成的微粒中,VSEPR模型为平面三角形的是
________________(填化学式,填一种即可)。
③已知图中两种甘氨酸铜的其中一种不溶于水,另一种能溶于水,依据相似相容原理判断,能溶于水的是_____________ (填物质名称)。
④ 顺式一甘氨酸合铜中,Cu的配位数为_____ ,以sp3杂化的原子有____ (填元素符号)。
(4)铁与硫能形成多种化合物,某种化合物的晶胞结构如图所示。该化合物的化学式是____
______ ;若该晶胞边长为a nm,NA为阿伏加德罗常数的值,则该晶体的密度为___________
g cm-3。
19. (15分)(有机化学基础)化合物G是一些三唑类药物的重要中间体,其某种合成路线如图所示:
回答下列问题:
(1) A的名称为________ 。
(2) E中含氧官能团的名称是______ ;E→F的反应类型是_______ 。
(3) D的结构简式为_______________ 。
(4) A→B的化学方程式为________________________ 。
(5) 芳香族化合物M是D的同分异构体,符合下列条件的M的结构有_____ 种;其中核磁共振氢谱图中峰面积比是6 :6:3 : 1的结构简式为___________________ 。
①分子中除苯环不含其他的环
(6) 请设计以和CH3CO〇OH为原料制备的合成路线(无机试剂和溶剂任选)。
高三化学考试参考答案
1.A【解析】本题主要考查化学与生活,侧重考查学生对基础知识的认知能力。定窑白釉孩儿枕为瓷器,主要成分为硅酸盐,A项符合题意;填漆戗金炕桌主体材质为木材,B项不符合题意;金錾云龙纹执壶的材质为 金,C项不符合题意;朱碧山银槎是元代的银器,其材质为银,D项不符合题意。
2.B【解析】本题主要考查硝酸的有关性质,侧重考查学生的知识记忆能力。实验室的浓硝酸通常呈黄色是因为浓硝酸不稳定,易分解生成N02,N02溶于浓硝酸使浓硝酸呈黄色,A项错误;浓氨水和浓硝酸都具有挥 发性,用蘸有浓氨水的玻璃棒靠近浓硝酸时,挥发出的氨气与硝酸蒸气反应生成硝酸铵,会有白烟产生,B项 正确;常温下铁在浓硝酸中发生钝化,生成的致密氧化膜阻碍反应的进行,C项错误;浓硝酸的氧化性强于稀 硝酸,D项错误。
3. D【解析】本题主要考查有机物Q的结构与性质,侧重考查学生的知识迁移能力。该有机物结构中含有氧原子,不属于芳香烃,属于芳香族化合物,A项错误;该有机物属于芳香羧酸,与乙酸结构不相似,不互为同系物,B项错误;苯环上有两种等效氢原子,故苯环上的一氯取代物有两种,C项错误。
4.C【解析】本题主要考查金属化合物的性质,侧重考查学生对知识的理解能力。苛性钠是强碱,不能用于治疗胃酸过多,一般用碳酸氢钠治疗胃酸过多,C项错误。
5. A【解析】本题主要考查离子方程式的书写,侧重考查学生对基础知识的理解能力。铜锈的主要成分为碱式碳酸铜,B项错误;稀硝酸有强氧化性,会将Na2S203氧化成硫酸钠,C项错误;Mg(OH)2是弱碱且难溶于 水,不能拆分,D项错误。
6. B【解析】本题主要考查化学实验,侧重考查学生的实验能力。)02能与水发生反应,A项不符合题意;冷却后的氨气与氯化氢能再次化合生成氯化铵,C项不符合题意;碳酸钠与碳酸氢钠的溶解度不同,没有控制 唯一变量,且Na2C03溶液中无明显现象,D项不符合题意。
7. D【解析】本题主要考查阿伏加德罗常数,侧重考查学生的分析和计算能力。标准状况下,S03非气体,A项 错误;7. 8gNa202中含有的离子总数为0. 3NA , B项错误;粗铜中含许多杂质,减少的64g不全是铜,C项错误。
8. C【解析】本题主要考查元素周期律,侧重考查学生对知识的综合运用能力。五种元素分处三个短周期,且原子序数依次增大,则R为H;五种元素包含地壳中含量前三的元素0、S、Al,五种元素原子最外层电子数之和为20,则另一种元素为S,故W为0,X为Al,Y为S,Z为S。电子层结构相同的离子,原子序数越大,半径越小,所以Al3+<02-,A项错误;非金属性:0>S>Si,所以最简单氢化物的稳定性:H20>H2S> SiH4,B项错误;Si02只能与氢氟酸反应,与其他酸均不反应,属于酸性氧化物,D项错误。
9. D【解析】本题主要考查化学反应历程,侧重考查学生的模型认知和证据推理能力。根据图示可知历程①是 CA+与H( S气体发生复分解反应产生CuS黑色沉淀和H> , A项错误;在历程②中,CuS与Fe3+发生氧化还 原反应,生成S、Cu2+、Fe2+ , CuS作还原剂,B项错误;在历程③中,Fe2+与02发生氧化还原反应,产生Fe3+、 H20,根据氧化还原反应过程中电子转移守恒可知,n(Fe2+) : n(02)=4 : 1,C项错误。
10. B【解析】本题主要考查化学反应速率与平衡,侧重考查学生的分析和运用能力。达到平衡时,N减少 8mo1—2mol=6mol , M增加5mo1—2mol=3mol ,由此可知该反应的化学方程式为2N(g)M(g) , A项错误;t1 t2 min 内,N 减少 6mo1 — 4mol=2mol,容器容积为 2L,v(N) = mol L—1 min—1 ,B 项正确;t2 min时,M和N的物质的量仍然在变化,正、逆反应速率不相等,反应没有达到平衡状态,C项错误; 容器容积不变,充入惰性气体Ar、M、N的浓度不变,正、逆反应速率不变,平衡不移动,D项错误。
11. C【解析】本题主要考查明矾的制备流程,侧重考查学生分析和解决问题的能力。氨水不能溶解Al, A项 错误;生成“沉淀”的离子方程式为Al02-+HC03-+H20=Al(0H)3 ↓ +C032-, B项错误;明矶是带结晶水的晶体,“操作a”应为蒸发浓缩、冷却结晶、过滤、洗涤、干燥等,D项错误。
12. B【解析】本题主要考查化学实验,侧重考查学生的证据推理能力。Na0H过量,再滴加FeCl3溶液后,FeCl3与NaOH直接反应生成Fe(OH) 3,不能说明Ksp [Mg(OH)2,>KSP[Fe(OH) 3,B项符合题意。
13. D【解析】本题主要考查电化学,侧重考查学生的知识迁移能力。在电解加工中,加工工件作阳极,电极反 应式为Cu—2e-+2OH-=Cu(OH)2,故M为电源的正极,A项、C项均正确;辅助电极为阴极,电极反应 式为2H++2e- =H2 ↑ ,B项正确;超纯水中H+向辅助电极移动,OH-向工件电极移动,阳离子交换膜向下的面上发生的反应式为RSO3-+H2ORSO3H+OH- ,D项错误。
14.D【解析】本题主要考查电解质溶液中的离子平衡,侧重考查学生的综合运用能力。三种碱浓度都是 0. 100mol L-1 ,Ba(OH)2是二元强碱,NaOH是一元强碱,它们均完全电离,而NH3 H2O是一元弱碱, 在溶液中存在电离平衡,因此离子浓度:Ba(OH)2>NaOH>NH3 H2O,曲线①②③分别代表Ba(OH)2、 NaOH和NH3 H2O,A项正确;c点表示的是硫酸与Ba(OH)2恰好完全反应,反应为H2SO4+Ba(OH)2 =BaSO4↓+2H2O,由于二者消耗的体积相同,二者反应的物质的量之比是1 : 1,所以H2SO4的浓度与 Ba(OH)2相同,均为0. 100 mol L-1 ,B项正确;a点时NH3 H2O恰好被中和得到(NH4)2SO4溶液,该盐是强酸弱碱盐,水解使溶液显酸性,水的电离受到促进作用,b点时NaOH恰好被中和得到Na2SO4溶液,该盐是强酸强碱盐,不水解,水的电离不受影响,c点时H2SO4恰好被完全中和产生BaSO4,BaSO4是强酸强碱盐,不水解,溶液显中性,水的电离也不受影响,d点是H2SO4、(NH4)2SO4等浓度的混合溶液,过量的酸电离产生H+ ,使水的电离平衡受到抑制作用,所以a、b、c、d四点中,水的电离程度a点最大,d点最小,C项正确;根据电荷守恒可知溶液中离子浓度关系为c(NH4+)十c(H+) = 2c(SO42-)十c(OH-),D项错误。
15. (1)分液漏斗(1分);a(1分)
(2)取少量水解液于一洁净试管中,滴人几滴碘水,观察溶液是否变蓝(2分)
(3)先将硝酸加入烧杯中,然后加人浓硫酸,边加边搅拌(2分)水浴加热(1分)减少硝酸的挥发或分解(或防止有机物脱水炭化或其他合理答案,2分)
(4)C6H12O6 十 10HNO3 =3H2C2O4 + 6NO2 ↑+4NO ↑十8H2O(2 分)
(5)5H2C2O4 + 2MnO4—十6H+=2Mn2++10CO2 ↑十8H2O(2 分);69. 93(2 分)
【解析】本题主要考查草酸的制备实验,考查学生的实验能力和计算能力。
(3)浓硫酸与硝酸混合时,相当于稀释浓硫酸,会放出大量热,故需先将硝酸加人烧杯中,然后加入浓硫酸,边加边搅拌。
(4)依据反应 2NaOH + 2NO2=NaNO3+NaNO2+H2O和反应 2NaOH + NO2+NO= 2NaNO2 +H2O,当产物NaNO3与NaNO2的物质的量之比为1 : 9时,参与反应的NO2和
NO的物质的量之比为 3 : 2,故葡萄糖(C6H12O6)被氧化的化学方程式为C6H12O6+10HNO3 =3H2C2O4+6NO2 ↑+NO↑+ 8H2O。
(5)依据数据,第一次消耗KMnO4标准液22. 25 mL,第二次消耗KMnO4标准液20. 60 mL,第三次消耗 KMnO4标准液22. 15mL。第二次为无效数据,故本次实验平均消耗KMnO4标准液22. 20 mL,则该草酸晶体(H2C2O4 2H2O)的纯度为X100% = 69. 93%。
16. ⑴增大接触面积,加快酸浸速率(1分)搅拌(1分)
(3)Ksp[Mn(OH)2]>Ksp[Al(OH)3]>Ksp[Fe(OH)3](2 分)4. 7(1 分)8. 1(分)
(4)蒸发结晶、趁热过滤(分)样品失去部分结晶水(或样品中混有硫酸盐杂质,2分)
【解析】本题主要考查制备MnSO4 ﹒H2O的工艺流程,考查学生的推理与综合运用能力。
(1)粉碎能增大表面积,从而加快酸浸速率,由于苯胺微溶于水,故需搅拌使反应物充分接触。
⑶依据Ksp的定义以及表中数据,依次可算出Ksp [Mn(OH)2] = 0. 01X (108.1-14)2 = 10-13.8、 Ksp[Fe(OH)3] = 0. 01 X(102.2—14 )3 =10—37.4、Ksp[Al(OH)3] =0. 01 X(103.7—14 )3 = 10—32.9。
17. (1) -103. 7(1 分);C(1 分)
(2) ①50%(2 分)
②BD(2分)
③逆向移动(分)
(3) ①9(2 分)
② 11 : 10(2 分)
(4)负(1分)CO(NH2)2 —6e-+8OH-=N2 ↑十CO32-+6H2O(2 分)
【解析】本题主要考查化学反应原理,考查学生的分析与计算能力。
(2)①设平衡时,CO2转化了 a mol,据此列三段式:
2NH3(g)+ CO2(g)CO(NH2)2(s)+H2O(g) 气体总物质的量
起始/mol 2 1 0 3
转化/mol 2a a a
平衡/mol 2-2a 1-a a 3 -2a
起始压强为平衡时压强的1. 5倍,依据pV=nRT,则起始时气体物质的量为平衡时的1. 5倍,即3 —2a = 2,a = 0. 5,故氨气的平衡转化率为50%。
10 min时反应刚好达到平衡时,K= = 4,同时充入0. 5mol CO2(g)和0. 5mol H2O(g)后,依据pv=nRT,容器的体积由原来的2 L变为3 L,此时Q= = 9>K=4,平衡将逆向移动。
⑶设A点对应体系起始时NH3为3x mol,CO2为xmol, B点对应体系起始时NH3为2y mol,CO2为 y mol,据此列三段式:
2NH3 (g) +CO2 (g)CO(NH2) ( s) + H2O(g)气体总物质的量
A点对应体系 起始 /mol 3x x 0
转化 /mol x 0. 5x 0.5x
平衡/mol 2x 0. 5x 0.5x 3x
B 点对应体系 起始/mol 2y y 0
转化 /mol 0.8y 0. 4y 0.4y
平衡/mol 1.2y 0. 6y 0.4y 2. 2y
①A点容器内总压强为0. 5 MPa,则Kp= = 9 (MPa)-2。
②平衡时,A、B对应的容器压强相等,依据pV=nRT,则3x=2. 2:y,nA(NH3) : nB(NH3) = 11 : 10。
18. (1)[Ar]3d34s2 (或 1s22s22p63s23p63d34s2,1 分)1:4 : 3(1 分)
(2) Cu+的最高能级为3d9 ,而Cu+的最高能级为3d10,结构上全充满的3d10更稳定(2分)
(3) ①进行X—射线衍射实验(1分)
② O>N>C>H(2分);HCHO (或其他合理答案,1分)
③ 顺式一甘氨酸合铜(1分)
④ 4(1分);C、O、N(2分,少写一种扣1分,扣完为止)
(4) FeS2( 1 分); ( 2 分)
【解析】本题主要考查物质结构与性质,考查学生的计算和综合运用能力。
(3)②中心原子以sp2杂化的四原子微粒的VSEPR模型一般为平面三角形,符合条件的微粒有HCHO、 C032-、NO3- 等。
③水为极性溶剂,顺式一甘氨酸合铜的极性更强,因此能溶于水的是顺式一甘氨酸合铜。
⑷依据均摊原则,晶胞中Fe的数目为8 + 6 + = 4,S的数目为122+12 = 8,故该化合物的化学式为FeS2;该晶体的密度为 (g cm 3)。
19. (1)氯苯(1分)
(2)羰基(或酮羰基)、硝基(2分)氧化反应(1分)
【解析】本题主要考查有机合成路线,考查学生的推理和综合运用能力。
(5)M的分子式为C12H16ON2,依据条件可推知,苯环上的6个取代基有两种组合:①-N=N-CH3-CH0和4个-CH3 ;②-N=N-CH3、-OH、-CH=CH2和3个-CH3。若为①组合,则有3种位置异构,若为②组合,则有10种位置异构,故符合条件的M共有13种结构。
同课章节目录
