四川省成都市重点中学2023届高三上学期8月入学考试化学试题(Word版含答案)
文档属性
| 名称 | 四川省成都市重点中学2023届高三上学期8月入学考试化学试题(Word版含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 737.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-30 15:52:34 | ||
图片预览


文档简介
成都市重点中学2023届高三上学期8月入学考试
化学试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间90分钟。
可能用到的相对原子质量:Cu—64 Zn—65
第Ⅰ卷(选择题 共40分,1—5题2分,6—15题3分)
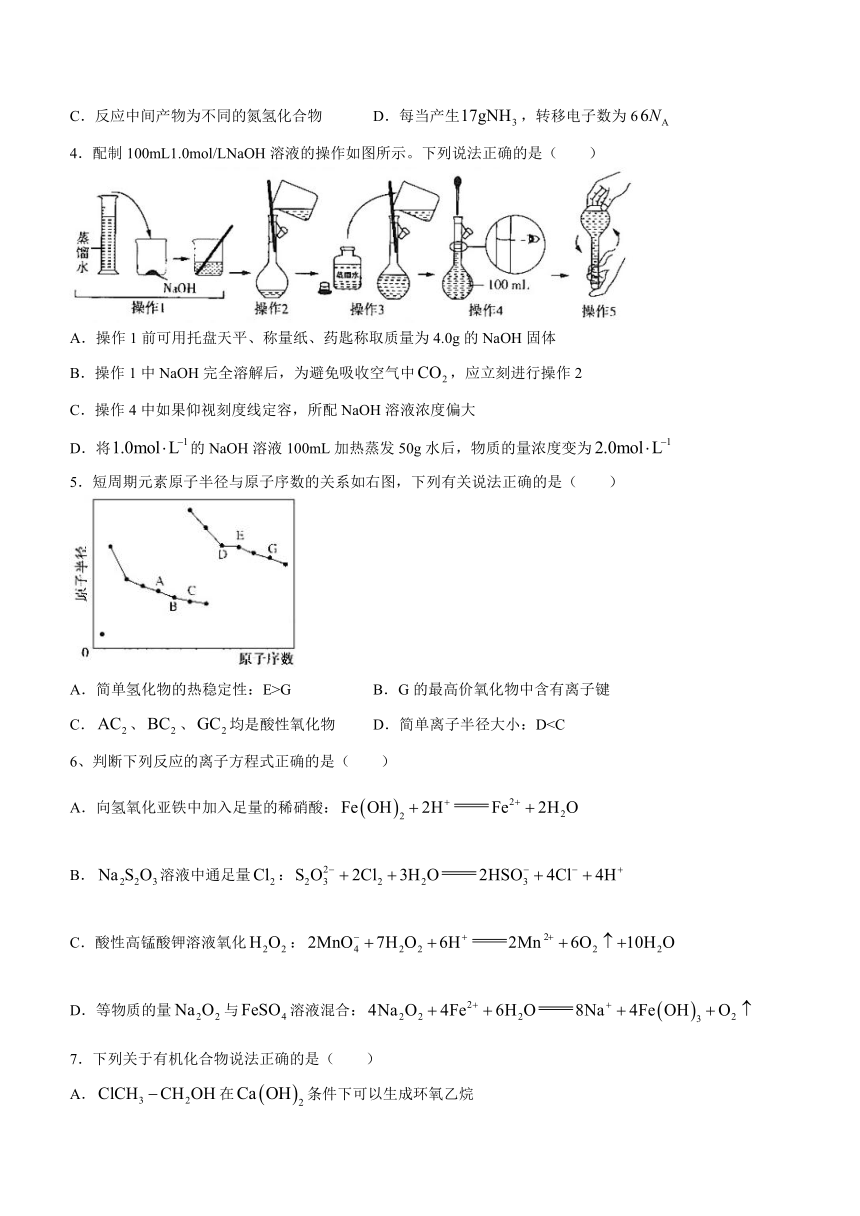
1.化学与生活密切相关。下列说法错误的是( )
A.是指粒径不大于的可吸入悬浮颗粒物
B.绿色化学要求从源头上消除或减少生产活动对环境的污染
C.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D.天然气和液化石油气是我国日前推广使用的清洁燃料
2.下列化学用语的说法正确的是( )
A.球棍模型为的分子可发生加成反应
B.芳香经的组成通式不一定是
C.三氟化氮电子式:
D.聚羟基乙酸结构简式为
3.近期,我国研究人员报道了温和条件下实现固氮的一类三元NiFeV催化剂,下图为其电催化固氮的机理示意图。设为阿佛加德罗常数的值。关于该电催化过程叙述正确的是( )
A.该反应是在强碱性条件下进行的 B.1mol反应最多消耗个离子
C.反应中间产物为不同的氮氢化合物 D.每当产生,转移电子数为6
4.配制100mL1.0mol/LNaOH溶液的操作如图所示。下列说法正确的是( )
A.操作1前可用托盘天平、称量纸、药匙称取质量为4.0g的NaOH固体
B.操作1中NaOH完全溶解后,为避免吸收空气中,应立刻进行操作2
C.操作4中如果仰视刻度线定容,所配NaOH溶液浓度偏大
D.将的NaOH溶液100mL加热蒸发50g水后,物质的量浓度变为
5.短周期元素原子半径与原子序数的关系如右图,下列有关说法正确的是( )
A.简单氢化物的热稳定性:E>G B.G的最高价氧化物中含有离子键
C.、、均是酸性氧化物 D.简单离子半径大小:D6、判断下列反应的离子方程式正确的是( )
A.向氢氧化亚铁中加入足量的稀硝酸:
B.溶液中通足量:
C.酸性高锰酸钾溶液氧化:
D.等物质的量与溶液混合:
7.下列关于有机化合物说法正确的是( )
A.在条件下可以生成环氧乙烷
B.乙醇转变成乙醛的反应属于消去反应,乙醇与Na的反应属于取代反应
C.烯烃就是分子中含有C=C键的不饱和烂,烯烃催化氧化和催化水化都可以转化成醛
D.乙苯、均有4种同分异构体
8.设为阿佛加德罗常数的值。下列说法中错误的有几项
①与含个C-C键的金刚石质量相等的石墨与混合物中含有的C-C键少于个
②65g乙炔、苯、苯乙烯、聚乙快混合物含有的原子数为个
③电解精炼的阳极减少32gCu时,对应电路中转移个电子
④71g溶水后,
⑤标准状况下,22.4LNO与11.2L充分反应后,生成物的分子总数为
A.1项 B.2项 C.3项 D.4项
9.下列生产活动中涉及的原理正确的是( )
选项 生产活动 原理
A 从石油中得到裂化汽油 依烷烃沸点不同,在不同温度下分馏
B 催化氧化 因过量而得到NO,甚至
C 利用溶液刻蚀印刷电路板 Cu的还原性比强
D 用焦炭还原石英砂制粗硅 C的非金属性比Si的强
10.石墨烯是从石墨材料中剥离出米的,由单层碳原子组成的二维晶体,将氢气加入石墨烯中可制得一种新材料石墨烷。下列说法错误的是( )
A.石墨烯C原子间存在键和键,是一种强度很高的材料
B.石墨烯是电的良导体而石墨烷则是绝缘体
C.石墨烯和石墨烧均为高分子化合物
D.石墨烯与制得石墨烷的反应属于加成反应
11.判断下列操作可达到预期目的的是( )
选项 操作 目的
A 用分液漏斗对乙酸乙酯和乙醇分液 利用密度不同,使两者混合物分离
B 在、Ni催化下对混合物催化加氢 除去己烷中混有的己烯
C 加入新制生石灰,后经过滤得到乙醇 除去乙醇中的少量水
D 将少量溴水滴入分别盛有苯和甲苯的两支试管中 鉴别苯和甲苯
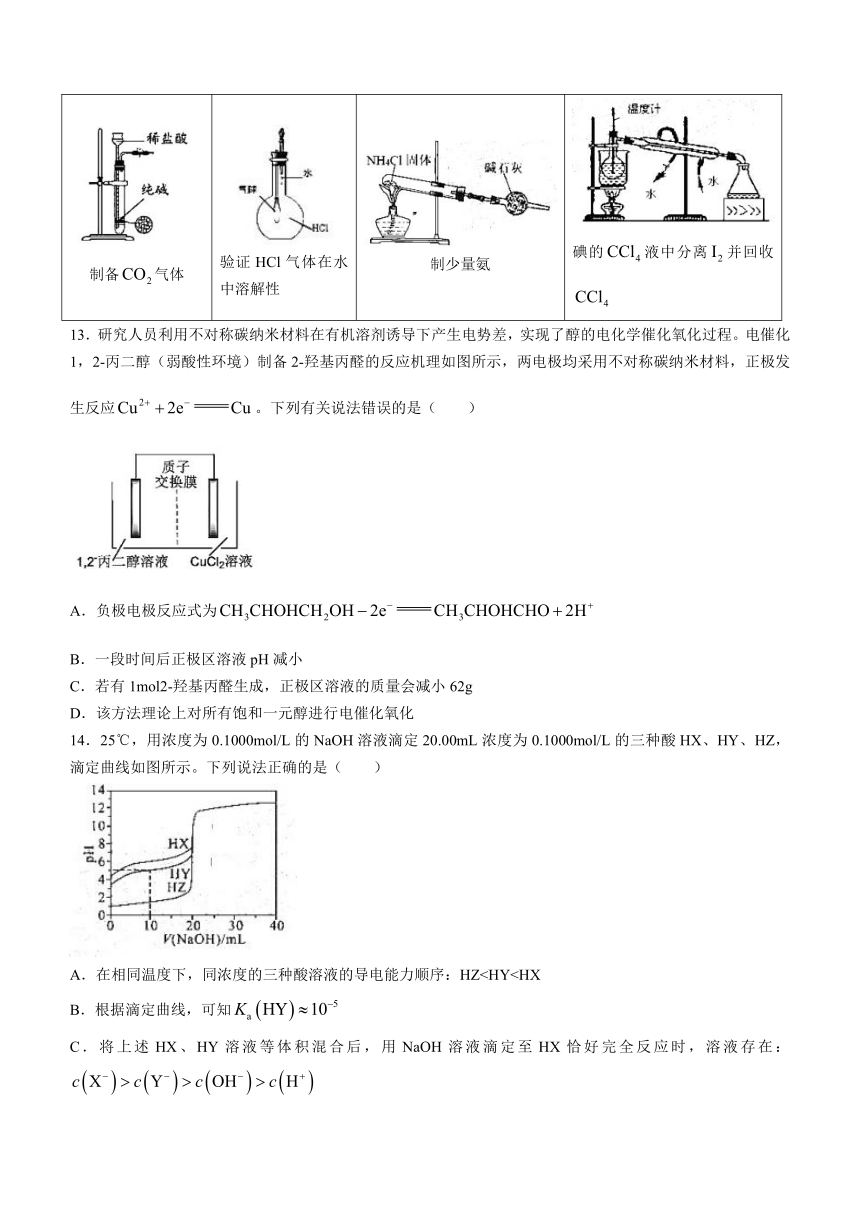
12.下列实验装置无误,并可以达到实验目的的是( )
A B C D
制备气体 验证HCl气体在水中溶解性 制少量氨 碘的液中分离并回收
13.研究人员利用不对称碳纳米材料在有机溶剂诱导下产生电势差,实现了醇的电化学催化氧化过程。电催化1,2-丙二醇(弱酸性环境)制备2-羟基丙醛的反应机理如图所示,两电极均采用不对称碳纳米材料,正极发生反应。下列有关说法错误的是( )
A.负极电极反应式为
B.一段时间后正极区溶液pH减小
C.若有1mol2-羟基丙醛生成,正极区溶液的质量会减小62g
D.该方法理论上对所有饱和一元醇进行电催化氧化
14.25℃,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZB.根据滴定曲线,可知
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,溶液存在:
D.将HY和HZ溶液混合后,溶液中存在:
15.下图为室温下某二元酸溶液中、、的浓度对数随pH的变化图像。下列分析错误的是( )
A.该二元酸浓度为0.10mol/L
B.pH=1.89时,
C.pH=7.0时,
D.在NaHM溶液中,水的电离受到抑制
第Ⅱ卷(非选择题 共60分)
16.工业废水的业硝酸盐常常需要处理。回答下列问题:
(1)尿素()可将还原为。在尿素分子中所含原子中,第一电离能最大者的轨道表示式为________。
(2)离子的空间构型为V形,写出一个与离子互为等电子体的分子________。酸性弱于,请解释原因________。
(3)尿素中所有原子共平面,据此推断其中N原子的杂化轨道类型为________。尿素晶体的熔点为132.7℃,比相同摩尔质量的乙酸熔点(16.7℃)高116℃,这是主要是因为________。
(4)氨基磺酸也可将还原为。氨基磺酸内盐结构()中接受孤对电子的是________(填“N”或“S”)。
(5)亚硝酸钠晶胞结构如图所示,其中亚硝酸根呈体心正交堆积,晶胞参数(单位为cm)。假设为阿伏加德罗常数的值,则晶体密度d为________。图示晶胞,的原子坐标除(1/2,u,1/2)外还有________。
17.有一无色透明溶液200mL,欲确定是否含有下列离子:、、、、、、,、、、、。分成四等份,取一份溶液进行如下实验:
①加几滴甲基橙溶液变红色;
②加入足量溶液,生成白色沉淀和溶液A;在溶液A中加溶液有稳定的白色沉淀生成,且不溶于稀硝酸;
③加热浓缩,加入Cu片和稀盐酸,有无色气体产生,气体遇空气变成红棕色,溶液中阴离子种类不变;
④加入足量NaOH溶液,生成白色沉淀和溶液B,溶液B中通入过量,加热、过滤、洗涤、灼烧,得到白色沉淀(1.02g)。
回答下列问题:
(1)溶液中肯定存在的阴离子是________。
(2)如何实验检验其中的________,说明存在。
(3)为了进一步确定其它离子,应该补充的实验为(不必写详细操作步骤)________。
(4)步骤④中“加入足量NaOH溶液”,共有________种阳离子发生反应。
(5)原溶液中________。
(6)步骤④中加热的目的是________。
18.铅铬黄是一种颜料,主要成分是铬酸铅(摩尔质量323g/mol)。现以和等为原料制备该物质,并测定产物纯度。
回答下列问题:
(1)已知不溶于水,具有两性。第①步所得绿色溶液中的有色离子是________。
(2)第②步生成了,写出该步骤的离子方程式________。为了使反应充分而不剩余,以下方案中最合理的是________(填序号)。
A.首先加热绿色溶液,然后将一定量浓溶液滴入其中
B.首先加热浓溶液,然后转入热的绿色溶液中
C.首先将一定量浓溶液滴入绿色溶液中,然后加热煮沸
(3)第③步调节pH=5的目的是为了将转化为________(填写离子符号),并且防止在碱性条件下________形成沉淀。
(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加溶液后,产生黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:________。
(5)测定铅铬黄的纯度:取mg铅铭黄样品用盐酸酸化溶解,加足量KI将其还原为,再用标准溶液滴定至淡黄绿色,发生反应。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=________(用含c、m和V的式子表示)。
19.以黄铜矿精矿为原料,制取金属铜的工艺如下。
Ⅰ.将黄铜矿精矿(主要成分为,含有少量CaO、MgO、)粉碎;
Ⅱ.采用如图所示装置进行电化学浸出实验。将精选黄铜矿粉加入电解槽的阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂;
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:分离出有机相,向其中加入一定浓度的硫酸,使得以再生;
Ⅳ.电解硫酸铜溶液制得金属铜。
回答下列问题:
(1)黄铜矿粉加入阳极区与硫酸主要发生以下反应:,阳极区硫酸铁的主要作用是________。
(2)阴极区,电极上开始时有大量气泡产生,后有红色固体析出,一段时间后红色固体溶解。红色固体溶解相当于________(选填“析氢”或“吸氧”)腐蚀。
(3)若在实验室进行步骤Ⅲ,加入有机萃取剂的目的是________。
(4)步骤Ⅲ中得以再生的原理是________。
20.温度T℃时,向体积不等的恒容容器中分别加入足量活性炭和1mol,发生反应。反应相同时间,测得各容器中的转化率a与容器体积的关系如图1所示。
回答下列问题:
(1)该反应的平衡常数的值为________。
(2)c点:________点,充入一定量后,再次达到平衡,转化率变________,的物质的量分数变________。
(3)若容器a、b体积相等,则容器压强________。
(4)另测得平衡时和的物质的量浓度与平衡总压的关系如图2。A、B、C三点中,转化率最低的为________点。B点时,若反应初始压强为12.8kPa,则________。
21.氧化锌为白色粉末,可用于湿疹、癖等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钟的还原产物是。回答下列问题:
(1)反应②中除掉的杂质离子所发生的离子方程式为________、________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________。
(2)反应③的反应类型为________,过滤得到的滤渣中,除了过量的锌外还有________。
(3)反应④中产物的成分是,取干操后的滤饼11.2g,煅烧后可得到产品8.1g,则x=________。
化学试卷
本试卷分第Ⅰ卷(选择题)和第Ⅱ卷(非选择题)两部分。满分100分,考试时间90分钟。
可能用到的相对原子质量:Cu—64 Zn—65
第Ⅰ卷(选择题 共40分,1—5题2分,6—15题3分)
1.化学与生活密切相关。下列说法错误的是( )
A.是指粒径不大于的可吸入悬浮颗粒物
B.绿色化学要求从源头上消除或减少生产活动对环境的污染
C.燃煤中加入CaO可以减少酸雨的形成及温室气体的排放
D.天然气和液化石油气是我国日前推广使用的清洁燃料
2.下列化学用语的说法正确的是( )
A.球棍模型为的分子可发生加成反应
B.芳香经的组成通式不一定是
C.三氟化氮电子式:
D.聚羟基乙酸结构简式为
3.近期,我国研究人员报道了温和条件下实现固氮的一类三元NiFeV催化剂,下图为其电催化固氮的机理示意图。设为阿佛加德罗常数的值。关于该电催化过程叙述正确的是( )
A.该反应是在强碱性条件下进行的 B.1mol反应最多消耗个离子
C.反应中间产物为不同的氮氢化合物 D.每当产生,转移电子数为6
4.配制100mL1.0mol/LNaOH溶液的操作如图所示。下列说法正确的是( )
A.操作1前可用托盘天平、称量纸、药匙称取质量为4.0g的NaOH固体
B.操作1中NaOH完全溶解后,为避免吸收空气中,应立刻进行操作2
C.操作4中如果仰视刻度线定容,所配NaOH溶液浓度偏大
D.将的NaOH溶液100mL加热蒸发50g水后,物质的量浓度变为
5.短周期元素原子半径与原子序数的关系如右图,下列有关说法正确的是( )
A.简单氢化物的热稳定性:E>G B.G的最高价氧化物中含有离子键
C.、、均是酸性氧化物 D.简单离子半径大小:D
A.向氢氧化亚铁中加入足量的稀硝酸:
B.溶液中通足量:
C.酸性高锰酸钾溶液氧化:
D.等物质的量与溶液混合:
7.下列关于有机化合物说法正确的是( )
A.在条件下可以生成环氧乙烷
B.乙醇转变成乙醛的反应属于消去反应,乙醇与Na的反应属于取代反应
C.烯烃就是分子中含有C=C键的不饱和烂,烯烃催化氧化和催化水化都可以转化成醛
D.乙苯、均有4种同分异构体
8.设为阿佛加德罗常数的值。下列说法中错误的有几项
①与含个C-C键的金刚石质量相等的石墨与混合物中含有的C-C键少于个
②65g乙炔、苯、苯乙烯、聚乙快混合物含有的原子数为个
③电解精炼的阳极减少32gCu时,对应电路中转移个电子
④71g溶水后,
⑤标准状况下,22.4LNO与11.2L充分反应后,生成物的分子总数为
A.1项 B.2项 C.3项 D.4项
9.下列生产活动中涉及的原理正确的是( )
选项 生产活动 原理
A 从石油中得到裂化汽油 依烷烃沸点不同,在不同温度下分馏
B 催化氧化 因过量而得到NO,甚至
C 利用溶液刻蚀印刷电路板 Cu的还原性比强
D 用焦炭还原石英砂制粗硅 C的非金属性比Si的强
10.石墨烯是从石墨材料中剥离出米的,由单层碳原子组成的二维晶体,将氢气加入石墨烯中可制得一种新材料石墨烷。下列说法错误的是( )
A.石墨烯C原子间存在键和键,是一种强度很高的材料
B.石墨烯是电的良导体而石墨烷则是绝缘体
C.石墨烯和石墨烧均为高分子化合物
D.石墨烯与制得石墨烷的反应属于加成反应
11.判断下列操作可达到预期目的的是( )
选项 操作 目的
A 用分液漏斗对乙酸乙酯和乙醇分液 利用密度不同,使两者混合物分离
B 在、Ni催化下对混合物催化加氢 除去己烷中混有的己烯
C 加入新制生石灰,后经过滤得到乙醇 除去乙醇中的少量水
D 将少量溴水滴入分别盛有苯和甲苯的两支试管中 鉴别苯和甲苯
12.下列实验装置无误,并可以达到实验目的的是( )
A B C D
制备气体 验证HCl气体在水中溶解性 制少量氨 碘的液中分离并回收
13.研究人员利用不对称碳纳米材料在有机溶剂诱导下产生电势差,实现了醇的电化学催化氧化过程。电催化1,2-丙二醇(弱酸性环境)制备2-羟基丙醛的反应机理如图所示,两电极均采用不对称碳纳米材料,正极发生反应。下列有关说法错误的是( )
A.负极电极反应式为
B.一段时间后正极区溶液pH减小
C.若有1mol2-羟基丙醛生成,正极区溶液的质量会减小62g
D.该方法理论上对所有饱和一元醇进行电催化氧化
14.25℃,用浓度为0.1000mol/L的NaOH溶液滴定20.00mL浓度为0.1000mol/L的三种酸HX、HY、HZ,滴定曲线如图所示。下列说法正确的是( )
A.在相同温度下,同浓度的三种酸溶液的导电能力顺序:HZ
C.将上述HX、HY溶液等体积混合后,用NaOH溶液滴定至HX恰好完全反应时,溶液存在:
D.将HY和HZ溶液混合后,溶液中存在:
15.下图为室温下某二元酸溶液中、、的浓度对数随pH的变化图像。下列分析错误的是( )
A.该二元酸浓度为0.10mol/L
B.pH=1.89时,
C.pH=7.0时,
D.在NaHM溶液中,水的电离受到抑制
第Ⅱ卷(非选择题 共60分)
16.工业废水的业硝酸盐常常需要处理。回答下列问题:
(1)尿素()可将还原为。在尿素分子中所含原子中,第一电离能最大者的轨道表示式为________。
(2)离子的空间构型为V形,写出一个与离子互为等电子体的分子________。酸性弱于,请解释原因________。
(3)尿素中所有原子共平面,据此推断其中N原子的杂化轨道类型为________。尿素晶体的熔点为132.7℃,比相同摩尔质量的乙酸熔点(16.7℃)高116℃,这是主要是因为________。
(4)氨基磺酸也可将还原为。氨基磺酸内盐结构()中接受孤对电子的是________(填“N”或“S”)。
(5)亚硝酸钠晶胞结构如图所示,其中亚硝酸根呈体心正交堆积,晶胞参数(单位为cm)。假设为阿伏加德罗常数的值,则晶体密度d为________。图示晶胞,的原子坐标除(1/2,u,1/2)外还有________。
17.有一无色透明溶液200mL,欲确定是否含有下列离子:、、、、、、,、、、、。分成四等份,取一份溶液进行如下实验:
①加几滴甲基橙溶液变红色;
②加入足量溶液,生成白色沉淀和溶液A;在溶液A中加溶液有稳定的白色沉淀生成,且不溶于稀硝酸;
③加热浓缩,加入Cu片和稀盐酸,有无色气体产生,气体遇空气变成红棕色,溶液中阴离子种类不变;
④加入足量NaOH溶液,生成白色沉淀和溶液B,溶液B中通入过量,加热、过滤、洗涤、灼烧,得到白色沉淀(1.02g)。
回答下列问题:
(1)溶液中肯定存在的阴离子是________。
(2)如何实验检验其中的________,说明存在。
(3)为了进一步确定其它离子,应该补充的实验为(不必写详细操作步骤)________。
(4)步骤④中“加入足量NaOH溶液”,共有________种阳离子发生反应。
(5)原溶液中________。
(6)步骤④中加热的目的是________。
18.铅铬黄是一种颜料,主要成分是铬酸铅(摩尔质量323g/mol)。现以和等为原料制备该物质,并测定产物纯度。
回答下列问题:
(1)已知不溶于水,具有两性。第①步所得绿色溶液中的有色离子是________。
(2)第②步生成了,写出该步骤的离子方程式________。为了使反应充分而不剩余,以下方案中最合理的是________(填序号)。
A.首先加热绿色溶液,然后将一定量浓溶液滴入其中
B.首先加热浓溶液,然后转入热的绿色溶液中
C.首先将一定量浓溶液滴入绿色溶液中,然后加热煮沸
(3)第③步调节pH=5的目的是为了将转化为________(填写离子符号),并且防止在碱性条件下________形成沉淀。
(4)由于铬酸铅的溶解度比重铬酸铅的小的多,在第④步中逐滴滴加溶液后,产生黄色沉淀,此时为了提高铅铬黄的产率,可补加少最NaOH溶液,请用化学平衡移动原理加以解释:________。
(5)测定铅铬黄的纯度:取mg铅铭黄样品用盐酸酸化溶解,加足量KI将其还原为,再用标准溶液滴定至淡黄绿色,发生反应。加入淀粉指示剂,继续滴定,当溶液蓝色褪去,且30s不变色,即为终点。测得平均消耗标准溶液体积为VmL。此铅铬黄样品的质量分数w=________(用含c、m和V的式子表示)。
19.以黄铜矿精矿为原料,制取金属铜的工艺如下。
Ⅰ.将黄铜矿精矿(主要成分为,含有少量CaO、MgO、)粉碎;
Ⅱ.采用如图所示装置进行电化学浸出实验。将精选黄铜矿粉加入电解槽的阳极区,恒速搅拌,使矿粉溶解。在阴极区通入氧气,并加入少量催化剂;
Ⅲ.一段时间后,抽取阴极区溶液,向其中加入有机萃取剂(RH)发生反应:分离出有机相,向其中加入一定浓度的硫酸,使得以再生;
Ⅳ.电解硫酸铜溶液制得金属铜。
回答下列问题:
(1)黄铜矿粉加入阳极区与硫酸主要发生以下反应:,阳极区硫酸铁的主要作用是________。
(2)阴极区,电极上开始时有大量气泡产生,后有红色固体析出,一段时间后红色固体溶解。红色固体溶解相当于________(选填“析氢”或“吸氧”)腐蚀。
(3)若在实验室进行步骤Ⅲ,加入有机萃取剂的目的是________。
(4)步骤Ⅲ中得以再生的原理是________。
20.温度T℃时,向体积不等的恒容容器中分别加入足量活性炭和1mol,发生反应。反应相同时间,测得各容器中的转化率a与容器体积的关系如图1所示。
回答下列问题:
(1)该反应的平衡常数的值为________。
(2)c点:________点,充入一定量后,再次达到平衡,转化率变________,的物质的量分数变________。
(3)若容器a、b体积相等,则容器压强________。
(4)另测得平衡时和的物质的量浓度与平衡总压的关系如图2。A、B、C三点中,转化率最低的为________点。B点时,若反应初始压强为12.8kPa,则________。
21.氧化锌为白色粉末,可用于湿疹、癖等皮肤病的治疗。纯化工业级氧化锌[含有Fe(Ⅱ)、Mn(Ⅱ)、Ni(Ⅱ)等杂质]的流程如下:
提示:在本实验条件下,Ni(Ⅱ)不能被氧化;高锰酸钟的还原产物是。回答下列问题:
(1)反应②中除掉的杂质离子所发生的离子方程式为________、________;在加高锰酸钾溶液前,若pH较低,对除杂的影响是________。
(2)反应③的反应类型为________,过滤得到的滤渣中,除了过量的锌外还有________。
(3)反应④中产物的成分是,取干操后的滤饼11.2g,煅烧后可得到产品8.1g,则x=________。
同课章节目录
