人教版化学九年级上册 第四单元 课题4 化学式与化合价 第2课时 化合价 课件(共42张PPT)
文档属性
| 名称 | 人教版化学九年级上册 第四单元 课题4 化学式与化合价 第2课时 化合价 课件(共42张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 509.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-08-30 19:54:30 | ||
图片预览








文档简介
(共42张PPT)
第四单元
自然界的水
课题4
化学式与化合价
第2课时 化合价
课前自学准备
课标要求
学习目标
知识与技能
1.熟记常见元素及原子团的化合价。
2.能利用化学式简单推求化合价,进而能用化学式正确地表示常见物质的组成。
过程与方法
通过化合价特点的学习,初步学会运用观察、比较、概括等处理信息的方法。
情感、态度与价值观
1.通过不同的化合价记忆方法的交流,培养合作精神和竞争意识。
2.通过激励学生用不同的方法记忆元素及原子团的化合价,培养学生的创新精神。
学习难点
学习重点
1.熟记常见元素及原子团的化合价。
2.能用化合价推求化学式。
学具准备
利用化合价写化学式。
多媒体课件。
1.一般情况下,我们通过元素的 可以确定不同元素形成化合物时各元素的原子个数比。
2.氢元素通常显 价,氧元素通常显 价。在化合物中,元素化合价的代数和为
。
课前自学准备
预习检测
化合价
零
+1
-2
课堂教学展示
新课导入
上节课我们学习了化学式的意义,读法和写法,同学们对化学式都有了一定的了解与认识。
化合物的化学式一定要死记硬背吗?
我们可以利用化合价书写化学式。
课堂教学展示
课堂探究
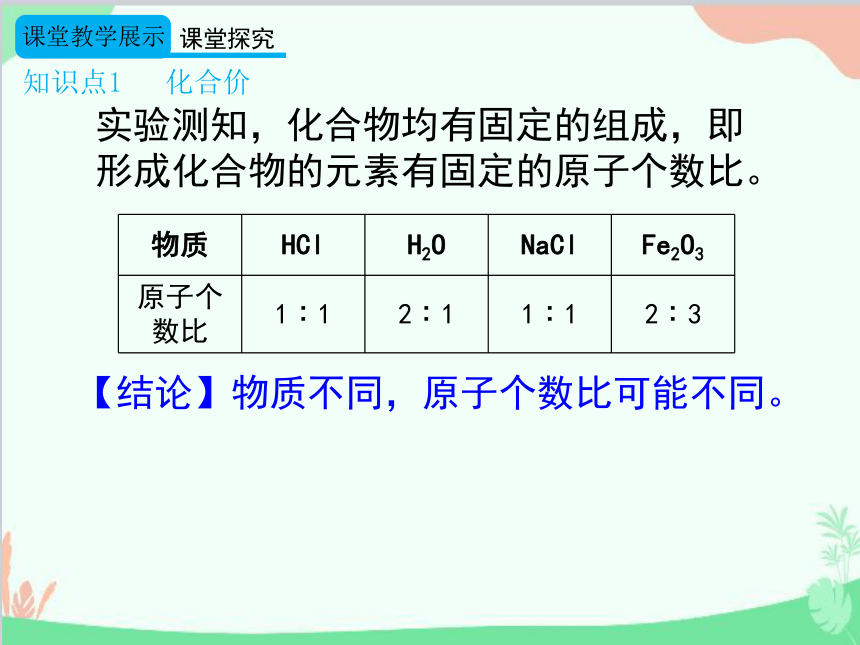
知识点1 化合价
实验测知,化合物均有固定的组成,即形成化合物的元素有固定的原子个数比。
物质 HCl H2O NaCl Fe2O3
原子个数比 1∶1 2∶1 1∶1 2∶3
【结论】物质不同,原子个数比可能不同。
【思考】化学式中的各原子个数比为何都是固定且唯一的?
在形成化合物时,各原子为了使其结构达到稳定,即最外层电子数达到8,不同原子的个数比是电子数目不同造成的。
【注意】元素的化合价是元素的原子在形成化合物时表现出来的一种性质,因此,通常称为元素的化合价而不应称为原子的化合价。
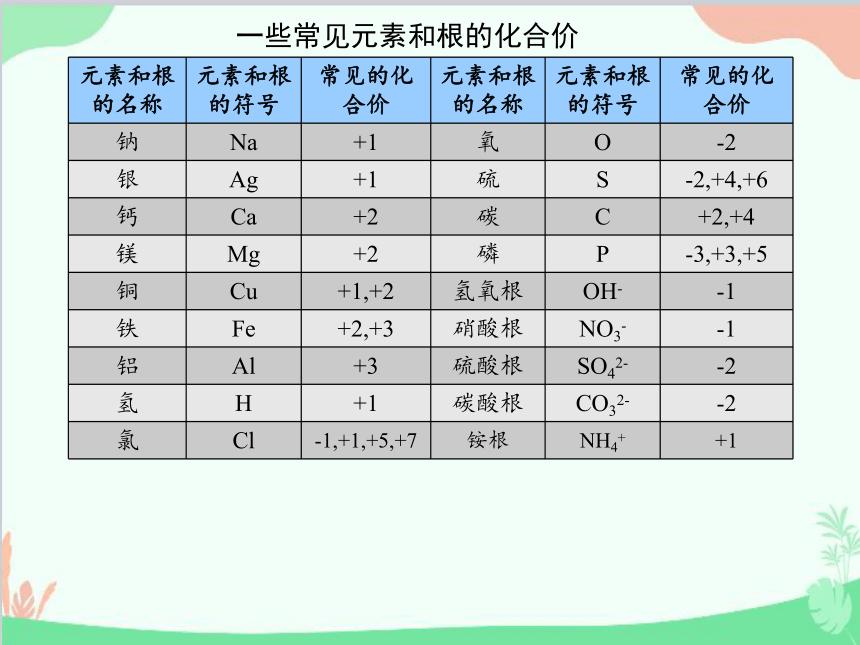
一些常见元素和根的化合价
元素和根的名称 元素和根的符号 常见的化合价 元素和根的名称 元素和根的符号 常见的化合价
钠 Na +1 氧 O -2
银 Ag +1 硫 S -2,+4,+6
钙 Ca +2 碳 C +2,+4
镁 Mg +2 磷 P -3,+3,+5
铜 Cu +1,+2 氢氧根 OH- -1
铁 Fe +2,+3 硝酸根 NO3- -1
铝 Al +3 硫酸根 SO42- -2
氢 H +1 碳酸根 CO32- -2
氯 Cl -1,+1,+5,+7 铵根 NH4+ +1
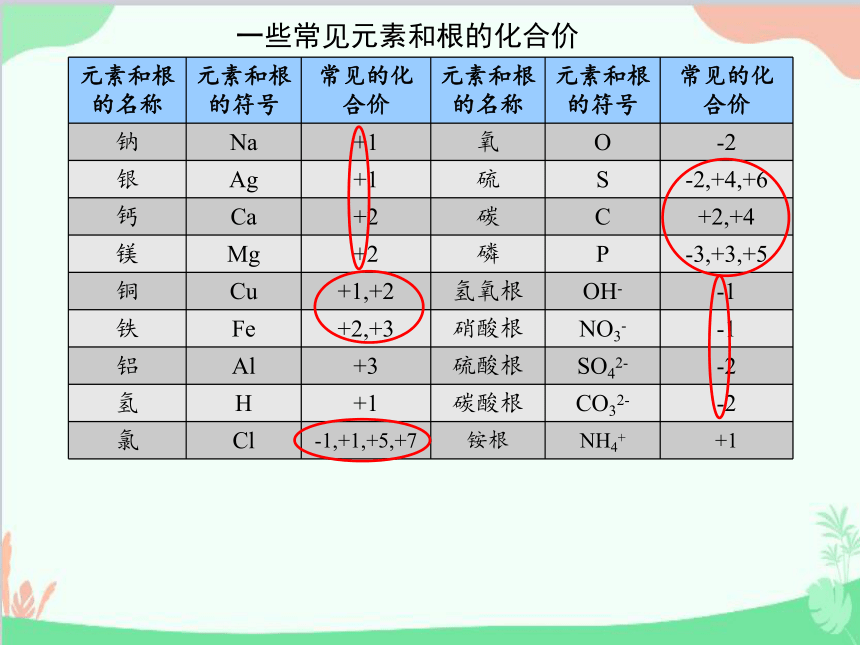
化合价的一般规律:
1.化合价有正价和负价之分,有些元素有多种化合价,称之为具有可变价。
一些常见元素和根的化合价
元素和根的名称 元素和根的符号 常见的化合价 元素和根的名称 元素和根的符号 常见的化合价
钠 Na +1 氧 O -2
银 Ag +1 硫 S -2,+4,+6
钙 Ca +2 碳 C +2,+4
镁 Mg +2 磷 P -3,+3,+5
铜 Cu +1,+2 氢氧根 OH- -1
铁 Fe +2,+3 硝酸根 NO3- -1
铝 Al +3 硫酸根 SO42- -2
氢 H +1 碳酸根 CO32- -2
氯 Cl -1,+1,+5,+7 铵根 NH4+ +1
化合价的一般规律:
1.化合价有正价和负价之分,有些元素有多种化合价,称之为具有可变价。
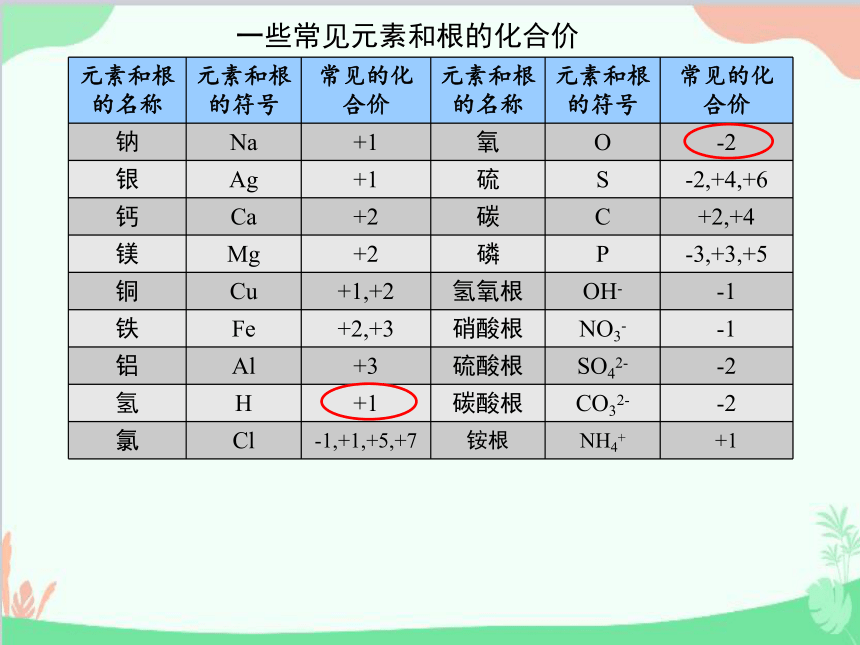
2.在化合物中,氧元素通常显负2价,氢元素通常显正1价。
一些常见元素和根的化合价
元素和根的名称 元素和根的符号 常见的化合价 元素和根的名称 元素和根的符号 常见的化合价
钠 Na +1 氧 O -2
银 Ag +1 硫 S -2,+4,+6
钙 Ca +2 碳 C +2,+4
镁 Mg +2 磷 P -3,+3,+5
铜 Cu +1,+2 氢氧根 OH- -1
铁 Fe +2,+3 硝酸根 NO3- -1
铝 Al +3 硫酸根 SO42- -2
氢 H +1 碳酸根 CO32- -2
氯 Cl -1,+1,+5,+7 铵根 NH4+ +1
化合价的一般规律:
1.化合价有正价和负价之分,有些元素有多种化合价,称之为具有可变价。
2.在化合物中,氧元素通常显负2价,氢元素通常显正1价。
3.金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价。
有些物质如Ca(OH)2、CaCO3中的一些原子集团,作为整体参加化学反应,这样的原子集团叫做原子团,也叫根,根也有化合价。
【注意】
(1)原子团的化合价是其组成元素的化合价的代数和。
(2)原子团不是一种物质,它只是组成物质的一部分,原子团是带电荷的。
原子团在许多情况下作为一个整体参加反应,但有时也会被破坏,如氯酸钾(KClO3)中的氯酸根(ClO3-)在加热分解时被破坏。
NaCl MgO N2 Al2O3 H2O SO2 MnO2
+1
-1
+2
-2
0
+3
-2
+1
-2
-2
+4
+4
-2
化合价的原则:
在化合物里,正、负化合价的代数和为零。
单质分子中元素的化合价为零。
【观察】下列化合物中,正、负化合价的代数和有什么特点?
【规律方法小结】
①化合价是元素的原子化合时表现出来的一种性质,一种元素的原子和不同元素的原子化合时可能显示不同的化合价。
②化合价一定要标出“+”“-”号。
③原子团(根)是一个整体,不能随意拆开。
④化合价与离子的区别:如Na+表示钠离子,Na表示钠元素的化合价为+1。
+1
【课堂拓展】
化合价与离子符号的区别与联系:
①区别:化合价用+2、+1、-2、-1……表示,标在元素符号正上方(“1”不省略);离子符号用2+、+、2-、-……表示,标在元素符号的右上角(“1”省略)。
②联系:同种元素的化合价和其离子所带的电荷,通常数值相等、正负相同。
例 下列说法正确的是( )
A.在氢气中,氢元素的化合价为+1价
B.一种元素只有一种化合价
C.在化合物中,非金属元素只显示负价
D.化合物中正、负化合价的代数和为零
课堂教学展示
典例剖析
D
×
× 可以有不同的化合价
×
√
0
NH4Cl
课堂教学展示
课堂探究
知识点2 化合价与化学式
【例题】已知某种磷的氧化物中磷为+5价,氧为-2价,写出这种磷的氧化物的化学式。
解题步骤:
①写出组成化合物的两种元素的符号,正价的写在左边,负价的写在右边。
P O
一.已知化合价书写化学式(知价写式)
解题步骤:
②求两种元素正、负化合价绝对值的最小公倍数。
5×2=10
③求各元素的原子数:
最小公倍数÷正价数(或负价数)=原子数
P:10÷5=2 O:10÷2=5
P O
+5 -2
解题步骤:
④把原子数写在各元素符号的右下方,即得化学式:
⑤检查化学式,当正价总数与负价总数的代数和等于0时,化学式才算是正确的。
(+5)×2 +(-2)×5 = + 10 - 10 = 0
答:这种磷的化合物的化学式是P2O5。
P O
2
5
【补充】十字交叉法写化学式:
P O
+5
-2
2
5
【口诀】一排序,二标价,三约简,四交叉,五检查。
【小结】知价写式一般步骤:
①写出元素符号,正价在左,负价在右。(有些化合物书写时负价元素在左边,正价元素在右边,如NH3、CH4等)
②求两种元素正、负化合价绝对值的最小公倍数。
③求各元素的原子数。
④把原子数写在各元素符号的右下方,即得化学式。
⑤按正负化合价代数和为0的原则检查化学式。
例题:写出下列物质的化学式
氧化铝 硫化氢 水 氯化镁
Al O
H S
H O
Mg Cl
+3
-2
+1
-2
+1
-2
+2
-1
2
3
2
2
2
练习:写出下列物质的化学式
氧化钠 氯化钡 氯化银
Na2O BaCl2 AgCl
你会验证吗?
二.已知化合价书写化学式(知价写式)
【例题】
(1)已知:O为-2价,求Fe2O3中铁元素的化合价。
计算依据:化合物中,正、负化合价代数和为0。
解:Fe的化合价为:
【例题】
(2)已知:Fe为+3价,求Fe2(SO4)3中硫酸根的化合价。
解:硫酸根的化合价为:
练习:标出下列蓝色元素的化合价:
S SO2 H2SO4 NO N2O5 NH4NO3
0
+4
+6
+2
+5
-3
+5
【补充拓展】物质的命名
如何读下列化学式
1.HCl、HF、MgO、Al2O3、AgCl、Al2S3、CaF2
2.P2O5、SiO2、N2O、CO
两种元素组成的物质读为“某化某”(从后往前读)
由非金属元素和氧元素组成的物质,读为“几氧化几某”。
若非金属元素原子为一个,数字“1”不读。
3.HClO3、HMnO4、HNO3、H2SO4、H3PO4、H2MnO4
4.NaOH、Ba(OH)2、Al(OH)3、Mg(OH)2
氢元素和原子团组成的物质,读为“某酸”。
【注意】含“MnO4”时,先标化合价,然后命名:高锰酸根或锰酸根。
金属元素和氢氧根组成的物质,读为“氢氧化某”。
5.Hg(NO3)2、KClO3、KMnO4、CaMnO4、BaSO4、AlPO4、CaCO3、K2MnO4
6.NH4Cl、NH4F、(NH4)2S、NH4NO3、(NH4)2SO4、(NH4)3PO4
金属元素和原子团(除氢氧根、铵根外)组成的物质,读为“某酸某”。
“NH4+”命名时看成一种金属元素。
7.FeO、Fe2S3、FeCl2、FeS、Fe(OH)3、
FeSO4、Fe(OH)2、FePO4、FeSO3、
Fe2(SO4)3、FeMnO4、CuCl2、CuO、CuSO4、Cu(OH)2、Cu2S、Cu2O
Fe:+2 +3 Cu:+1 +2
高价时读为“铁或铜”,低价时读为“亚铁或亚铜”。
课堂教学展示
典例剖析
例1 交警常用装有重铬酸钾(K2Cr2O7)的仪器检测司机是否酒后驾车,因为酒中的乙醇分子能使橙红色的重铬酸钾变为绿色的硫酸铬[Cr2(SO4)3],重铬酸钾和硫酸铬中铬的化合价依次是( )
A.+6、+3
B.+3、+5
C.+3、+3
D.+3、+6
A
已知钾元素为+1价,氧元素为-2价,硫酸根离子为-2价,设在这两种化合物中铬元素的化合价依次为x、y,则有:
(+1)×2+2x+(-2)×7=0
y×2+(-2)×3=0
解得 x=+6
y=+3
例2 (湖南株洲中考)下列含氮化合物中,氮元素化合价由高到低排列的一组是( )
A.NH3 NO HNO3
B.N2O5 N2O4 NO2
C.HNO3 NO2 NH3
D.NO NO2 N2O3
-3
+2
+5
+5
+4
+4
+5
+4
-3
+2
+4
+3
C
课堂教学展示
教学板书
课题4 化学式与化合价
第2课时 化合价
化合价
(1)元素的化合价是元素的原子在形成化合物时表现出来的一种性质。
(2)原子团:作为一个整体参加反应的原子集团,也叫根。
(3)注意事项
(4)应用
①已知化合价书写化学式
②已知化学式书写化合价
课堂教学展示
课堂小结
概念
化合价
书写
①氧元素通常显负2价,氢元素通常显正1价;
②金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价;
③在化合物里,正、负化合价的代数和为零。单质分子中元素的化合价为零。
用来表示元素在形成化合物时的原子个数比
已知化学式求算化合价
已知化合价书写化学式
规律
1.从课后习题中选取;
2.完成练习册本课时的习题。
课后反馈总结
课后作业
课后反馈总结
教学反思
在本节课的教学中,化合价概念较抽象使学生接受有一定的困难,所以应分散难点。前面的离子、元素等知识的学习不容忽视,它是这节课的重要基础。记忆化合价十分枯燥,组织好本课的活动与探究,让学生主动投入到学习活动中。化合价的识记和应用是本节的重点和难点,应用一节习题课或自习课进行练习和落实。
2.选择题
(4)某工地发生多人食物中毒,经化验为误食工业用盐亚硝酸钠(NaNO2)所致。NaNO2中氮元素的化合价是( )。
A.+2 B.+3 C.+4 D.+5
课后反馈总结
课本习题
练习与应用
B
3.下列化合物中,氧为-2价,氯为-1价,判断化合物里其他元素的化合价:SO2,Na2O,CaCl2,AgCl,WO3。(W的原子序数为74,其名称可从元素周期表中查知)
解:S:+4, Na:+1,
Ca:+2, Ag:+1, W:+6
4.计算下列化合物中氮元素的化合价。
(1)一氧化氮(NO)
(2)二氧化氮(NO2)
(3)硝酸(HNO3)
(4)氨(NH3)
解:(1)+2 (2)+4
(3)+5 (4)-3
5.已知下列元素在氧化物中的化合价,写出它们氧化物的化学式。(提示:元素符号上方的数字是化合价。)
Ba S C N Mg Ca
+2
+4
+2
+5
+2
+2
解:BaO,SO2,CO,N2O5,MgO,CaO
6.已知下列元素在氯化物中的化合价,写出它们的氯化物的化学式。(提示:在氯化物中氯的化合价是-1。)
K Fe Al
+1
+2
+3
解:KCl,FeCl2,AlCl3
第四单元
自然界的水
课题4
化学式与化合价
第2课时 化合价
课前自学准备
课标要求
学习目标
知识与技能
1.熟记常见元素及原子团的化合价。
2.能利用化学式简单推求化合价,进而能用化学式正确地表示常见物质的组成。
过程与方法
通过化合价特点的学习,初步学会运用观察、比较、概括等处理信息的方法。
情感、态度与价值观
1.通过不同的化合价记忆方法的交流,培养合作精神和竞争意识。
2.通过激励学生用不同的方法记忆元素及原子团的化合价,培养学生的创新精神。
学习难点
学习重点
1.熟记常见元素及原子团的化合价。
2.能用化合价推求化学式。
学具准备
利用化合价写化学式。
多媒体课件。
1.一般情况下,我们通过元素的 可以确定不同元素形成化合物时各元素的原子个数比。
2.氢元素通常显 价,氧元素通常显 价。在化合物中,元素化合价的代数和为
。
课前自学准备
预习检测
化合价
零
+1
-2
课堂教学展示
新课导入
上节课我们学习了化学式的意义,读法和写法,同学们对化学式都有了一定的了解与认识。
化合物的化学式一定要死记硬背吗?
我们可以利用化合价书写化学式。
课堂教学展示
课堂探究
知识点1 化合价
实验测知,化合物均有固定的组成,即形成化合物的元素有固定的原子个数比。
物质 HCl H2O NaCl Fe2O3
原子个数比 1∶1 2∶1 1∶1 2∶3
【结论】物质不同,原子个数比可能不同。
【思考】化学式中的各原子个数比为何都是固定且唯一的?
在形成化合物时,各原子为了使其结构达到稳定,即最外层电子数达到8,不同原子的个数比是电子数目不同造成的。
【注意】元素的化合价是元素的原子在形成化合物时表现出来的一种性质,因此,通常称为元素的化合价而不应称为原子的化合价。
一些常见元素和根的化合价
元素和根的名称 元素和根的符号 常见的化合价 元素和根的名称 元素和根的符号 常见的化合价
钠 Na +1 氧 O -2
银 Ag +1 硫 S -2,+4,+6
钙 Ca +2 碳 C +2,+4
镁 Mg +2 磷 P -3,+3,+5
铜 Cu +1,+2 氢氧根 OH- -1
铁 Fe +2,+3 硝酸根 NO3- -1
铝 Al +3 硫酸根 SO42- -2
氢 H +1 碳酸根 CO32- -2
氯 Cl -1,+1,+5,+7 铵根 NH4+ +1
化合价的一般规律:
1.化合价有正价和负价之分,有些元素有多种化合价,称之为具有可变价。
一些常见元素和根的化合价
元素和根的名称 元素和根的符号 常见的化合价 元素和根的名称 元素和根的符号 常见的化合价
钠 Na +1 氧 O -2
银 Ag +1 硫 S -2,+4,+6
钙 Ca +2 碳 C +2,+4
镁 Mg +2 磷 P -3,+3,+5
铜 Cu +1,+2 氢氧根 OH- -1
铁 Fe +2,+3 硝酸根 NO3- -1
铝 Al +3 硫酸根 SO42- -2
氢 H +1 碳酸根 CO32- -2
氯 Cl -1,+1,+5,+7 铵根 NH4+ +1
化合价的一般规律:
1.化合价有正价和负价之分,有些元素有多种化合价,称之为具有可变价。
2.在化合物中,氧元素通常显负2价,氢元素通常显正1价。
一些常见元素和根的化合价
元素和根的名称 元素和根的符号 常见的化合价 元素和根的名称 元素和根的符号 常见的化合价
钠 Na +1 氧 O -2
银 Ag +1 硫 S -2,+4,+6
钙 Ca +2 碳 C +2,+4
镁 Mg +2 磷 P -3,+3,+5
铜 Cu +1,+2 氢氧根 OH- -1
铁 Fe +2,+3 硝酸根 NO3- -1
铝 Al +3 硫酸根 SO42- -2
氢 H +1 碳酸根 CO32- -2
氯 Cl -1,+1,+5,+7 铵根 NH4+ +1
化合价的一般规律:
1.化合价有正价和负价之分,有些元素有多种化合价,称之为具有可变价。
2.在化合物中,氧元素通常显负2价,氢元素通常显正1价。
3.金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价。
有些物质如Ca(OH)2、CaCO3中的一些原子集团,作为整体参加化学反应,这样的原子集团叫做原子团,也叫根,根也有化合价。
【注意】
(1)原子团的化合价是其组成元素的化合价的代数和。
(2)原子团不是一种物质,它只是组成物质的一部分,原子团是带电荷的。
原子团在许多情况下作为一个整体参加反应,但有时也会被破坏,如氯酸钾(KClO3)中的氯酸根(ClO3-)在加热分解时被破坏。
NaCl MgO N2 Al2O3 H2O SO2 MnO2
+1
-1
+2
-2
0
+3
-2
+1
-2
-2
+4
+4
-2
化合价的原则:
在化合物里,正、负化合价的代数和为零。
单质分子中元素的化合价为零。
【观察】下列化合物中,正、负化合价的代数和有什么特点?
【规律方法小结】
①化合价是元素的原子化合时表现出来的一种性质,一种元素的原子和不同元素的原子化合时可能显示不同的化合价。
②化合价一定要标出“+”“-”号。
③原子团(根)是一个整体,不能随意拆开。
④化合价与离子的区别:如Na+表示钠离子,Na表示钠元素的化合价为+1。
+1
【课堂拓展】
化合价与离子符号的区别与联系:
①区别:化合价用+2、+1、-2、-1……表示,标在元素符号正上方(“1”不省略);离子符号用2+、+、2-、-……表示,标在元素符号的右上角(“1”省略)。
②联系:同种元素的化合价和其离子所带的电荷,通常数值相等、正负相同。
例 下列说法正确的是( )
A.在氢气中,氢元素的化合价为+1价
B.一种元素只有一种化合价
C.在化合物中,非金属元素只显示负价
D.化合物中正、负化合价的代数和为零
课堂教学展示
典例剖析
D
×
× 可以有不同的化合价
×
√
0
NH4Cl
课堂教学展示
课堂探究
知识点2 化合价与化学式
【例题】已知某种磷的氧化物中磷为+5价,氧为-2价,写出这种磷的氧化物的化学式。
解题步骤:
①写出组成化合物的两种元素的符号,正价的写在左边,负价的写在右边。
P O
一.已知化合价书写化学式(知价写式)
解题步骤:
②求两种元素正、负化合价绝对值的最小公倍数。
5×2=10
③求各元素的原子数:
最小公倍数÷正价数(或负价数)=原子数
P:10÷5=2 O:10÷2=5
P O
+5 -2
解题步骤:
④把原子数写在各元素符号的右下方,即得化学式:
⑤检查化学式,当正价总数与负价总数的代数和等于0时,化学式才算是正确的。
(+5)×2 +(-2)×5 = + 10 - 10 = 0
答:这种磷的化合物的化学式是P2O5。
P O
2
5
【补充】十字交叉法写化学式:
P O
+5
-2
2
5
【口诀】一排序,二标价,三约简,四交叉,五检查。
【小结】知价写式一般步骤:
①写出元素符号,正价在左,负价在右。(有些化合物书写时负价元素在左边,正价元素在右边,如NH3、CH4等)
②求两种元素正、负化合价绝对值的最小公倍数。
③求各元素的原子数。
④把原子数写在各元素符号的右下方,即得化学式。
⑤按正负化合价代数和为0的原则检查化学式。
例题:写出下列物质的化学式
氧化铝 硫化氢 水 氯化镁
Al O
H S
H O
Mg Cl
+3
-2
+1
-2
+1
-2
+2
-1
2
3
2
2
2
练习:写出下列物质的化学式
氧化钠 氯化钡 氯化银
Na2O BaCl2 AgCl
你会验证吗?
二.已知化合价书写化学式(知价写式)
【例题】
(1)已知:O为-2价,求Fe2O3中铁元素的化合价。
计算依据:化合物中,正、负化合价代数和为0。
解:Fe的化合价为:
【例题】
(2)已知:Fe为+3价,求Fe2(SO4)3中硫酸根的化合价。
解:硫酸根的化合价为:
练习:标出下列蓝色元素的化合价:
S SO2 H2SO4 NO N2O5 NH4NO3
0
+4
+6
+2
+5
-3
+5
【补充拓展】物质的命名
如何读下列化学式
1.HCl、HF、MgO、Al2O3、AgCl、Al2S3、CaF2
2.P2O5、SiO2、N2O、CO
两种元素组成的物质读为“某化某”(从后往前读)
由非金属元素和氧元素组成的物质,读为“几氧化几某”。
若非金属元素原子为一个,数字“1”不读。
3.HClO3、HMnO4、HNO3、H2SO4、H3PO4、H2MnO4
4.NaOH、Ba(OH)2、Al(OH)3、Mg(OH)2
氢元素和原子团组成的物质,读为“某酸”。
【注意】含“MnO4”时,先标化合价,然后命名:高锰酸根或锰酸根。
金属元素和氢氧根组成的物质,读为“氢氧化某”。
5.Hg(NO3)2、KClO3、KMnO4、CaMnO4、BaSO4、AlPO4、CaCO3、K2MnO4
6.NH4Cl、NH4F、(NH4)2S、NH4NO3、(NH4)2SO4、(NH4)3PO4
金属元素和原子团(除氢氧根、铵根外)组成的物质,读为“某酸某”。
“NH4+”命名时看成一种金属元素。
7.FeO、Fe2S3、FeCl2、FeS、Fe(OH)3、
FeSO4、Fe(OH)2、FePO4、FeSO3、
Fe2(SO4)3、FeMnO4、CuCl2、CuO、CuSO4、Cu(OH)2、Cu2S、Cu2O
Fe:+2 +3 Cu:+1 +2
高价时读为“铁或铜”,低价时读为“亚铁或亚铜”。
课堂教学展示
典例剖析
例1 交警常用装有重铬酸钾(K2Cr2O7)的仪器检测司机是否酒后驾车,因为酒中的乙醇分子能使橙红色的重铬酸钾变为绿色的硫酸铬[Cr2(SO4)3],重铬酸钾和硫酸铬中铬的化合价依次是( )
A.+6、+3
B.+3、+5
C.+3、+3
D.+3、+6
A
已知钾元素为+1价,氧元素为-2价,硫酸根离子为-2价,设在这两种化合物中铬元素的化合价依次为x、y,则有:
(+1)×2+2x+(-2)×7=0
y×2+(-2)×3=0
解得 x=+6
y=+3
例2 (湖南株洲中考)下列含氮化合物中,氮元素化合价由高到低排列的一组是( )
A.NH3 NO HNO3
B.N2O5 N2O4 NO2
C.HNO3 NO2 NH3
D.NO NO2 N2O3
-3
+2
+5
+5
+4
+4
+5
+4
-3
+2
+4
+3
C
课堂教学展示
教学板书
课题4 化学式与化合价
第2课时 化合价
化合价
(1)元素的化合价是元素的原子在形成化合物时表现出来的一种性质。
(2)原子团:作为一个整体参加反应的原子集团,也叫根。
(3)注意事项
(4)应用
①已知化合价书写化学式
②已知化学式书写化合价
课堂教学展示
课堂小结
概念
化合价
书写
①氧元素通常显负2价,氢元素通常显正1价;
②金属元素跟非金属元素化合时,金属元素显正价,非金属元素显负价;
③在化合物里,正、负化合价的代数和为零。单质分子中元素的化合价为零。
用来表示元素在形成化合物时的原子个数比
已知化学式求算化合价
已知化合价书写化学式
规律
1.从课后习题中选取;
2.完成练习册本课时的习题。
课后反馈总结
课后作业
课后反馈总结
教学反思
在本节课的教学中,化合价概念较抽象使学生接受有一定的困难,所以应分散难点。前面的离子、元素等知识的学习不容忽视,它是这节课的重要基础。记忆化合价十分枯燥,组织好本课的活动与探究,让学生主动投入到学习活动中。化合价的识记和应用是本节的重点和难点,应用一节习题课或自习课进行练习和落实。
2.选择题
(4)某工地发生多人食物中毒,经化验为误食工业用盐亚硝酸钠(NaNO2)所致。NaNO2中氮元素的化合价是( )。
A.+2 B.+3 C.+4 D.+5
课后反馈总结
课本习题
练习与应用
B
3.下列化合物中,氧为-2价,氯为-1价,判断化合物里其他元素的化合价:SO2,Na2O,CaCl2,AgCl,WO3。(W的原子序数为74,其名称可从元素周期表中查知)
解:S:+4, Na:+1,
Ca:+2, Ag:+1, W:+6
4.计算下列化合物中氮元素的化合价。
(1)一氧化氮(NO)
(2)二氧化氮(NO2)
(3)硝酸(HNO3)
(4)氨(NH3)
解:(1)+2 (2)+4
(3)+5 (4)-3
5.已知下列元素在氧化物中的化合价,写出它们氧化物的化学式。(提示:元素符号上方的数字是化合价。)
Ba S C N Mg Ca
+2
+4
+2
+5
+2
+2
解:BaO,SO2,CO,N2O5,MgO,CaO
6.已知下列元素在氯化物中的化合价,写出它们的氯化物的化学式。(提示:在氯化物中氯的化合价是-1。)
K Fe Al
+1
+2
+3
解:KCl,FeCl2,AlCl3
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
