浙教版科学2022-2023学年上学期八年级“冲刺重高”讲义(九):物质的溶解性(3)---溶液的计算【word,含解析】
文档属性
| 名称 | 浙教版科学2022-2023学年上学期八年级“冲刺重高”讲义(九):物质的溶解性(3)---溶液的计算【word,含解析】 |  | |
| 格式 | doc | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 浙教版 | ||
| 科目 | 科学 | ||
| 更新时间 | 2022-09-01 08:51:01 | ||
图片预览



文档简介
一、溶液、溶质、溶质质量分数
溶液中:溶质的质量=溶液的体积×溶液的密度×溶质的质量分数
同一温度下,同种溶质饱和溶液的溶质的质量分数最大。饱和溶液的溶质的质量分数有两种计算方法,
溶液的稀释、浓缩
①稀释:稀释前后溶质质量不变
②浓缩: A增加溶质
B蒸发溶剂
C两者混合
例1、(2022杭州)40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,此过程中不发生变化的是( )
A.溶剂的质量 B.溶质的质量 C.溶液中溶质的质量分数 D.食盐的溶解度
例2、在20℃时,100克5%的食盐溶液温度升高到60℃(忽略水分蒸发),则溶质的质量分数为________ ;若将该溶液恒温蒸发水分,则溶液中溶质的质量分数会________(选填“增大”或“减小”) ;在20℃时,当溶液成为________时,该溶液的质量分数最大,其最大值为________。(20°C时,食盐的溶解度为36克)
例3、某同学在实验室观察到浓硫酸瓶上的标签如表所示。
浓硫酸(H2SO4)500毫升
溶质的质量分数 98%
密度 1.84克/厘米3
相对分子质量 98
强腐蚀性,阴冷,密封储藏
(1)这瓶浓硫酸溶液的质量是多少克 ?该溶液中的溶质质量是多少克 ?
(2)欲配制1000克质量分数为19.6%的稀硫酸,需要这种浓硫酸多少毫升 ?需要加水多少毫升 ?
例4、二氧化氯消毒液是国际上公认的新一代强力、安全、高效的消毒剂,能够迅速,彻底杀灭各种细菌(大肠杆菌、白色念珠菌等)和病毒(肝炎病毒、流感病毒等)。小应同学观察到瓶上的标签如表所示,试回答:
二氧化氯(ClO2)1000毫升
溶质质量分数 80%
密度 1.2克/厘米3
强腐蚀性,阴冷、密封储藏
(1)这1000毫升二氧化氯消毒液中含溶质二氧化氯多少克?
(2)若将这1000毫升二氧化氯消毒液与5000克水均匀混合,所得稀二氧化氧消毒液中二氧化氯的质量分数是多少?(小数点后保留一位有效数字)
(3)该校欲配置30千克20%的稀二氧化氯消毒液用以消毒,需多少千克这样二氧化氧消毒液和多少升水?
1.用氯化镁溶液喷洒路面可融雪。已知20℃时,氯化镁的溶解度为54.6克,若按表中数据配制溶液(温度均为20℃),则下列说法正确的是( )
序号 ① ② ③ ④
氯化镁的质量/克 40 50 60 70
水的质量/克 100 100 100 100
A.①所得溶液,其溶质和溶剂的质量比为2:7
B.②所得溶液,其溶质的质量分数为50%
C.③④所得溶液均为20℃时氯化镁的饱和溶液
D.③所得溶液的溶质质量分数小于④所得溶液
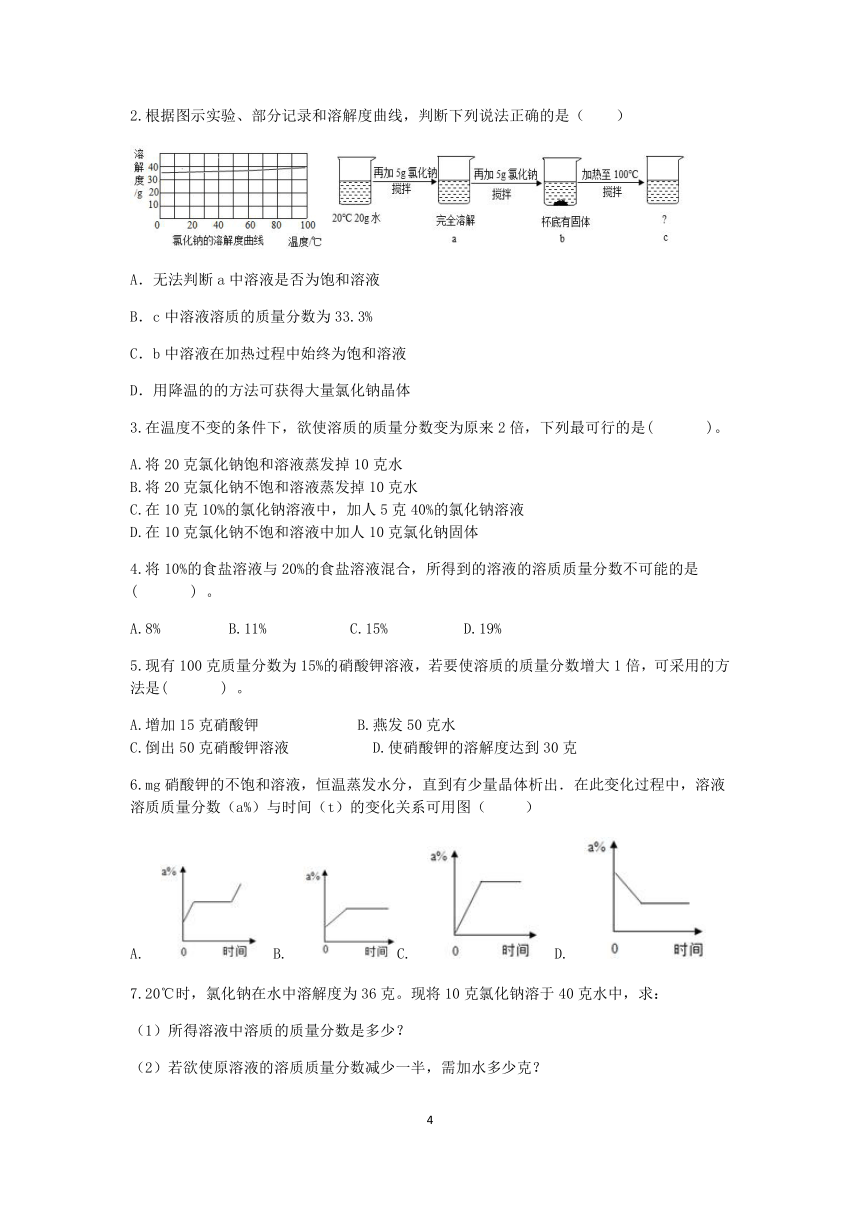
2.根据图示实验、部分记录和溶解度曲线,判断下列说法正确的是( )
A.无法判断a中溶液是否为饱和溶液
B.c中溶液溶质的质量分数为33.3%
C.b中溶液在加热过程中始终为饱和溶液
D.用降温的的方法可获得大量氯化钠晶体
3.在温度不变的条件下,欲使溶质的质量分数变为原来2倍,下列最可行的是( )。
A.将20克氯化钠饱和溶液蒸发掉10克水
B.将20克氯化钠不饱和溶液蒸发掉10克水
C.在10克10%的氯化钠溶液中,加人5克40%的氯化钠溶液
D.在10克氯化钠不饱和溶液中加人10克氯化钠固体
4.将10%的食盐溶液与20%的食盐溶液混合,所得到的溶液的溶质质量分数不可能的是( ) 。
A.8% B.11% C.15% D.19%
5.现有100克质量分数为15%的硝酸钾溶液,若要使溶质的质量分数增大1倍,可采用的方法是( ) 。
A.增加15克硝酸钾 B.燕发50克水
C.倒出50克硝酸钾溶液 D.使硝酸钾的溶解度达到30克
6.mg硝酸钾的不饱和溶液,恒温蒸发水分,直到有少量晶体析出.在此变化过程中,溶液溶质质量分数(a%)与时间(t)的变化关系可用图( )
A. B. C. D.
7.20℃时,氯化钠在水中溶解度为36克。现将10克氯化钠溶于40克水中,求:
(1)所得溶液中溶质的质量分数是多少?
(2)若欲使原溶液的溶质质量分数减少一半,需加水多少克?
(3)若欲使原溶液恰好形成该温度下的饱和溶液,可恒温蒸发多少克水?(结果保留一位小数)
8.下表是硝酸钾在不同温度时的溶解度,根据表中数据回答下列问题。
温度/℃ 0 10 20 30 40
溶解度/克 13.3 20.9 31.6 45.8 63.9
(1)10℃时,100 克水中最多可溶解硝酸钾的质量为________克。
(2)20℃时,将 10 克硝酸钾加入 40 克水中,所得溶液溶质质量分数为________。
(3)如图是硝酸钾溶液的变化情况,若要通过蒸发溶剂的方法达到,请问要蒸发多少克的溶剂。(写出计算过程)
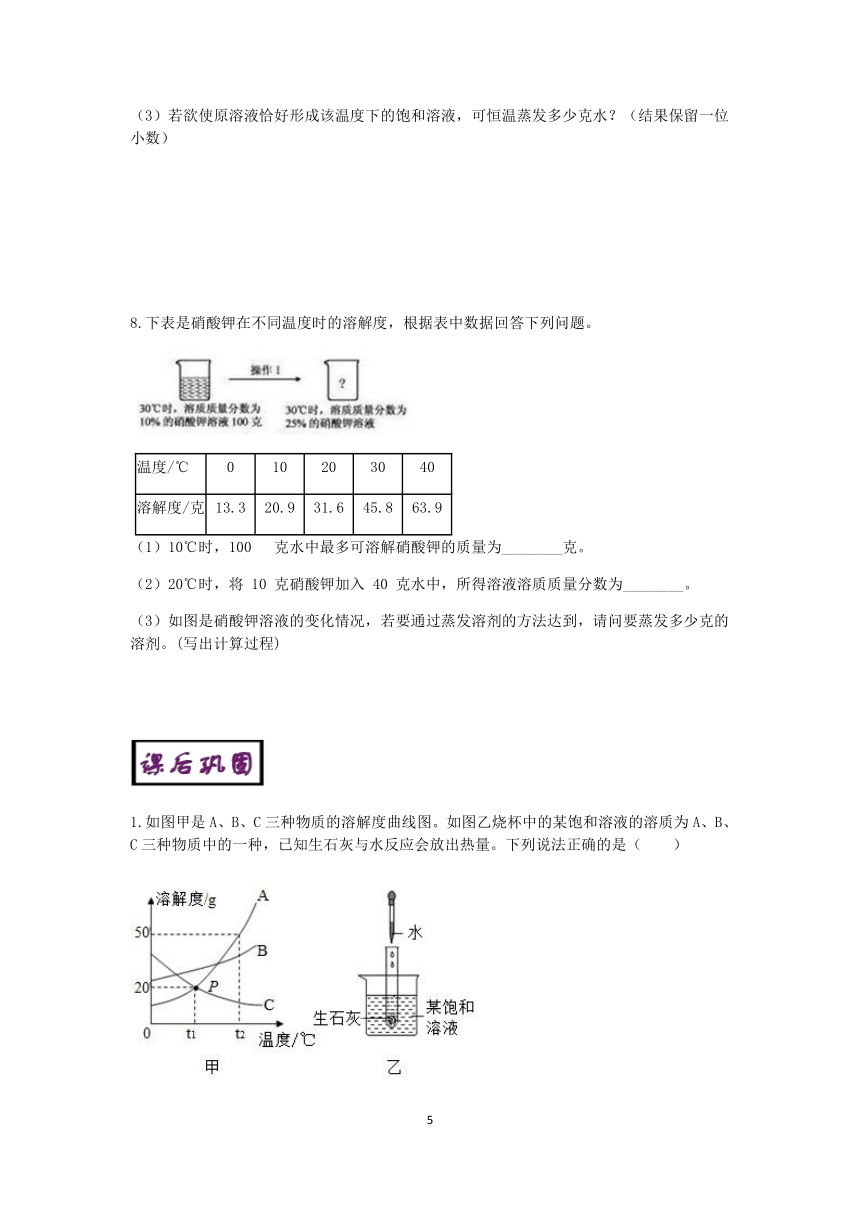
1.如图甲是A、B、C三种物质的溶解度曲线图。如图乙烧杯中的某饱和溶液的溶质为A、B、C三种物质中的一种,已知生石灰与水反应会放出热量。下列说法正确的是( )
A.三种物质的溶解度大小关系为A>B>C
B.在t2 ℃时,30 g A加入到50 g水中形成80 g溶液
C.将t2℃下A、B、C的饱和溶液降温到t1℃,所得溶液中溶质质量分数大小关系为B>A=C
D.生石灰与水反应完全后,如图乙烧杯中的饱和溶液变浑浊,说明该饱和溶液的溶质是C
2.现有一定温度的氯化铵饱和溶液200克,欲改变此溶液中溶质的质量分数,可采用的方法是( )
A. 温度不变,蒸发掉20克水 B. 温度不变,加入10克氯化铵固体
C. 温度不变,取出10克原溶液 D. 温度不变,加入20克水
3.(2021·台州)下表是氢氧化钠溶液的密度与其质量分数对照表(20℃)。回答下列问题:
质量分数(%) 10 20 30 40 50
密度(克/厘米3) 1.11 1.22 1.33 1.43 1.53
(1)20℃时,随着溶质质量分数增大、氢氧化钠溶液的密度逐渐________。
(2)配制100克10%的氢氧化钠溶液。需要氢氧化钠固体________。
(3)10℃的氢氧化钠溶液,体积为100毫升时的质量为________。
4.20℃氯化钾的溶解度是34g。取氯化钾溶液65g放入烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。
(1)甲图烧杯中是氯化钾的________溶液(选填“饱和”或“不饱和”)
(2)丁图烧杯中氯化钾溶液的质量分数为多少?(计算结果保留一位小数)
5.氯化钠俗名食盐,是工业生产和生活的一种重要原料,也是实验室里常见的一种药品。 下表是20℃时,氯化钠溶解于水的实验数据,回答下列问题:
实验序号 水的质量(g) 加入氯化钠的质量(g) 溶液的质量(g)
① 20 4 24
② 20 6 26
③ 20 8 27.2
④ 20 10 m
(1)表中m=________;
(2)在这4次实验中,得到的20℃氯化钠溶液属于饱和溶液的是________。(填实验序号) (3)计算第3次实验得到的氢化钠溶液的溶质质量分数。(结果保留一位小数)
(4)20℃时,实验室把100克溶质质量分数为20%的氯化钠溶液稀释成5%的氯化钠溶液,请计算需加入水多少克?
答案及解析
例1、【答案】D
【详解】A、40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,溶剂的质量逐渐减少,故选项说法错误;
B、40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,溶质的质量逐渐减少,故选项说法错误;
C、40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,溶液由不饱和溶液变为饱和溶液,溶质的质量分数变大,故选项说法错误;
D、温度不变,食盐的溶解度不变,故选项说法正确。
故选D。
例2、【答案】5%;增大;饱和溶液;26.47%
【解析】根据溶质量分数=溶质质量/溶液质量、改变温度饱和溶液变不饱和溶液时溶质质量分数不变,蒸发溶剂时溶质质量分数增大,一定温度下饱和溶液溶质质量分数达到最大值且等于溶解度/100+溶解度分析。
【解答】 在20℃时,100克5%的食盐溶液温度升高到60℃,变成不饱和溶液,溶质质量分数不变,仍为5%;若将该溶液恒温蒸发水分,则溶液中溶质的质量分数会因溶剂质量减小而增大 ;在20℃时, 当溶液成为饱和溶液时溶质质量分数最大,20℃食盐的溶解度为36克 ,则饱和溶液溶质质量分数为=26.47%。
例3、【答案】(1)这瓶浓硫酸溶液的质量为500毫升× 1.84克/厘米3 =920克,
该溶液中的溶质质量是920克 ×98%=901.6克;
(2)设需浓硫酸质量为x
1000克×19.6% =98%x
x=2000克,
则体积为200克 1.84克/厘米3 =108.7毫升,
需水的质量为1000克-200克=800克,体积为800毫升。
【解析】(1)根据溶质质量=溶液质量×溶质质量分数,溶液质量=溶液体积×密度分析;
(2)根据溶液稀释前后溶质质量不变及所加水的质量即为稀溶液质量-浓溶液质量分析。
例4、【答案】(1)m液=ρ液V液=1.2g/cm3×1000ml=1200g m质=80%m液=960g
(2)由于m质前=m质后 所以960g=P%×(1200g+5000g) 得到:P%=15.5%
(3)由于m质前=m质后 所以80%×m液=20%×30kg m液=7.5kgV加水=m加水ρ水=30kg 7.5kg1×103kg/m3=22.5L
【解析】(1)首先根据密度公式m液=ρ液V液计算消毒液的质量,再根据溶质质量=溶液质量×溶质质量分数计算即可。
(2)稀释前后,溶质的质量保持不变,据此根据溶质质量=溶液质量×溶质质量分数列出方程,计算出所得溶液的溶质质量分数。
(3)用(2)中的方法列出方程,计算出需要消毒液的质量,然后两个消毒液的质量之差就是需要加水的质量,最后根据计算需要加水的体积。
【解答】(1)二氧化氯消毒液的质量:m液=ρ液V液=1.2g/cm3×1000ml=1200g;
溶质的质量: m质=80%m液=80%×1200g=960g。
(2)由于m质前=m质后 ,
所以960g=P%×(1200g+5000g);
得到:P%=15.5%。
(3)由于m质前=m质后,
所以80%×m液=20%×30kg ;
解得:m液=7.5kg;
需要加水的体积。
1.【答案】C
【分析】20℃时,氯化镁的溶解度为54.6克,即该温度下,100克水最多溶解54.6克氯化镁。
【详解】A、由分析可知,40克氯化镁能完全溶解在100克水中,所以①所得溶液中溶质和溶剂的质量比为40g:100g=2:5,故说法错误;
B、由分析可知,50克氯化镁能完全溶解在100克水中,②所得溶液中溶质的质量分数为,故说法错误;
C、由分析可知,20℃时,60克、70克都不能完全溶解在100克水中,故③④所得溶液均为20℃时氯化镁的饱和溶液,故说法正确;
D、由分析可知,20℃时,60克、70克都不能完全溶解在100克水中,故③④所得溶液均为20℃时氯化镁的饱和溶液,所以③④所得溶液的溶质质量分数相等,故说法错误。
故选C。
2.【答案】C
【详解】A、由图可知,20℃时氯化钠的溶解度约为36g,则此时20g水中最多溶解7.2g氯化钠,20℃将5g氯化钠放入20g水中,氯化钠固体会完全溶解形成不饱和溶液,选项错误;
B、100℃时,氯化钠的溶解度为40g,20g水中最多溶解氯化钠8g,则题目中加入的10g氯化钠只能溶解8g,所得溶液的溶质质量分数=×100%≈28.6%,选项错误;
C、b溶液的底部有固体剩余,溶液为饱和溶液,升温至100℃时,c溶液中只能溶解8g氯化钠,溶液为饱和溶液,即b中溶液在加热过程中始终为饱和溶液,选项正确;
D、氯化钠的溶解度随温度升高而增大,氮氯化钠的溶解度收温度影响较小,用降温的的方法不能获得大量氯化钠晶体,应选择蒸发结晶的方法来获得氯化钠晶体,选项错误;
故选C。
3.【答案】 C
【解答】A、将20克氯化钠饱和溶液蒸发掉10克水 ,仍是该温度下的饱和溶液,溶质质量分数不变,不符合题意;
B、 将20克氯化钠不饱和溶液蒸发掉10克水,若无晶体析出,则可使溶质质量分数变为原了2倍,但若析出晶体,则不能 ,不符合题意;
C、 在10克10%的氯化钠溶液中,加人5克40%的氯化钠溶液 ,所得溶液的溶质质量分数为=20%,符合题意;
D、在10克氯化钠不饱和溶液中加入10克氯化钠固体 ,因未确定原溶液的溶质质量分数,所以混合后的溶质质量分数不有确定,不符合题意;
故选C。
4.【答案】 A
【解答】将10%的食盐溶液与20%的食盐溶液混合,其溶质质量分数在10%-20%之间,所以不可能是8%;
故选A。
5.【答案】 B
【解答】A、 增加15克硝酸钾 ,所得溶液溶质质量分数为=26.1%,不符合题意;
B、蒸发掉50克水,则溶质质量分数为 , 符合题意;
C、 倒出50克硝酸钾溶液,溶质质量分数不变,仍是15% ,不符合题意;
D、使硝酸钾的溶解度达到30克 ,其饱和溶液溶质质量分数为=23.1%,不符合题意;
故选B。
6.【答案】 B
【解答】当硝酸钾溶液为不饱和溶液时,随着时间的延长,溶质的质量不变,而溶剂的质量减小,根据可知,这段时间内溶质质量分数不断增大;
当硝酸钾溶液达到饱和后,不断有晶体析出,溶质的质量和溶剂的质量都在减小。硝酸钾的溶解度不变,根据可知,此时溶液的溶质质量分数保持不变。
故B符合题意,而A、C、D不合题意。
故选B。
7.【答案】(1)设40g水中最多溶解氯化钠的质量为x,
;
解得:x=14.4g;
因为10g<14.4g,所以得到氯化钠的不饱和溶液。
溶质质量分数为:.
(2)若欲使原溶液的溶质质量分数减少一半,需加水的质量为y,
;解得:y=50g。
(3)20℃时,10g氯化钠配制成饱和溶液时需要水的质量为z,
;解得:z≈27.8g;
则需要蒸发水的质量为:40g-27.8g=12.2g。
【解析】(1)根据溶解度计算出40g水中最多溶解氯化钠的质量,从而确定溶液是否包含,再计算溶质质量分数。
(2)根据溶质质量分数=列方程计算即可;
(3)根据溶解度计算出10g氯化钠配制成饱和溶液时需要水的质量,然后前后两个水的质量相减即可。
8.【答案】(1)20.9
(2)20%
(3)解:m稀×A%稀=m浓×A%浓 ,
100克×10%=m浓×25%,
m浓=40克
m蒸发=m稀-m浓=100克-40克=60克
【解析】(1)通过表格确定10℃时硝酸钾的溶解度,然后根据溶解度的意义分析解答;
(2)在同一温度下,物质的溶解度相同,即饱和溶液的溶质质量分数相等;通过表格查找20℃时的溶解度,然后计算出40g水中最多溶解硝酸钾的质量,接下来与10g比较,进而确定溶质的质量,并计算出溶液的溶质质量分数;
(3)蒸发溶剂前后,溶质的质量不变,据此根据溶质质量=溶液质量×溶质质量分数列出方程,计算出得到25%的溶液质量,最后将两个溶液的质量相减得到蒸发水的质量。
【解答】(1)根据表格可知,10℃时,硝酸钾的溶解度为20.9g,那么该温度下,100g水中最多溶解硝酸钾的质量为20.9g。
(2)20℃时,硝酸钾的溶解度为31.6g,设40g水中最多溶解硝酸钾的质量为x,
;
解得:x=12.64g;
因为10g<12.64g,所以硝酸钾溶液为不饱和溶液。
它的溶质质量分数为:。
(3)蒸发溶剂前后,溶质的质量保持不变;
m稀×A%=m浓×B%,
100克×10%=m浓×25%,
解得:m浓=40克;
需要蒸发水的质量:m蒸发=m稀-m浓=100克-40克=60克。
1.【答案】D
【详解】A、由图可知,当温度为t1℃时,三种物质的溶解度的关系为B>A=C,当温度为t2℃时,三种物质的溶解度的关系为A >B> C,题文中没有明确温度,不能比较三种物质的溶解度的关系,选项错误;
B、由图可知,t2℃时,A的溶解度为50g,则t2℃时,将30 g A加入到50 g水中充分溶解,只能够溶解25gA物质,所得溶液的质量=50g+25g=75g,选项错误;
C、由图可知,A、B的溶解度都随温度升高而增大,且t1℃时B的溶解度大于A的溶解度,则将t2 ℃下A、B的饱和溶液降温到t1 ℃,A、B的溶解度都减小,溶液底部均有晶体析出,溶液仍为饱和溶液,此时B溶液的溶质质量分数大于A溶液的溶质质量分数,C的溶解度随温度升高而减小,且t2 ℃时,C的溶解度小于t1 ℃时A的溶解度,将t2 ℃下C的饱和溶液降温到t1 ℃,C的溶解度增大,溶液变为不饱和溶液,溶液的溶质质量分数不变,溶液的溶质质量分数小于A溶液的溶质质量分数,即将t2 ℃下A、B、C的饱和溶液降温到t1 ℃,所得溶液中溶质质量分数大小关系为B>A>C,选项错误;
D、生石灰与水反应会放出热量,溶液的温度升高,图乙烧杯中的饱和溶液变浑浊,说明烧杯溶液中的溶质的溶解度随温度升高而减小,图中A、B、C三种物质中,C的溶解度随温度升高而减小,即图乙烧杯中的饱和溶液中的溶质是C,选项正确,故选D。
2.【答案】 D
【解答】氯化铵已经达到饱和,如果温度不变,那么它的溶解度不变,即饱和溶液的溶质质量分数保持不变。
蒸发掉20g水后仍然为饱和溶液,溶质质量分数不变,故A错误;
加入10g氯化铵固体,但是不会溶解,溶质质量分数不变,故B错误;
取出10g溶液,不会改变剩余溶液的溶质质量分数,故C错误;
温度不变,加入20g水后,溶液的质量会增大而溶质质量不变,那么溶质质量分数减小,故D正确。
故选D。
3.【答案】(1)大 (2)10g (3)111g
【解析】(1)根据表格分析溶液密度随溶质质量分数的变化规律;
(2)溶质质量=溶液质量×溶质质量分数;
(3)根据表格确定10℃时氢氧化钠的溶液密度,然后根据m=ρV计算它的质量。
【解答】(1)根据表格可知,0℃时,随着溶质质量分数增大、氢氧化钠溶液的密度逐渐增大。
(2)需要氢氧化钠固体:100g×10%=10g;
(3)10℃时氢氧化钠的溶液密度为1.11g/cm3,则体积为100mL质量为:m=ρV=1.11g/cm3×100cm3=111g。
4.【答案】(1)不饱和
(2)20℃时,氯化钾的溶解度为34g,
那么丁溶液的溶质质量分数:。
【解析】(1)甲溶液中加5g氯化钾后完全溶解,这说明甲溶液肯定没有饱和;
(2)根据图片可知,氯化钾溶液降温到20℃时,溶液中析出3g氯化钾晶体,此时得到的丁溶液肯定是20℃时的饱和溶液,根据溶质质量分数=计算即可。
【解答】(1)甲图烧杯中是氯化钾的不饱和溶液。
(2)20℃时,氯化钾的溶解度为34g,
那么丁溶液的溶质质量分数:。
5.【答案】(1)27.2
(2)③④
(3)解: ×100%=26.5%
答:第三次实验得到的氯化钠溶液的溶质质量分数为26.5%。
(4)解:m溶质=100g×20%=20g
m溶质= = 400g
m水=400g-100g=300g
答:需要加入水的质量是300g。
【解析】(1)当溶液的质量小于水和氯化钠的总质量时,说明此时溶液已经饱和,据此确定20g水中最多溶解氯化钠的质量,进而计算出m的值;
(2)根据(1)中的分析解答;
(3)根据计算;
(4)首先根据溶质质量=溶液质量×溶质质量分数计算出100g溶液中氯化钠的质量,再根据计算出5%的溶液质量,最后将两个溶液质量相减得到加水的质量。
【解答】(1)在第③次实验中,水和氯化钠的总质量为:20g+8g=28g。因为27.2g<28g,所以③为氯化钠的饱和溶液,即20g水中最多溶解氯化钠:27.2g-20g=7.2g。当再加入10g氯化钠时,由于10g>7.2g,因此④仍然饱和,那么溶液质量不变,依然为27.2g,即m=27.2g。
(2)在这4次实验中,得到的20℃氯化钠溶液属于饱和溶液的是③④。
2022-2023学年上学期浙教版科学八年级“冲刺重高”讲义(九)
物质的溶解性(3)
溶液中:溶质的质量=溶液的体积×溶液的密度×溶质的质量分数
同一温度下,同种溶质饱和溶液的溶质的质量分数最大。饱和溶液的溶质的质量分数有两种计算方法,
溶液的稀释、浓缩
①稀释:稀释前后溶质质量不变
②浓缩: A增加溶质
B蒸发溶剂
C两者混合
例1、(2022杭州)40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,此过程中不发生变化的是( )
A.溶剂的质量 B.溶质的质量 C.溶液中溶质的质量分数 D.食盐的溶解度
例2、在20℃时,100克5%的食盐溶液温度升高到60℃(忽略水分蒸发),则溶质的质量分数为________ ;若将该溶液恒温蒸发水分,则溶液中溶质的质量分数会________(选填“增大”或“减小”) ;在20℃时,当溶液成为________时,该溶液的质量分数最大,其最大值为________。(20°C时,食盐的溶解度为36克)
例3、某同学在实验室观察到浓硫酸瓶上的标签如表所示。
浓硫酸(H2SO4)500毫升
溶质的质量分数 98%
密度 1.84克/厘米3
相对分子质量 98
强腐蚀性,阴冷,密封储藏
(1)这瓶浓硫酸溶液的质量是多少克 ?该溶液中的溶质质量是多少克 ?
(2)欲配制1000克质量分数为19.6%的稀硫酸,需要这种浓硫酸多少毫升 ?需要加水多少毫升 ?
例4、二氧化氯消毒液是国际上公认的新一代强力、安全、高效的消毒剂,能够迅速,彻底杀灭各种细菌(大肠杆菌、白色念珠菌等)和病毒(肝炎病毒、流感病毒等)。小应同学观察到瓶上的标签如表所示,试回答:
二氧化氯(ClO2)1000毫升
溶质质量分数 80%
密度 1.2克/厘米3
强腐蚀性,阴冷、密封储藏
(1)这1000毫升二氧化氯消毒液中含溶质二氧化氯多少克?
(2)若将这1000毫升二氧化氯消毒液与5000克水均匀混合,所得稀二氧化氧消毒液中二氧化氯的质量分数是多少?(小数点后保留一位有效数字)
(3)该校欲配置30千克20%的稀二氧化氯消毒液用以消毒,需多少千克这样二氧化氧消毒液和多少升水?
1.用氯化镁溶液喷洒路面可融雪。已知20℃时,氯化镁的溶解度为54.6克,若按表中数据配制溶液(温度均为20℃),则下列说法正确的是( )
序号 ① ② ③ ④
氯化镁的质量/克 40 50 60 70
水的质量/克 100 100 100 100
A.①所得溶液,其溶质和溶剂的质量比为2:7
B.②所得溶液,其溶质的质量分数为50%
C.③④所得溶液均为20℃时氯化镁的饱和溶液
D.③所得溶液的溶质质量分数小于④所得溶液
2.根据图示实验、部分记录和溶解度曲线,判断下列说法正确的是( )
A.无法判断a中溶液是否为饱和溶液
B.c中溶液溶质的质量分数为33.3%
C.b中溶液在加热过程中始终为饱和溶液
D.用降温的的方法可获得大量氯化钠晶体
3.在温度不变的条件下,欲使溶质的质量分数变为原来2倍,下列最可行的是( )。
A.将20克氯化钠饱和溶液蒸发掉10克水
B.将20克氯化钠不饱和溶液蒸发掉10克水
C.在10克10%的氯化钠溶液中,加人5克40%的氯化钠溶液
D.在10克氯化钠不饱和溶液中加人10克氯化钠固体
4.将10%的食盐溶液与20%的食盐溶液混合,所得到的溶液的溶质质量分数不可能的是( ) 。
A.8% B.11% C.15% D.19%
5.现有100克质量分数为15%的硝酸钾溶液,若要使溶质的质量分数增大1倍,可采用的方法是( ) 。
A.增加15克硝酸钾 B.燕发50克水
C.倒出50克硝酸钾溶液 D.使硝酸钾的溶解度达到30克
6.mg硝酸钾的不饱和溶液,恒温蒸发水分,直到有少量晶体析出.在此变化过程中,溶液溶质质量分数(a%)与时间(t)的变化关系可用图( )
A. B. C. D.
7.20℃时,氯化钠在水中溶解度为36克。现将10克氯化钠溶于40克水中,求:
(1)所得溶液中溶质的质量分数是多少?
(2)若欲使原溶液的溶质质量分数减少一半,需加水多少克?
(3)若欲使原溶液恰好形成该温度下的饱和溶液,可恒温蒸发多少克水?(结果保留一位小数)
8.下表是硝酸钾在不同温度时的溶解度,根据表中数据回答下列问题。
温度/℃ 0 10 20 30 40
溶解度/克 13.3 20.9 31.6 45.8 63.9
(1)10℃时,100 克水中最多可溶解硝酸钾的质量为________克。
(2)20℃时,将 10 克硝酸钾加入 40 克水中,所得溶液溶质质量分数为________。
(3)如图是硝酸钾溶液的变化情况,若要通过蒸发溶剂的方法达到,请问要蒸发多少克的溶剂。(写出计算过程)
1.如图甲是A、B、C三种物质的溶解度曲线图。如图乙烧杯中的某饱和溶液的溶质为A、B、C三种物质中的一种,已知生石灰与水反应会放出热量。下列说法正确的是( )
A.三种物质的溶解度大小关系为A>B>C
B.在t2 ℃时,30 g A加入到50 g水中形成80 g溶液
C.将t2℃下A、B、C的饱和溶液降温到t1℃,所得溶液中溶质质量分数大小关系为B>A=C
D.生石灰与水反应完全后,如图乙烧杯中的饱和溶液变浑浊,说明该饱和溶液的溶质是C
2.现有一定温度的氯化铵饱和溶液200克,欲改变此溶液中溶质的质量分数,可采用的方法是( )
A. 温度不变,蒸发掉20克水 B. 温度不变,加入10克氯化铵固体
C. 温度不变,取出10克原溶液 D. 温度不变,加入20克水
3.(2021·台州)下表是氢氧化钠溶液的密度与其质量分数对照表(20℃)。回答下列问题:
质量分数(%) 10 20 30 40 50
密度(克/厘米3) 1.11 1.22 1.33 1.43 1.53
(1)20℃时,随着溶质质量分数增大、氢氧化钠溶液的密度逐渐________。
(2)配制100克10%的氢氧化钠溶液。需要氢氧化钠固体________。
(3)10℃的氢氧化钠溶液,体积为100毫升时的质量为________。
4.20℃氯化钾的溶解度是34g。取氯化钾溶液65g放入烧杯中,按如图所示进行操作(整个过程中无溶剂损失)。
(1)甲图烧杯中是氯化钾的________溶液(选填“饱和”或“不饱和”)
(2)丁图烧杯中氯化钾溶液的质量分数为多少?(计算结果保留一位小数)
5.氯化钠俗名食盐,是工业生产和生活的一种重要原料,也是实验室里常见的一种药品。 下表是20℃时,氯化钠溶解于水的实验数据,回答下列问题:
实验序号 水的质量(g) 加入氯化钠的质量(g) 溶液的质量(g)
① 20 4 24
② 20 6 26
③ 20 8 27.2
④ 20 10 m
(1)表中m=________;
(2)在这4次实验中,得到的20℃氯化钠溶液属于饱和溶液的是________。(填实验序号) (3)计算第3次实验得到的氢化钠溶液的溶质质量分数。(结果保留一位小数)
(4)20℃时,实验室把100克溶质质量分数为20%的氯化钠溶液稀释成5%的氯化钠溶液,请计算需加入水多少克?
答案及解析
例1、【答案】D
【详解】A、40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,溶剂的质量逐渐减少,故选项说法错误;
B、40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,溶质的质量逐渐减少,故选项说法错误;
C、40℃时恒温蒸发一杯不饱和食盐水至有晶体析出,溶液由不饱和溶液变为饱和溶液,溶质的质量分数变大,故选项说法错误;
D、温度不变,食盐的溶解度不变,故选项说法正确。
故选D。
例2、【答案】5%;增大;饱和溶液;26.47%
【解析】根据溶质量分数=溶质质量/溶液质量、改变温度饱和溶液变不饱和溶液时溶质质量分数不变,蒸发溶剂时溶质质量分数增大,一定温度下饱和溶液溶质质量分数达到最大值且等于溶解度/100+溶解度分析。
【解答】 在20℃时,100克5%的食盐溶液温度升高到60℃,变成不饱和溶液,溶质质量分数不变,仍为5%;若将该溶液恒温蒸发水分,则溶液中溶质的质量分数会因溶剂质量减小而增大 ;在20℃时, 当溶液成为饱和溶液时溶质质量分数最大,20℃食盐的溶解度为36克 ,则饱和溶液溶质质量分数为=26.47%。
例3、【答案】(1)这瓶浓硫酸溶液的质量为500毫升× 1.84克/厘米3 =920克,
该溶液中的溶质质量是920克 ×98%=901.6克;
(2)设需浓硫酸质量为x
1000克×19.6% =98%x
x=2000克,
则体积为200克 1.84克/厘米3 =108.7毫升,
需水的质量为1000克-200克=800克,体积为800毫升。
【解析】(1)根据溶质质量=溶液质量×溶质质量分数,溶液质量=溶液体积×密度分析;
(2)根据溶液稀释前后溶质质量不变及所加水的质量即为稀溶液质量-浓溶液质量分析。
例4、【答案】(1)m液=ρ液V液=1.2g/cm3×1000ml=1200g m质=80%m液=960g
(2)由于m质前=m质后 所以960g=P%×(1200g+5000g) 得到:P%=15.5%
(3)由于m质前=m质后 所以80%×m液=20%×30kg m液=7.5kgV加水=m加水ρ水=30kg 7.5kg1×103kg/m3=22.5L
【解析】(1)首先根据密度公式m液=ρ液V液计算消毒液的质量,再根据溶质质量=溶液质量×溶质质量分数计算即可。
(2)稀释前后,溶质的质量保持不变,据此根据溶质质量=溶液质量×溶质质量分数列出方程,计算出所得溶液的溶质质量分数。
(3)用(2)中的方法列出方程,计算出需要消毒液的质量,然后两个消毒液的质量之差就是需要加水的质量,最后根据计算需要加水的体积。
【解答】(1)二氧化氯消毒液的质量:m液=ρ液V液=1.2g/cm3×1000ml=1200g;
溶质的质量: m质=80%m液=80%×1200g=960g。
(2)由于m质前=m质后 ,
所以960g=P%×(1200g+5000g);
得到:P%=15.5%。
(3)由于m质前=m质后,
所以80%×m液=20%×30kg ;
解得:m液=7.5kg;
需要加水的体积。
1.【答案】C
【分析】20℃时,氯化镁的溶解度为54.6克,即该温度下,100克水最多溶解54.6克氯化镁。
【详解】A、由分析可知,40克氯化镁能完全溶解在100克水中,所以①所得溶液中溶质和溶剂的质量比为40g:100g=2:5,故说法错误;
B、由分析可知,50克氯化镁能完全溶解在100克水中,②所得溶液中溶质的质量分数为,故说法错误;
C、由分析可知,20℃时,60克、70克都不能完全溶解在100克水中,故③④所得溶液均为20℃时氯化镁的饱和溶液,故说法正确;
D、由分析可知,20℃时,60克、70克都不能完全溶解在100克水中,故③④所得溶液均为20℃时氯化镁的饱和溶液,所以③④所得溶液的溶质质量分数相等,故说法错误。
故选C。
2.【答案】C
【详解】A、由图可知,20℃时氯化钠的溶解度约为36g,则此时20g水中最多溶解7.2g氯化钠,20℃将5g氯化钠放入20g水中,氯化钠固体会完全溶解形成不饱和溶液,选项错误;
B、100℃时,氯化钠的溶解度为40g,20g水中最多溶解氯化钠8g,则题目中加入的10g氯化钠只能溶解8g,所得溶液的溶质质量分数=×100%≈28.6%,选项错误;
C、b溶液的底部有固体剩余,溶液为饱和溶液,升温至100℃时,c溶液中只能溶解8g氯化钠,溶液为饱和溶液,即b中溶液在加热过程中始终为饱和溶液,选项正确;
D、氯化钠的溶解度随温度升高而增大,氮氯化钠的溶解度收温度影响较小,用降温的的方法不能获得大量氯化钠晶体,应选择蒸发结晶的方法来获得氯化钠晶体,选项错误;
故选C。
3.【答案】 C
【解答】A、将20克氯化钠饱和溶液蒸发掉10克水 ,仍是该温度下的饱和溶液,溶质质量分数不变,不符合题意;
B、 将20克氯化钠不饱和溶液蒸发掉10克水,若无晶体析出,则可使溶质质量分数变为原了2倍,但若析出晶体,则不能 ,不符合题意;
C、 在10克10%的氯化钠溶液中,加人5克40%的氯化钠溶液 ,所得溶液的溶质质量分数为=20%,符合题意;
D、在10克氯化钠不饱和溶液中加入10克氯化钠固体 ,因未确定原溶液的溶质质量分数,所以混合后的溶质质量分数不有确定,不符合题意;
故选C。
4.【答案】 A
【解答】将10%的食盐溶液与20%的食盐溶液混合,其溶质质量分数在10%-20%之间,所以不可能是8%;
故选A。
5.【答案】 B
【解答】A、 增加15克硝酸钾 ,所得溶液溶质质量分数为=26.1%,不符合题意;
B、蒸发掉50克水,则溶质质量分数为 , 符合题意;
C、 倒出50克硝酸钾溶液,溶质质量分数不变,仍是15% ,不符合题意;
D、使硝酸钾的溶解度达到30克 ,其饱和溶液溶质质量分数为=23.1%,不符合题意;
故选B。
6.【答案】 B
【解答】当硝酸钾溶液为不饱和溶液时,随着时间的延长,溶质的质量不变,而溶剂的质量减小,根据可知,这段时间内溶质质量分数不断增大;
当硝酸钾溶液达到饱和后,不断有晶体析出,溶质的质量和溶剂的质量都在减小。硝酸钾的溶解度不变,根据可知,此时溶液的溶质质量分数保持不变。
故B符合题意,而A、C、D不合题意。
故选B。
7.【答案】(1)设40g水中最多溶解氯化钠的质量为x,
;
解得:x=14.4g;
因为10g<14.4g,所以得到氯化钠的不饱和溶液。
溶质质量分数为:.
(2)若欲使原溶液的溶质质量分数减少一半,需加水的质量为y,
;解得:y=50g。
(3)20℃时,10g氯化钠配制成饱和溶液时需要水的质量为z,
;解得:z≈27.8g;
则需要蒸发水的质量为:40g-27.8g=12.2g。
【解析】(1)根据溶解度计算出40g水中最多溶解氯化钠的质量,从而确定溶液是否包含,再计算溶质质量分数。
(2)根据溶质质量分数=列方程计算即可;
(3)根据溶解度计算出10g氯化钠配制成饱和溶液时需要水的质量,然后前后两个水的质量相减即可。
8.【答案】(1)20.9
(2)20%
(3)解:m稀×A%稀=m浓×A%浓 ,
100克×10%=m浓×25%,
m浓=40克
m蒸发=m稀-m浓=100克-40克=60克
【解析】(1)通过表格确定10℃时硝酸钾的溶解度,然后根据溶解度的意义分析解答;
(2)在同一温度下,物质的溶解度相同,即饱和溶液的溶质质量分数相等;通过表格查找20℃时的溶解度,然后计算出40g水中最多溶解硝酸钾的质量,接下来与10g比较,进而确定溶质的质量,并计算出溶液的溶质质量分数;
(3)蒸发溶剂前后,溶质的质量不变,据此根据溶质质量=溶液质量×溶质质量分数列出方程,计算出得到25%的溶液质量,最后将两个溶液的质量相减得到蒸发水的质量。
【解答】(1)根据表格可知,10℃时,硝酸钾的溶解度为20.9g,那么该温度下,100g水中最多溶解硝酸钾的质量为20.9g。
(2)20℃时,硝酸钾的溶解度为31.6g,设40g水中最多溶解硝酸钾的质量为x,
;
解得:x=12.64g;
因为10g<12.64g,所以硝酸钾溶液为不饱和溶液。
它的溶质质量分数为:。
(3)蒸发溶剂前后,溶质的质量保持不变;
m稀×A%=m浓×B%,
100克×10%=m浓×25%,
解得:m浓=40克;
需要蒸发水的质量:m蒸发=m稀-m浓=100克-40克=60克。
1.【答案】D
【详解】A、由图可知,当温度为t1℃时,三种物质的溶解度的关系为B>A=C,当温度为t2℃时,三种物质的溶解度的关系为A >B> C,题文中没有明确温度,不能比较三种物质的溶解度的关系,选项错误;
B、由图可知,t2℃时,A的溶解度为50g,则t2℃时,将30 g A加入到50 g水中充分溶解,只能够溶解25gA物质,所得溶液的质量=50g+25g=75g,选项错误;
C、由图可知,A、B的溶解度都随温度升高而增大,且t1℃时B的溶解度大于A的溶解度,则将t2 ℃下A、B的饱和溶液降温到t1 ℃,A、B的溶解度都减小,溶液底部均有晶体析出,溶液仍为饱和溶液,此时B溶液的溶质质量分数大于A溶液的溶质质量分数,C的溶解度随温度升高而减小,且t2 ℃时,C的溶解度小于t1 ℃时A的溶解度,将t2 ℃下C的饱和溶液降温到t1 ℃,C的溶解度增大,溶液变为不饱和溶液,溶液的溶质质量分数不变,溶液的溶质质量分数小于A溶液的溶质质量分数,即将t2 ℃下A、B、C的饱和溶液降温到t1 ℃,所得溶液中溶质质量分数大小关系为B>A>C,选项错误;
D、生石灰与水反应会放出热量,溶液的温度升高,图乙烧杯中的饱和溶液变浑浊,说明烧杯溶液中的溶质的溶解度随温度升高而减小,图中A、B、C三种物质中,C的溶解度随温度升高而减小,即图乙烧杯中的饱和溶液中的溶质是C,选项正确,故选D。
2.【答案】 D
【解答】氯化铵已经达到饱和,如果温度不变,那么它的溶解度不变,即饱和溶液的溶质质量分数保持不变。
蒸发掉20g水后仍然为饱和溶液,溶质质量分数不变,故A错误;
加入10g氯化铵固体,但是不会溶解,溶质质量分数不变,故B错误;
取出10g溶液,不会改变剩余溶液的溶质质量分数,故C错误;
温度不变,加入20g水后,溶液的质量会增大而溶质质量不变,那么溶质质量分数减小,故D正确。
故选D。
3.【答案】(1)大 (2)10g (3)111g
【解析】(1)根据表格分析溶液密度随溶质质量分数的变化规律;
(2)溶质质量=溶液质量×溶质质量分数;
(3)根据表格确定10℃时氢氧化钠的溶液密度,然后根据m=ρV计算它的质量。
【解答】(1)根据表格可知,0℃时,随着溶质质量分数增大、氢氧化钠溶液的密度逐渐增大。
(2)需要氢氧化钠固体:100g×10%=10g;
(3)10℃时氢氧化钠的溶液密度为1.11g/cm3,则体积为100mL质量为:m=ρV=1.11g/cm3×100cm3=111g。
4.【答案】(1)不饱和
(2)20℃时,氯化钾的溶解度为34g,
那么丁溶液的溶质质量分数:。
【解析】(1)甲溶液中加5g氯化钾后完全溶解,这说明甲溶液肯定没有饱和;
(2)根据图片可知,氯化钾溶液降温到20℃时,溶液中析出3g氯化钾晶体,此时得到的丁溶液肯定是20℃时的饱和溶液,根据溶质质量分数=计算即可。
【解答】(1)甲图烧杯中是氯化钾的不饱和溶液。
(2)20℃时,氯化钾的溶解度为34g,
那么丁溶液的溶质质量分数:。
5.【答案】(1)27.2
(2)③④
(3)解: ×100%=26.5%
答:第三次实验得到的氯化钠溶液的溶质质量分数为26.5%。
(4)解:m溶质=100g×20%=20g
m溶质= = 400g
m水=400g-100g=300g
答:需要加入水的质量是300g。
【解析】(1)当溶液的质量小于水和氯化钠的总质量时,说明此时溶液已经饱和,据此确定20g水中最多溶解氯化钠的质量,进而计算出m的值;
(2)根据(1)中的分析解答;
(3)根据计算;
(4)首先根据溶质质量=溶液质量×溶质质量分数计算出100g溶液中氯化钠的质量,再根据计算出5%的溶液质量,最后将两个溶液质量相减得到加水的质量。
【解答】(1)在第③次实验中,水和氯化钠的总质量为:20g+8g=28g。因为27.2g<28g,所以③为氯化钠的饱和溶液,即20g水中最多溶解氯化钠:27.2g-20g=7.2g。当再加入10g氯化钠时,由于10g>7.2g,因此④仍然饱和,那么溶液质量不变,依然为27.2g,即m=27.2g。
(2)在这4次实验中,得到的20℃氯化钠溶液属于饱和溶液的是③④。
2022-2023学年上学期浙教版科学八年级“冲刺重高”讲义(九)
物质的溶解性(3)
同课章节目录
- 第1章 水和水的溶液
- 第1节 地球上的水
- 第2节 水的组成
- 第3节 水的浮力
- 第4节 物质在水中的分散状况
- 第5节 物质的溶解
- 第6节 物质的分离
- 第7节 水资源的利用、开发和保护
- 第2章 天气与气候
- 第1节 大气层
- 第2节 气温
- 第3节 大气的压强
- 第4节 风和降水
- 第5节 天气预报
- 第6节 气候和影响气候的因素
- 第7节 我国的气候特征与主要气象灾害
- 第3章 生命活动的调节
- 第1节 植物生命活动的调节
- 第2节 人体的激素调节
- 第3节 神经调节
- 第4节 动物的行为
- 第5节 体温的控制
- 第4章 电路探秘
- 第1节 电荷与电流
- 第2节 电流的测量
- 第3节 物质的导电性与电阻
- 第4节 变阻器
- 第5节 电压的测量
- 第6节 电流与电压、电阻的关系
- 第7节 电路分析与应用
- 研究性学习课题
- 一 测定本地区的“酸雨”情况及分析原因
- 二 太阳黑子活动与本地区降水的关系
- 三 训练小动物建立某种条件反射
- 四 调查在自然界或生命活动中的电现象
