人教版化学九年级上册 第六单元 课题3 二氧化碳和一氧化碳 (第2课时)课件(共20张PPT)
文档属性
| 名称 | 人教版化学九年级上册 第六单元 课题3 二氧化碳和一氧化碳 (第2课时)课件(共20张PPT) | 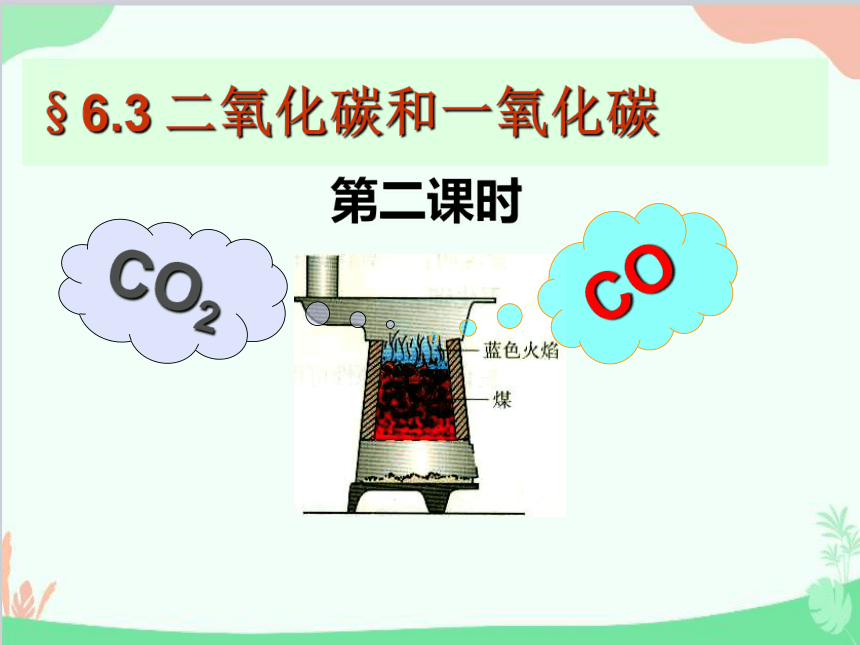 | |
| 格式 | ppt | ||
| 文件大小 | 644.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-01 10:01:00 | ||
图片预览





文档简介
(共20张PPT)
§6.3 二氧化碳和一氧化碳
CO2
CO
第二课时
空气中的CO有一半来自于汽车排放的尾气。
性 质
气体
色、态、味
密 度
溶 解 性
CO
CO2
无色无味的气体
无色无味的气体
比空气略小
比空气大
难溶于水
能溶于水
比较 CO 和 CO2 的物理性质
〈探讨〉CO和CO2 的物理性质不同的原因?
相 同
不相同
不相同
虽然元素组成相同,但是分子构成不同,所以它们的物理性质有差异。
⒈CO物理性质
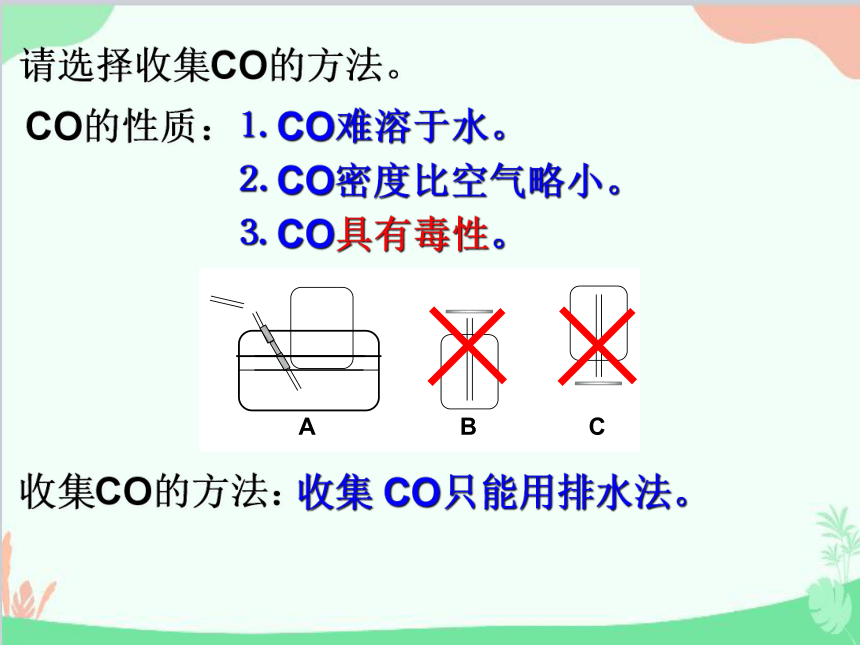
请选择收集CO的方法。
C
A
B
CO的性质:
⒈ CO难溶于水。
⒉ CO密度比空气略小。
⒊ CO具有毒性。
收集CO的方法:
收集 CO只能用排水法。
CO和CO2 的组成元素完全相同, 它们的化学性质是相似还是不同呢?
⒈CO化学性质
假设:
CO和CO2性质相似或性质不同。
(以CO2的性质为基础提出性质的假设)
1. 能否与水化合。
2. 是否不可燃,也不支持燃烧。
3. 能否与石灰水反应。
4. 是否具有其它化学性质。
⒉CO化学性质
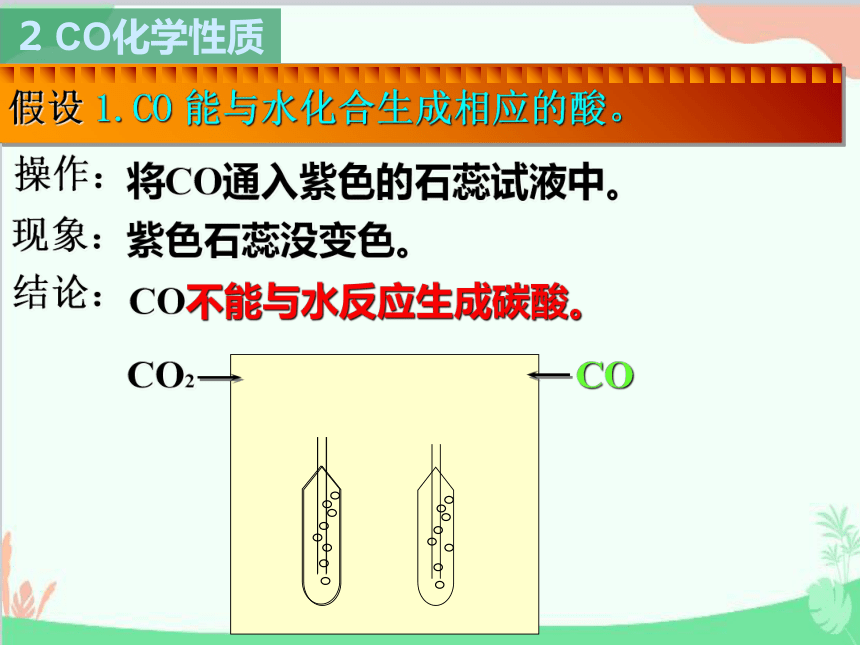
假设 1.CO 能与水化合生成相应的酸。
现象:
结论:
操作:
将CO通入紫色的石蕊试液中。
紫色石蕊没变色。
CO不能与水反应生成碳酸。
CO2
CO
⒉CO化学性质
假设 2.CO 不能燃烧,也不支持燃烧。
现象:
结论:
操作:
⑴点燃纯净的CO。
⑴CO燃烧,产生蓝色火焰,放出热量。
⑵在火焰上方罩一内壁涂有石灰水的烧杯。
⑵澄清石灰水变浑浊。
2CO + O2 2CO2
点 燃
⑴CO具有燃性。
⑵CO燃烧的产物是CO2。
CO2 + Ca(OH)2 CaCO3↓+ H2O
在点燃CO之前是否也要通过验纯?为什么?
你知道吗?
煤炉里的煤在燃烧过程中,发生了哪些化学反应?
2CO + O2 2CO2
点 燃
2C + O2 2CO
点 燃
C + CO2 2CO
高 温
C + O2 CO2
点 燃
液化气、天然气等含碳燃料在不充分燃烧时都会有CO生成。
CO是许多气体燃料如水煤气的主要成分。
⒈CO化学性质
假设 3.CO 也具有还原性。
现象:
结论:
操作:
将纯净的 CO 通过灼热的CuO,再将生成的气体通入澄清的石灰水中。并对尾气处理。
⑴黑色的CuO粉逐渐变成红色。
⑵产生的气体使澄清石灰水变浑浊。
⑴ CO具有还原性;CO + CuO Cu + CO2
△
⑵ CO2 + Ca(OH)2 CaCO3↓+ H2O
⑶此套装置中增添了尾气处理装置。
仔细观察CO和H2在还原CuO时,装置有何不同?为什么要这样设计装置?
对CO还原CuO实验中的尾气处理方法有哪几种?你认为哪种方法较好?请说明理由。
对一氧化碳还原性的分析
△
CO CO2↑
CuO Cu
得氧
失氧
一氧化碳具有还原性,是还原剂;
在反应中被氧化,发生氧化反应。
氧化铜具有氧化性,是氧化剂;
在反应中被还原,发生还原反应。
⒉CO化学性质
假设 4.CO 能与石灰水反应。
现象:
结论:
操作:
将CO通入澄清石灰水中观察现象。
石灰水不变浑浊。
CO不与Ca(OH)2 反应。
CO
CO2
⒉CO化学性质
假设 5.CO 还具有其他化学性质。
现象:
结论:
正常的血液呈深红色,当通入CO后,血液由深红色变成鲜红色。
CO有剧毒!与血液中的血红蛋白结合,使血液丧失携氧能力。
⒉CO化学性质
讨 论 题 ㈠
⒈ 煤气厂为什么常在家用煤气(含有CO)中掺入微量具有难闻气味的气体?
⒉ 如发生煤气泄漏应当怎么办?注意哪些事项?
有利于及时发现煤气泄漏。
关闭总闸,打开门窗,禁止明火。
任何物质都必须合理运用。在应用中,物质的性质可能有利于人类,也可能不利于人类。请仿照示例填写下表:
物 质 有利的一面(用途) 不利的一面
示例:H2 可用作高能燃料 使用不当容易引起爆炸
O2
CO
CO2
广泛用于支持燃烧;
供动植物呼吸
可用于民用或工业燃料
植物的光合作用;
灭火;人工降雨
造成食物的腐烂;
钢铁的锈蚀
使用不当容易引起中毒事故
大气中含量过多会引起“温室效应”
⒈ 此实验装置还能做哪些改进?
讨 论 题 ㈡
⒉ 由此实验中的现象,可得出哪些物质的性质?你能写出哪些反应的化学方程式?
⒊ 怎样实现下列变化?用化学方程式来表示。
C
CO
CO2
⑴
⑵
⑶
⑷
CaCO3
⑸
⑹
总 结
三、CO的性质。
四、CO对生活和环境的影响。
⒉CO的化学性质:
通常CO是无色无味的气体,难溶于水,密度比空气略小。
⒈CO的物理性质:
⑴CO具有可燃性。
⑵CO具有还原性。
⑶CO有剧毒。
⑷CO既不与水反应,也不与石灰水反应。
2CO + O2 2CO2
点 燃
CO + CuO Cu + CO2
△
使用清洁燃料和开放整洁的厨房,能最大限度地减少室内空气污染源,全面提高健康生活的质量。
§6.3 二氧化碳和一氧化碳
CO2
CO
第二课时
空气中的CO有一半来自于汽车排放的尾气。
性 质
气体
色、态、味
密 度
溶 解 性
CO
CO2
无色无味的气体
无色无味的气体
比空气略小
比空气大
难溶于水
能溶于水
比较 CO 和 CO2 的物理性质
〈探讨〉CO和CO2 的物理性质不同的原因?
相 同
不相同
不相同
虽然元素组成相同,但是分子构成不同,所以它们的物理性质有差异。
⒈CO物理性质
请选择收集CO的方法。
C
A
B
CO的性质:
⒈ CO难溶于水。
⒉ CO密度比空气略小。
⒊ CO具有毒性。
收集CO的方法:
收集 CO只能用排水法。
CO和CO2 的组成元素完全相同, 它们的化学性质是相似还是不同呢?
⒈CO化学性质
假设:
CO和CO2性质相似或性质不同。
(以CO2的性质为基础提出性质的假设)
1. 能否与水化合。
2. 是否不可燃,也不支持燃烧。
3. 能否与石灰水反应。
4. 是否具有其它化学性质。
⒉CO化学性质
假设 1.CO 能与水化合生成相应的酸。
现象:
结论:
操作:
将CO通入紫色的石蕊试液中。
紫色石蕊没变色。
CO不能与水反应生成碳酸。
CO2
CO
⒉CO化学性质
假设 2.CO 不能燃烧,也不支持燃烧。
现象:
结论:
操作:
⑴点燃纯净的CO。
⑴CO燃烧,产生蓝色火焰,放出热量。
⑵在火焰上方罩一内壁涂有石灰水的烧杯。
⑵澄清石灰水变浑浊。
2CO + O2 2CO2
点 燃
⑴CO具有燃性。
⑵CO燃烧的产物是CO2。
CO2 + Ca(OH)2 CaCO3↓+ H2O
在点燃CO之前是否也要通过验纯?为什么?
你知道吗?
煤炉里的煤在燃烧过程中,发生了哪些化学反应?
2CO + O2 2CO2
点 燃
2C + O2 2CO
点 燃
C + CO2 2CO
高 温
C + O2 CO2
点 燃
液化气、天然气等含碳燃料在不充分燃烧时都会有CO生成。
CO是许多气体燃料如水煤气的主要成分。
⒈CO化学性质
假设 3.CO 也具有还原性。
现象:
结论:
操作:
将纯净的 CO 通过灼热的CuO,再将生成的气体通入澄清的石灰水中。并对尾气处理。
⑴黑色的CuO粉逐渐变成红色。
⑵产生的气体使澄清石灰水变浑浊。
⑴ CO具有还原性;CO + CuO Cu + CO2
△
⑵ CO2 + Ca(OH)2 CaCO3↓+ H2O
⑶此套装置中增添了尾气处理装置。
仔细观察CO和H2在还原CuO时,装置有何不同?为什么要这样设计装置?
对CO还原CuO实验中的尾气处理方法有哪几种?你认为哪种方法较好?请说明理由。
对一氧化碳还原性的分析
△
CO CO2↑
CuO Cu
得氧
失氧
一氧化碳具有还原性,是还原剂;
在反应中被氧化,发生氧化反应。
氧化铜具有氧化性,是氧化剂;
在反应中被还原,发生还原反应。
⒉CO化学性质
假设 4.CO 能与石灰水反应。
现象:
结论:
操作:
将CO通入澄清石灰水中观察现象。
石灰水不变浑浊。
CO不与Ca(OH)2 反应。
CO
CO2
⒉CO化学性质
假设 5.CO 还具有其他化学性质。
现象:
结论:
正常的血液呈深红色,当通入CO后,血液由深红色变成鲜红色。
CO有剧毒!与血液中的血红蛋白结合,使血液丧失携氧能力。
⒉CO化学性质
讨 论 题 ㈠
⒈ 煤气厂为什么常在家用煤气(含有CO)中掺入微量具有难闻气味的气体?
⒉ 如发生煤气泄漏应当怎么办?注意哪些事项?
有利于及时发现煤气泄漏。
关闭总闸,打开门窗,禁止明火。
任何物质都必须合理运用。在应用中,物质的性质可能有利于人类,也可能不利于人类。请仿照示例填写下表:
物 质 有利的一面(用途) 不利的一面
示例:H2 可用作高能燃料 使用不当容易引起爆炸
O2
CO
CO2
广泛用于支持燃烧;
供动植物呼吸
可用于民用或工业燃料
植物的光合作用;
灭火;人工降雨
造成食物的腐烂;
钢铁的锈蚀
使用不当容易引起中毒事故
大气中含量过多会引起“温室效应”
⒈ 此实验装置还能做哪些改进?
讨 论 题 ㈡
⒉ 由此实验中的现象,可得出哪些物质的性质?你能写出哪些反应的化学方程式?
⒊ 怎样实现下列变化?用化学方程式来表示。
C
CO
CO2
⑴
⑵
⑶
⑷
CaCO3
⑸
⑹
总 结
三、CO的性质。
四、CO对生活和环境的影响。
⒉CO的化学性质:
通常CO是无色无味的气体,难溶于水,密度比空气略小。
⒈CO的物理性质:
⑴CO具有可燃性。
⑵CO具有还原性。
⑶CO有剧毒。
⑷CO既不与水反应,也不与石灰水反应。
2CO + O2 2CO2
点 燃
CO + CuO Cu + CO2
△
使用清洁燃料和开放整洁的厨房,能最大限度地减少室内空气污染源,全面提高健康生活的质量。
同课章节目录
- 绪言 化学使世界变得更加绚丽多彩
- 第一单元 走进化学世界
- 课题1 物质的变化和性质
- 课题2 化学是一门以实验为基础的科学
- 课题3 走进化学实验室
- 第二单元 我们周围的空气
- 课题1 空气
- 课题2 氧气
- 课题3 制取氧气
- 实验活动1 氧气的实验室制取与性质
- 第三单元 物质构成的奥秘
- 课题1 分子和原子
- 课题2 原子的结构
- 课题3 元素
- 第四单元 自然界的水
- 课题1 爱护水资源
- 课题2 水的净化
- 课题3 水的组成
- 课题4 化学式与化合价
- 第五单元 化学方程式
- 课题 1 质量守恒定律
- 课题 2 如何正确书写化学方程式
- 课题 3 利用化学方程式的简单计算
- 第六单元 碳和碳的氧化物
- 课题1 金刚石、石墨和C60
- 课题2 二氧化碳制取的研究
- 课题3 二氧化碳和一氧化碳
- 实验活动2 二氧化碳的实验室制取与性质
- 第七单元 燃料及其利用
- 课题 1 燃烧和灭火
- 课题2 燃料的合理利用与开发
- 实验活动 3 燃烧的条件
