化学人教版2019必修第一册2.3.1 物质的量(1)(共35张ppt)
文档属性
| 名称 | 化学人教版2019必修第一册2.3.1 物质的量(1)(共35张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 5.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-01 16:33:01 | ||
图片预览







文档简介
(共35张PPT)
第二章 海水中的重要元素──钠和氯
第三节 物质的量
第1课时
2
1
本节重点
本节难点
物质的量
物质的量、微粒数、摩尔质量之间的换算
古时,皇帝给公主招驸马出了一个这样问题是:100 石小米是多少粒?同学们你们能不能帮帮他?哪种方法最科学?(古代十六两为一斤,一百五十斤为一石)
把微小物质扩大倍数形成一定数目的集体以便于方便生活、方便科学研究。
方法:
生活事例:
一双筷子
一打鸡蛋
一箱瓶酒
24听
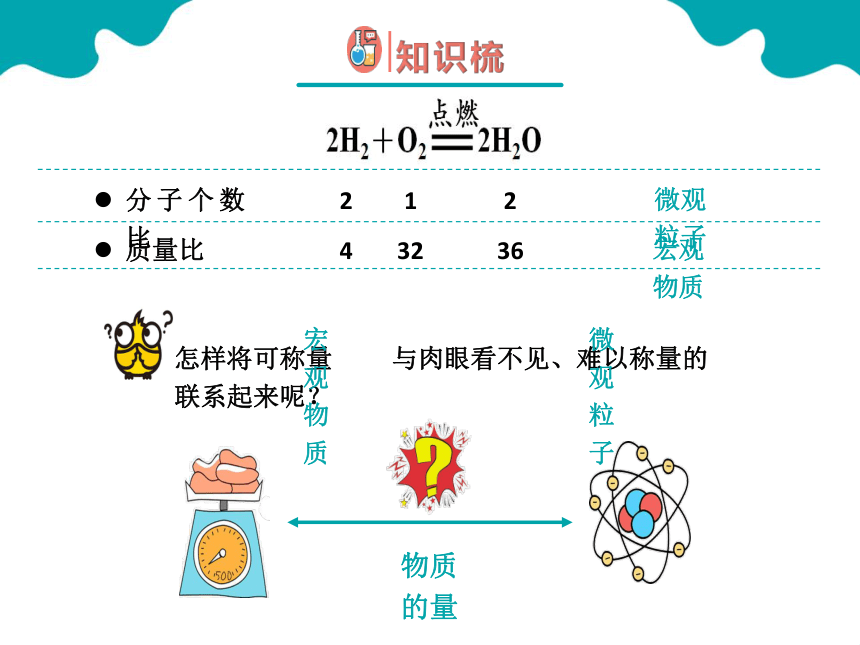
请同学们正确读出下列化学反应方程的意义(定量描述)
每2个氢分子可以和1个氧分子发生反应产生2个水分子
每4份质量的氢气就可以和32份质量的氧气恰好完全反应生成36份质量的水
每2体积的氢气就可以和1体积的氧气恰好完全反应生成水
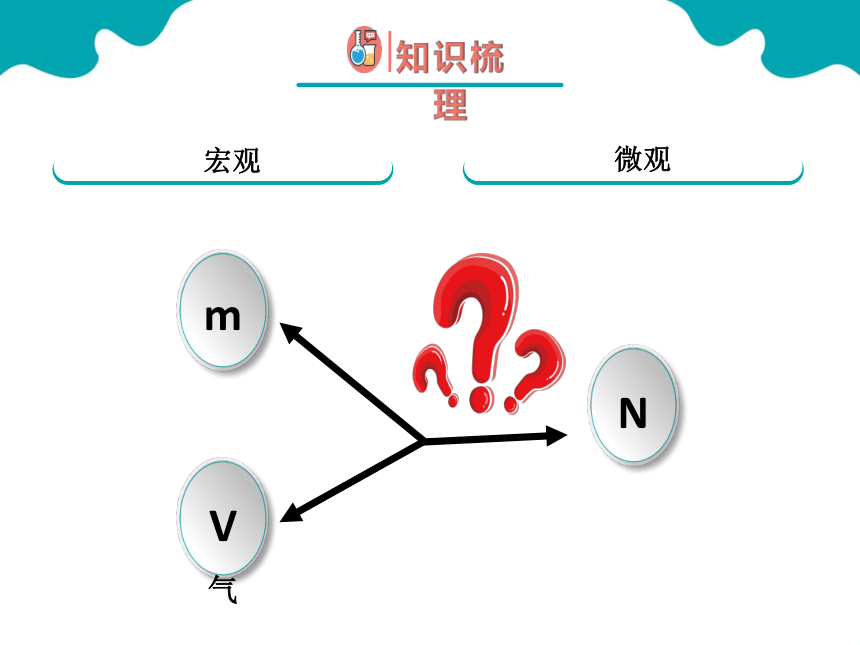
微观角度
宏观角度
N
V气
宏观
微观
m
2
1
2
4
32
36
物质的量
分子个数比
质量比
宏观物质
微观粒子
怎样将可称量 与肉眼看不见、难以称量的 联系起来呢?
宏观
物质
微观
粒子
物质的量
将宏观物质和微观粒子联系起来的一座桥梁
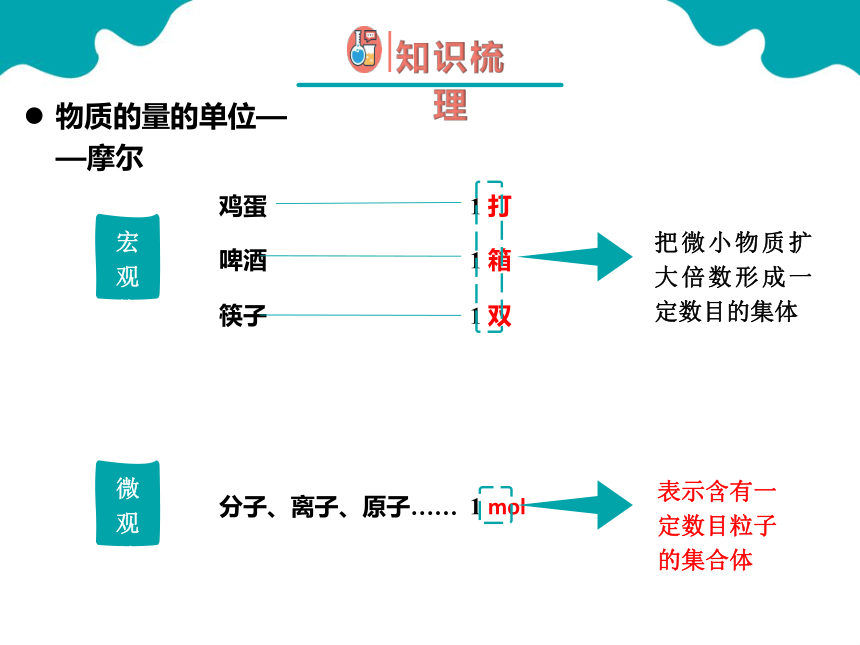
物质的量的单位——摩尔
1 双
1 箱
1 打
筷子
啤酒
鸡蛋
1 mol
分子、离子、原子……
微观
粒子
宏观
物质
把微小物质扩大倍数形成一定数目的集体
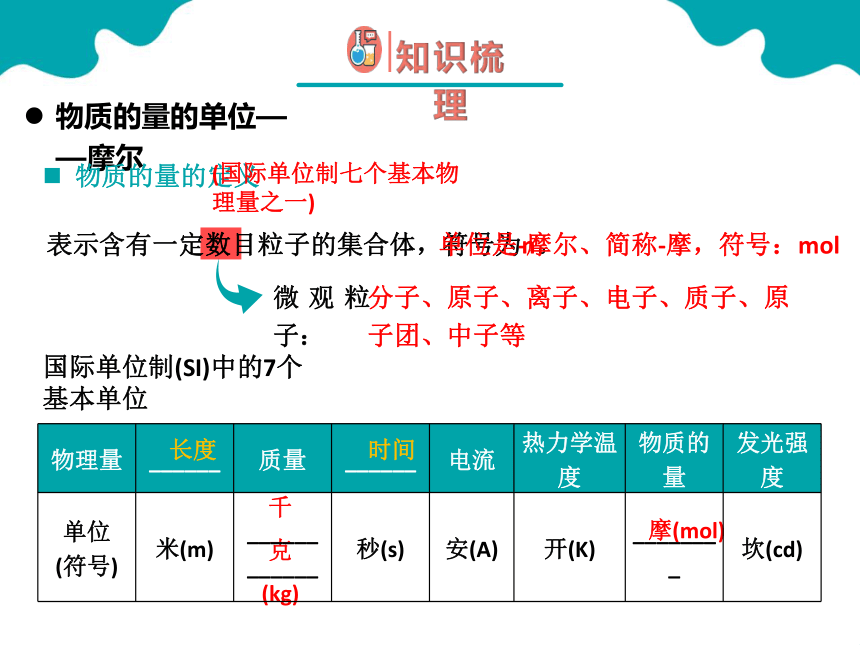
表示含有一定数目粒子的集合体
物质的量的单位——摩尔
表示含有一定数目粒子的集合体,符号为n。
单位是-摩尔、简称-摩,符号:mol
物质的量的定义
微观粒子:
分子、原子、离子、电子、质子、原子团、中子等
千克
(kg)
摩(mol)
物理量 ______ 质量 ______ 电流 热力学温度 物质的量 发光强度
单位 (符号) 米(m) ______ ______ 秒(s) 安(A) 开(K) ________ 坎(cd)
国际单位制(SI)中的7个基本单位
(国际单位制七个基本物理量之一)
长度
时间
物质的量的单位——摩尔
物质的量的数值可以是整数,也可以是小数。
注意事项
“物质的量”是一个物理量的全称,是一个专有名词;物质的量不能当成物质的数量或质量来理解。
“物质的量”只能描述原子、分子、离子、质子、中子和电子等微观粒子,不能描述宏观物质。
用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称、符号或化学式。如:1 mol H、1 mol H+、 1 mol H2 ,不能用 “1 mol 氢”这样含糊无意义的表示。
【例题1】下列说法不正确的是( )
物质的量可以理解为物质的数量
物质的量是国际单位制中七个基本物理量之一
摩尔是物质的量的单位
物质的量描述对象是分子、原子等微观粒子
A
【例题2】判断正误(正确的打“√”,错误的打“×”)。
(1) 1 mol铅笔( )
(2) 2 mol氧( )
(3) 4 mol H2( )
(4) 1 mol Na2CO3中含有2 mol Na+( )
(5) 0.012 kg 12C中约含有6.02×1023个碳原子( )
×
×
√
√
√
1双筷子是2支,1 打鸡蛋是12个,1 箱啤酒是24听,那么,1 mol微观粒子是多少个呢?
阿伏加德罗常数到底有多大呢?如果把 6.02×1023 粒米给全球70亿人吃,每人每天吃一斤,同学们计算下,可以吃多少年?
阿伏加德罗常数
符号:NA
数值: 近似等于6.02 ×1023
单位: mol-1 (每摩尔)
规定: 0.012 Kg12C 中所含的碳原子数
也就是说:若某物质含有与 0.012 Kg12C 中所含的碳原子数相同的粒子数,该物质的物质的量为1mol 。
洛喜密脱
我是测出者
阿伏加德罗常数与微观粒子数之间的关系
约为6.02×1023
1 mol粒子的粒子数
0.012Kg12C中所含原子数
阿伏加德罗常数
=
阿伏加德罗常数
=
=
不能认为1 mol粒子等于6.02×1023个,也不能认为6.02×1023就是阿伏加德罗常数
物质的量(n)、阿伏加德罗常数(NA)、微粒数(N)之间的关系式
(约6.02×1023mol-1)
=
NA
×
n
×NA
÷ NA
【规律】微粒之间的物质的量之比等于微粒的_______之比
N = n×NA
阿伏加德罗常数
N
粒子
个数
物质的量
NA=N /n
粒子数
解:O2的分子数为
N(O2) = n × NA
【例1】在0.5 mol O2中含有的氧分子数目是多少?氧原子数目是多少?
N(O2) = 0.5 mol × 6.02×1023mol-1
N(O2) = 3.01 × 1023
氧原子数为
N(O) = 2 × N(O2)
N(O) = 2 × 3.01 × 1023
N(O) = 6.02×1023
1个水分子中有2个氢原子和1个氧原子,有如下关系:
2NA
NA
NA
即 H2O——2H——O
1mol 2mol 1mol
(n1︰n2 = N1︰N2)
1 2 1
粒子个数:
物质的量:
×NA
×NA
×NA
分子中原子的物质的量之比==分子中原子个数之比
分子中原子个数之比
【例1】1个CO2分子中有1个C原子、2个O原子。那么1 mol CO2中有___ mol C和__ mol O,0.5 mol CO2中有____ mol C和__ mol O。含有0.5 mol O的CO2的物质的量为_____ mol。
1
0.5
1
0.25
2
【例2】1(1)1 mol Na2SO4中含有Na+的数目是___________,与其含有相同Na+数目的NaCl的物质的量为______。
(2)若测得某Na2SO4溶液中含有0.5 molSO42-,则溶液中含有__ mol Na+。
(3)____ mol NH3与0.3 mol H2O中所含H原子一样多。
(4)0.3 mol H2O中含____ mol原子,含___________个电子。
1.204×1024
2 mol
1
0.2
0.9
1.806×1024
1 mol H2O
约含有6.02×1023个水分子,质量是18g
1 mol Al
约含有6.02×1023 个铝原子,质量是27g
1mol不同物质所含的粒子数是相同的,但由于不同粒子的质量不同,1mol不同物质的质量也不同。
1mol任何微观物质都约含6.02×1023个粒子,那么,这1mol物质的质量到底有多大?
粒子符号 相对分子或原子质量 1个粒子的质量 1mol物质含有的粒子数(个) 1mol物质质量(g)
C 12 1.993×10-23g
Fe 56 9.032×10-23g
H2SO4 98 1.628×10-22g
H2O 18 2.990×10-23g
Na+ 23 3.821×10-23g
OH- 17 2.824×10-23g
NA
NA
NA
NA
NA
NA
12
56
98
18
23
17
分析以上计算结果可得出什么规律?
(6.02×1023)
(6.02×1023)
(6.02×1023)
(6.02×1023)
(6.02×1023)
(6.02×1023)
规律
1mol任何原子的质量(以克为单位)在数值上等于这种原子的相对原子质量。
1mol任何分子的质量(以克为单位)在数值上等于这种分子的相对分子质量。
1mol任何离子的质量(以克为单位)在数值上等于这种离子的式量。
1mol任何微粒或物质的质量,当以g为单位时,在数值上等于该微粒的相对原子质量或相对分子质量。
结论:
摩尔质量
定义:
符号: M
常用单位:g · mol-1
公式 :m= n×M
数值:等于物质的相对原子(分子)质量
摩尔质量
单位物质的量(即1mol)的物质所具有的质量叫做该物质的摩尔质量。
摩尔质量概念的理解
确定性:
对于指定的物质来说,其摩尔质量的值是一个定值,不随物质的物质的量的多少而改变。
物质的量
将宏观物质和微观粒子联系起来的一座桥梁
NA
N
=
M
m
=
n
质量、物质的量、摩尔质量、阿伏伽德罗常数、粒子数之间的关系
思考题:
1 mol 物质的质量、摩尔质量、相对分子质量(或相对原子质量)是否等同?
不等同。
1 mol 物质的质量、摩尔质量、相对分子质量(或相对原子质量)是不同的概念。
当摩尔质量以“g·mol-1”为单位时,三者在数值上相等,但单位不同,故三者不等同。
【例1】计算下列物质的摩尔质量。
(1)已知氨气的相对分子质量为17,则氨气的摩尔质量为__________。
(2)1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为 __________。
(3)已知一个铁原子的质量为b g,则铁的摩尔质量为____________。
(4)NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩
尔质量为_____________。
17 g·mol-1
64 g·mol-1
bNA g·mol-1
b
aNA
g·mol-1
摩尔的出现先于物质的量
德国化学家奥斯特瓦尔德(Osrwald,Friedrich Wilhelm,1853-1932)基于对道尔顿原子假说和阿伏加德罗分子假说的质疑,于1900年首次提出“摩尔(mole)”这个名称,将其定义为一个关于质量的量。采用“摩尔”来统一“克分子”“克原子”“克离子”“克当量”等概念。这与当时盛行的当量理论一致,与分子原子论不一致。采用“摩尔”主要是达到反对原子假说和分子假说的目的,因为摩尔是拉丁语,其含义是“质量很大、一堆”,刚好与原子、分子的含义“质量很小”相反。
1. 判断正误
(1)摩尔是七个物理量之一 ( )
(2)摩尔是物质的质量单位 ( )
(3)摩尔是物质的数量单位 ( )
(4) 1摩尔小麦含有6.02 ×1023个麦粒 ( )
(5) 3mol氢 ( )
(6) 4.5molNH3 ( )
(7)摩尔是国际科学界建议采用的一种物理量 ( )
(8)摩尔是物质的量的单位,简称摩,符号为mol ( )
×
×
×
×
×
√
×
√
2.(1)9 g H2O的物质的量为_______,含有的氢原子数为__________。
(2)3.01×1023个H2SO4分子的物质的量为_______,质量为_____。
(3)0.5 mol H2SO4分子中N(H)=___________,N(O)=____________。
(4)Fe的摩尔质量为56 g·mol-1,
则1个Fe原子质量为________________ g(列式)。
0.5 mol
6.02×1023
0.5 mol
49 g
6.02×1023
1.204×1024
56
NA
解:M(H2SO4)=98g/mol
m(H2SO4)
n(H2SO4)=
M(H2SO4)
49g
n(H2SO4)=
98g/mol
=0.5mol
=0.5mol×6.02×1023 mol-1
N(H2SO4)=
n(H2SO4)×NA
=3.01×1023
3. 49gH2SO4的物质的量是多少?所含H2SO4分子的个数是多少?
5. 求0.3 mol H2O的质量?其中所含O原子个数?
解:m(H2O)
=
N(H2O)
M(H2O)
×
N(O)
=
n(O)
NA
×
0.3mol
18g·mol-1
×
=
5.4g
=
0.3mol
6.02 ×1023mol-1
×
=
1.806 ×1023
=
N = n×NA
m= n×M
第三节
物质的量
第1课时
阿伏加德罗常数
物质的量
符号
符号
单位
表示方法
摩尔质量
符号
单位
第二章 海水中的重要元素──钠和氯
第三节 物质的量
第1课时
2
1
本节重点
本节难点
物质的量
物质的量、微粒数、摩尔质量之间的换算
古时,皇帝给公主招驸马出了一个这样问题是:100 石小米是多少粒?同学们你们能不能帮帮他?哪种方法最科学?(古代十六两为一斤,一百五十斤为一石)
把微小物质扩大倍数形成一定数目的集体以便于方便生活、方便科学研究。
方法:
生活事例:
一双筷子
一打鸡蛋
一箱瓶酒
24听
请同学们正确读出下列化学反应方程的意义(定量描述)
每2个氢分子可以和1个氧分子发生反应产生2个水分子
每4份质量的氢气就可以和32份质量的氧气恰好完全反应生成36份质量的水
每2体积的氢气就可以和1体积的氧气恰好完全反应生成水
微观角度
宏观角度
N
V气
宏观
微观
m
2
1
2
4
32
36
物质的量
分子个数比
质量比
宏观物质
微观粒子
怎样将可称量 与肉眼看不见、难以称量的 联系起来呢?
宏观
物质
微观
粒子
物质的量
将宏观物质和微观粒子联系起来的一座桥梁
物质的量的单位——摩尔
1 双
1 箱
1 打
筷子
啤酒
鸡蛋
1 mol
分子、离子、原子……
微观
粒子
宏观
物质
把微小物质扩大倍数形成一定数目的集体
表示含有一定数目粒子的集合体
物质的量的单位——摩尔
表示含有一定数目粒子的集合体,符号为n。
单位是-摩尔、简称-摩,符号:mol
物质的量的定义
微观粒子:
分子、原子、离子、电子、质子、原子团、中子等
千克
(kg)
摩(mol)
物理量 ______ 质量 ______ 电流 热力学温度 物质的量 发光强度
单位 (符号) 米(m) ______ ______ 秒(s) 安(A) 开(K) ________ 坎(cd)
国际单位制(SI)中的7个基本单位
(国际单位制七个基本物理量之一)
长度
时间
物质的量的单位——摩尔
物质的量的数值可以是整数,也可以是小数。
注意事项
“物质的量”是一个物理量的全称,是一个专有名词;物质的量不能当成物质的数量或质量来理解。
“物质的量”只能描述原子、分子、离子、质子、中子和电子等微观粒子,不能描述宏观物质。
用摩尔为单位表示某物质的物质的量时,必须指明物质微粒的名称、符号或化学式。如:1 mol H、1 mol H+、 1 mol H2 ,不能用 “1 mol 氢”这样含糊无意义的表示。
【例题1】下列说法不正确的是( )
物质的量可以理解为物质的数量
物质的量是国际单位制中七个基本物理量之一
摩尔是物质的量的单位
物质的量描述对象是分子、原子等微观粒子
A
【例题2】判断正误(正确的打“√”,错误的打“×”)。
(1) 1 mol铅笔( )
(2) 2 mol氧( )
(3) 4 mol H2( )
(4) 1 mol Na2CO3中含有2 mol Na+( )
(5) 0.012 kg 12C中约含有6.02×1023个碳原子( )
×
×
√
√
√
1双筷子是2支,1 打鸡蛋是12个,1 箱啤酒是24听,那么,1 mol微观粒子是多少个呢?
阿伏加德罗常数到底有多大呢?如果把 6.02×1023 粒米给全球70亿人吃,每人每天吃一斤,同学们计算下,可以吃多少年?
阿伏加德罗常数
符号:NA
数值: 近似等于6.02 ×1023
单位: mol-1 (每摩尔)
规定: 0.012 Kg12C 中所含的碳原子数
也就是说:若某物质含有与 0.012 Kg12C 中所含的碳原子数相同的粒子数,该物质的物质的量为1mol 。
洛喜密脱
我是测出者
阿伏加德罗常数与微观粒子数之间的关系
约为6.02×1023
1 mol粒子的粒子数
0.012Kg12C中所含原子数
阿伏加德罗常数
=
阿伏加德罗常数
=
=
不能认为1 mol粒子等于6.02×1023个,也不能认为6.02×1023就是阿伏加德罗常数
物质的量(n)、阿伏加德罗常数(NA)、微粒数(N)之间的关系式
(约6.02×1023mol-1)
=
NA
×
n
×NA
÷ NA
【规律】微粒之间的物质的量之比等于微粒的_______之比
N = n×NA
阿伏加德罗常数
N
粒子
个数
物质的量
NA=N /n
粒子数
解:O2的分子数为
N(O2) = n × NA
【例1】在0.5 mol O2中含有的氧分子数目是多少?氧原子数目是多少?
N(O2) = 0.5 mol × 6.02×1023mol-1
N(O2) = 3.01 × 1023
氧原子数为
N(O) = 2 × N(O2)
N(O) = 2 × 3.01 × 1023
N(O) = 6.02×1023
1个水分子中有2个氢原子和1个氧原子,有如下关系:
2NA
NA
NA
即 H2O——2H——O
1mol 2mol 1mol
(n1︰n2 = N1︰N2)
1 2 1
粒子个数:
物质的量:
×NA
×NA
×NA
分子中原子的物质的量之比==分子中原子个数之比
分子中原子个数之比
【例1】1个CO2分子中有1个C原子、2个O原子。那么1 mol CO2中有___ mol C和__ mol O,0.5 mol CO2中有____ mol C和__ mol O。含有0.5 mol O的CO2的物质的量为_____ mol。
1
0.5
1
0.25
2
【例2】1(1)1 mol Na2SO4中含有Na+的数目是___________,与其含有相同Na+数目的NaCl的物质的量为______。
(2)若测得某Na2SO4溶液中含有0.5 molSO42-,则溶液中含有__ mol Na+。
(3)____ mol NH3与0.3 mol H2O中所含H原子一样多。
(4)0.3 mol H2O中含____ mol原子,含___________个电子。
1.204×1024
2 mol
1
0.2
0.9
1.806×1024
1 mol H2O
约含有6.02×1023个水分子,质量是18g
1 mol Al
约含有6.02×1023 个铝原子,质量是27g
1mol不同物质所含的粒子数是相同的,但由于不同粒子的质量不同,1mol不同物质的质量也不同。
1mol任何微观物质都约含6.02×1023个粒子,那么,这1mol物质的质量到底有多大?
粒子符号 相对分子或原子质量 1个粒子的质量 1mol物质含有的粒子数(个) 1mol物质质量(g)
C 12 1.993×10-23g
Fe 56 9.032×10-23g
H2SO4 98 1.628×10-22g
H2O 18 2.990×10-23g
Na+ 23 3.821×10-23g
OH- 17 2.824×10-23g
NA
NA
NA
NA
NA
NA
12
56
98
18
23
17
分析以上计算结果可得出什么规律?
(6.02×1023)
(6.02×1023)
(6.02×1023)
(6.02×1023)
(6.02×1023)
(6.02×1023)
规律
1mol任何原子的质量(以克为单位)在数值上等于这种原子的相对原子质量。
1mol任何分子的质量(以克为单位)在数值上等于这种分子的相对分子质量。
1mol任何离子的质量(以克为单位)在数值上等于这种离子的式量。
1mol任何微粒或物质的质量,当以g为单位时,在数值上等于该微粒的相对原子质量或相对分子质量。
结论:
摩尔质量
定义:
符号: M
常用单位:g · mol-1
公式 :m= n×M
数值:等于物质的相对原子(分子)质量
摩尔质量
单位物质的量(即1mol)的物质所具有的质量叫做该物质的摩尔质量。
摩尔质量概念的理解
确定性:
对于指定的物质来说,其摩尔质量的值是一个定值,不随物质的物质的量的多少而改变。
物质的量
将宏观物质和微观粒子联系起来的一座桥梁
NA
N
=
M
m
=
n
质量、物质的量、摩尔质量、阿伏伽德罗常数、粒子数之间的关系
思考题:
1 mol 物质的质量、摩尔质量、相对分子质量(或相对原子质量)是否等同?
不等同。
1 mol 物质的质量、摩尔质量、相对分子质量(或相对原子质量)是不同的概念。
当摩尔质量以“g·mol-1”为单位时,三者在数值上相等,但单位不同,故三者不等同。
【例1】计算下列物质的摩尔质量。
(1)已知氨气的相对分子质量为17,则氨气的摩尔质量为__________。
(2)1.28 g某气体含有的分子数目为1.204×1022,则该气体的摩尔质量为 __________。
(3)已知一个铁原子的质量为b g,则铁的摩尔质量为____________。
(4)NA为阿伏加德罗常数,已知a g某气体中含分子数为b,则该气体的摩
尔质量为_____________。
17 g·mol-1
64 g·mol-1
bNA g·mol-1
b
aNA
g·mol-1
摩尔的出现先于物质的量
德国化学家奥斯特瓦尔德(Osrwald,Friedrich Wilhelm,1853-1932)基于对道尔顿原子假说和阿伏加德罗分子假说的质疑,于1900年首次提出“摩尔(mole)”这个名称,将其定义为一个关于质量的量。采用“摩尔”来统一“克分子”“克原子”“克离子”“克当量”等概念。这与当时盛行的当量理论一致,与分子原子论不一致。采用“摩尔”主要是达到反对原子假说和分子假说的目的,因为摩尔是拉丁语,其含义是“质量很大、一堆”,刚好与原子、分子的含义“质量很小”相反。
1. 判断正误
(1)摩尔是七个物理量之一 ( )
(2)摩尔是物质的质量单位 ( )
(3)摩尔是物质的数量单位 ( )
(4) 1摩尔小麦含有6.02 ×1023个麦粒 ( )
(5) 3mol氢 ( )
(6) 4.5molNH3 ( )
(7)摩尔是国际科学界建议采用的一种物理量 ( )
(8)摩尔是物质的量的单位,简称摩,符号为mol ( )
×
×
×
×
×
√
×
√
2.(1)9 g H2O的物质的量为_______,含有的氢原子数为__________。
(2)3.01×1023个H2SO4分子的物质的量为_______,质量为_____。
(3)0.5 mol H2SO4分子中N(H)=___________,N(O)=____________。
(4)Fe的摩尔质量为56 g·mol-1,
则1个Fe原子质量为________________ g(列式)。
0.5 mol
6.02×1023
0.5 mol
49 g
6.02×1023
1.204×1024
56
NA
解:M(H2SO4)=98g/mol
m(H2SO4)
n(H2SO4)=
M(H2SO4)
49g
n(H2SO4)=
98g/mol
=0.5mol
=0.5mol×6.02×1023 mol-1
N(H2SO4)=
n(H2SO4)×NA
=3.01×1023
3. 49gH2SO4的物质的量是多少?所含H2SO4分子的个数是多少?
5. 求0.3 mol H2O的质量?其中所含O原子个数?
解:m(H2O)
=
N(H2O)
M(H2O)
×
N(O)
=
n(O)
NA
×
0.3mol
18g·mol-1
×
=
5.4g
=
0.3mol
6.02 ×1023mol-1
×
=
1.806 ×1023
=
N = n×NA
m= n×M
第三节
物质的量
第1课时
阿伏加德罗常数
物质的量
符号
符号
单位
表示方法
摩尔质量
符号
单位
