18a双线桥与氧化还原反应方程式的配平
图片预览



文档简介
年 级 高一 学 科 化学 版 本 苏教版
内容标题 双线桥与氧化还原反应方程式的配平
编稿老师
【本讲教育信息】
一. 教学内容:
双线桥与氧化还原反应方程式的配平
二. 教学过程
(引入)氧化还原反应的实质是电子的转移,那么我们怎样表示电子在氧化还原反应中的转移情况呢?我们通常用双线桥和单线桥来表示电子的转移情况。
双线桥法:表示同种元素的原子在反应前后转移电子的情况
得 2×6e
提示:
1. 箭头从反应物指向产物,但并不表示电子转移的方向,桥两端连接同种元素。
2. 电子有得必有失,电子得失总数应相等。
反馈练习:
1. 请写出下列氧化还原反应的化学方程式,并用双线桥表示电子转移情况,注明电子转移数目。
(1)碳还原氧化铜
(2)高锰酸钾制氧气
(3)氯气与水反应生成盐酸和次氯酸
(4)黑火药的爆炸
答案:
失4e
(1) C + 2CuO = CO2 + 2Cu
得2×2e
得1e 得3e
(2) 2KMnO4 = K2MnO4 + MnO2 + O2
失2×2e
得1e
(3) Cl2 + H2O = HCl + HClO
失1e
得2×e
(4) 2KNO3 + C + S = K2S + 2NO2 + CO2
得2e
失4e
单线桥:表示反应过程中电子在反应之间的转移情况
提示:
1. 箭头从还原剂中失电子的元素指向得电子的元素
2. 箭头表示电子转移的方向,数字表示元素失电子的总数
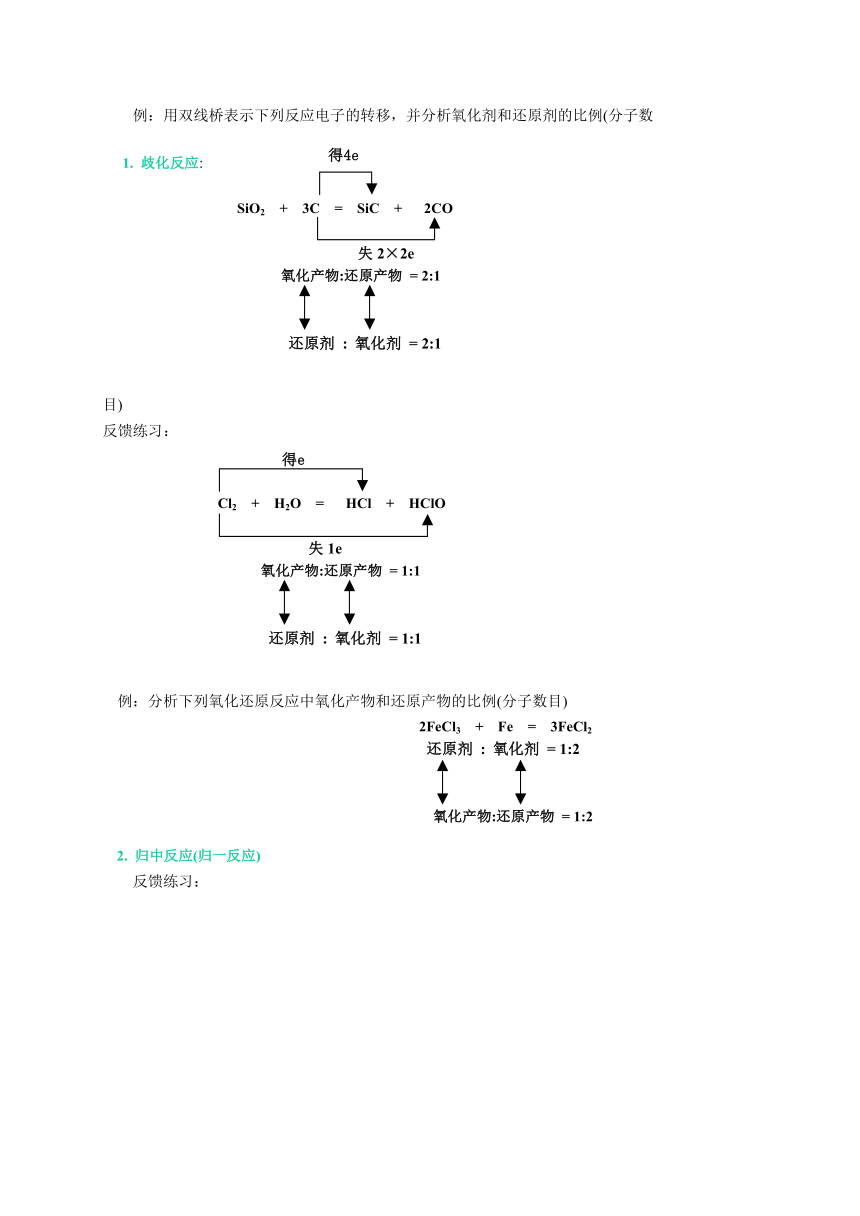
例:用双线桥表示下列反应电子的转移,并分析氧化剂和还原剂的比例(分子数目)
1. 歧化反应
:
SiO2 + 3C = SiC + 2CO
失2×2e
氧化产物:还原产物 = 2:1
还原剂 : 氧化剂 = 2:1
反馈练习:
Cl2 + H2O = HCl + HClO
失1e
氧化产物:还原产物 = 1:1
还原剂 : 氧化剂 = 1:1
例:分析下列氧化还原反应中氧化产物和还原产物的比例(分子数目)
2. 归中反应(归一反应)
2FeCl3 + Fe = 3FeCl2
还原剂 : 氧化剂 = 1:2
氧化产物:还原产物 = 1:2
反馈练习:
2H2S + SO2 = 3S + 2H2O
氧化产物 : 还原产物 = 2:1
还原剂 : 氧化剂 = 2:1
2Na2S + Na2SO3 + 3H2SO4 = 3S↓ + 3Na2SO4 + 3H2O
氧化产物 : 还原产物 = 2:1
还原剂 : 氧化剂 = 2:1
例:分析下列氧化还原反应中氧化剂和还原剂的比例(分子数目)
3. 部分氧化还原反应
3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO + 4H2O
(1)氧化剂是HNO3,但是并不是所有HNO3都是氧化剂;
(2)氧化剂中有元素化合价下降,化合价下降的原子的数目决定氧化剂的分子数;
(3)HNO3中有两氮原子化合价下降,因此有两分子HNO3是氧化剂
故: 氧化剂: 还原剂 = 2:3
反馈练习:
(1) 8NH3 + 3Cl2 = 6NH4Cl + N2
氧化剂: 还原剂 = 3:2
(2) 在反应KClO3+6HCl=KCl+3Cl2+3H2O中,电子转移的方向和数目的叙述中,正确的是( )
A. 由,共6e B. 由,共5e
C. 由,共6e D. 由,共5e
氧化剂: 还原剂 = 1:5
氧化还原反应方程式的配平:
方法:利用化合价升高和降低的总价数相等,或得电子总数和失电子总数相等的原理。
例:
Fe + AgNO3 Fe(NO3)2 + Ag
Fe + 2 AgNO3 Fe(NO3)2 + 2 Ag
Fe + 2 AgNO3 = Fe(NO3)2 + 2Ag
反馈练习:
1. 2H2S + SO2 S + H2O
2×2 4×1
2H2S + SO2 = 3 S + 2 H2O
2. ClO3- + H + + Cl- Cl2 + H2O
ClO3- + 6 H + + 5 Cl- = 3 Cl2 + 3 H2O
3. Cl2 + NaOH(浓) 5NaCl + NaClO3 + H2O
1×5 5×1
3Cl2 +6 NaOH(浓) = 5 NaCl + NaClO3 + 3H2O
4. Cu + HNO3(稀) Cu(NO3)2 + NO + H2O
3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO + 4H2O
EMBED Word.Picture.8 5. KMnO4 + HCl KCl + MnCl2 + Cl2 + H2O
2KMnO4 + 16 HCl = 2 KCl + 2MnCl2 + 5Cl2 + 8H2O
综合运用:
离子跟亚硫酸钠反应时,作氧化剂,亚硫酸钠被氧化成硫酸钠。现有1mol/L的100mL,需要2.5mol/L的亚硫酸钠溶液100mL才能使它还原。试讨论被还原后X的最终化合价态。
解:根据得电子总数=失电子总数,可得出下列结论:
1×0.1×(5 – x) = 2.5×0.1×2
解方程,得: x = 0
【模拟试题】
一、选择题:
1、从氯元素的化合价态上判断,下列物质中的氯元素不能表现氧化性的是 ( )
A. NaCl B. Cl2 C. ClO2 D. HClO4
2、氧化还原反应发生在同种元素之间的是 ( )
A. Zn+2HCl=ZnCl2+H2↑ B. 2H2S+SO2=3S+2H2O
C. H2+CuO=Cu +H2O D. 2H2O 2H2↑+O2↑
3、下列反应中氯元素被氧化的是 ( )
A. 5Cl2+I2+6H2O=10HCl+2HIO3
B. 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
C. MnO2+4HCl=MnCl2+2H2O+Cl2↑
D. 2NaCl+2H2O2NaOH+Cl2↑+H2↑
4、下列反应中,不属于氧化还原反应的是 ( )
A. 3Cl2+6KOH5KCl+KClO3+3H2O
B. 2NO2+2NaOHNaNO3+NaNO2+H2O
C. SnCl4+2H2OSnO2+4HCl
D. 3CCl4+K2Cr2O72CrO2Cl2+3COCl2+2KCl
5、P单质在反应4P+3KOH+3H2O3KH2PO2+PH3中是 ( )
A. 被氧化 B. 被还原 C. 既被氧化又被还原 D. 既未被氧化又未被还原
6、下列说法正确的是 ( )
A. 有单质参加的反应一定是氧化还原反应
B. 阳离子只有氧化性,阴离子只有还原性
C. 还原剂失电子越多,其还原性越强
D. 化学反应中,某元素由化合态变成游离态时,此元素可能被氧化也可能被还原
7、根据下列反应判断有关物质的还原性由强到弱的顺序是 ( )
H2SO3+I2+H2O=H2SO4+2HI;2FeCl3+2HI=2FeCl2+2HCl+I2;
3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3
A. H2SO3>I->Fe2+> NO B. I-> Fe2+>H2SO3 >NO
C. Fe2+>I->H2SO3> NO D. NO > Fe2+>H2SO3> I-
8、对于反应3S+6KOH=2K2S+K2SO3+3H2O,下列说法正确的是 ( )
A. S是氧化剂,KOH是还原剂 B. 反应中共转移了6个电子
C. 还原剂与氧化剂质量比为1:2 D. 氧化产物和还原产物分别是K2S和K2SO3
9、在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中 ( )
A. 氧化产物与还原产物粒子个数比是2∶5
B. 被氧化的HCl占参加反应HCl总分子数的5/8
C. KMnO4只有一部分发生还原反应
D. KMnO4与HCl恰好分别完全发生还原反应和氧化反应
10、据下列反应判断有关物质的氧化性顺序正确的是 ( )
①F2+2NaCl(熔融) =2NaF+Cl2 ②Cl2+2NaBr=2NaCl+Br2
③Br2+2NaI=2NaBr+I2
A. F2>Br2>I2>Cl2 B. I2>Br2>Cl2>F2
C. F2>Cl2>Br2>I2 D. NaI>NaBr>NaCl>NaF
11、氯气有毒,化工厂常用浓氨水检验管道是否漏氯气,如氯气泄漏,会在管道周围产生大量白烟,反应的化学方程式为:3Cl2+8NH3=6NH4Cl+N2,关于此反应的说法正确的是 ( )
A. 3分子氯气将8分子NH3氧化了 B. 3分子氯气只氧化了2分子NH3
C. N2是还原产物,NH4Cl是氧化产物 D. NH4Cl既是氧化产物,又是还原产物
12、试从化合价角度分析下列粒子的性质:在Fe3+、Fe2+、Al3+、H+、S、Cl-等粒子中只有氧化性的是________,只有还原性的是_______,兼有氧化性和还原性的是___________。
13、已知下列反应:
A. 2Na+2H2O=2NaOH+H2↑ B. 2F2+2H2O=4HF+O2
C. Cl2+H2O=HCl+HClO D. 2NaCl+2H2O2NaOH+H2↑+Cl2↑
E. CaO+H2O=Ca(OH)2 F. CaCO3+CO2+H2O=Ca(HCO3)2
(1)水在反应中作氧化剂的反应是(填代号,下同) ;
(2)水在反应中作还原剂的反应是 ;
(3)属于氧化还原反应,水在反应中既不作氧化剂也不作还原剂的反应是 。
14、在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中, 是氧化剂; 是还原剂;_____元素被氧化; 元素被还原; 是氧化产物; 是还原产物;电子转移的总数是 。
15、配平下列反应方程式,并用双线桥标明电子转移情况:
⑴高锰酸钾受热分解
⑵浓盐酸和高锰酸钾反应生成氯化锰、氯化钾、水和氯气
⑶氯气和澄清的石灰水反应生成次氯酸钙、氯化钙和水
【试题答案】
1. A 2. B 3. BCD 4. CD 5. C
6. D 7. A 8. C 9. B 10. C 11. B
12. Fe3+ Al3+ H+ ; Cl- ; Fe2+ S
13. (1) AD (2)B (3)C
14. K2CrO4 ; HCl ; Cl ; Cr ; Cl2 ; CrCl3 ; 6 ;
15. (1) 得1e 得3e
2KMnO4 = K2MnO4 + MnO2 +O2
失2×2e
(2)见反馈练习
得2×e
(3)
Cl2 + SO2 + 2 H2O = 2HCl + H2SO4
失2e
内容标题 双线桥与氧化还原反应方程式的配平
编稿老师
【本讲教育信息】
一. 教学内容:
双线桥与氧化还原反应方程式的配平
二. 教学过程
(引入)氧化还原反应的实质是电子的转移,那么我们怎样表示电子在氧化还原反应中的转移情况呢?我们通常用双线桥和单线桥来表示电子的转移情况。
双线桥法:表示同种元素的原子在反应前后转移电子的情况
得 2×6e
提示:
1. 箭头从反应物指向产物,但并不表示电子转移的方向,桥两端连接同种元素。
2. 电子有得必有失,电子得失总数应相等。
反馈练习:
1. 请写出下列氧化还原反应的化学方程式,并用双线桥表示电子转移情况,注明电子转移数目。
(1)碳还原氧化铜
(2)高锰酸钾制氧气
(3)氯气与水反应生成盐酸和次氯酸
(4)黑火药的爆炸
答案:
失4e
(1) C + 2CuO = CO2 + 2Cu
得2×2e
得1e 得3e
(2) 2KMnO4 = K2MnO4 + MnO2 + O2
失2×2e
得1e
(3) Cl2 + H2O = HCl + HClO
失1e
得2×e
(4) 2KNO3 + C + S = K2S + 2NO2 + CO2
得2e
失4e
单线桥:表示反应过程中电子在反应之间的转移情况
提示:
1. 箭头从还原剂中失电子的元素指向得电子的元素
2. 箭头表示电子转移的方向,数字表示元素失电子的总数
例:用双线桥表示下列反应电子的转移,并分析氧化剂和还原剂的比例(分子数目)
1. 歧化反应
:
SiO2 + 3C = SiC + 2CO
失2×2e
氧化产物:还原产物 = 2:1
还原剂 : 氧化剂 = 2:1
反馈练习:
Cl2 + H2O = HCl + HClO
失1e
氧化产物:还原产物 = 1:1
还原剂 : 氧化剂 = 1:1
例:分析下列氧化还原反应中氧化产物和还原产物的比例(分子数目)
2. 归中反应(归一反应)
2FeCl3 + Fe = 3FeCl2
还原剂 : 氧化剂 = 1:2
氧化产物:还原产物 = 1:2
反馈练习:
2H2S + SO2 = 3S + 2H2O
氧化产物 : 还原产物 = 2:1
还原剂 : 氧化剂 = 2:1
2Na2S + Na2SO3 + 3H2SO4 = 3S↓ + 3Na2SO4 + 3H2O
氧化产物 : 还原产物 = 2:1
还原剂 : 氧化剂 = 2:1
例:分析下列氧化还原反应中氧化剂和还原剂的比例(分子数目)
3. 部分氧化还原反应
3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO + 4H2O
(1)氧化剂是HNO3,但是并不是所有HNO3都是氧化剂;
(2)氧化剂中有元素化合价下降,化合价下降的原子的数目决定氧化剂的分子数;
(3)HNO3中有两氮原子化合价下降,因此有两分子HNO3是氧化剂
故: 氧化剂: 还原剂 = 2:3
反馈练习:
(1) 8NH3 + 3Cl2 = 6NH4Cl + N2
氧化剂: 还原剂 = 3:2
(2) 在反应KClO3+6HCl=KCl+3Cl2+3H2O中,电子转移的方向和数目的叙述中,正确的是( )
A. 由,共6e B. 由,共5e
C. 由,共6e D. 由,共5e
氧化剂: 还原剂 = 1:5
氧化还原反应方程式的配平:
方法:利用化合价升高和降低的总价数相等,或得电子总数和失电子总数相等的原理。
例:
Fe + AgNO3 Fe(NO3)2 + Ag
Fe + 2 AgNO3 Fe(NO3)2 + 2 Ag
Fe + 2 AgNO3 = Fe(NO3)2 + 2Ag
反馈练习:
1. 2H2S + SO2 S + H2O
2×2 4×1
2H2S + SO2 = 3 S + 2 H2O
2. ClO3- + H + + Cl- Cl2 + H2O
ClO3- + 6 H + + 5 Cl- = 3 Cl2 + 3 H2O
3. Cl2 + NaOH(浓) 5NaCl + NaClO3 + H2O
1×5 5×1
3Cl2 +6 NaOH(浓) = 5 NaCl + NaClO3 + 3H2O
4. Cu + HNO3(稀) Cu(NO3)2 + NO + H2O
3Cu + 8HNO3(稀) = 3Cu(NO3)2 + 2NO + 4H2O
EMBED Word.Picture.8 5. KMnO4 + HCl KCl + MnCl2 + Cl2 + H2O
2KMnO4 + 16 HCl = 2 KCl + 2MnCl2 + 5Cl2 + 8H2O
综合运用:
离子跟亚硫酸钠反应时,作氧化剂,亚硫酸钠被氧化成硫酸钠。现有1mol/L的100mL,需要2.5mol/L的亚硫酸钠溶液100mL才能使它还原。试讨论被还原后X的最终化合价态。
解:根据得电子总数=失电子总数,可得出下列结论:
1×0.1×(5 – x) = 2.5×0.1×2
解方程,得: x = 0
【模拟试题】
一、选择题:
1、从氯元素的化合价态上判断,下列物质中的氯元素不能表现氧化性的是 ( )
A. NaCl B. Cl2 C. ClO2 D. HClO4
2、氧化还原反应发生在同种元素之间的是 ( )
A. Zn+2HCl=ZnCl2+H2↑ B. 2H2S+SO2=3S+2H2O
C. H2+CuO=Cu +H2O D. 2H2O 2H2↑+O2↑
3、下列反应中氯元素被氧化的是 ( )
A. 5Cl2+I2+6H2O=10HCl+2HIO3
B. 2Cl2+2Ca(OH)2=CaCl2+Ca(ClO)2+2H2O
C. MnO2+4HCl=MnCl2+2H2O+Cl2↑
D. 2NaCl+2H2O2NaOH+Cl2↑+H2↑
4、下列反应中,不属于氧化还原反应的是 ( )
A. 3Cl2+6KOH5KCl+KClO3+3H2O
B. 2NO2+2NaOHNaNO3+NaNO2+H2O
C. SnCl4+2H2OSnO2+4HCl
D. 3CCl4+K2Cr2O72CrO2Cl2+3COCl2+2KCl
5、P单质在反应4P+3KOH+3H2O3KH2PO2+PH3中是 ( )
A. 被氧化 B. 被还原 C. 既被氧化又被还原 D. 既未被氧化又未被还原
6、下列说法正确的是 ( )
A. 有单质参加的反应一定是氧化还原反应
B. 阳离子只有氧化性,阴离子只有还原性
C. 还原剂失电子越多,其还原性越强
D. 化学反应中,某元素由化合态变成游离态时,此元素可能被氧化也可能被还原
7、根据下列反应判断有关物质的还原性由强到弱的顺序是 ( )
H2SO3+I2+H2O=H2SO4+2HI;2FeCl3+2HI=2FeCl2+2HCl+I2;
3FeCl2+4HNO3=2FeCl3+NO↑+2H2O+Fe(NO3)3
A. H2SO3>I->Fe2+> NO B. I-> Fe2+>H2SO3 >NO
C. Fe2+>I->H2SO3> NO D. NO > Fe2+>H2SO3> I-
8、对于反应3S+6KOH=2K2S+K2SO3+3H2O,下列说法正确的是 ( )
A. S是氧化剂,KOH是还原剂 B. 反应中共转移了6个电子
C. 还原剂与氧化剂质量比为1:2 D. 氧化产物和还原产物分别是K2S和K2SO3
9、在2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O反应中 ( )
A. 氧化产物与还原产物粒子个数比是2∶5
B. 被氧化的HCl占参加反应HCl总分子数的5/8
C. KMnO4只有一部分发生还原反应
D. KMnO4与HCl恰好分别完全发生还原反应和氧化反应
10、据下列反应判断有关物质的氧化性顺序正确的是 ( )
①F2+2NaCl(熔融) =2NaF+Cl2 ②Cl2+2NaBr=2NaCl+Br2
③Br2+2NaI=2NaBr+I2
A. F2>Br2>I2>Cl2 B. I2>Br2>Cl2>F2
C. F2>Cl2>Br2>I2 D. NaI>NaBr>NaCl>NaF
11、氯气有毒,化工厂常用浓氨水检验管道是否漏氯气,如氯气泄漏,会在管道周围产生大量白烟,反应的化学方程式为:3Cl2+8NH3=6NH4Cl+N2,关于此反应的说法正确的是 ( )
A. 3分子氯气将8分子NH3氧化了 B. 3分子氯气只氧化了2分子NH3
C. N2是还原产物,NH4Cl是氧化产物 D. NH4Cl既是氧化产物,又是还原产物
12、试从化合价角度分析下列粒子的性质:在Fe3+、Fe2+、Al3+、H+、S、Cl-等粒子中只有氧化性的是________,只有还原性的是_______,兼有氧化性和还原性的是___________。
13、已知下列反应:
A. 2Na+2H2O=2NaOH+H2↑ B. 2F2+2H2O=4HF+O2
C. Cl2+H2O=HCl+HClO D. 2NaCl+2H2O2NaOH+H2↑+Cl2↑
E. CaO+H2O=Ca(OH)2 F. CaCO3+CO2+H2O=Ca(HCO3)2
(1)水在反应中作氧化剂的反应是(填代号,下同) ;
(2)水在反应中作还原剂的反应是 ;
(3)属于氧化还原反应,水在反应中既不作氧化剂也不作还原剂的反应是 。
14、在K2Cr2O7+14HCl=2KCl+2CrCl3+3Cl2↑+7H2O反应中, 是氧化剂; 是还原剂;_____元素被氧化; 元素被还原; 是氧化产物; 是还原产物;电子转移的总数是 。
15、配平下列反应方程式,并用双线桥标明电子转移情况:
⑴高锰酸钾受热分解
⑵浓盐酸和高锰酸钾反应生成氯化锰、氯化钾、水和氯气
⑶氯气和澄清的石灰水反应生成次氯酸钙、氯化钙和水
【试题答案】
1. A 2. B 3. BCD 4. CD 5. C
6. D 7. A 8. C 9. B 10. C 11. B
12. Fe3+ Al3+ H+ ; Cl- ; Fe2+ S
13. (1) AD (2)B (3)C
14. K2CrO4 ; HCl ; Cl ; Cr ; Cl2 ; CrCl3 ; 6 ;
15. (1) 得1e 得3e
2KMnO4 = K2MnO4 + MnO2 +O2
失2×2e
(2)见反馈练习
得2×e
(3)
Cl2 + SO2 + 2 H2O = 2HCl + H2SO4
失2e
