江西省抚州市金溪县2022-2023学年高二上学期8月开学考试化学试卷(Word版含答案)
文档属性
| 名称 | 江西省抚州市金溪县2022-2023学年高二上学期8月开学考试化学试卷(Word版含答案) |
|
|
| 格式 | docx | ||
| 文件大小 | 482.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-01 00:00:00 | ||
图片预览




文档简介
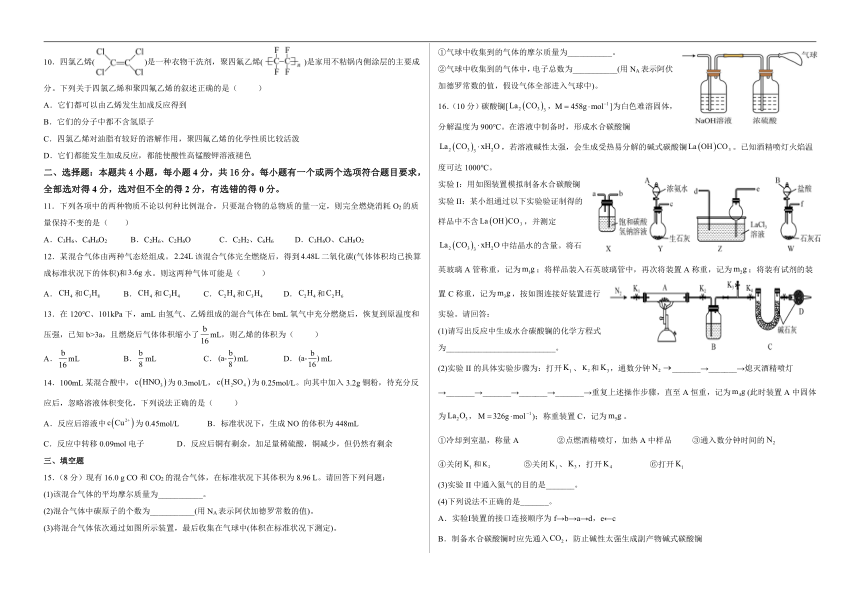
抚州市金溪县2022-2023学年高二上学期8月开学考试
化学试卷
可能用到原子量:Al:27 Na:23 C:12 He:4 Fe:56 P:31 Cu:64 Zn:65 S:32 O:16
一、选择题:本题共10小题,每小题3分,共30分.每小题只有一个选项符合题目要求。
1.VmLAl2(SO4)3溶液中含有mgAl3+,取mL该溶液用水稀释至4VmL,则SO物质的量浓度为( )
A.mol·L-1 B.mol·L-1 C.mol·L-1 D.mol·L-1
2.均含有短周期元素W的X、Y、Z三种物质间的转化关系如图所示。下列说法不正确的是( )
A.W可能是非金属元素
B.X可能是氧化物
C.Y、Z之间的转化可能是氧化还原反应
D.Y和Z在溶液中反应可能生成X
3.下列说法正确的是( )
A.的物质的量为 B.常温常压下,的体积是
C.溶液中含有 D.含有的分子数约为
4.用NA表示阿伏加德罗常数的值。下列叙述正确的有( )
①1molFeCl3溶于水形成的胶体中含有NA个Fe(OH)3胶体粒子
②3.9gNa2O2固体所含阴离子数为0.05NA
③标准状况下,46g乙醇中含有NA个分子
④常温下,2g氦气所含的原子数目为NA
⑤1molCl2通入足量的水中,最多生成1molHClO
⑥56g铁与氯气在一定条件下充分反应,最多消耗氯气的体积是33.6L
⑦142gNa2SO4和Na2HPO4的固体混合物中所含阴、阳离子的总数为3NA
A.1个 B.2个 C.3个 D.4个
5.下列离子方程式能用来解释相应实验现象的是( )
选项 实验现象 离子方程式
A 氢氧化亚铁溶于稀硝酸
B 向氢氧化镁悬浊液中滴加硫酸铵溶液,沉淀溶解
C 二氧化硫使酸性高锰酸钾溶液褪色
D 将新制氯水滴入含有酚酞的NaOH溶液中,溶液红色褪去
6.一定条件下的合成氨反应:,下列四个数据都表示合成氨的反应速率,其中表示的反应速率相同的是( )
① ②
③ ④
A.①②③ B.①③ C.①②④ D.②④
7.某甲烷燃料电池构造示意图如下,关于该电池的说法不正确的是( )
A.电解质溶液中Na+向b极移动
B.b极的电极反应是:O2+2H2O+4e-=4OH-
C.a极是负极,发生氧化反应
D.电子通过外电路从b电极流向a电极
8.下列物质的沸点由高到低排列的顺序是( )
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.④③②① B.④②①③ C.②④①③ D.②④③①
9.化合物(b)、(d)、(p)的分子式均为C6H6,下列说法正确的是( )
A.b的同分异构体只有d和p两种
B.b、d、p的二氯代物均只有三种
C.b、d、p均可与酸性高锰酸钾溶液反应
D.b、d、p中只有b的所有原子处于同一平面
10.四氯乙烯()是一种衣物干洗剂,聚四氟乙烯()是家用不粘锅内侧涂层的主要成分。下列关于四氯乙烯和聚四氟乙烯的叙述正确的是( )
A.它们都可以由乙烯发生加成反应得到
B.它们的分子中都不含氢原子
C.四氯乙烯对油脂有较好的溶解作用,聚四氟乙烯的化学性质比较活泼
D.它们都能发生加成反应,都能使酸性高锰酸钾溶液褪色
二、选择题:本题共4小题,每小题4分,共16分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列各项中的两种物质不论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧消耗O2的质量保持不变的是( )
A.C3H6、C4H6O2 B.C2H6、C2H6O C.C2H2、C6H6 D.C3H6O、C4H8O2
12.某混合气体由两种气态烃组成。该混合气体完全燃烧后,得到二氧化碳(气体体积均已换算成标准状况下的体积)和水。则这两种气体可能是( )
A.和 B.和 C.和 D.和
13.在120℃、101kPa下,amL由氢气、乙烯组成的混合气体在bmL氧气中充分燃烧后,恢复到原温度和压强,已知b>3a,且燃烧后气体体积缩小了mL,则乙烯的体积为( )
A.mL B.mL C.mL D.mL
14.100mL某混合酸中,为0.3mol/L,为0.25mol/L。向其中加入3.2g铜粉,待充分反应后,忽略溶液体积变化,下列说法正确的是( )
A.反应后溶液中为0.45mol/L B.标准状况下,生成NO的体积为448mL
C.反应中转移0.09mol电子 D.反应后铜有剩余,加足量稀硫酸,铜减少,但仍然有剩余
三、填空题
15.(8分)现有16.0 g CO和CO2的混合气体,在标准状况下其体积为8.96 L。请回答下列问题:
(1)该混合气体的平均摩尔质量为___________。
(2)混合气体中碳原子的个数为___________(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如图所示装置,最后收集在气球中(体积在标准状况下测定)。
①气球中收集到的气体的摩尔质量为___________。
②气球中收集到的气体中,电子总数为___________(用NA表示阿伏加德罗常数的值,假设气体全部进入气球中)。
16.(10分)碳酸镧[,]为白色难溶固体,分解温度为900℃。在溶液中制备时,形成水合碳酸镧,若溶液碱性太强,会生成受热易分解的碱式碳酸镧。已知酒精喷灯火焰温度可达1000℃。
实验I:用如图装置模拟制备水合碳酸镧
实验II:某小组通过以下实验验证制得的样品中不含,并测定中结晶水的含量。将石英玻璃A管称重,记为;将样品装入石英玻璃管中,再次将装置A称重,记为;将装有试剂的装置C称重,记为,按如图连接好装置进行实验。请回答:
(1)请写出反应中生成水合碳酸镧的化学方程式为___________________________。
(2)实验II的具体实验步骤为:打开、和,通数分钟_______→_______→熄灭酒精喷灯→_______→_______→_______→_______→重复上述操作步骤,直至A恒重,记为(此时装置A中固体为,);称重装置C,记为。
①冷却到室温,称量A ②点燃酒精喷灯,加热A中样品 ③通入数分钟时间的
④关闭和 ⑤关闭、,打开 ⑥打开
(3)实验II中通入氮气的目的是_______。
(4)下列说法不正确的是_______。
A.实验Ⅰ装置的接口连接顺序为f→b→a→d,e←c
B.制备水合碳酸镧时应先通入,防止碱性太强生成副产物碱式碳酸镧
C.根据实验记录,当时,说明制得的样品中不含
D.实验II装置B中的试剂是浓硫酸,也可通过装置B的增重量达成实验II的目的
(5)计算水合碳酸镧化学式中结晶水数目x=_______(用含、、的式子表示,不用化简)。
17.(9分)有A、B、C、D四种有机物,A、B属于烃类物质,C、D都是烃的衍生物。A是含氢质量分数最大的有机物,分子结构为正四面体;B的球棍模型为;C的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应;D的空间填充模型为,向该物质的水溶液中滴加紫色石蕊溶液,溶液变红色。请回答下列问题:
(1)A的电子式是______,C中官能团的名称是______。
(2)B的结构简式是______,该物质发生加聚反应的化学方程式为_________________。
(3)已知B可以发生如图转化过程:
完成转化①、②反应的化学方程式:①________________;②________________。
18.(11分)(1)根据要求回答下列问题:
a.l6O和l8O b.H2O和H2O2 c.C2H6和C4H10 d.和
e.和
以上各组物质中互为同位素的是 ______;互为同系物的是_______;互为同分异构体的是_______,
属于同种物质的是_____。(以上填序号)
(2)表是元素周期表一部分,请用化学用语回答下列问题 。
i.在元素①②③中,金属性最强的元素是_________________;
ii.上述10种元素的最高价氧化物对应的水化物中酸性最强的物质是______;
iii.请写出元素⑤⑦形成的非极性化合物的电子式:____________;
iv.非金属性最强的元素是________;它在元素周期表中的位置为________。
(3)将等质量的锌片和铜片用导线连接并插入CuSO4溶液中,装置如图所示。
①该装置中锌电极发生______________反应。
②反应一段时间内溶液的质量增加2克,则该时间内通过导线的电子的物质的量为_______ mol。
19.(8分)近年来甲醇用途日益广泛,越来越引起商家的关注。工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,400 ℃时发生反应CO(g)+2H2(g) CH3OH(g),体系中n(CO)随时间的变化如表:
时间(s) 0 1 2 3 5
n(CO)(mol) 0.020 0.011 0.008 0.007 0.007
(1)图中表示CH3OH 的变化的曲线是_______;
(2)下列措施不能提高反应速率的有_________(请用相应字母填空);
a 升高温度 b 加入催化剂
c 增大压强 d 及时分离出CH3OH
(3)下列叙述能说明反应达到平衡状态的是__________(请用相应字母填空);
a.CO和H2的浓度保持不变 b.v(H2)=2 v(CO) c.CO的物质的量分数保持不变
d.容器内气体密度保持不变 e.每生成1molCH3OH的同时有2molH-H键断裂
(4)CH3OH与O2的反应可将化学能转化为电能,
其工作原理如图所示,
图中CH3OH从_______(填A或B)通入,
b极的电极反应式是__________。
抚州市金溪县2022-2023学年高二上学期8月开学考试
化学答题卷
15.(8分,每空2分)(1)___________________。(2)___________________
(3)①___________________。②___________
16.(10分,每空2分)(1)_______________________________________________。
(2)_______→_______→熄灭酒精喷灯→_______→_______→_______→_______→重复上述操作步骤,
(3)______________________________________。
(4)______________________________________。
(5)x=______________________________________(用含、、的式子表示,不用化简)。
17.(9分)(1)__________________________(1分),__________________________。(1分)
(2)_____________________________________(1分),__________________________。(2分)
(3):①____________________________________________________________________;(2分)
②______________________________________________________________。 (2分)
(11分,每空1分)
(1)___________________;____________________;__________________,______________。
(2)i._________________;ii._____________;iii.___________________;
iv._______________;_______________。
(3)①_____________________。②______________ mol。
19.(8分)(1)______________;(1分)(2)________________(2分)
(3)________________(2分);
(4)______________(1分),_______________________________。(2分)
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.A
【详解】mgAl3+的物质的量为n(Al3+)==mol,根据2Al3+~3SO42-关系式得VmL溶液中SO42-的物质的量为n(SO42-)=×mol=mol,取mL该溶液用水稀释至4VmL,稀释后溶液中SO42-物质的量浓度为c(SO42-)mol·L-1,选A。
2.C
【详解】A.W可能是非金属元素,如X为NaHCO3,Y为CO2,Z为Na2CO3时,W为碳元素,A项正确;
B.X可能是氧化物,如X为Al2O3,Y为Al2(SO4)3,Z为NaAlO2,B项正确;
C.Y、Z之间的相互转化方式为加酸或加碱,不可能是氧化还原反应,C项错误;
D.当X为Al(OH)3时,Y为Al2(SO4)3,Z为NaAlO2,Y和Z在溶液中反应可生成X,D项正确;
故答案为C。
3.D
【详解】A.,36g水的物质的量为,故A错误;
B.根据,常温常压下,,所以1mol氯气的体积不是22.4L,故B错误;
C.根据,溶液的体积未知,不能计算出钠离子的物质的量,故C错误;
D.根据,得,则1mol二氧化碳含有的分子数约为,故D正确;
故选D。
4.C
【详解】①1个Fe(OH)3胶体粒子是多个氢氧化铁的聚集体,故所得的氢氧化铁胶粒个数小于NA个,故①错误;
②3.9g Na2O2的物质的量为n=3.9g÷78g/mol=0.05mol,而过氧化钠由2个钠离子和1个过氧根构成,故0.05mol过氧化钠中含阴离子为0.05NA个,故②正确;
③46g乙醇的物质的量为46g÷46g/mol=1mol,含有NA个分子,故③正确;
④氦气由氦原子构成,故2g氦气中含有的氦原子的物质的量为n=2g÷4g/mol=0.5mol,即0.5NA个,故④错误;
⑤Cl2和水的反应为可逆反应,不能进行彻底,故所得HClO的物质的量小于1mol,故⑤错误;
⑥56g铁的物质的量为n=56g÷56g/mol=1mol,和氯气反应消耗氯气为1.5mol,但氯气所处的状态不明确,故其物质的量无法计算,故⑥错误;
⑦Na2SO4和Na2HPO4的摩尔质量均为142g/mol,故142g Na2SO4和Na2HPO4的物质的量为n=142g÷142g/mol=1mol,且两者均由2个钠离子和1个阴离子构成,故1mol混合物中含离子共3NA个,故⑦正确。
故选C。
5.B
【详解】A.稀硝酸具有强氧化性,可将氧化成并生成NO气体,描述错误,不符题意;
B.氢氧化镁的碱性强于氨水,满足“强碱制弱碱原理”,描述正确,符合题意;
C.题给离子方程式的电荷不守恒,正确的离子方程式为,描述错误,不符题意;
D.NaOH是可溶性强碱,应拆写为和,正确的离子方程式为,描述错误,不符题意;
故选B。
6.D
【详解】根据同一化学反应中,化学反应速率之比等于化学方程式中各物质的化学计量数之比,可将不同物质表示的化学反应速率转化为同一物质(如)表示的化学反应速率,
则②,③,④,故D项正确。
故选:D。
7.D
【分析】通过示意图可知,a电极为燃料电池的负极,b电极为电池正极,且电解质溶液为碱液,并可写出电池总反应式为CH4+2O2+2NaOH=Na2CO3+3H2O,负极反应为CH4+10OH--8e-=CO32- +7H2O,正极反应为2O2+8e-+4H2O=8OH-。
【详解】A. 原电池中,电解质溶液的阳离子向正极移动,所以钠离子向b极移动,故A正确;
B. b极为正极,电极反应式为O2+2H2O+4e-=4OH-,故B正确;
C. a极是负极,甲烷在负极失去电子,发生氧化反应,故C正确;
D. 电子通过外电路从a电极流向b电极,故D错误;
故答案选D。
8.C
【详解】碳原子个数不同的烷烃,碳原子个数越大,沸点越高,碳原子个数相同的烷烃,支链越多,沸点越低,则四种烷烃的沸点由高到低排列的顺序为②④①③,故选C。
9.D
【详解】A.b为苯,对应的同分异构体可为环状烃,也可为链状烃,如HC≡C-CH=CH-CH=CH2,则同分异构体不仅仅d和p两种,故A错误;
B.d编号如图,对应的二氯代物中,两个氯原子可分别位于1、2,1、3,1、4,2、3等位置,故B错误;
C.b为苯,p为饱和烃,与高锰酸钾不反应,故C错误;
D.d、p都含有饱和碳原子,具有甲烷的结构特点,则d、p所有原子不可能处于同一平面,只有b为平面形结构,故D正确;
故选:D。
10.B
【详解】A.. 四氟乙烯可由乙炔发生加成反应得到,聚四氟乙烯是由四氟乙烯发生加聚反应得到,所以二者都不能用乙烯发生加成反应得到,故A错误;
B.二者都只含C和卤族元素,所以二者都不含氢原子,故B正确;
C.聚四氟乙烯中不含碳碳不饱和键,性质较稳定,所以聚四氟乙烯中化学性质不活泼,故C错误;
D.碳碳不饱和键能发生加成反应,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,四氯乙烯含有碳碳不饱和键而能发生加成反应,能使酸性高锰酸钾溶液褪色,聚四氟乙烯不含碳碳双键而不能发生加成反应、不能使酸性高锰酸钾溶液褪色,故D错误;
故答案为B。
11.A
【分析】只要混合物的总物质的量一定,完全燃烧消耗O2的质量保持不变,则1mol各组分消耗氧气的量相等,据此解答。
【详解】A.C4H6O2可以改写为C3H6·CO2,1molC3H6与1mol C4H6O2耗氧量相等,符合题意,故A正确;
B.C2H6O比C2H6多1个O原子,1molC2H6与1molC2H6O耗氧量不相同,不符合题意,故B错误;
C.C2H2、C6H6最简式相同,1molC6H6的耗氧量为1molC2H2耗氧量的3倍,不符合题意,故C错误;
D.C3H6O改写为C3H4·H2O,C4H8O2改写为C3H8·CO2,比较1molC3H4、1molC3H8的耗氧量,二者C原子数目相同,但C3H8中H原子数目较多,故二者各1mol耗氧量不同,不符合题意,故D错误,
故选A。
12.B
【分析】标况下,求得混合气体的物质的量为0.1mol,CO2物质的量为0.2mol,H2O物质的量为0.2mol,则0.1mol混合气体含有0.2molC和0.4molH,则混合气体可以表示为C2H4,所以一份混合气体中含有两份碳原子和四份氢原子。
【详解】A.和无论如何混合,一份混合气体中氢原子份数均大于4,A错误;
B.和无论如何混合,一份混合气体中含有两份碳原子和四份氢原子,B正确。
C.和无论如何混合,一份混合气体均不能含有两份碳原子,C错误;
D.和无论如何混合,一份混合气体中氢原子份数均大于4,D错误。
答案选B
13.C
【详解】根据反应方程式,知,充分燃烧后气体体积无变化,故燃烧后气体体积缩小了是燃烧引起的;同一条件下,气体的体积之比和气体的物质的量成正比,根据反应可知,2mL氢气完全反应后,气体体积缩小1mL,题给燃烧后气体体积缩小了mL,所以消耗的氢气的体积为,故的体积为,C满足题意;
故选C。
14.BD
【分析】3.2g铜粉的物质的量为n(Cu)==0.05mol,混合溶液中n(H+)=100mL×10-3L/mL×0.3mol/L+100mL×10-3L/mL×0.25mol/L×2=0.08mol,n(NO)=0.03mol,根据3Cu+8H++2NO=3Cu2++2NO↑+4H2O,H+不足,Cu和NO过量,按照H+进行计算,据此分析;
【详解】A.根据上述分析,H+不足,Cu和NO过量,按照H+进行计算,充分反应后,溶液中n(Cu2+)=0.03mol,即c(Cu2+)==0.3mol/L,故A错误;
B.根据上述分析,标准状况下,产生NO的体积为=0.448L,即产生标准状况下NO的体积为448mL,故B正确;
C.根据B选项分析,生成NO的物质的量为0.02mol,即转移电子物质的量为0.02mol×(5-2)=0.06mol,故C错误;
D.根据上述分析,反应后剩余铜粉的物质的量为0.02mol,剩余n(NO)=0.01mol,加入足量稀硫酸时,0.01molNO全部反应时消耗Cu的物质的量为=0.015<0.02mol,因此加入足量稀硫酸时,铜减少,但仍然有剩余,故D正确;
答案为BD。
15.(1)40 g·mol-1
(2)0.4NA
(3) 28 g·mol-1 1.4NA
【分析】16.0 g CO和CO2的混合气体,在标准状况下其体积为8.96 L,则混合气体的总物质的量是; 设混合气体中CO和CO2的物质的量分别为xmol、ymol;,解得。
(1)该混合气体的平均摩尔质量为g·mol-1;
(2)CO和CO2分子中都只含1个碳原子,混合气体的总物质的量是0.4mol,所以混合气体中碳原子的个数为0.4 NA;
(3)①二氧化碳被氢氧化钠吸收,气球中收集到的气体是CO,CO的摩尔质量为28 g·mol-1;②1个CO分子中有14个电子,气球中收集到的气体是0.1molCO,电子总数为1.4NA;
16.(1)
(2) ⑤ ② ⑥ ③ ④ ①
(3)第一次是为了排出装置内的空气,防止空气中干扰实验;第二次是为了将装置中残留的全部排入装置C中被吸收,减小实验误差
(4)BD
(5)
【解析】(1)
由题中可知反应物为、、、,则反应中生成水合碳酸镧的化学方程式为:
故正确答案:
(2)
实验II的具体实验步骤为:打开、和,通数分钟为了排出装置内的空气,防止空气中 干扰实验→⑤关闭、,打开→②点燃酒精喷灯,加热A中样品→熄灭酒精喷灯→⑥打开→③通入数分钟时间的为了装置中残留的全部排入装置C中被吸收,减小实验误差→④关闭和→①冷却到室温,称量A
故正确答案:⑤、②、⑥、③、④、①
(3)
实验II中通入氮气的目的是:第一次是为了排出装置内的空气,防止空气中干扰实验;第二次是为了将装置中残留的全部排入装置C中被吸收,减小实验误差。
故正确答案:第一次是为了排出装置内的空气,防止空气中干扰实验;第二次是为了将装置中残留的全部排入装置C中被吸收,减小实验误差。
(4)
A.装置X为洗气瓶,用其除去二氧化碳中的氯化氢,Y装置制取氨气,Z装置制取碳酸镧 La2(CO3)3,由于氨气极易溶于水中,用球形干燥管防止倒吸,W装置制取二氧化碳气体,所以实验Ⅰ装置的接口连接顺序为f→b→a→d,e←c,故A正确。
B.制备水合碳酸镧时应先通入NH3再通入,故B错误。
C.根据化学式可知即当时,说明制得的样品中不含,故C正确。
D.实验II装置B中的试剂是浓硫酸是用于吸收分解产生的水蒸气,所以不能通过装置B的增重量达成实验II的目的,故D错误。
故正确答案:BD
(5)
如果制得的样品中不含有La(OH)CO3,则由化学式知,根据已知信息,m2-m1为的质量,m4-m1为的质量,m5-m3为CO2的质量,B中装有浓硫酸,C中装有碱石灰,D中碱石灰的作用是防止空气中CO2和 H2O进入到装置C中影响实验结果,第一次通入N2目的是排除装置中的空气,防止空气中 CO2干扰实验结果,第二次通入N2将装置中残留的CO2全部排入装置C中被吸收,减小实验误差,,可求出合碳酸镧化学式中结晶水数目
故正确答案:
17. 羟基 nCH2=CH2
【分析】由A是含氢质量分数最大的有机物,分子结构为正四面体可知,A为甲烷;由B的球棍模型为可知,B为乙烯;由C的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应可知,C为乙醇;由D的空间填充模型为,向该物质的水溶液中滴加紫色石蕊溶液,溶液变红色可知,D为乙酸。
【详解】(1)A为甲烷,甲烷为共价化合物,电子式为;C为乙醇,结构简式为CH3CH2OH,故官能团为羟基。
(2)B为乙烯,结构简式为,一定条件下,乙烯能发生加聚反应生成聚乙烯,反应的化学方程式为nCH2=CH2。
(3)转化①为在催化剂作用下,乙烯与水共热发生加成反应生成乙醇,反应的化学方程式为;
转化②为在铜或银作用下,乙醇与氧气发生催化氧化反应生成乙醛,反应的化学方程式为。
18. a c d e K HClO4 F 第二周期第ⅦA族 氧化 4
【详解】(1)质子数相同中子数不同的同一种元素形成的不同核素互为同位素,则以上各组物质中互为同位素的是l6O和l8O,答案选a;结构相似分子相差若干个CH2原子团的有机物互为同系物,C2H6和C4H10均属于烷烃,则互为同系物的是C2H6和C4H10,答案选c;分子式相同结构不同的化合物互为同分异构体,互为同分异构体的是C(CH3)4和(CH3)2CHCH2CH3,答案选d;结构和性质完全相同的是同种物质,则属于同种物质的是和,答案选e;
(2)根据元素在周期表中的相对位置可知①~⑩分别是Na、K、Mg、Al、C、S、O、F、Cl、Si,则
i.同主族从上到下金属性逐渐增强,同周期从左到右金属性逐渐减弱,则在元素①②③中,金属性最强的元素是K;
ii.非金属性越强,最高价含氧酸的酸性越强,则上述10种元素的最高价氧化物对应的水化物中酸性最强的物质是高氯酸,化学式为HClO4;
iii.元素⑤⑦形成的非极性化合物是CO2,电子式为;
iv.同主族从上到下非金属性逐渐增弱,同周期从左到右非金属性逐渐减强,则非金属性最强的元素是F,在元素周期表中的位置为第二周期第ⅦA族;
(3)①金属性Zn强于Cu,则该装置中锌电极是负极,发生氧化反应;
②反应的总方程式为Zn+Cu2+=Cu+Zn2+,根据方程式可知每消耗1mol锌,溶液质量增加65g-64g=1g,反应一段时间内溶液的质量增加2克,则该时间内消耗2mol锌,所以通过导线的电子的物质的量为2×2mol=4mol。
19. b d ac A O2+4e-+2H2O=4OH-
【分析】(1)CH3OH是产物,随反应进行浓度增大,平衡时物质的量为CO物质的量的变化量n(CO);
(2) 根据影响化学反应速率的因素分析;
(3)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变;
(4) CH3OH与O2的反应可将化学能转化为电能,形成的是原电池反应,甲醇在负极失电子发生氧化反应,正极是氧气得到电子发生还原反应。
【详解】(1)CH3OH是产物,随反应进行物质的量增大,平衡时物质的量为CO物质的量的变化量n(CO),表中CO的物质的量0~3s变化=0.02mol-0.007mol=0.013mol,所以图像中只有b符合,
因此,本题正确答案是:b;
(2)升高温度、增大压强和使用催化剂都能使化学反应速率增大,及时分离出CH3OH,
使生成物浓度减小,逆反应速率减小,平衡正向移动,正反应速率也随之减小,
因此,本题正确答案是:d;
(3) a.CO和H2的浓度保持不变,说明反应达到平衡状态,故a正确;
b. 反应速率之比等于化学方程式计量数之比,v(H2)=2 v(CO)为正反应速率之比,故b错误; c.反应从开始到平衡的建立过程中CO的物质的量的分数在不断改变,当CO的物质的量分数保持不变时,说明反应达到平衡状态,故c正确;
d. 根据质量守恒定律知,混合物质量始终不变,容器的体积不变,则容器内混合气体的密度始终不变,所以不能据此判断是否达到平衡状态,故d错误;
e.每生成1molCH3OH的同时有2molH-H键断裂均表示正反应速率之比,所以不能据此判断是否达到平衡状态,故e错误。
因此,本题正确答案是:ac;
(4)电子由a流向b说明a为负极,b为正极,CH3OH与O2的反应可将化学能转化为电能,甲醇失电子发生氧化反应,所以CH3OH从A通,B通入氧气,b电极发生的电极反应为氧气得到电子生成氢氧根离子,电极反应为:O2+4e-+2H2O=4OH-,
因此,本题正确答案是:A;O2+4e-+2H2O=4OH-。
答案第1页,共2页
化学试卷
可能用到原子量:Al:27 Na:23 C:12 He:4 Fe:56 P:31 Cu:64 Zn:65 S:32 O:16
一、选择题:本题共10小题,每小题3分,共30分.每小题只有一个选项符合题目要求。
1.VmLAl2(SO4)3溶液中含有mgAl3+,取mL该溶液用水稀释至4VmL,则SO物质的量浓度为( )
A.mol·L-1 B.mol·L-1 C.mol·L-1 D.mol·L-1
2.均含有短周期元素W的X、Y、Z三种物质间的转化关系如图所示。下列说法不正确的是( )
A.W可能是非金属元素
B.X可能是氧化物
C.Y、Z之间的转化可能是氧化还原反应
D.Y和Z在溶液中反应可能生成X
3.下列说法正确的是( )
A.的物质的量为 B.常温常压下,的体积是
C.溶液中含有 D.含有的分子数约为
4.用NA表示阿伏加德罗常数的值。下列叙述正确的有( )
①1molFeCl3溶于水形成的胶体中含有NA个Fe(OH)3胶体粒子
②3.9gNa2O2固体所含阴离子数为0.05NA
③标准状况下,46g乙醇中含有NA个分子
④常温下,2g氦气所含的原子数目为NA
⑤1molCl2通入足量的水中,最多生成1molHClO
⑥56g铁与氯气在一定条件下充分反应,最多消耗氯气的体积是33.6L
⑦142gNa2SO4和Na2HPO4的固体混合物中所含阴、阳离子的总数为3NA
A.1个 B.2个 C.3个 D.4个
5.下列离子方程式能用来解释相应实验现象的是( )
选项 实验现象 离子方程式
A 氢氧化亚铁溶于稀硝酸
B 向氢氧化镁悬浊液中滴加硫酸铵溶液,沉淀溶解
C 二氧化硫使酸性高锰酸钾溶液褪色
D 将新制氯水滴入含有酚酞的NaOH溶液中,溶液红色褪去
6.一定条件下的合成氨反应:,下列四个数据都表示合成氨的反应速率,其中表示的反应速率相同的是( )
① ②
③ ④
A.①②③ B.①③ C.①②④ D.②④
7.某甲烷燃料电池构造示意图如下,关于该电池的说法不正确的是( )
A.电解质溶液中Na+向b极移动
B.b极的电极反应是:O2+2H2O+4e-=4OH-
C.a极是负极,发生氧化反应
D.电子通过外电路从b电极流向a电极
8.下列物质的沸点由高到低排列的顺序是( )
①CH3(CH2)2CH3 ②CH3(CH2)3CH3 ③(CH3)3CH ④(CH3)2CHCH2CH3
A.④③②① B.④②①③ C.②④①③ D.②④③①
9.化合物(b)、(d)、(p)的分子式均为C6H6,下列说法正确的是( )
A.b的同分异构体只有d和p两种
B.b、d、p的二氯代物均只有三种
C.b、d、p均可与酸性高锰酸钾溶液反应
D.b、d、p中只有b的所有原子处于同一平面
10.四氯乙烯()是一种衣物干洗剂,聚四氟乙烯()是家用不粘锅内侧涂层的主要成分。下列关于四氯乙烯和聚四氟乙烯的叙述正确的是( )
A.它们都可以由乙烯发生加成反应得到
B.它们的分子中都不含氢原子
C.四氯乙烯对油脂有较好的溶解作用,聚四氟乙烯的化学性质比较活泼
D.它们都能发生加成反应,都能使酸性高锰酸钾溶液褪色
二、选择题:本题共4小题,每小题4分,共16分。每小题有一个或两个选项符合题目要求,全部选对得4分,选对但不全的得2分,有选错的得0分。
11.下列各项中的两种物质不论以何种比例混合,只要混合物的总物质的量一定,则完全燃烧消耗O2的质量保持不变的是( )
A.C3H6、C4H6O2 B.C2H6、C2H6O C.C2H2、C6H6 D.C3H6O、C4H8O2
12.某混合气体由两种气态烃组成。该混合气体完全燃烧后,得到二氧化碳(气体体积均已换算成标准状况下的体积)和水。则这两种气体可能是( )
A.和 B.和 C.和 D.和
13.在120℃、101kPa下,amL由氢气、乙烯组成的混合气体在bmL氧气中充分燃烧后,恢复到原温度和压强,已知b>3a,且燃烧后气体体积缩小了mL,则乙烯的体积为( )
A.mL B.mL C.mL D.mL
14.100mL某混合酸中,为0.3mol/L,为0.25mol/L。向其中加入3.2g铜粉,待充分反应后,忽略溶液体积变化,下列说法正确的是( )
A.反应后溶液中为0.45mol/L B.标准状况下,生成NO的体积为448mL
C.反应中转移0.09mol电子 D.反应后铜有剩余,加足量稀硫酸,铜减少,但仍然有剩余
三、填空题
15.(8分)现有16.0 g CO和CO2的混合气体,在标准状况下其体积为8.96 L。请回答下列问题:
(1)该混合气体的平均摩尔质量为___________。
(2)混合气体中碳原子的个数为___________(用NA表示阿伏加德罗常数的值)。
(3)将混合气体依次通过如图所示装置,最后收集在气球中(体积在标准状况下测定)。
①气球中收集到的气体的摩尔质量为___________。
②气球中收集到的气体中,电子总数为___________(用NA表示阿伏加德罗常数的值,假设气体全部进入气球中)。
16.(10分)碳酸镧[,]为白色难溶固体,分解温度为900℃。在溶液中制备时,形成水合碳酸镧,若溶液碱性太强,会生成受热易分解的碱式碳酸镧。已知酒精喷灯火焰温度可达1000℃。
实验I:用如图装置模拟制备水合碳酸镧
实验II:某小组通过以下实验验证制得的样品中不含,并测定中结晶水的含量。将石英玻璃A管称重,记为;将样品装入石英玻璃管中,再次将装置A称重,记为;将装有试剂的装置C称重,记为,按如图连接好装置进行实验。请回答:
(1)请写出反应中生成水合碳酸镧的化学方程式为___________________________。
(2)实验II的具体实验步骤为:打开、和,通数分钟_______→_______→熄灭酒精喷灯→_______→_______→_______→_______→重复上述操作步骤,直至A恒重,记为(此时装置A中固体为,);称重装置C,记为。
①冷却到室温,称量A ②点燃酒精喷灯,加热A中样品 ③通入数分钟时间的
④关闭和 ⑤关闭、,打开 ⑥打开
(3)实验II中通入氮气的目的是_______。
(4)下列说法不正确的是_______。
A.实验Ⅰ装置的接口连接顺序为f→b→a→d,e←c
B.制备水合碳酸镧时应先通入,防止碱性太强生成副产物碱式碳酸镧
C.根据实验记录,当时,说明制得的样品中不含
D.实验II装置B中的试剂是浓硫酸,也可通过装置B的增重量达成实验II的目的
(5)计算水合碳酸镧化学式中结晶水数目x=_______(用含、、的式子表示,不用化简)。
17.(9分)有A、B、C、D四种有机物,A、B属于烃类物质,C、D都是烃的衍生物。A是含氢质量分数最大的有机物,分子结构为正四面体;B的球棍模型为;C的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应;D的空间填充模型为,向该物质的水溶液中滴加紫色石蕊溶液,溶液变红色。请回答下列问题:
(1)A的电子式是______,C中官能团的名称是______。
(2)B的结构简式是______,该物质发生加聚反应的化学方程式为_________________。
(3)已知B可以发生如图转化过程:
完成转化①、②反应的化学方程式:①________________;②________________。
18.(11分)(1)根据要求回答下列问题:
a.l6O和l8O b.H2O和H2O2 c.C2H6和C4H10 d.和
e.和
以上各组物质中互为同位素的是 ______;互为同系物的是_______;互为同分异构体的是_______,
属于同种物质的是_____。(以上填序号)
(2)表是元素周期表一部分,请用化学用语回答下列问题 。
i.在元素①②③中,金属性最强的元素是_________________;
ii.上述10种元素的最高价氧化物对应的水化物中酸性最强的物质是______;
iii.请写出元素⑤⑦形成的非极性化合物的电子式:____________;
iv.非金属性最强的元素是________;它在元素周期表中的位置为________。
(3)将等质量的锌片和铜片用导线连接并插入CuSO4溶液中,装置如图所示。
①该装置中锌电极发生______________反应。
②反应一段时间内溶液的质量增加2克,则该时间内通过导线的电子的物质的量为_______ mol。
19.(8分)近年来甲醇用途日益广泛,越来越引起商家的关注。工业上甲醇的合成途径多种多样。现在实验室中模拟甲醇合成反应,在2 L密闭容器内,400 ℃时发生反应CO(g)+2H2(g) CH3OH(g),体系中n(CO)随时间的变化如表:
时间(s) 0 1 2 3 5
n(CO)(mol) 0.020 0.011 0.008 0.007 0.007
(1)图中表示CH3OH 的变化的曲线是_______;
(2)下列措施不能提高反应速率的有_________(请用相应字母填空);
a 升高温度 b 加入催化剂
c 增大压强 d 及时分离出CH3OH
(3)下列叙述能说明反应达到平衡状态的是__________(请用相应字母填空);
a.CO和H2的浓度保持不变 b.v(H2)=2 v(CO) c.CO的物质的量分数保持不变
d.容器内气体密度保持不变 e.每生成1molCH3OH的同时有2molH-H键断裂
(4)CH3OH与O2的反应可将化学能转化为电能,
其工作原理如图所示,
图中CH3OH从_______(填A或B)通入,
b极的电极反应式是__________。
抚州市金溪县2022-2023学年高二上学期8月开学考试
化学答题卷
15.(8分,每空2分)(1)___________________。(2)___________________
(3)①___________________。②___________
16.(10分,每空2分)(1)_______________________________________________。
(2)_______→_______→熄灭酒精喷灯→_______→_______→_______→_______→重复上述操作步骤,
(3)______________________________________。
(4)______________________________________。
(5)x=______________________________________(用含、、的式子表示,不用化简)。
17.(9分)(1)__________________________(1分),__________________________。(1分)
(2)_____________________________________(1分),__________________________。(2分)
(3):①____________________________________________________________________;(2分)
②______________________________________________________________。 (2分)
(11分,每空1分)
(1)___________________;____________________;__________________,______________。
(2)i._________________;ii._____________;iii.___________________;
iv._______________;_______________。
(3)①_____________________。②______________ mol。
19.(8分)(1)______________;(1分)(2)________________(2分)
(3)________________(2分);
(4)______________(1分),_______________________________。(2分)
第1页 共4页 ◎ 第2页 共4页
参考答案:
1.A
【详解】mgAl3+的物质的量为n(Al3+)==mol,根据2Al3+~3SO42-关系式得VmL溶液中SO42-的物质的量为n(SO42-)=×mol=mol,取mL该溶液用水稀释至4VmL,稀释后溶液中SO42-物质的量浓度为c(SO42-)mol·L-1,选A。
2.C
【详解】A.W可能是非金属元素,如X为NaHCO3,Y为CO2,Z为Na2CO3时,W为碳元素,A项正确;
B.X可能是氧化物,如X为Al2O3,Y为Al2(SO4)3,Z为NaAlO2,B项正确;
C.Y、Z之间的相互转化方式为加酸或加碱,不可能是氧化还原反应,C项错误;
D.当X为Al(OH)3时,Y为Al2(SO4)3,Z为NaAlO2,Y和Z在溶液中反应可生成X,D项正确;
故答案为C。
3.D
【详解】A.,36g水的物质的量为,故A错误;
B.根据,常温常压下,,所以1mol氯气的体积不是22.4L,故B错误;
C.根据,溶液的体积未知,不能计算出钠离子的物质的量,故C错误;
D.根据,得,则1mol二氧化碳含有的分子数约为,故D正确;
故选D。
4.C
【详解】①1个Fe(OH)3胶体粒子是多个氢氧化铁的聚集体,故所得的氢氧化铁胶粒个数小于NA个,故①错误;
②3.9g Na2O2的物质的量为n=3.9g÷78g/mol=0.05mol,而过氧化钠由2个钠离子和1个过氧根构成,故0.05mol过氧化钠中含阴离子为0.05NA个,故②正确;
③46g乙醇的物质的量为46g÷46g/mol=1mol,含有NA个分子,故③正确;
④氦气由氦原子构成,故2g氦气中含有的氦原子的物质的量为n=2g÷4g/mol=0.5mol,即0.5NA个,故④错误;
⑤Cl2和水的反应为可逆反应,不能进行彻底,故所得HClO的物质的量小于1mol,故⑤错误;
⑥56g铁的物质的量为n=56g÷56g/mol=1mol,和氯气反应消耗氯气为1.5mol,但氯气所处的状态不明确,故其物质的量无法计算,故⑥错误;
⑦Na2SO4和Na2HPO4的摩尔质量均为142g/mol,故142g Na2SO4和Na2HPO4的物质的量为n=142g÷142g/mol=1mol,且两者均由2个钠离子和1个阴离子构成,故1mol混合物中含离子共3NA个,故⑦正确。
故选C。
5.B
【详解】A.稀硝酸具有强氧化性,可将氧化成并生成NO气体,描述错误,不符题意;
B.氢氧化镁的碱性强于氨水,满足“强碱制弱碱原理”,描述正确,符合题意;
C.题给离子方程式的电荷不守恒,正确的离子方程式为,描述错误,不符题意;
D.NaOH是可溶性强碱,应拆写为和,正确的离子方程式为,描述错误,不符题意;
故选B。
6.D
【详解】根据同一化学反应中,化学反应速率之比等于化学方程式中各物质的化学计量数之比,可将不同物质表示的化学反应速率转化为同一物质(如)表示的化学反应速率,
则②,③,④,故D项正确。
故选:D。
7.D
【分析】通过示意图可知,a电极为燃料电池的负极,b电极为电池正极,且电解质溶液为碱液,并可写出电池总反应式为CH4+2O2+2NaOH=Na2CO3+3H2O,负极反应为CH4+10OH--8e-=CO32- +7H2O,正极反应为2O2+8e-+4H2O=8OH-。
【详解】A. 原电池中,电解质溶液的阳离子向正极移动,所以钠离子向b极移动,故A正确;
B. b极为正极,电极反应式为O2+2H2O+4e-=4OH-,故B正确;
C. a极是负极,甲烷在负极失去电子,发生氧化反应,故C正确;
D. 电子通过外电路从a电极流向b电极,故D错误;
故答案选D。
8.C
【详解】碳原子个数不同的烷烃,碳原子个数越大,沸点越高,碳原子个数相同的烷烃,支链越多,沸点越低,则四种烷烃的沸点由高到低排列的顺序为②④①③,故选C。
9.D
【详解】A.b为苯,对应的同分异构体可为环状烃,也可为链状烃,如HC≡C-CH=CH-CH=CH2,则同分异构体不仅仅d和p两种,故A错误;
B.d编号如图,对应的二氯代物中,两个氯原子可分别位于1、2,1、3,1、4,2、3等位置,故B错误;
C.b为苯,p为饱和烃,与高锰酸钾不反应,故C错误;
D.d、p都含有饱和碳原子,具有甲烷的结构特点,则d、p所有原子不可能处于同一平面,只有b为平面形结构,故D正确;
故选:D。
10.B
【详解】A.. 四氟乙烯可由乙炔发生加成反应得到,聚四氟乙烯是由四氟乙烯发生加聚反应得到,所以二者都不能用乙烯发生加成反应得到,故A错误;
B.二者都只含C和卤族元素,所以二者都不含氢原子,故B正确;
C.聚四氟乙烯中不含碳碳不饱和键,性质较稳定,所以聚四氟乙烯中化学性质不活泼,故C错误;
D.碳碳不饱和键能发生加成反应,能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,四氯乙烯含有碳碳不饱和键而能发生加成反应,能使酸性高锰酸钾溶液褪色,聚四氟乙烯不含碳碳双键而不能发生加成反应、不能使酸性高锰酸钾溶液褪色,故D错误;
故答案为B。
11.A
【分析】只要混合物的总物质的量一定,完全燃烧消耗O2的质量保持不变,则1mol各组分消耗氧气的量相等,据此解答。
【详解】A.C4H6O2可以改写为C3H6·CO2,1molC3H6与1mol C4H6O2耗氧量相等,符合题意,故A正确;
B.C2H6O比C2H6多1个O原子,1molC2H6与1molC2H6O耗氧量不相同,不符合题意,故B错误;
C.C2H2、C6H6最简式相同,1molC6H6的耗氧量为1molC2H2耗氧量的3倍,不符合题意,故C错误;
D.C3H6O改写为C3H4·H2O,C4H8O2改写为C3H8·CO2,比较1molC3H4、1molC3H8的耗氧量,二者C原子数目相同,但C3H8中H原子数目较多,故二者各1mol耗氧量不同,不符合题意,故D错误,
故选A。
12.B
【分析】标况下,求得混合气体的物质的量为0.1mol,CO2物质的量为0.2mol,H2O物质的量为0.2mol,则0.1mol混合气体含有0.2molC和0.4molH,则混合气体可以表示为C2H4,所以一份混合气体中含有两份碳原子和四份氢原子。
【详解】A.和无论如何混合,一份混合气体中氢原子份数均大于4,A错误;
B.和无论如何混合,一份混合气体中含有两份碳原子和四份氢原子,B正确。
C.和无论如何混合,一份混合气体均不能含有两份碳原子,C错误;
D.和无论如何混合,一份混合气体中氢原子份数均大于4,D错误。
答案选B
13.C
【详解】根据反应方程式,知,充分燃烧后气体体积无变化,故燃烧后气体体积缩小了是燃烧引起的;同一条件下,气体的体积之比和气体的物质的量成正比,根据反应可知,2mL氢气完全反应后,气体体积缩小1mL,题给燃烧后气体体积缩小了mL,所以消耗的氢气的体积为,故的体积为,C满足题意;
故选C。
14.BD
【分析】3.2g铜粉的物质的量为n(Cu)==0.05mol,混合溶液中n(H+)=100mL×10-3L/mL×0.3mol/L+100mL×10-3L/mL×0.25mol/L×2=0.08mol,n(NO)=0.03mol,根据3Cu+8H++2NO=3Cu2++2NO↑+4H2O,H+不足,Cu和NO过量,按照H+进行计算,据此分析;
【详解】A.根据上述分析,H+不足,Cu和NO过量,按照H+进行计算,充分反应后,溶液中n(Cu2+)=0.03mol,即c(Cu2+)==0.3mol/L,故A错误;
B.根据上述分析,标准状况下,产生NO的体积为=0.448L,即产生标准状况下NO的体积为448mL,故B正确;
C.根据B选项分析,生成NO的物质的量为0.02mol,即转移电子物质的量为0.02mol×(5-2)=0.06mol,故C错误;
D.根据上述分析,反应后剩余铜粉的物质的量为0.02mol,剩余n(NO)=0.01mol,加入足量稀硫酸时,0.01molNO全部反应时消耗Cu的物质的量为=0.015<0.02mol,因此加入足量稀硫酸时,铜减少,但仍然有剩余,故D正确;
答案为BD。
15.(1)40 g·mol-1
(2)0.4NA
(3) 28 g·mol-1 1.4NA
【分析】16.0 g CO和CO2的混合气体,在标准状况下其体积为8.96 L,则混合气体的总物质的量是; 设混合气体中CO和CO2的物质的量分别为xmol、ymol;,解得。
(1)该混合气体的平均摩尔质量为g·mol-1;
(2)CO和CO2分子中都只含1个碳原子,混合气体的总物质的量是0.4mol,所以混合气体中碳原子的个数为0.4 NA;
(3)①二氧化碳被氢氧化钠吸收,气球中收集到的气体是CO,CO的摩尔质量为28 g·mol-1;②1个CO分子中有14个电子,气球中收集到的气体是0.1molCO,电子总数为1.4NA;
16.(1)
(2) ⑤ ② ⑥ ③ ④ ①
(3)第一次是为了排出装置内的空气,防止空气中干扰实验;第二次是为了将装置中残留的全部排入装置C中被吸收,减小实验误差
(4)BD
(5)
【解析】(1)
由题中可知反应物为、、、,则反应中生成水合碳酸镧的化学方程式为:
故正确答案:
(2)
实验II的具体实验步骤为:打开、和,通数分钟为了排出装置内的空气,防止空气中 干扰实验→⑤关闭、,打开→②点燃酒精喷灯,加热A中样品→熄灭酒精喷灯→⑥打开→③通入数分钟时间的为了装置中残留的全部排入装置C中被吸收,减小实验误差→④关闭和→①冷却到室温,称量A
故正确答案:⑤、②、⑥、③、④、①
(3)
实验II中通入氮气的目的是:第一次是为了排出装置内的空气,防止空气中干扰实验;第二次是为了将装置中残留的全部排入装置C中被吸收,减小实验误差。
故正确答案:第一次是为了排出装置内的空气,防止空气中干扰实验;第二次是为了将装置中残留的全部排入装置C中被吸收,减小实验误差。
(4)
A.装置X为洗气瓶,用其除去二氧化碳中的氯化氢,Y装置制取氨气,Z装置制取碳酸镧 La2(CO3)3,由于氨气极易溶于水中,用球形干燥管防止倒吸,W装置制取二氧化碳气体,所以实验Ⅰ装置的接口连接顺序为f→b→a→d,e←c,故A正确。
B.制备水合碳酸镧时应先通入NH3再通入,故B错误。
C.根据化学式可知即当时,说明制得的样品中不含,故C正确。
D.实验II装置B中的试剂是浓硫酸是用于吸收分解产生的水蒸气,所以不能通过装置B的增重量达成实验II的目的,故D错误。
故正确答案:BD
(5)
如果制得的样品中不含有La(OH)CO3,则由化学式知,根据已知信息,m2-m1为的质量,m4-m1为的质量,m5-m3为CO2的质量,B中装有浓硫酸,C中装有碱石灰,D中碱石灰的作用是防止空气中CO2和 H2O进入到装置C中影响实验结果,第一次通入N2目的是排除装置中的空气,防止空气中 CO2干扰实验结果,第二次通入N2将装置中残留的CO2全部排入装置C中被吸收,减小实验误差,,可求出合碳酸镧化学式中结晶水数目
故正确答案:
17. 羟基 nCH2=CH2
【分析】由A是含氢质量分数最大的有机物,分子结构为正四面体可知,A为甲烷;由B的球棍模型为可知,B为乙烯;由C的相对分子质量为46,能与Na反应,但不能与NaOH溶液反应可知,C为乙醇;由D的空间填充模型为,向该物质的水溶液中滴加紫色石蕊溶液,溶液变红色可知,D为乙酸。
【详解】(1)A为甲烷,甲烷为共价化合物,电子式为;C为乙醇,结构简式为CH3CH2OH,故官能团为羟基。
(2)B为乙烯,结构简式为,一定条件下,乙烯能发生加聚反应生成聚乙烯,反应的化学方程式为nCH2=CH2。
(3)转化①为在催化剂作用下,乙烯与水共热发生加成反应生成乙醇,反应的化学方程式为;
转化②为在铜或银作用下,乙醇与氧气发生催化氧化反应生成乙醛,反应的化学方程式为。
18. a c d e K HClO4 F 第二周期第ⅦA族 氧化 4
【详解】(1)质子数相同中子数不同的同一种元素形成的不同核素互为同位素,则以上各组物质中互为同位素的是l6O和l8O,答案选a;结构相似分子相差若干个CH2原子团的有机物互为同系物,C2H6和C4H10均属于烷烃,则互为同系物的是C2H6和C4H10,答案选c;分子式相同结构不同的化合物互为同分异构体,互为同分异构体的是C(CH3)4和(CH3)2CHCH2CH3,答案选d;结构和性质完全相同的是同种物质,则属于同种物质的是和,答案选e;
(2)根据元素在周期表中的相对位置可知①~⑩分别是Na、K、Mg、Al、C、S、O、F、Cl、Si,则
i.同主族从上到下金属性逐渐增强,同周期从左到右金属性逐渐减弱,则在元素①②③中,金属性最强的元素是K;
ii.非金属性越强,最高价含氧酸的酸性越强,则上述10种元素的最高价氧化物对应的水化物中酸性最强的物质是高氯酸,化学式为HClO4;
iii.元素⑤⑦形成的非极性化合物是CO2,电子式为;
iv.同主族从上到下非金属性逐渐增弱,同周期从左到右非金属性逐渐减强,则非金属性最强的元素是F,在元素周期表中的位置为第二周期第ⅦA族;
(3)①金属性Zn强于Cu,则该装置中锌电极是负极,发生氧化反应;
②反应的总方程式为Zn+Cu2+=Cu+Zn2+,根据方程式可知每消耗1mol锌,溶液质量增加65g-64g=1g,反应一段时间内溶液的质量增加2克,则该时间内消耗2mol锌,所以通过导线的电子的物质的量为2×2mol=4mol。
19. b d ac A O2+4e-+2H2O=4OH-
【分析】(1)CH3OH是产物,随反应进行浓度增大,平衡时物质的量为CO物质的量的变化量n(CO);
(2) 根据影响化学反应速率的因素分析;
(3)当反应达到平衡状态时,正逆反应速率相等,各物质的浓度不再改变,由此衍生的一些物理量也不变;
(4) CH3OH与O2的反应可将化学能转化为电能,形成的是原电池反应,甲醇在负极失电子发生氧化反应,正极是氧气得到电子发生还原反应。
【详解】(1)CH3OH是产物,随反应进行物质的量增大,平衡时物质的量为CO物质的量的变化量n(CO),表中CO的物质的量0~3s变化=0.02mol-0.007mol=0.013mol,所以图像中只有b符合,
因此,本题正确答案是:b;
(2)升高温度、增大压强和使用催化剂都能使化学反应速率增大,及时分离出CH3OH,
使生成物浓度减小,逆反应速率减小,平衡正向移动,正反应速率也随之减小,
因此,本题正确答案是:d;
(3) a.CO和H2的浓度保持不变,说明反应达到平衡状态,故a正确;
b. 反应速率之比等于化学方程式计量数之比,v(H2)=2 v(CO)为正反应速率之比,故b错误; c.反应从开始到平衡的建立过程中CO的物质的量的分数在不断改变,当CO的物质的量分数保持不变时,说明反应达到平衡状态,故c正确;
d. 根据质量守恒定律知,混合物质量始终不变,容器的体积不变,则容器内混合气体的密度始终不变,所以不能据此判断是否达到平衡状态,故d错误;
e.每生成1molCH3OH的同时有2molH-H键断裂均表示正反应速率之比,所以不能据此判断是否达到平衡状态,故e错误。
因此,本题正确答案是:ac;
(4)电子由a流向b说明a为负极,b为正极,CH3OH与O2的反应可将化学能转化为电能,甲醇失电子发生氧化反应,所以CH3OH从A通,B通入氧气,b电极发生的电极反应为氧气得到电子生成氢氧根离子,电极反应为:O2+4e-+2H2O=4OH-,
因此,本题正确答案是:A;O2+4e-+2H2O=4OH-。
答案第1页,共2页
同课章节目录
