鲁教版(五四制)八年级化学 3.1.1 原子的结构 课件(共14张PPT)
文档属性
| 名称 | 鲁教版(五四制)八年级化学 3.1.1 原子的结构 课件(共14张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-01 20:20:01 | ||
图片预览




文档简介
(共14张PPT)
3.1 原子的构成
第三单元 物质构成的奥秘
主讲:XXX
3.1.1 原子的结构
①回顾旧知 导入新课
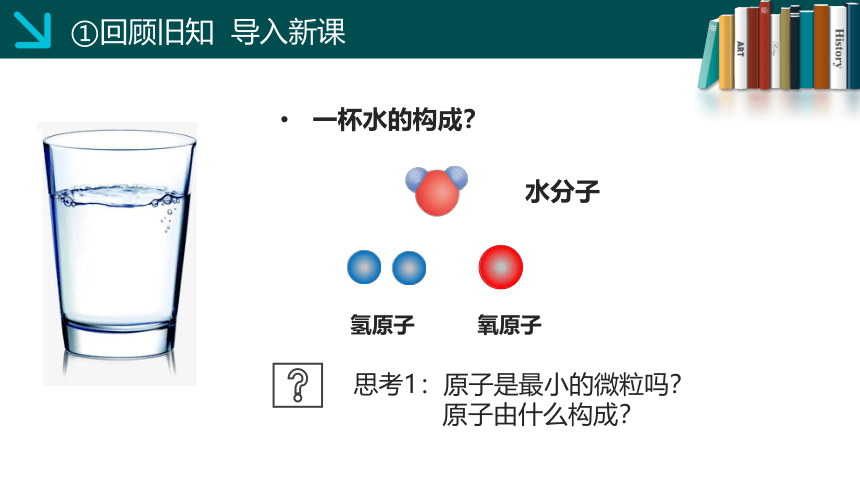
一杯水的构成?
水分子
氢原子
氧原子
思考1:原子是最小的微粒吗?
原子由什么构成?
②阅读资料 建立模型
汤姆森等人认真分析了高压放电管的
,发现它是由一种带 的
粒子形成的粒子流,这种粒子就是 。
汤姆森进行了一系列实验后发现,不论阴极材料是什么,都会发射出 。
这让他意识到,电子是所有物质的原子中 。
既然原子中存在更小的粒子,那么原子就是 。
阴极射线
负电荷
电子
共有的粒子
可分的
电子
原子里面究竟有什么?
阅读课本,完成填空
②阅读资料 建立模型
阅读课本,完成填空
汤姆森猜测原子中一定还有带 的物质,并由此提出新的原子模型:
原子呈 , 充斥着 ,而带
的电子则像一粒粒葡萄干一样镶
嵌其中。这就是原子的“ ”
模型。
圆球状
汤姆森的原子模型是正确的吗?如何验证?
正电
正电荷
负电荷
葡萄干布丁
②阅读资料 建立模型
阅读课本,完成填空
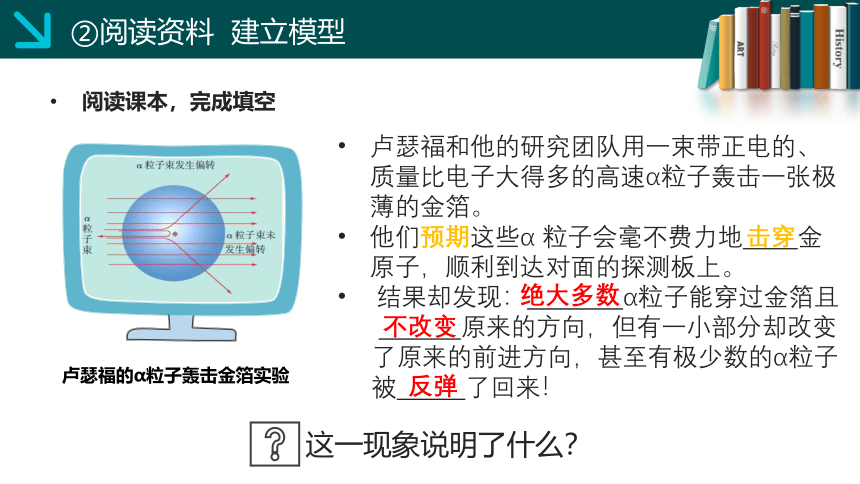
卢瑟福和他的研究团队用一束带正电的、质量比电子大得多的高速α粒子轰击一张极薄的金箔。
他们预期这些α 粒子会毫不费力地 金原子,顺利到达对面的探测板上。
结果却发现: α粒子能穿过金箔且
原来的方向,但有一小部分却改变
了原来的前进方向,甚至有极少数的α粒子
被 了回来!
击穿
绝大多数
不改变
反弹
这一现象说明了什么?
卢瑟福的α粒子轰击金箔实验
②阅读资料 建立模型
阅读课本,完成填空
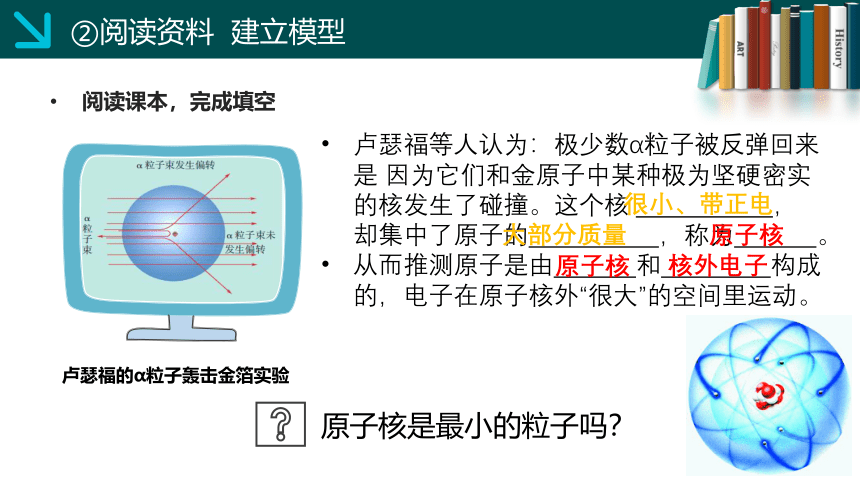
卢瑟福的α粒子轰击金箔实验
卢瑟福等人认为:极少数α粒子被反弹回来是 因为它们和金原子中某种极为坚硬密实的核发生了碰撞。这个核 ,却集中了原子的 ,称为 。
从而推测原子是由 和 构成的,电子在原子核外“很大”的空间里运动。
很小、带正电
核外电子
原子核是最小的粒子吗?
大部分质量
原子核
原子核
②阅读资料 建立模型
阅读课本,完成填空
原子核很小,它的体积仅为原子体积的几千亿分 之一。即使这样,原子核仍然是可以再分的。
后来的研究表明,原子核是由带 的 和
的 构成的,因此原子核带 。
其所带的正电荷数称为 。
质子和中子的质量差不多,都比电子大得多,质子质量约为电子质量的1836倍,因此原子的质量几乎全部集中在 上。
正电荷
不带电荷
质子
中子
正电
核电荷数
原子核
③归纳总结 探索规律
原子核
原子
质子
中子
(1个质子带1个单位正电荷)
(不带电)
核外电子
(1个电子带1个单位负电荷)
(不显电性)
原子的构成有什么规律?
(带正电)
思考以下问题
1.不同种原子的质子数相同吗?那同种原子呢?同种原子的质子数与原子序数有何关系 ?
2.所有原子都是由质子、中子、电子构成的吗?
3.同一种原子质子、电子、中子在数量上有什么关系?
③归纳总结 探索规律
③归纳总结 探索规律
解答问题
在原子中:核电荷数=质子数=核外电子数
1.同种原子的质子数相同吗?那同种原子呢?同种原子的质子数与原子序数有何关系 ?
2.所有原子都是由质子、中子、电子构成的吗?
3.同一种原子质子、电子、中子在数量上有什么关系?
不同原子的质子数不同;同种原子的质子数相同;同种原子质子数与原子序数相等。
所有原子都有质子和电子,但不是所有的原子都有中子氢原子的中子数为0,氢原子的中子数为0
质子数一定等于电子数,但不一定等于中子数。
小结
③归纳总结 探索规律
原子是构成物质的一种基本粒子,铁、金、金刚石等都是由原子直接构成的。
因此原子具有微观粒子的一般性质,如质量和体积很小、原子之间存在间隔和相互作用、总在不断运动等。
下列有关原子构成的叙述不正确的是( )。
A.原子不显电性
B. 相对于原子来说,原子核的体积小到几乎可以忽略不计
C. 原子核是不可分割的实心球体
D. 原子的质量主要集中在原子核上
C
质子、中子
④课堂练习 巩固知识
2. 卢瑟福在测定原子构成时做了如下实验:用α粒子轰击一张极薄的金箔,发现绝大多数α粒子通过了金箔,极少数α粒子发生偏转或被弹回。根据上述现象得出以下结论,其中正确的是( )。
A.金原子是实心球体,紧密排列
B.金原子核的质量比α粒子大得多
C.金原子核带正电荷
D.金原子质量与α粒子质量相当
C
④课堂练习 巩固知识
感谢聆听
主讲:XXX
3.1 原子的构成
第三单元 物质构成的奥秘
主讲:XXX
3.1.1 原子的结构
①回顾旧知 导入新课
一杯水的构成?
水分子
氢原子
氧原子
思考1:原子是最小的微粒吗?
原子由什么构成?
②阅读资料 建立模型
汤姆森等人认真分析了高压放电管的
,发现它是由一种带 的
粒子形成的粒子流,这种粒子就是 。
汤姆森进行了一系列实验后发现,不论阴极材料是什么,都会发射出 。
这让他意识到,电子是所有物质的原子中 。
既然原子中存在更小的粒子,那么原子就是 。
阴极射线
负电荷
电子
共有的粒子
可分的
电子
原子里面究竟有什么?
阅读课本,完成填空
②阅读资料 建立模型
阅读课本,完成填空
汤姆森猜测原子中一定还有带 的物质,并由此提出新的原子模型:
原子呈 , 充斥着 ,而带
的电子则像一粒粒葡萄干一样镶
嵌其中。这就是原子的“ ”
模型。
圆球状
汤姆森的原子模型是正确的吗?如何验证?
正电
正电荷
负电荷
葡萄干布丁
②阅读资料 建立模型
阅读课本,完成填空
卢瑟福和他的研究团队用一束带正电的、质量比电子大得多的高速α粒子轰击一张极薄的金箔。
他们预期这些α 粒子会毫不费力地 金原子,顺利到达对面的探测板上。
结果却发现: α粒子能穿过金箔且
原来的方向,但有一小部分却改变
了原来的前进方向,甚至有极少数的α粒子
被 了回来!
击穿
绝大多数
不改变
反弹
这一现象说明了什么?
卢瑟福的α粒子轰击金箔实验
②阅读资料 建立模型
阅读课本,完成填空
卢瑟福的α粒子轰击金箔实验
卢瑟福等人认为:极少数α粒子被反弹回来是 因为它们和金原子中某种极为坚硬密实的核发生了碰撞。这个核 ,却集中了原子的 ,称为 。
从而推测原子是由 和 构成的,电子在原子核外“很大”的空间里运动。
很小、带正电
核外电子
原子核是最小的粒子吗?
大部分质量
原子核
原子核
②阅读资料 建立模型
阅读课本,完成填空
原子核很小,它的体积仅为原子体积的几千亿分 之一。即使这样,原子核仍然是可以再分的。
后来的研究表明,原子核是由带 的 和
的 构成的,因此原子核带 。
其所带的正电荷数称为 。
质子和中子的质量差不多,都比电子大得多,质子质量约为电子质量的1836倍,因此原子的质量几乎全部集中在 上。
正电荷
不带电荷
质子
中子
正电
核电荷数
原子核
③归纳总结 探索规律
原子核
原子
质子
中子
(1个质子带1个单位正电荷)
(不带电)
核外电子
(1个电子带1个单位负电荷)
(不显电性)
原子的构成有什么规律?
(带正电)
思考以下问题
1.不同种原子的质子数相同吗?那同种原子呢?同种原子的质子数与原子序数有何关系 ?
2.所有原子都是由质子、中子、电子构成的吗?
3.同一种原子质子、电子、中子在数量上有什么关系?
③归纳总结 探索规律
③归纳总结 探索规律
解答问题
在原子中:核电荷数=质子数=核外电子数
1.同种原子的质子数相同吗?那同种原子呢?同种原子的质子数与原子序数有何关系 ?
2.所有原子都是由质子、中子、电子构成的吗?
3.同一种原子质子、电子、中子在数量上有什么关系?
不同原子的质子数不同;同种原子的质子数相同;同种原子质子数与原子序数相等。
所有原子都有质子和电子,但不是所有的原子都有中子氢原子的中子数为0,氢原子的中子数为0
质子数一定等于电子数,但不一定等于中子数。
小结
③归纳总结 探索规律
原子是构成物质的一种基本粒子,铁、金、金刚石等都是由原子直接构成的。
因此原子具有微观粒子的一般性质,如质量和体积很小、原子之间存在间隔和相互作用、总在不断运动等。
下列有关原子构成的叙述不正确的是( )。
A.原子不显电性
B. 相对于原子来说,原子核的体积小到几乎可以忽略不计
C. 原子核是不可分割的实心球体
D. 原子的质量主要集中在原子核上
C
质子、中子
④课堂练习 巩固知识
2. 卢瑟福在测定原子构成时做了如下实验:用α粒子轰击一张极薄的金箔,发现绝大多数α粒子通过了金箔,极少数α粒子发生偏转或被弹回。根据上述现象得出以下结论,其中正确的是( )。
A.金原子是实心球体,紧密排列
B.金原子核的质量比α粒子大得多
C.金原子核带正电荷
D.金原子质量与α粒子质量相当
C
④课堂练习 巩固知识
感谢聆听
主讲:XXX
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
