鲁教版(五四制)八年级化学 3.1.2原子的构成 课件(共16张PPT)
文档属性
| 名称 | 鲁教版(五四制)八年级化学 3.1.2原子的构成 课件(共16张PPT) |

|
|
| 格式 | zip | ||
| 文件大小 | 3.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版(五四学制) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-09-01 21:53:54 | ||
图片预览






文档简介
(共16张PPT)
3.1 原子的构成
主讲:XXX
第三单元 物质构成的奥秘
3.1.2 原子质量的计量
3.1.3 原子中的电子
①预习检测 导入新课
原子的实际(绝对)质量很小,1个氧原子的质量为
, 1个铁原子的质量为 。
这么小的数字, 书写、记忆和运算非常麻烦,很不
方便,为此国际上统一采用 来计量原
子的质量。
2.657×10-26 kg
相对原子质量
9.288×10-26 kg
2. 什么是相对原子质量?
以一个碳12原子的实际质量(1.993×10-26 kg) 的1/12作为基准,计算出其他原子的相对质量,就是这种原子的相对原子质量。
①预习检测 导入新课
3. 相对原子质量的计算公式:
4. 相对原子质量有无单位:
是原子间质量之比,单位为1,一般不写
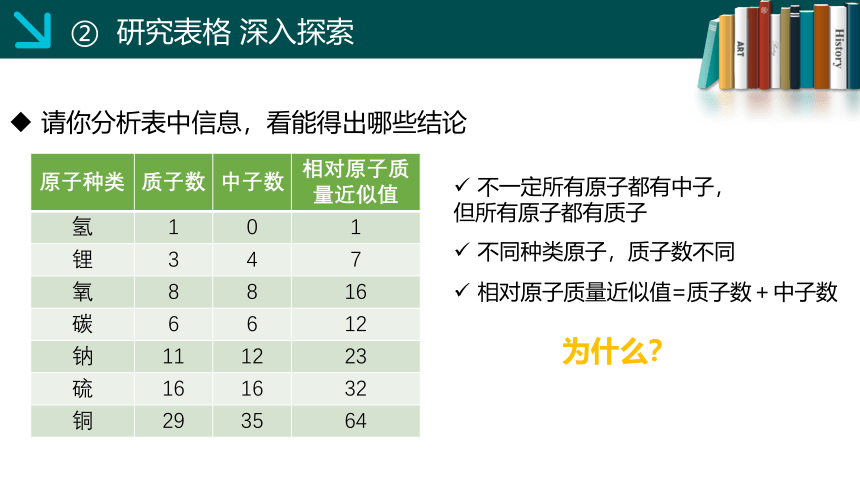
② 研究表格 深入探索
原子种类 质子数 中子数 相对原子质量近似值
氢 1 0 1
锂 3 4 7
氧 8 8 16
碳 6 6 12
钠 11 12 23
硫 16 16 32
铜 29 35 64
请你分析表中信息,看能得出哪些结论
相对原子质量近似值=质子数+中子数
不一定所有原子都有中子,
但所有原子都有质子
不同种类原子,质子数不同
为什么?
② 研究表格 深入探索
粒子种类 质量
质子 1.6726×10-27 kg
中子 1.6749×10-27 kg
电子 质子质量的1/1836
相对原子质量近似值=质子数+中子数
说明:跟质子、中子相比,电子质量很小,
通常忽略不计,原子的质量主要集中在
原子核上。
关于相对原子质量,下列叙述正确的是( )。
A.相对原子质量就是原子质量
B. 两种原子的质量之比等于它们的相对原子质量之比
C. 碳原子的相对原子质量是12 g
D. 采用相对原子质量后,就增大了原子的质量
B
随堂检测
解析:
A.两者概念不同
C.相对原子质量单位为1,一般省略不写
D.采用相对原子质量只是计算书写方便,原子的质量没有变化
② 研究表格 深入探索
随堂检测
② 研究表格 深入探索
2.已知一个碳12原子的质量是1.993×10-26 kg,氧的相对原子质量为16,则一个氧原子的实际质量为 。
m氧原子kg
氧的相对原子质量=
1.993×10-26kg/12
m氧原子kg
×12
=
1.993×10-26kg
= 16
=2.657×10-26kg
m氧原子
2.657×10-26kg
③深入研究 学习电子
不同的原子含有的电子数目不同。
例如:1个碳 原子含有6个电子,1个氧原子含有8个电子。
原子种类 质子数 中子数 核外电子数 相对原子质量
氢 1 0 1 1
碳 6 6 6 12
氧 8 8 8 16
钠 11 12 11 23
硫 16 16 16 32
你发现了什么?
③深入研究 学习电子
不同的原子含有的电子数目不同。
原子种类 质子数 中子数 核外电子数 相对原子质量
氢 1 0 1 1
碳 6 6 6 12
氧 8 8 8 16
钠 11 12 11 23
硫 16 16 16 32
质子数=核外电子数
不同种类原子核外电子数不同
③深入研究 学习电子
在多电子原子中,核外电子的能量是不同的。
能量高的在离核较远的区域运动,能量低的在离核较近的区域运动。通常把电子在离核远近不同的区域运动称为电子的分层排布。
在原子结构示意图中:圆圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上面的数字表示该层的电子数
用原子结构示意图可以方便简明地表示原子核外电子的排布。
③深入研究 学习电子
核外电子对原子在化学反应中的表现有很大影响。
在化学反应中:
有的原子容易失去电子,如多数金属原子;
有的原子容易得到电子,如许多非金属原子;
也有的原子既不易失去电子,也不易得到电子, 如氦、氖、氩等稀有气体的原子。
在化学反应中,原子核是不变的,发生改变的只是原子核外的电子。
原子失去电子后变成带正电荷的阳离子
得到电子后变成带负电荷的阴离子
在化学反应中,原子核是不变的,发生改变的只是原子核外的电子。
例如: 钠原子(Na)失去1个电子,形成带1个单位正电荷的钠离子(Na+);氯原子(Cl)得到1个电子,形成带1个单位负电荷的氯离子(Cl-)。带相反电荷的钠 离子和氯离子相互作用,就形成了新的物质——氯化 钠(NaCl),它是食盐的主要成分。
除氯化钠外, 氧化镁(MgO)、氯化钾(KCl)等很多物质都是由离子构成的
离子也是构成物质的一种基本粒子。
③深入研究 学习电子
分子、原子、离子
思考:它们之间有什么关系?
分子由原子构成
离子由原子得失电子构成
构成物质的基本粒子有:
③深入研究 学习电子
原子得到或失去电子后形成离子。
右图为某粒子的结构示意图。
① 当a = 时,该粒子是原子。
② 当a = 11时,该粒子是 (原子/阳离子/阴离子)。
③ 当a = ,该粒子是带有1个单位负电荷的阴离子。
10
阳离子
9
随堂检测,巩固成果
③深入研究 学习电子
④交流分享 收获知识
1、这节课你学到了哪些知识?
2、通过这节课,你在学习方法和思想上有哪些收获
原子的构成
1
2
3
某原子的相对原子质量是一个该原子的质量跟一个碳12原子质量的1/12 的比值。
原子在化学反应中的表现主要是由原子的最外层电子数决定的。最外层电子数较多的原子在化学反应中易得到电子;最外层电子数较少的原子在化学反应中易失去电子。
原子得到或失去电子后转变为离子。离子也是构成物质的一种基本粒子。
感谢聆听
主讲:XXX
3.1 原子的构成
主讲:XXX
第三单元 物质构成的奥秘
3.1.2 原子质量的计量
3.1.3 原子中的电子
①预习检测 导入新课
原子的实际(绝对)质量很小,1个氧原子的质量为
, 1个铁原子的质量为 。
这么小的数字, 书写、记忆和运算非常麻烦,很不
方便,为此国际上统一采用 来计量原
子的质量。
2.657×10-26 kg
相对原子质量
9.288×10-26 kg
2. 什么是相对原子质量?
以一个碳12原子的实际质量(1.993×10-26 kg) 的1/12作为基准,计算出其他原子的相对质量,就是这种原子的相对原子质量。
①预习检测 导入新课
3. 相对原子质量的计算公式:
4. 相对原子质量有无单位:
是原子间质量之比,单位为1,一般不写
② 研究表格 深入探索
原子种类 质子数 中子数 相对原子质量近似值
氢 1 0 1
锂 3 4 7
氧 8 8 16
碳 6 6 12
钠 11 12 23
硫 16 16 32
铜 29 35 64
请你分析表中信息,看能得出哪些结论
相对原子质量近似值=质子数+中子数
不一定所有原子都有中子,
但所有原子都有质子
不同种类原子,质子数不同
为什么?
② 研究表格 深入探索
粒子种类 质量
质子 1.6726×10-27 kg
中子 1.6749×10-27 kg
电子 质子质量的1/1836
相对原子质量近似值=质子数+中子数
说明:跟质子、中子相比,电子质量很小,
通常忽略不计,原子的质量主要集中在
原子核上。
关于相对原子质量,下列叙述正确的是( )。
A.相对原子质量就是原子质量
B. 两种原子的质量之比等于它们的相对原子质量之比
C. 碳原子的相对原子质量是12 g
D. 采用相对原子质量后,就增大了原子的质量
B
随堂检测
解析:
A.两者概念不同
C.相对原子质量单位为1,一般省略不写
D.采用相对原子质量只是计算书写方便,原子的质量没有变化
② 研究表格 深入探索
随堂检测
② 研究表格 深入探索
2.已知一个碳12原子的质量是1.993×10-26 kg,氧的相对原子质量为16,则一个氧原子的实际质量为 。
m氧原子kg
氧的相对原子质量=
1.993×10-26kg/12
m氧原子kg
×12
=
1.993×10-26kg
= 16
=2.657×10-26kg
m氧原子
2.657×10-26kg
③深入研究 学习电子
不同的原子含有的电子数目不同。
例如:1个碳 原子含有6个电子,1个氧原子含有8个电子。
原子种类 质子数 中子数 核外电子数 相对原子质量
氢 1 0 1 1
碳 6 6 6 12
氧 8 8 8 16
钠 11 12 11 23
硫 16 16 16 32
你发现了什么?
③深入研究 学习电子
不同的原子含有的电子数目不同。
原子种类 质子数 中子数 核外电子数 相对原子质量
氢 1 0 1 1
碳 6 6 6 12
氧 8 8 8 16
钠 11 12 11 23
硫 16 16 16 32
质子数=核外电子数
不同种类原子核外电子数不同
③深入研究 学习电子
在多电子原子中,核外电子的能量是不同的。
能量高的在离核较远的区域运动,能量低的在离核较近的区域运动。通常把电子在离核远近不同的区域运动称为电子的分层排布。
在原子结构示意图中:圆圈和圈内的数字表示原子核和核内质子数,弧线表示电子层,弧线上面的数字表示该层的电子数
用原子结构示意图可以方便简明地表示原子核外电子的排布。
③深入研究 学习电子
核外电子对原子在化学反应中的表现有很大影响。
在化学反应中:
有的原子容易失去电子,如多数金属原子;
有的原子容易得到电子,如许多非金属原子;
也有的原子既不易失去电子,也不易得到电子, 如氦、氖、氩等稀有气体的原子。
在化学反应中,原子核是不变的,发生改变的只是原子核外的电子。
原子失去电子后变成带正电荷的阳离子
得到电子后变成带负电荷的阴离子
在化学反应中,原子核是不变的,发生改变的只是原子核外的电子。
例如: 钠原子(Na)失去1个电子,形成带1个单位正电荷的钠离子(Na+);氯原子(Cl)得到1个电子,形成带1个单位负电荷的氯离子(Cl-)。带相反电荷的钠 离子和氯离子相互作用,就形成了新的物质——氯化 钠(NaCl),它是食盐的主要成分。
除氯化钠外, 氧化镁(MgO)、氯化钾(KCl)等很多物质都是由离子构成的
离子也是构成物质的一种基本粒子。
③深入研究 学习电子
分子、原子、离子
思考:它们之间有什么关系?
分子由原子构成
离子由原子得失电子构成
构成物质的基本粒子有:
③深入研究 学习电子
原子得到或失去电子后形成离子。
右图为某粒子的结构示意图。
① 当a = 时,该粒子是原子。
② 当a = 11时,该粒子是 (原子/阳离子/阴离子)。
③ 当a = ,该粒子是带有1个单位负电荷的阴离子。
10
阳离子
9
随堂检测,巩固成果
③深入研究 学习电子
④交流分享 收获知识
1、这节课你学到了哪些知识?
2、通过这节课,你在学习方法和思想上有哪些收获
原子的构成
1
2
3
某原子的相对原子质量是一个该原子的质量跟一个碳12原子质量的1/12 的比值。
原子在化学反应中的表现主要是由原子的最外层电子数决定的。最外层电子数较多的原子在化学反应中易得到电子;最外层电子数较少的原子在化学反应中易失去电子。
原子得到或失去电子后转变为离子。离子也是构成物质的一种基本粒子。
感谢聆听
主讲:XXX
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 自然界中的水
- 第三节 水分子的变化
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 物质构成的奥秘
- 第一节 原子的构成
- 第二节 元素
- 第三节 物质组成的表示
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去 二氧化碳的实验室制取与性质
